Закон сохранения массы. Закон сохранения массы. Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Изобарный процесс Основная статья: Изобарный процесс 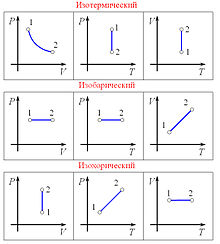 Графики изопроцессов в различных системах координат Изобарный процесс (др.-греч. ισος, isos — «одинаковый» + βαρος, baros — «вес») — процесс изменения состояния термодинамической системы при постоянном давлении (P = const) Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована в 1802 году Жозефом Луи Гей-Люссаком.Закон Гей-Люссака: При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const. Изохорный процесс Изохорный процесс (от греч. хора — занимаемое место) — процесс изменения состояния термодинамической системы при постоянном обьеме (V =const). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объеме, давление прямо пропорционально температуре: Линия, изображающая изохорный процесс на диаграмме, называется изохорой. ещё стоит указать что поданная к газу энергия расходуется на изменение внутренней энергии то есть Q = 3* ν*R*T/2=3*V*ΔP, где R — универсальная газовая постоянная, ν количество молей в газе, T температура в Кельвинах, V объём газа, ΔP приращение изменения давления. а линию, изображающая изохорный процесс на диаграмме, в осях Р(Т), стоит продлить и пунктиром соединить с началом координат, так как может возникнуть недопонимание. Изотермический процесс Изотермический процесс (от греч. «термос» — тёплый, горячий) — процесс изменения состояния термодинамической системы при постоянной температуре (T = const)(PV = const). Изотермический процесс описывается законом Бойля — Мариотта: При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const. Изоэнтропийный процесс Изоэнтропийный процесс — процесс изменения состояния термодинамической системы при постоянной энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением: pVγ = const где γ — показатель адиабаты, определяемый типом газа. Закон Гесса Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращениев одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы. 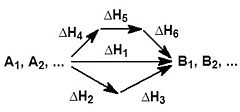 На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением: ΔH1 = ΔH2 + ΔH3 = ΔH4 + ΔH5 + ΔH6 Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него. Следствия из закона Гесса Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа). Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν): Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν): Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры. Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю. Скорость химической реакции Под скоростью химической реакции понимают изменение концентрации реагирующих или образующихся веществ в единицу времени, то есть: 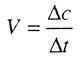 Скорость химической реакции — изменение количества вещества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1. Например для реакции: выражение для скорости будет выглядеть так: В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс: Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени. Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа), давление, площадь поверхности реагирующих веществ. Если мы рассмотрим самую простую химическую реакцию A + B → C, то мы заметим, что мгновенная скорость химической реакции величина непостоянная. Катализаторы и ингибиторы Многие реакции можно ускорить или замедлить путем введения некоторых веществ. Добавляемые вещества не участвуют в реакции и не расходуются в ходе ее протекания, но оказывают существенное влияние на скорость реакции. Эти вещества изменяют механизм реакции (в том числе состав активированного комплекса) и понижают энергию активации, что обеспечивает ускорение химических реакций. Вещества – ускорители реакций называют катализаторами, а само явление такого ускорения реакции – катализом. Многие реакции в отсутствие катализаторов протекают очень медленно или не протекают совсем. Одной из таких реакций является разложение пероксида водорода: 2Н2О2 = 2Н2О + О2. Если опустить в сосуд с водным раствором пероксида водорода кусочек твердого диоксида марганца, то начнется бурное выделение кислорода. После удаления диоксида марганца реакция практически прекращается. Путем взвешивания нетрудно убедиться, что диоксид марганца в данном процессе не расходуется – он лишь катализирует реакцию. В зависимости от того, в одинаковых или различных агрегатных состояниях находится катализатор и реагирующие вещества, различают гомогенный и гетерогенный катализ. При гомогенном катализе катализатор может ускорить реакцию путем образования промежуточных веществ за счет взаимодействия с одним из исходных реагентов. Например: При гетерогенном катализе химическая реакция обычно протекает на поверхности катализатора: Катализаторы широко распространены в природе. Практически все превращения веществ в живых организмах протекают с участием органических катализаторов – ферментов. Катализаторы используют в химическом производстве для ускорения тех или иных процессов. Кроме них применяют также вещества, замедляющие химические реакции, – ингибиторы. С помощью ингибиторов, в частности, защищают металлы от коррозии. Факторы, влияющие на скорость химической реакции
Правило Вант-Гоффа Материал из Википедии — свободной энциклопедии Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
Уравнение, которое описывает это правило следующее: где Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса. Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле: Закон действующих масс Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. Закон действующих масс в химической кинетике Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентрацийреагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции[1]. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции: закон действующих масс может быть записан в виде кинетического уравнения вида: где Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в «один шаг». Такие реакции называют формально простыми[2]. Для формально простых реакций кинетическое уравнение может быть получено в виде: (для трех исходных веществ, аналогично приведённому выше уравнению). Здесь Закон действующих масс в химической термодинамике В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции, согласно соотношению: где ai — активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов); νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным); Ka — константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле. На практике в расчётах, не требующих особой точности, значения активности обычно заменяются на соответствующие значения концентраций (для реакций в растворах) либо парциальных давлений (для реакций между газами). Константу равновесия при этом обозначают Kc или Kp соответственно. Впервые закон действующих масс был выведен из кинетических представлений Гульдбергом и Вааге, а термодинамический вывод его дан Вант-Гоффом в 1885 году[3]. Пример: для стандартной реакции константа химического равновесия определяется по формуле 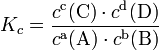 Химическое равновесие Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 июня 2010; проверки требуют 38 правок. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1] А2 + В2 ⇄ 2AB В состоянии равновесия скорости прямой и обратной реакции становятся равными. |
