Закон сохранения массы. Закон сохранения массы. Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Температурная зависимость теплового эффекта (энтальпии) реакции Чтобы рассчитать температурную зависимость энтальпии реакции, необходимо знать мольные теплоемкости веществ, участвующих в реакции. Изменение энтальпии реакции при увеличении температуры от Т1 до Т2 рассчитывают по закону Кирхгофа (предполагается, что в данном интервале температур мольные теплоемкости не зависят от температуры и нет фазовых превращений): 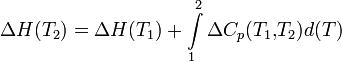 Если в данном интервале температур происходят фазовые превращения, то при расчёте необходимо учесть теплоты соответствующих превращений, а также изменение температурной зависимости теплоемкости веществ, претерпевших такие превращения: 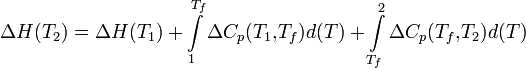 где ΔCp(T1,Tf) — изменение теплоемкости в интервале температур от Т1 до температуры фазового перехода; ΔCp(Tf,T2) — изменение теплоемкости в интервале температур от температуры фазового перехода до конечной температуры, и Tf — температура фазового перехода. Стандартная энтальпия сгорания Стандартная энтальпия сгорания — ΔHгоро, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю. Стандартная энтальпия растворения Стандартная энтальпия растворения — ΔHраство, тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Складывается из теплоты разрушения кристаллической решетки и теплоты гидратации (или теплоты сольватации для неводных растворов), выделяющейся в результате взаимодействия молекул растворителя с молекулами или ионами растворяемого вещества с образованием соединений переменного состава — гидратов (сольватов). Разрушение кристаллической решетки, как правило, эндотермический процесс — ΔHреш > 0, а гидратация ионов — экзотермический, ΔHгидр < 0. В зависимости от соотношения значений ΔHреш и ΔHгидр энтальпия растворения может иметь как положительное, так и отрицательное значение. Так растворение кристаллического гидроксида калия сопровождается выделением тепла: ΔHраствKOHо = ΔHрешо + ΔHгидрК+о + ΔHгидрOH−о = −59 КДж/моль Под энтальпией гидратации — ΔHгидр, понимается теплота, которая выделяется при переходе 1 моля ионов из вакуума в раствор. Стандартная энтальпия нейтрализации Стандартная энтальпия нейтрализации — ΔHнейтро энтальпия реакции взаимодействия сильных кислот и оснований с образованием 1 моля воды при стандартных условиях: HCl + NaOH = NaCl + H2O H+ + OH− = H2O, ΔHнейтр° = −55,9 кДж/моль Стандартная энтальпия нейтрализации для концентрированных растворов сильных электролитов зависит от концентрации ионов, вследствие изменения значения ΔHгидратации° ионов при разбавлении. Энтальпия Энтальпия — это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту. Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении.Единицы энтальпии — британская тепловая единица или джоуль для энергии и Btu/lbm или Дж/кг для удельной энергии. Количество энтальпии Количество энтальпии вещества основано на его данной температуре. Данная температура — это значение, которая выбрано учеными и инженерами, как основание для вычислений. Это температура, при которой энтальпия вещества равна нулю Дж. Другими словами, у вещества нет доступной энергии, которую можно преобразовать в теплоту. Данная температура у различных веществ разная. Например, данная температура воды — это тройная точка (О °С), азота −150°С, а хладагентов на основе метана и этана −40°С. Если температура вещества выше его данной температуры или изменяет состояние на газообразное при данной температуре, энтальпия выражается положительным числом. И наоборот при температуре ниже данной энтальпия вещества выражается отрицательным числом. Энтальпия используется в вычислениях для определения разницы уровней энергии между двумя состояниями. Это необходимо для настройки оборудования и определения коэффициента полезного действия процесса. Энтальпию часто определяют как полную энергию вещества, так как она равна сумме его внутренней энергии (и) в данном состоянии наряду с его способностью проделать работу (pv). Но в действительности энтальпия не указывает полную энергию вещества при данной температуре выше абсолютного нуля (-273°С). Следовательно, вместо того, чтобы определять энтальпию как полную теплоту вещества, более точно определять ее как общее количество доступной энергии вещества, которое можно преобразовать в теплоту. H = U + pV Внутренняя энергия Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход. Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии: где Эта формула является математическим выражением первого начала термодинамики Для квазистатических процессов выполняется следующее соотношение: где Идеальные газы Согласно закону Джоуля, выведенному эмпирически, внутренняя энергия идеального газа не зависит от давления или объёма. Исходя из этого факта, можно получить выражение для изменения внутренней энергии идеального газа. По определению молярной теплоёмкости при постоянном объёме, 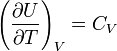 . Так как внутренняя энергия идеального газа является функцией только от температуры, то . Так как внутренняя энергия идеального газа является функцией только от температуры, то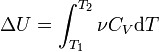 . .Эта же формула верна и для вычисления изменения внутренней энергии любого тела, но только в процессах при постоянном объёме (изохорных процессах); в общем случае CV(T,V) является функцией и температуры, и объёма. Если пренебречь изменением молярной теплоёмкости при изменении температуры, получим: ΔU = νCVΔT, где ν — количество вещества, ΔT — изменение температуры. ВНУТРЕННЯЯ ЭНЕРГИЯ ВЕЩЕСТВА, ТЕЛА, СИСТЕМЫ (Греч.: ένέργια - деятельность, энергия). Внутренняя энергия - это часть полной энергии тела (системы тел): E = Ek + Ep + U, где Ek - кинетическая энергиямакроскопического движения системы, Ep - потенциальная энергия, обусловленная наличием внешних силовых полей(гравитационного, электрического и т.д.), U - внутренняя энергия. Внутренняя энергия вещества, тела, системы тел - функция состояния, определяемая как полный запас энергии внутреннего состояния вещества, тела, системы, изменяющийся (высвобождающийся) в процессе химической реакции, теплообмена и выполнения работы. Составляющие внутренней энергии: (а) кинетическая энергия теплового вероятностного движения частиц (атомов, молекул, ионов и др.), составляющих вещество (тело, систему); (б) потенциальная энергия частиц, обусловленная их межмолекулярным взаимодействием; (в) энергия электронов в электронных оболочках, атомов и ионов; (г) внутриядерная энергия. Внутренняя энергия не связана с процессом изменения состояния системы. При любых изменениях системы внутренняя энергия системы вместе с ее окружением остается постоянной. То есть внутренняя энергия не утрачивается и не приобретается. Вместе с тем, энергия может переходить от одной части системы к другой или превращаться из одной формы в другую. Это одна из формулировок закона сохранения энергии - первый закон термодинамики. Часть внутренней энергии, может превращаться в работу. Эту часть внутренней энергии называют свободной энергией - G. (В химических соединениях ее называют химическим потенциалом). Остальную часть внутренней энергии, которая не может превращаться в работу, называют связанной энергией - Wb. Энтропия Энтропи́я (от греч. ἐντροπία — поворот, превращение) в естественных науках — мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит и количество информации; в исторической науке, для экспликации феноменаальтернативности истории (инвариантности и вариативности исторического процесса). Энтропия в информатике — степень неполноты, неопределённости знаний. Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной приобратимых процессах, тогда как в необратимых — её изменение всегда положительно. где dS — приращение энтропии; δQ — минимальная теплота подведенная к системе; T — абсолютная температура процесса; Потенциал Гиббса Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность химической реакции; это термодинамический потенциал следующего вида: Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.) Понятие энергии Гиббса широко используется в термодинамике и химии. Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж) Определение Классическим определением энергии Гиббса является выражение где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия. Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — через давление p и температуру T: Для системы с переменным числом частиц этот дифференциал записывается так: Здесь μ — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу. Связь с термодинамической устойчивостью системы Покажем, что минимум потенциала Гиббса соответствует устойчивому равновесию термодинамической системы с фиксированными температурой, давлением и числом частиц. Запишем обобщённое уравнение первого и второго начал термодинамики: При Таким образом в системе при постоянных температуре и давлении энергия Гиббса достигает минимального значения. Применение в химии Связь с химическим потенциалом Используя свойства экстенсивности термодинамических потенциалов, математическим следствием которых является соотношение Гиббса-Дюгема, можно показать, что химический потенциал для системы с одним типом частиц есть отношение энергии Гиббса к числу частиц в системе: Если система состоит из частиц нескольких сортов i с числом Ni частиц каждого сорта, то соотношения Гиббса-Дюгема приводят к выражению Химический потенциал применяется при анализе систем с переменным числом частиц, а также при изучении фазовых переходов. Так, исходя из соотношений Гиббса-Дюгема и из условий равенства химических потенциалов μ1 = μ2 находящихся в равновесии друг с другом фаз, можно получить уравнение Клапейрона-Клаузиуса, определяющее линию сосуществования двух фаз в координатах (p,T) через термодинамические параметры (удельные объёмы) фаз и теплоту перехода между фазами. Энергия Гиббса и направление протекания реакции В химических процессах одновременно действуют два противоположных фактора — энтропийный (TΔS) и энтальпийный (ΔH). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (G): Из этого выражения следует, что Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При ΔG < 0 процесс может протекать, при ΔG > 0 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же ΔG = 0, то система находится в состоянии химического равновесия. Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенстваΔG < 0 (по кинетическим причинам). Существует полезное соотношение, связывающее изменение свободной энергии Гиббса Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как где Изопроцессы Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 января 2010; проверки требуют 33 правки. Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии — изоэнтропийный (например, обратимый адиабатический процесс). Линии, изображающие данные процессы на какой-либо термодинамической диаграмме, называются изобара, изохора, изотерма и адиабатасоответственно. Изопроцессы являются частными случаями политропного процесса. |
