Закон сохранения массы. Закон сохранения массы. Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Смещение химического равновесия Основная статья: Принцип Ле Шателье — Брауна Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье. Факторы влияющие на химическое равновесие: 1) температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. CaCO3=CaO+CO2 -Q t↑ →, t↓ ← N2+3H2↔2NH3 +Q t↑ ←, t↓ → 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся. CaCO3=CaO+CO2 P↑ ←, P↓ → 1моль=1моль+1моль 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции-в сторону исходных веществ. S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ← Катализаторы не влияют на смещение химического равновесия! Принцип Ле Шателье — Брауна Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура,давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. Анри Ле Шателье (Франция) сформулировал этот термодинамический принцип подвижного равновесия, позже обобщённый Карлом Брауном [1]. [править]Влияние температуры Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа: 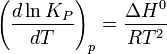 в системах с газовой фазой — уравнением изохоры Вант-Гоффа 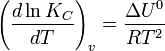 В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением: Например, в реакции синтеза аммиака N2 + 3H2 ⇄ 2NH3 + Q тепловой эффект в стандартных условиях составляет +92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта. Влияние давления Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам: При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот. В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3 Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
Влияние инертных газов Введение в реакционную смесь или образование в ходе реакции инертных газов действует также, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов. Влияние концентрации Влияние концентрации на состояние равновесия подчиняется следующим правилам: При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ. РАСТВОРЫ РАСТВОРЫ, гомогенные системы, состоящие из двух или более компонентов, состав к-рых в определенных пределах может непрерывно изменяться. От мех. смесей растворы отличаются своей однородностью и возрастанием энтропии системы при смешении компонентов. Поагрегатному состоянию различают растворы газовые (газовые смеси), жидкие и твердые. Обычно, если особо не оговаривается, термин "растворы" относят к жидким системам; см. также Твердые растворы. Концентрация растворов Концентрация — величина, характеризующая количественный состав раствора. Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это отношение неоднородных величин. Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями. Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов. Существует много способов выражения концентрации растворов. Массовая доля (также называют процентной концентрацией) Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах. где: m1 — масса растворённого вещества, г ; m — общая масса раствора, г . Массовое процентное содержание компонента, m% m%=(mi/Σmi)*100 В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят 2 измерения: непосредственное, и при небольшом разбавлении раствора. Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
Объёмная доля Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах. где: V1 — объём растворённого вещества, л; V — общий объём раствора, л. Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров. Молярность (молярная объёмная концентрация) Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации CM , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. д. где: ν — количество растворённого вещества, моль; V — общий объём раствора, л. Нормальная концентрация (мольная концентрация эквивалента) Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н. где: ν — количество растворённого вещества, моль; V — общий объём раствора, л; z — число эквивалентности. Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4. Мольная (молярная) доля Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. где: νi — количество i-го компонента, моль; n — число компонентов; Моляльность (молярная весовая концентрация) Моляльность — количество растворённого вещества (число молей) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-моляльным. где: ν — количество растворённого вещества, моль; m2 — масса растворителя, кг. Следует обратить особое внимание, что несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры. Титрраствора Титр раствора — масса растворённого вещества в 1 мл раствора. где: m1 — масса растворённого вещества, г; V — общий объём раствора, мл; В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора. Осмос О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя). Осмотическое давление Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 июля 2011; проверки требуют 6 правок. Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя. На примере воды появление осмотического давления обусловлено существованием полупроницаемых перегородок (мембран), которые пропускают отдельные молекулы воды, но препятствуют прохождению гидратированных ионов. Если подобная перегородка помещена между растворами разных концентраций, то из раствора меньшей концентрации в раствор большей концентрации будет переходить больше молекул воды, чем в обратном направлении. Возникает своеобразное явление перетекания воды, которое продолжается до тех пор, пока не произойдет выравнивание концентраций или пока этот процесс (если он протекает в ограниченном объеме) не будет уравновешен возникающим гидростатическим давлением. Такое давление называется осмотическим. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим. Осмотическое давление может быть весьма значительным. В дереве, например, под действием осмотического давления растительный сок (вода с растворёнными в ней минеральными веществами) поднимается по ксилеме от корней до самой верхушки. Одни только капиллярные явления не способны создать достаточную подъёмную силу — например, секвойямтребуется доставлять раствор на высоту даже до 100 метров. При этом в дереве движение концентрированного раствора, каким является растительный сок, ничем не ограничено. Если же подобный раствор находится в замкнутом пространстве, например, в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. Именно по этой причинелекарства, предназначенные для введения в кровь, растворяют в изотоническом растворе, содержащем столько хлорида натрия (поваренной соли), сколько нужно, чтобы уравновесить создаваемое клеточной жидкостью осмотическое давление. Если бы вводимые лекарственные препараты были изготовлены на воде или очень сильно разбавленном (гипотоническом по отношению к цитоплазме) растворе, осмотическое давление, заставляя воду проникать в клетки крови, приводило бы к их разрыву. Если же ввести в кровь слишком концентрированный раствор хлорида натрия (3-5-10 %, гипертонические растворы), то вода из клеток будет выходить наружу, и они сожмутся. В случае растительных клеток происходит отрыв протопласта от клеточной оболочки, что называетсяплазмолизом. Обратный же процесс, происходящий при помещении сжавшихся клеток в более разбавленный раствор, — соответственно, деплазмолизом. Величина осмотического давления, создаваемая раствором, зависит от количества, а не от химической природы растворенных в нём веществ (или ионов, если молекулы вещества диссоциируют), следовательно, осмотическое давление является коллигативным свойством раствора. Чем большеконцентрация вещества в растворе, тем больше создаваемое им осмотическое давление. Это правило, носящее название закона осмотического давления, выражается простой формулой, очень похожей на некий закон идеального газа: где i — изотонический коэффициент раствора; C — молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м3, а не в привычных моль/л; R —универсальная газовая постоянная; T — термодинамическая температура раствора. Это показывает также схожесть свойств частиц растворённого вещества в вязкой среде растворителя с частицами идеального газа в воздухе. Правомерность этой точки зрения подтверждают опыты Ж. Б. Перрена (1906): распределение частичек эмульсии смолы гуммигута в толще воды в общем подчинялось закону Больцмана. Осмотическое давление, которое зависит от содержания в растворе белков, называется онкотическим (0,03 — 0,04 атм.). При длительном голодании, болезни почек концентрация белков в крови уменьшается, онкотическое давление в крови снижается и возникают онкотические отёки: вода переходит из сосудов в ткани, где πОНК больше. При гнойных процессах πОНК в очаге воспаления возрастает в 2-3 раза, так как увеличивается число частиц из-за разрушения белков. В организме осмотическое давление должно быть постоянным (≈ 7,7 атм.). Поэтому пациентам вводят изотонические растворы (растворы, осмотическое давление которых равно πПЛАЗМЫ ≈ 7,7 атм. (0,9 % NaCl — физиологический раствор, 5 % раствор глюкозы). Гипертонические растворы, у которых π больше, чем πПЛАЗМЫ, применяются в медицине для очистки ран от гноя (10 % NaCl), для удаления аллергических отёков (10 % CaCl2, 20 %глюкоза), в качестве слабительных лекарств (Na2SO4∙10H2O, MgSO4∙7H2O). Закон осмотического давления можно использовать для расчёта молекулярной массы данного вещества (при известных дополнительных данных). Закон Рауля Зако́ны Ра́уля — общее название открытых французским химиком Ф. М. Раулем в 1887 г. количественных закономерностей, описывающих некоторые коллигативные (зависящие отконцентрации, но не от природы растворённого вещества) свойства растворов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
