все лекции по тд и тп. Закон тд для закр неподвиж сисмы. Сисма не обменивающаяся с окр средой вещвом называется закрытой
 Скачать 1.36 Mb. Скачать 1.36 Mb.
|
Необратимые термодинамические процессыЕсли процесс необратим то энтропия рабочего тела увеличивается за счет внутреннего производства энтропии. Согласно 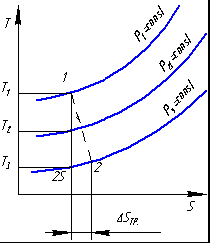 Рассмотрим обратимый процесс 1-2s и необратимый 1-2 адиабатного расширения рабочего тела до одного и того же давления. Необратимость обусловлена трением , для видно что из-за перехода части работы в теплоту трения Для вычисления 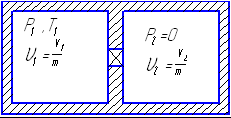 Сосуд теплоизолирован (адиабатная система) после расширения газа ОБРАТИМЫЕ И НЕОБРАТ ПРОЦЕССЫ В термодинамике сист хар-ся с помощью физ-х вел или переменны. Если переменные принимают устойчивые значения, то сист нах-ся в определенном сост. Поэтому переменные системы наз её параметрами состояния. Термодинамическое сост сист опысивают внут параметрами сост. Сист нах-ся в равновесном сост если при изоляции её от воздействия внешной сферы среды параметры сост сист не изменяются. Поэтому равновесное сост сист может изменится только вследствие внш воздействмя. Процесс при котором изм-ся сост сист наз-ся термодинамическим процессом. Карно вел понятие идеализированный процесс.таким процессом яв-ся обратным процессом . Если система в которои протекает про_сс вернуть в начальное стояние так что во внешней среде не произойдет каких-либо изменений то процесс называется обратным . В пративном случае он называется необратимым . Обратный процесс сост из последовательности равновесных состояний . М/у которыми отсутствует диссипативный эффект . В реальности квази статические изменения состоят и при отсутствие диссипативный эффект не наблюдается но обратный процессы очень важны в термодинамике т.к харак-ся потери мех-ой энергии . Поэтому их можно использовтаь в качестве эталона при оценке эффективности в реальных процессов мех-х устройств.  Реальныегазы Все реальные газы явл. Парами соответствующих жидкостей.изобразим в pv различные состояния газа:точка К критическая точка,кот. Соответств. Критич параметры:Pкр.Tкр.Vкр.При критич состоянии исчезают различия между жидк и паром.I-газообразное состояние,II-некипящ жидкость,III-двухфазное состояние(кип жидк+сух пар).При t>tкр газ ни при каком давлении не может сконденсироваться.Для расчета параметров реальн газа часто используют уравн Вандер-Ваальса Реальныегазы Все реальные газы явл. Парами соответствующих жидкостей.изобразим в pv различные состояния газа:точка К критическая точка,кот. Соответств. Критич параметры:Pкр.Tкр.Vкр.При критич состоянии исчезают различия между жидк и паром.I-газообразное состояние,II-некипящ жидкость,III-двухфазное состояние(кип жидк+сух пар).При t>tкр газ ни при каком давлении не может сконденсироваться.Для расчета параметров реальн газа часто используют уравн Вандер-Ваальсагде a/V^2 поправка на внутр давление,обусловл внутр притяжением молекул.b-поправка на обьем самих молекул. Это уравнение качественно правильно описывает непрерыв переход из жидк состояния в газообразное.Уточнение расчетов пытались обеспечить,за счет зависимостей: Где z фактор сжимаемости. ПОлитропные процессы ид.газа Используя ур: Дифференцируя pV=Rt определяем величину Исключая dT из (1) с помощью (2) получим:  Пусть:  (3).С учетом (3)ду примет вид: (3).С учетом (3)ду примет вид:Полагая n=const, в ходе термодинамического процесса проинтегр это уравнение, в результате получим, уравнение политроп процесса:nlnV+lnp=ln(const); Удельная работа расширения:  . .Располагая работу  ,определяем ,определяем ; ; ; ;Из (3)можно найти теплоемкость политропного процесса: Изменение энтропии: Термич.поле. Градиент температуры. Теория теплообмена- учение о самопр.необратимых процессах распр-я теплоты в пространстве. Для кол-й оценки теплоты, передаваемой в ед.времени ч/з произв.поверхность вводят понятие теплового потока Q [Дж/с=Вт].Тепловой поток, отнес-й к площади пов-ти наз-ся плотностью теплового потока или уд.теплов.потоком q [Дж/(с‡м2)=Вт/м2]. Под температурнымполемпонимают совокупность мгновенных значений температур во всех точках изучаемого пространства. Температура различных точек тела t определяется координатами х, у, zи временем т. Поэтому в общем случае t(rв,τ)=t(x,y,z, τ),где rв – радиус-вектор точки, x,y,z – координаты, τ– время. Поле, изменяющееся во времени наз-ся нестационарным или неустановившимся, в противном случае стационарным или установившимся, т.е. t(rв)=t(x,y,z).В скалярном поле можно выделить поверхность в 3-х мерном случае и изолинии в двумерном случае, как пов-ти или линии с одинаковыми знач-ми т-ры (изотермич.пов-ти или изотермы).По расположению этих изолиний оценивают интенсивность изменения т-ры в различ.направлениях. Наиболее быстрое изменение скал.поля хар-ся градиентом: Механизмы и законы переноса теплоты. Явление теплопроводности, теплоотдачи и излучения. Различают 3 механизма (процесса) переноса теплоты: 1) теплопроводность (кондукция) – перенос распр-я энергии только вследствие взаимодействия структурн.частиц в-ва (молекул, ионов, атомов, своб.эл-нов).В чистом виде теплопр-ть имеет место в тв.телах, в неподвиж. слоях жидкости или газа. 2) Конвекция – прц.переноса теплоты вследствие перемещения относ-но больших масс в-ва в неоднородном поле тем-р. Этот процесс имеет место в движ.квазисплошных средах (жидкостях, газах, сыпучих средах, в плазме) 3) Излучение (радиация) – пр.переноса энергии, выделившейся вследствие тепл.движения в в-ве в виде э/м волн ч/з полносью или частично прозрачную для них среду. Сложным теплообменом наз-ся пр-сы переноса теплоты одновр.неск. способами. Теплопередачей наз-ся пр-с теплообмена м/у средами, разделенными отчетливой границей (н-р, тв.тела - текучая среда, пов-ть раздела газ – жидкость или 2-х несмешивающихся жидкостей).  Теплопередача – процесс теплообмена м/у средами,разделенными некот.перегородкой. При расчете теплопроводности в среде пользуются з-ном Фурье: Теплопередача – процесс теплообмена м/у средами,разделенными некот.перегородкой. При расчете теплопроводности в среде пользуются з-ном Фурье: При α=const, tf =const, tw = const: Теплопередачу часто рассчитывают по формуле: Тепловая хар-ка обратимых циклов. Сравним(1,38) с(1,33) получим для ц.Карно: Отношение q/T наз-ся приведённой теплотой, след-но в обратимом цикле Карно, алгебр-я сумма приведённых теплот =0 (1,40) В (1,40) под q пон-ся алгебраическая величина q больше 0 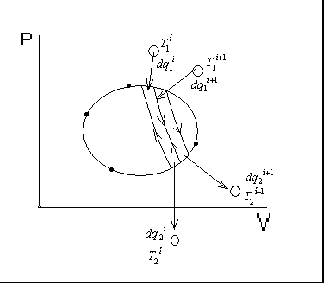 приводимой теплоты q меньше 0 отводимой теплоты. Выражение (1,40) называется тепловой характеристикой ц.Карно.Рассмотрим произвольный обратимый цикл.А-В-С-Д-А Он должен совершаться под воздействием бесконечно большого кол-ва в высших и низших ист-ов теплоты соот-но на линиях А-В-С и сжатия С-Д-А. Разобьем этот цикл на бесчисленное множество обратимых циклов Карно.Проведя адиабаты на бесконечно малом расстоянии друг от друга. Для каждого элементарного ц.Карно по аналогии с (1,40) можно записать что сумма приведённых теплот=0 приводимой теплоты q меньше 0 отводимой теплоты. Выражение (1,40) называется тепловой характеристикой ц.Карно.Рассмотрим произвольный обратимый цикл.А-В-С-Д-А Он должен совершаться под воздействием бесконечно большого кол-ва в высших и низших ист-ов теплоты соот-но на линиях А-В-С и сжатия С-Д-А. Разобьем этот цикл на бесчисленное множество обратимых циклов Карно.Проведя адиабаты на бесконечно малом расстоянии друг от друга. Для каждого элементарного ц.Карно по аналогии с (1,40) можно записать что сумма приведённых теплот=0или Сложив подобные выражения получим: Или (1,41) Выражение (1,41) наз-ся уравнением или интегралом Клаузиуса
Все тела при любых t излучают и поглощают энергию излучая, по кол-во этой энергии становится существенным только при высоких t или в условиях, когда перенос теплоты другими способами затруднен (при свободной конвенции особенно в разряженном газе) 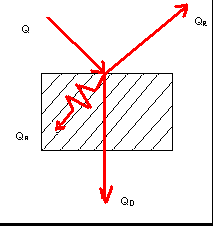 Поток излучения Q поглощ. телом не полностью Поток излучения Q поглощ. телом не полностью A+R+D=1 Тело способное погл. всю падающую энергию, наз-ся абсолютно черным телом (А=1; R=D=0) Тело отражающее всю падающую энергию наз-ся абс. Белым телом (R=1;A=D=0) Если отражение имеет правильный характер тело наз-ся зеркальным (угол падения = углу отражения) Большинство тв. и жид. тел не пропускают энергию излучения – не прозрачные тела. Поглощение энергии изл. в них происходит в тонком поверхностном слое. Для Ме=1мк.м , для неметаллов = 1мм (A+R=1). Тела пропуск. всю энергию падающ. Излуч. Наз-ся пропускающей способностью облад. газы. Для монохроматического: Излуч. Непрозрел. тел оценивается повыш. плотностью потока излучения Е , Е учитыв. излучение во всех напров-ях и при всех длинах воли ( |
