Закон термодинамики. Сообщенная системе теплота расходуется на приращение внутренней энергии и совершении работы против внешних сил
 Скачать 1.67 Mb. Скачать 1.67 Mb.
|
|
Краткая теория по вопросам : 3, 16, 29, 42 3. Первое начало термодинамики: осн. формулировки мат. выражение. Q=∆U + A – 1й закон термодинамики. Сообщенная системе теплота расходуется на приращение внутренней энергии и совершении работы против внешних сил. Первый закон имеет несколько формулир. : Внутренняя энергия изолированной системы постоянна. Работа и теплота эквивалентны. Вечный двигатель первого рода невозможен. В изобарно-изотермических условиях A= p*∆V  Энтальпия - это функция состояния, приращение которой равно тепловому эффекту процесса, протекающего при постоянном давлении: 1) По стандартным энтальпиям (теплотам) образования веществ Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па. Теплоты образования простых веществ равны нулю. νi , νj – стехиометрические коэффициенты перед соответствующими веществами в уравнении реакции. 2) По стандартным энтальпиям (теплотам) сгорания веществ Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях. Теплоты сгорания высших оксидов (в том числе СО2 и Н2О) приняты равными нулю. 16  29. Гидролиз. Константа гидролиза. Роль гидролиза в биопроцессах. гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества. 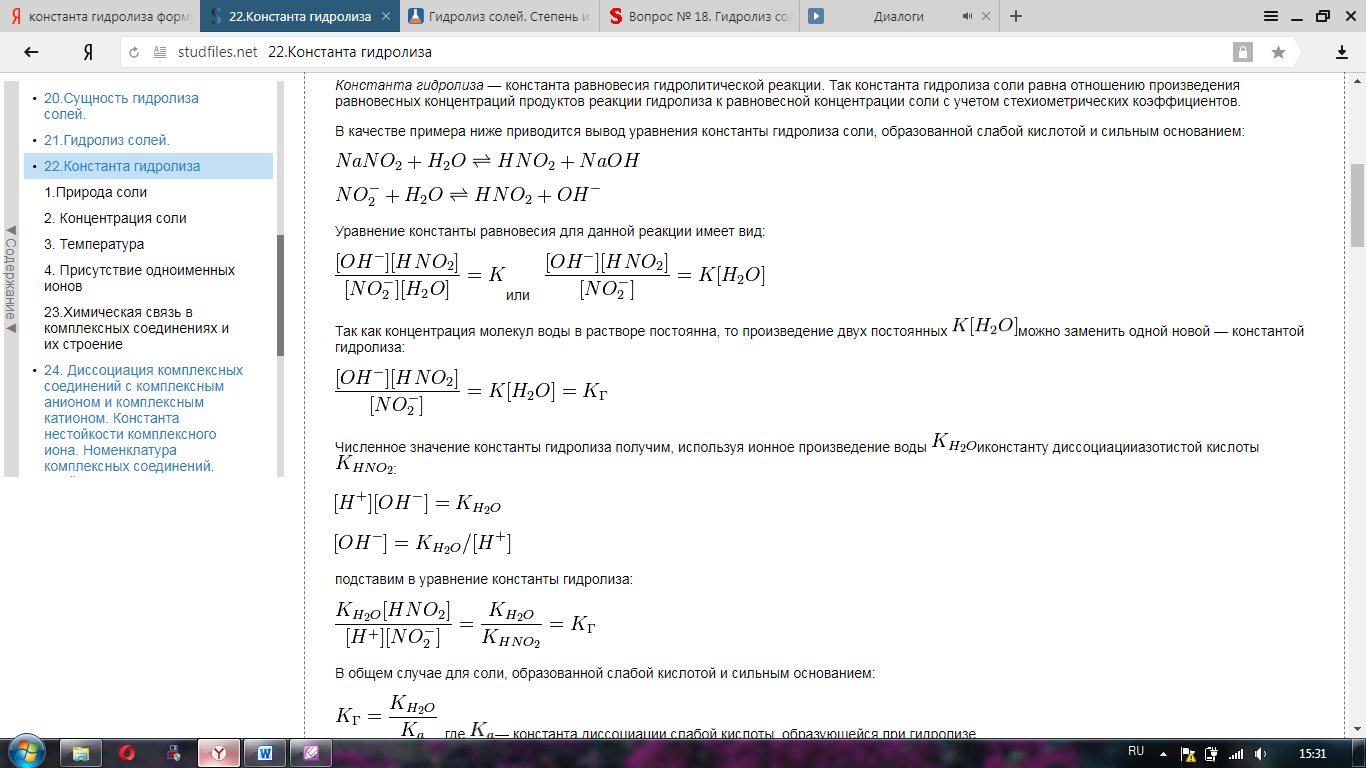 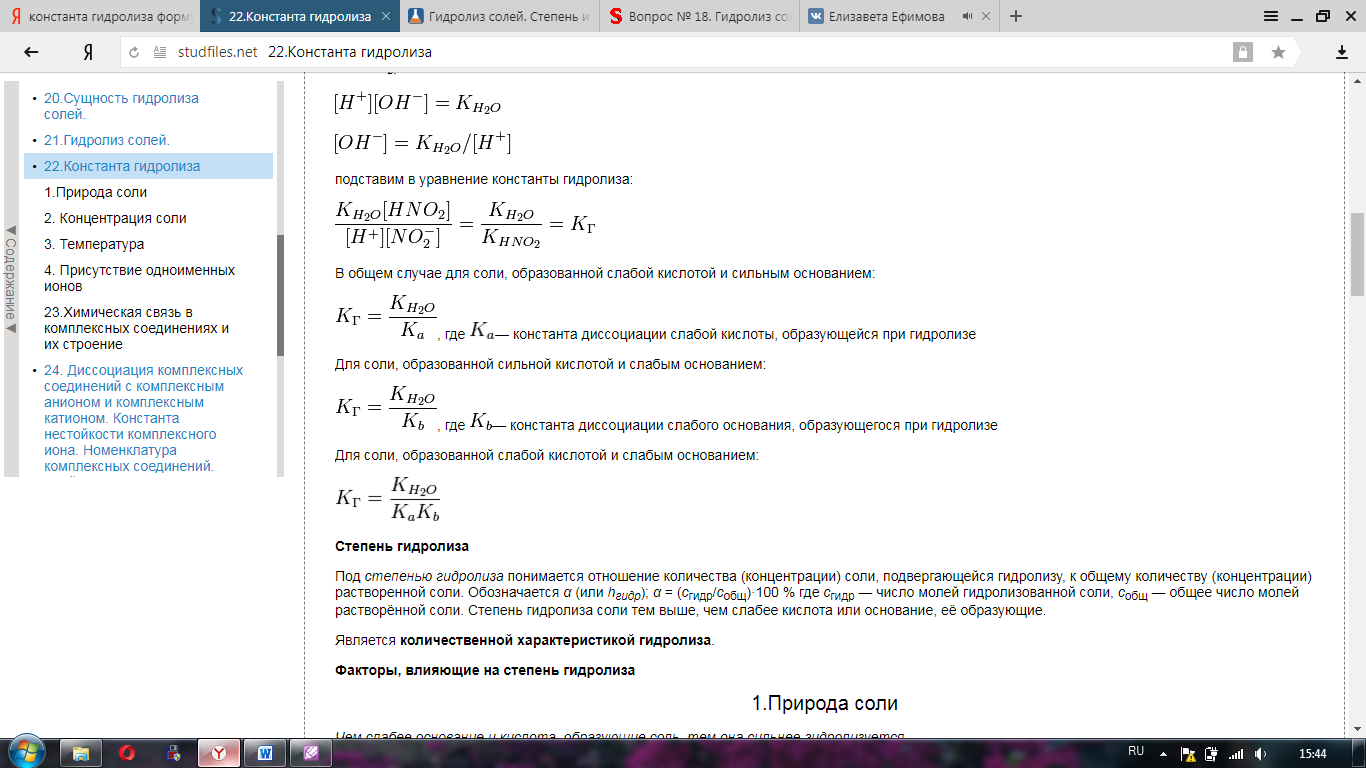 Так в процессе пищеварения высокомолекулярные вещества (белки, жиры, полисахариды и др.) подвергаются ферментативному гидролизу с образованием низкомолекулярных соединений (соответственно, аминокислот, жирных кислот и глицерина, глюкозы и др.). Без этого процесса не было бы возможным усвоение пищевых продуктов, так как высасываться в кишечнике способны только относительно небольшие молекулы. Так, например, усвоение полисахаридов и дисахаридов становится возможным лишь после полного их гидролиза ферментами до моносахаридов. Точно так же белки и липиды гидролизуются до веществ, которые лишь потом могут усваиваться. 42.   Осадок малорастворимого электролита образуется только тогда, когда ионное произведение (ИП) превысит при данной температуре величину его произведения растворимости. Если ИП < ПР – р-р ненасыщенный; ИП = ПР – р-р насыщенный; ИП > ПР – р-р пересыщенный; ИП  ПР↓ – условие образования осадков. ПР↓ – условие образования осадков.Образование и растворение осадков находится в определенной зависимости от произведения растворимости. Чем меньше ПР для однотипных электролитов, тем быстрее и полнее образуется осадок. Fe(OH)3↓ + 3HCl = FeCl3 + 3H2O Fe(OH)3↓ + 3H+ = Fe3+ + 3H2O Mg(OH)2↓ + 2HCl = MgCl2 + 2H2O Связать ионы ОН- можно и с помощью ионов аммония NH4+. Но гидроксид аммония диссоциирует сильнее, чем вода, и поэтому в солях аммония растворяются такие основания, как Mg(OH)2, Mn(OH)2, Fe(OH)2 такие малорастворимые основания, как Al(OH)3, Fe(OH)3, Cr(OH)3 и др. в солях аммония не растворяются. |
