Биологическая химия. 26-1 фип_Юданова Татьяна_М 3Контроль1. Занятие 1 (номер занятия) Тема занятия Модуль 3 Обмен углеводов Основные углеводы пищи. Переваривание углеводов. Глюкоза крови и ее регуляция
 Скачать 186.25 Kb. Скачать 186.25 Kb.
|
Вариант 12 4. Ферменты, участвующие в процессе переваривания углеводов. Пищеварение является этапом метаболизма питательных веществ, в ходе которого происходит гидролиз пищевых компонентов ферментами пищеварительного тракта. Характер гидролиза питательных веществ определяется составом ферментов пищеварительных соков и специфичностью действия этих ферментов. Большинство пищеварительных ферментов обладает относительной субстратной специфичностью, что облегчает гидролиз разнообразных питательных веществ большой молекулярной массы до мономеров и более простых соединений. Распаду в пищеварительном тракте подвергаются углеводы, липиды, белки и некоторые простетические группы сложных белков. Остальные компоненты пищи (витамины, минеральные вещества и вода) всасываются в неизменном виде. Переваривание происходит в трех отделах пищеварительного тракта: ротовой полости, желудке и тонком кишечнике, куда выделяются секреты желез, содержащие соответствующие гидролитические ферменты. В полость пищеварительного тракта ежесуточно поступает около 8,5 л пищеварительных соков, в которых содержится до 10 г различных ферментов. В зависимости от расположения ферментов пищеварение может быть трех видов: полостное (гидролиз ферментами, находящимися в свободном виде), мембранное, или пристеночное (гидролиз ферментами, находящимися в составе мембран) и внутриклеточное (гидролиз ферментами, находящимися в органоидах клетки). Для пищеварительного тракта характерны первые два вида. Мембранное пищеварение происходит в ворсинках кишечника. Особенность его состоит в том, что гидролиз небольших молекул (например, дипептидов, дисахаридов) происходит на поверхности клеточной мембраны кишечного эпителия и одновременно сочетается с транспортом продуктов гидролиза внутрь клетки. Внутриклеточный гидролиз осуществляется преимущественно ферментами лизосом, являющихся своеобразным пищеварительным аппаратом клеток. Ферменты пищеварительного тракта можно разделить на четыре группы: ферменты, участвующие в переваривании углеводов (амилолитические или глюканолитические ферменты); ферменты, участвующие в переваривании белков и пептидов (протеолитические ферменты); ферменты, участвующие в переваривании нуклеиновых кислот (нуклеазы, или нуклеинолитические ферменты) и гидролизе нуклеотидов; ферменты, участвующие в переваривании липидов (липолитические ферменты). Переваривание углеводов Переваривание углеводов начинается в ротовой полости главным образом с помощью α-амилазы слюны. Некоторые исследователи считают, что в слюне имеется и другой фермент - мальтаза. α-Амилаза состоит из одной полипептидной цепи, стабилизируется кальцием, имеет оптимум рН 7,1 и активируется ионами хлора. Фермент относится к эндоамилазам, действует на внутренние α-1,4-гликозидные связи крахмала и гликогена пищи и не способен гидролизовать α-1,6-гликозидные связи этих полисахаридов. α-Амилаза гидролизует весьма беспорядочно α-1,4-гликозидные связи полисахаридов в отличие от β- и γ-амилаз. β-Амилаза последовательно отщепляет от конца полисахарида дисахарид мальтозу, а γ-амилаза - концевой моносахарид глюкозу. Поэтому обе эти амилазы являются экзоамилазами. γ-Амилаза присутствует в ткани печени и участвует в расщеплении гликогена (β-амилазы в организме человека нет; она находится в бактериях). После действия α-амилaзы слюны полисахариды расщепляются на α-лимитдекстрин (разветвленный полисахарид меньшей молекулярной массы, чем крахмал и гликоген), мальтозу и небольшое количество глюкозы (возможно в результате присутствия мальтазы). Поскольку время нахождения пищи в ротовой полости невелико, доля расщепленных полисахаридов относительно мала, хотя содержание фермента в слюне очень велико. Дисахариды пищи, главными из которых являются сахароза, лактоза (особенно у детей, питающихся молоком и молочными продуктами), трегалоза (дисахарид грибов), не расщепляются в полости рта. В желудке α-амилаза инактивируется кислым содержимым желудка, и переваривание углеводов прекращается. В кишечнике происходит полный гидролиз полисахаридов, включая и образовавшийся в полости рта α-лимитдекстрин, и всех дисахаридов до моносахаридов. Действию ферментов благоприятствует нейтрализация поступающей в кишечник кислой пищи гидрокарбонатами, растворенными в щелочном содержимом сока поджелудочной железы и желчи. Гидролиз углеводов в кишечнике осуществляется ферментами поджелудочной железы и кишечника. К первым относятся панкреатическая α-амилаза и олиго-1,6-глюкозидаза. Остальные ферменты - олигосахаридазы и дисахаридазы - образуются преимущественно в слизистой кишечника. Панкреатическая α-амилаза сходна по действию с α-амилазой слюны. Она буквально в течение 4-5 мин гидролизует поступающий крахмал и гликоген до α-лимитдекстринов и мальтозы. Гидролиз α-лимитдекстрина происходит с помощью олиго-1,6-глюкозидазы, которая специфически разрывает α-1,6-гликозидные связи в точках "ветвления" полисахарида. При этом образуется мальтоза:  Дисахариды гидролизуются не в полости, а в стенке кишечника, поэтому образующиеся моносахариды сразу всасываются. Существуют α-специфичные и β-специфичные олигосахаридазы, которые расщепляют дисахариды до моносахаридов. К α-олигосахаридазам относятся мальтаза, изомальтаза, сахараза, α,α-трегалаза. Сахараза образует чаще всего комплекс с изомальтазой. Такой ферментативный сахаразо-изомальтазный комплекс (сахарозо-α-глюкогидролаза) расщепляет сахарозу на глюкозу и фруктозу, а изомальтозу - на две молекулы глюкозы. Мальтаза гидролизует мальтозу (иногда мальтаза образует комплекс с сахaразой): α, α-трегалаза расщепляет трегалозу: Среди β-олигосахаридаз наибольшее значение имеет специфичная β-галактозидаза, или лактаза, осуществляющая гидролиз лактозы: Конечными продуктами переваривания углеводов являются моносахариды, преимущественно глюкоза, фруктоза, галактоза. Доля остальных моносахаридов, поступающих с пищей, относительно невелика. Далее в тонком кишечнике происходит всасывание моносахаридов. Переваривание липидов Переваривание липидов происходит в тех отделах пищеварительного тракта, где имеются следующие обязательные условия: наличие липолитических ферментов, гидролизующих липиды; условия для эмульгирования липидов; оптимальный pH среды для действия липолитических ферментов (среда должна быть нейтральной или слабощелочной). Все эти условия создаются в кишечнике взрослого человека. У ребенка, особенно новорожденного, близкие условия создаются для переваривания триацилглицеринов молока желудочной липазой. pH среды желудочного содержимого ребенка около 5,0 (слабокислая среда), жир молока находится в виде эмульсии, поэтому возможно некоторое расщепление жира липазой. У взрослого человека сильнокислая среда инактивирует желудочную липазу. В кишечнике нейтрализуется поступающая из желудка пища, а жир подвергается эмульгированию. Эмульгирование липидов происходит под действием желчных кислот, поступающих в кишечник в составе желчи. В желчи находятся преимущественно следующие желчные кислоты - холевая, хенодезоксихолевая и их конъюгаты с глицином и таурином - гликохолевая и таурохенодезоксихолевая. Желчные кислоты выполняют следующие биологические функции: эмульгирующую; функцию активатора липолитических ферментов; транспортную, так как, образуя с высшими жирными кислотами транспортный комплекс, помогают их всасыванию в кишечнике. Все желчные кислоты являются амфифильными соединениями, поэтому обладают свойствами эмульгаторов. Располагаясь на поверхности раздела двух фаз жир-вода, желчные кислоты препятствуют их расслоению. Перистальтика кишечника помогает дроблению крупных капель жира, а желчные кислоты сохраняют их во взвешенном состоянии, мешая слиянию мелких жировых капель. Дополнительными эмульгаторами являются свободные жирные кислоты и моноацилглицерины, образующиеся в ходе переваривания липидов, пищевые фосфолипиды и продукты их частичного переваривания (фосфатидилхолин). Гидролиз триацилглицеринов, составляющих основную массу липидов пищи, происходит под действием панкреатической липазы. Липаза поступает в неактивном виде. Она активируется в кишечнике специальным кофактором - колипазой и желчными кислотами. Активная липаза действует на триацилглицерины жировой капли. Сам фермент растворен в водной части, а расщепляет субстрат, находящийся в липидной фазе. У липазы есть специальный гидрофобный участок (головка), с которым контактирует триацилглицерин. Гидролиз жира идет на самой поверхности раздела. Продуктами гидролиза являются чаще всего 2-моноацилглицерин и свободные жирные кислоты: 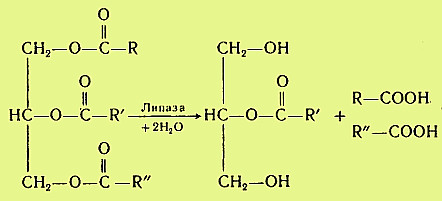 Карбоксиэстеразы кишечника и сока поджелудочной железы расщепляют 2-моноацилглицерин на свободную жирную кислоту и глицерин. Помогают гидролизу триацилглицеринов ионы кальция, которые образуют комплексы со свободными жирными кислотами. Гидролиз фосфолипидов осуществляется группой липолитических ферментов, называемых фосфолипазами. Существует несколько типов фосфолипаз, обозначаемых как А1, А2, С и D. Они гидролизуют разные связи в молекуле фосфолипида (показано на примере фосфатидилхолина): 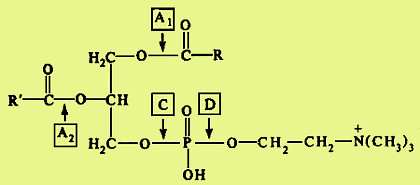 В кишечнике имеются фосфолипазы А2, С и, возможно, D и лизофосфолипаза, участвующие в расщеплении фосфолипидов пищи. В поджелудочной железе образуются преимущественно фосфолипаза А2 и в небольших количествах фосфолипаза С и лизофосфолипаза. В стенке кишечника также присутствуют фосфолипазы А2 и С. Кроме того, в кишечнике обнаружена лизофосфолипаза, которая отщепляет жирную кислоту не от целой молекулы фосфолипида, а от лизофосфатидов: 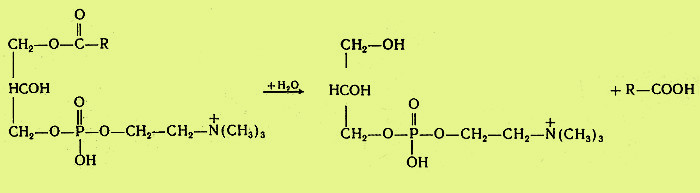 Активирование профосфолипазы А2 происходит в кишечном соке, где под действием трипсина отщепляется от профермента гексапептид. Кроме того, для работы фосфолипазы А2, как, впрочем, и для других фосфолипаз, требуются желчные кислоты и ионы кальция. Желчные кислоты помогают сближению субстрата с активным центром фермента, ионы кальция удаляют из зоны действия фермента свободные жирные кислоты (как и в случае с липазой) и препятствуют инактивации фосфолипазы. Продуктом действия фосфолипазы А2, являющейся основной пищеварительной фосфолипазой, являются чрезвычайно токсичные лизофосфатиды, которые тут же гидролизуются лизофосфолипазой. Фосфолипазы С и D завершают процесс гидролиза фосфоглицеридов. Конечными продуктами их гидролиза являются глицерин, жирные кислоты, неорганический фосфат и один из остаточных спиртов (холин, этаноламин, инозит, серии). Гидролиз других пищевых фосфолипидов - сфингофосфатидов, а также гликолипидов менее изучен. Однако в стенке кишечника обнаружены ферменты сфингомиелиназа и церамидаза. Первый из них гидролизует связь, образованную фосфорной кислотой и сфингозином в сфингомиелинах, а второй - N-ацильную связь в молекуле церамида. Это ведет к освобождению сфингозина, жирной кислоты и фосфохолина. Гидролиз стеридов. Поступающие с пищей эфиры холестерина, которыми богаты некоторые продукты (желток яиц, сливочное масло, икра и т. д.), расщепляются в эмульсионной капле кишечного содержимого с помощью панкреатической холестеролэстеразы. Активируется фермент также желчными кислотами. После действия фермента образуются свободный холестерин и жирные кислоты. Продукты гидролиза всех пищевых липидов всасываются в кишечнике. Переваривание белков Протеолитические ферменты, участвующие в переваривании белков и пептидов, синтезируются и выделяются в полость пищеварительного тракта в виде проферментов, или зимогенов. Зимогены неактивны и не могут переваривать собственные белки клеток. Активируются протеолитические ферменты в просвете кишечника, где действуют на пищевые белки. В желудочном соке человека имеются два протеолитических фермента - пепсин и гастриксин, которые очень близки по строению, что указывает на образование их из общего предшественника. Пепсин образуется в виде профермента - пепсиногена - в главных клетках слизистой желудка. Выделено несколько близких по строению пепсиногенов, из которых образуется несколько разновидностей пепсина: пепсин I, II (IIa, IIb), III. Пепсиногены активируются с помощью соляной кислоты, выделяющейся обкладочными клетками желудка, и аутокаталитически, т. е. с помощью образовавшихся молекул пепсина. Пепсиноген имеет молекулярную массу 40 000. Его полипептидная цепь включает пепсин (мол. масса 34 000); фрагмент полипептидной цепи, являющийся ингибитором пепсина (мол. масса 3100), и остаточный (структурный) полипептид. Ингибитор пепсина обладает резко основными свойствами, так как состоит из 8 остатков лизина и 4 остатков аргинина. Активация заключается в отщеплении от N-конца пепсиногена 42 аминокислотных остатков; сначала отщепляется остаточный полипептид, а затем ингибитор пепсина.  Пепсин относится к карбоксипротеиназам, содержащим остатки дикарбоновых аминокислот в активном центре с оптимумом pH 1,5-2,5. Субстратом пепсина являются белки - либо нативные, либо денатурированные. Последние легче поддаются гидролизу. Денатурацию белков пищи обеспечивает кулинарная обработка или действие соляной кислоты. Следует отметить следующие биологические функции соляной кислоты: активация пепсиногена; создание оптимума pH для действия пепсина и гастриксина в желудочном соке; денатурация пищевых белков; антимикробное действие. От денатурирующего влияния соляной кислоты и переваривающего действия пепсина собственные белки стенок желудка предохраняет слизистый секрет, содержащий гликопротеиды. Пепсин, являясь эндопептидазой, быстро расщепляет в белках внутренние пептидные связи, образованные карбоксильными группами ароматических аминокислот - фенилаланина, тирозина и триптофана. Медленнее гидролизует фермент пептидные связи между лейцином и дикарбоновыми аминокислотами типа: 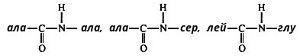 в полипептидной цепи. в полипептидной цепи.Гастриксин близок к пепсину по молекулярной массе (31 500). Оптимум pH у него около 3,5. Гастриксин гидролизует пептидные связи, образуемые дикарбоновыми аминокислотами. Соотношение пепсин/гастриксин в желудочном соке 4:1. При язвенной болезни соотношение меняется в пользу гастриксина. Присутствие в желудке двух протеиназ, из которых пепсин действует в сильнокислой среде, а гастриксин в среднекислой, позволяет организму легче приспосабливаться к особенностям питания. Например, растительно-молочное питание частично нейтрализует кислую среду желудочного сока, и pH благоприятствует переваривающему действию не пепсина, а гастриксина. Последний расщепляет связи в пищевом белке. Пепсин и гастриксин гидролизуют белки до смеси полипептидов (называемых также альбумозами и пептонами). Глубина переваривания белков в желудке зависит от длительности нахождения в нем пищи. Обычно это небольшой период, поэтому основная масса белков расщепляется в кишечнике.  Протеолитические ферменты кишечника. В кишечник протеолитические ферменты поступают из поджелудочной железы в виде проферментов: трипсиногена, химотрипсиногена, прокарбоксипептидаз А и В, проэластазы. Активирование этих ферментов происходит путем частичного протеолиза их полипептидной цепи, т. е. того фрагмента, который маскирует активный центр протеиназ. Ключевым процессом активирования всех проферментов является образование трипсина (рис. 1). Трипсиноген, поступающий из поджелудочной железы, активируется с помощью энтерокиназы, или энтеропептидазы, которая вырабатывается слизистой кишечника. Энтеропептидаза также выделяется в виде предшественника киназогена, который активируется протеазой желчи. Активированная энтеропептидаза быстро превращает трипсиноген в трипсин, трипсин осуществляет медленный аутокатализ и быстро активирует все остальные неактивные предшественники протеаз панкреатического сока. Механизм активирования трипсиногена заключается в гидролизе одной пептидной связи, в результате чего освобождается N-концевой гексапептид, называемый ингибитором трипсина. Далее трипсин, разрывая пептидные связи в остальных проферментах, вызывает образование активных ферментов. При этом образуются три разновидности химотрипсина, карбоксипептидазы А и В, эластаза. Кишечные протеиназы гидролизуют пептидные связи пищевых белков и полипептидов, образовавшихся после действия желудочных ферментов, до свободных аминокислот. Трипсин, химотрипсины, эластаза, будучи эндопептидазами, способствуют разрыву внутренних пептидных связей, дробя белки и полипептиды на более мелкие фрагменты. Трипсин гидролизует пептидные связи, образованные главным образом карбоксильными группами лизина и аргинина, менее активен он в отношении пептидных связей, образованных изолейцином. Химотрипсины наиболее активны в отношении пептидных связей, в образовании которых принимает участие тирозин, фенилаланин, триптофан. По специфичности действия химотрипсин похож на пепсин. Эластаза гидролизует те пептидные связи в полипептидах, где находится пролин. Карбоксипептидаза А относится к цинксодержащим ферментам. Она отщепляет от полипептидов С-концевые ароматические и алифатические аминокислоты, а карбоксипептидаза В - только С-концевые остатки лизина и аргинина. Ферменты, гидролизующие пептиды, имеются также и в слизистой кишечника, и хотя они могут секретироваться в просвет, но функционируют преимущественно внутриклеточно. Поэтому гидролиз небольших пептидов происходит после их поступления в клетки. Среди этих ферментов лейцинаминопептидаза, которая активируется цинком или марганцем, а также цистеином, и высвобождает N-концевые аминокислоты, а также дипептидазы, гидролизующие дипептиды на две аминокислоты. Дипептидазы активируются ионами кобальта, марганца и цистеином. Разнообразие протеолитических ферментов приводит к полному расщеплению белков до свободных аминокислот даже в том случае, если белки предварительно не подвергались действию пепсина в желудке. Поэтому больные после операции частичного или полного удаления желудка сохраняют способность усваивать белки пищи. Механизм переваривания сложных белков Белковая часть сложных белков переваривается так же, как и простых белков. Простетические группы их гидролизуются в зависимости от строения. Углеводный и липидный компоненты после отщепления их от белковой части гидролизуются амилолитическими и липолитическими ферментами. Порфириновая группа хромопротеидов не расщепляется. Представляет интерес процесс расщепления нуклеопротеидов, которыми богаты некоторые продукты питания. Нуклеиновый компонент отделяется от белка в кислой среде желудка. В кишечнике полинуклеотиды гидролизуются с помощью нуклеаз кишечника и поджелудочной железы. РНК и ДНК гидролизуются под действием панкреатических ферментов - рибонуклеазы (РНКазы) и дезоксирибонуклеазы (ДНКазы). Панкреатическая РНКаза имеет оптимум pH около 7,5. Она расщепляет внутренние межнуклеотидные связи в РНК. При этом образуются более короткие фрагменты полинуклеотида и циклические 2,3-нуклеотиды. Циклические фосфодиэфирные связи гидролизуются той же РНКазой или кишечной фосфодиэстеразой. Панкреатическая ДНКаза гидролизует межнуклеотидные связи в ДНК, поступающей с пищей. Продукты гидролиза полинуклеотидов - мононуклеотиды подвергаются действию ферментов кишечной стенки: нуклеотидазы и нуклеозидазы: 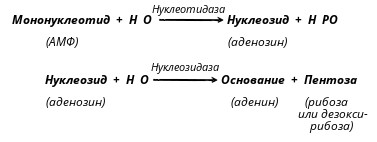 Эти ферменты обладают относительной групповой специфичностью и гидролизуют как рибонуклеотиды и рибонуклеозиды, так и дезоксирибонуклеотиды и дезоксирибонуклеозиды. Всасываются нуклеозиды, азотистые основания, рибоза или дезоксирибоза, Н3РO4. 13. Гликогеногенез. Схема процесса. Начинается с фосфорилирования глюкозы глюкокиназой (в печени) и гексокиназой в других тканях. На втором этапе глюкозо-6-фосфат превращается в глюкозо-1-фосфат под действием фосфоглюкомутазы. Далее происходит синтез нуклеотидного предшественника (УДФ-глюкозы). 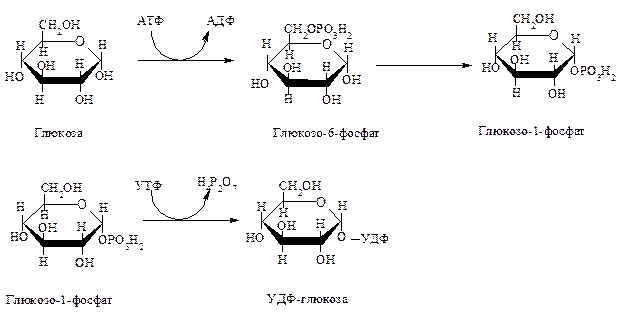 Уридиндифосфат-глюкоза (УДФ-глюкоза) образуется в результате реакции между глюкозо-1-фосфатом и уридинтрифосфатом. Образование новой молекулы гликогена требует наличия «затравки» гликогена. Остатки присоединяются к существующей гликогеновой цепи путем 1-4-гликозидной связи и таким образом наращивают полисахаридную цепь. УДФ-гл УДФ «Затравка» гликогена (С6Н10О5)n ----------------- → (С6Н10О5)n+1 Реакция катализируется гликогенсинтетазой. Это ограниченный по времени этап синтеза гликогена. Далее происходит разветвление молекулы. Сегменты амилозной цепи могут переноситься на другую аналогичную цепь с образованием α-1,6 гликозидной связи. Фермент, который осуществляет транспорт называется гликозил-1,6-трансфераза (разветвляющий фермент). д) Распад гликогена (гликогенолиз) Распад гликогена или его мобилизация происходит в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приемами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы. Процесс распада гликогена осуществляется 2 путями: 1 путь – фосфоролиз, 2 путь – гидролиз. Первый путь - фосфоролиз происходит во многих тканях. При этом к крайним молекулам глюкозы присоединяются фосфорные кислоты и одновременно происходит их отщепление в виде глюкозо-1-фосфатов. Ускоряет реакцию фосфорилаза. Так как гликоген сильно разветвленная молекула, концевых глюкоз много, фосфоролиз осуществляется быстро. 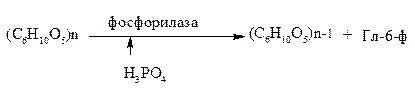 Глюкозо-1-фосфат затем переходит в глюкозо-6-фосфат, который не проникает через клеточную мембрану и используется только там, где образовался. Распад гликогена в печени и мышцах имеет одну различающую их реакцию, обусловленную наличием в печени фермента глюкозо-6-фосфатазы. Присутствие в печени этого фермента обусловливает главную функцию гликогена печени – освобождение глюкозы в кровь в период между приемами пищи и использование ее другими органами. Таким образом, мобилизация гликогена печени обеспечивает содержание глюкозы в крови на постоянном уровне. Это обстоятельство является обязательным условием для работы других органов и особенно мозга. Второй путь гликогенолиза – гидролиз, осуществляется преимущественно в печени под действием g-амилазы. При этом происходит отщепление крайней молекулы глюкозы от гликогена и свободная глюкоза может поступать в кровь. Е)Использование глюкозы в клетках. Глюкоза вклетке используется в различных превращениях, основными из которых являются: синтез гликогена, катаболизм с образованием лактата или СО2 и Н2О и выделением энергии, синтез пентоз. Часть глюкозы может быть использована на синтез галактозы, которая в свою очередь нужна для образования галактозо-6-фосфата→ Гагов→ гликопротеидов. В молочной железе в период лактации из галактозы и глюкозы образуется лактоза. Некоторая часть глюкозы может окислиться до глюкуроновой кислоты, которая может быть использована на синтез ГАГов или на реакции обезвреживания. Распад глюкозы до конечных продуктов служит источником энергии для организма. Вместе с тем промежуточные продукты метаболизма глюкозо-1-фосфата могут использоваться для синтеза аминокислот, нуклеотидов, глицерола и жирных кислот, других моносахаридов, гетерополисхаридов. 4. Студент при подготовке к экзаменам съел сразу 200 г сахара. Полезно ли это? Какие могут быть последствия? Ответ: Многое зависит от его почек, существует так называемый почечный порог. Если концентрация глюкозы в крови будет превышена почечного порога, тогда следует ожидать глюкозурию. Для глюкозы пороговая концентрация составляет около 150 мг на 100 мл крови. По математическим расчетам, если взять, что в среднестатистическом человеке 5 литров крови, то получается, что этот порог сильно превышен. Глюкозурия – нередко является врождённым расстройством, но может возникать под воздействием других факторов. Характеризуется тем, что из организма вместе с мочой выводится глюкоза, но, тем не менее уровень сахара в крови остаётся в пределах нормы. Такой процесс возникает потому, что нарушается всасывание почками глюкозы, которая попадает в кровь. Это заболевание обычно не сопровождается проявлением каких-либо симптомов. Диагноз подтверждается на основе анализов мочи, в которых обнаруживается высокая концентрация сахара. Иногда при сахарном диабете или при беременности такое нарушение может прогрессировать. |
