15. ПАТОЛОГИЯ МОЧЕОБРАЗОВАНИЯ И МОЧЕОТДЕЛЕНИЯ. Занятие 15 патология мочеобразования и мочеотделения тема основные синдромы в патологии почек. Методы оценки нарушений почечных функций
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
Не отмечается прямой зависимости между выраженностью цилиндрурии и тяжестью почечного поражения; при туберкулезе почки цилиндры обнаруживаются крайне редко. II. Гипертензивный синдром Диагноз гипертензии ставится в том случае, если давление крови, измеренное на обеих руках индивидуума моложе 50 лет не менее чем при трех посещениях врача превышает 150/95 мм рт. ст. (H. Harter. 1987). Специфическое давление крови определяется величиной сердечного выброса и сопротивлением сосудов и выражается следующей формулой: Давление крови = СВ ОПС, где СВ – величина сердечного выброса, а ОПС – общее периферическое сопротивление сосудов. Значительное влияние на АД оказывает и масса циркулирующей крови, которая принимает участие в формировании величин сердечного выброса. Почечные механизмы гипертензивного синдрома могут быть обусловлены (H. Harter. 1987): нарушением почечной экскреции натрия; нарушением функционирования ренин-ангиотензин-альдостероновой системы; нарушением высвобождения вазодепрессоров - простагландинов или калликреинов (рис. ….) Резистентность почек Неадекватное высвобождение ренина Высвобождение вазодепрессоров 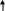 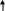 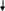 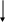 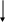  Нарушение экскреции натрия Ангиотензин II 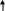 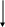 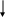 Объем плазмы Сопротивление сосудов      Сердечный выброс Кровяное давление    Рис. Нарушение почечных функций, обусловливающих развитие гипертензии (H. Harter. 1987) В настоящее время в регуляции АД наиболее изучена роль системы ренин-ангиотензин, запуск которой осуществляется при повышенной секреции ренина образующегося в той части афферентных артериол почек, которая прилежит к начальному сегменту дистальных извитых канальцев – плотному пятну. Секреция ренина  
Рис. Факторы, регулирующие секрецию ренина (по T.A.Kotchen, M.W. Roy, 1987; S. Klahr, 1987) Ангиотензиноген  Ренин  Расщепление брадикинина Агиотензинпревращающий фермент (АПФ), продуцируемый клетками эндотеля сосудов Ангитензин I Ангиотензин II Не АПФ-энзимный (химазный путь при участии сериновых протеиназ)        Первый подтип рецепторов Второй подтип рецепторов Рис. Схема ренин-ангиотензиновой системы (по В.А.Алмазову соавт., 1999) III. Нефротический синдром Нефротический синдром – клинико-лабораторный симптомокомплекс, характерный для разных заболеваний и включающий в себя помимо массивной протеинурии (белка более 3,5 г/сутки), гипоальбуминемию (менее 30 г/л сыворотки), гипопротеинемию и отеки (Л.Р. Полянцев, И.Е. Тареева, 1995). По данным А.Robson (1987), Д.Кершоу, Р.К.Виггинса (1999), В.А.Алмазова с соавт. (1999), к признакам нефротического синдрома относят и гиперлипедемию (гипертриглицеринемию). Частым (но не обязательным признаком нефротического синдрома) является гиперхолестеринемия. В детской практике нижней границей содержания белка при нефротической протеинурии считают 50 мг/кг/сутки. Для нефротического синдрома характерно развитие диспротеинемии, проявляющейся на фоне гипопротеинемии увеличением 2-глобулинов (на 50-70%), в основном, за счет гаптоглобина и 2-макроглобулина. Увеличение 2-глобулинов связано с их большей молекулярной массой, некоторым снижение катаболических процессов и стимуляция синтеза. Повышение продукции 2-макроглобулина вызывает изменения в системе гемостаза, так как этот белок является поливалентным ингибитором протеаз, таких как плазмин, тромбин, калликреин (В.А.Алмазов с соавт., 1999). Хотя у больных с нефротическим синдромом альбумины являются белком, теряющимся с мочой в наибольших количествах, потря с мочой других белков, хотя и в меньших количествах, может привести к значительным клиническим последствиям (Табл. ….). Таблица Последствия потери белка с мочой при нефротическом синдроме (по R.J.Glassock, 1978 – цитируется по A.Robson, 1987)
IV Отечный синдром Развитие отечного синдрома при патологии почек обусловлено, главным образом, такими механизмами как уменьшение онкотического давления, увеличение среднего гидростатического давления в капиллярах и повышение капиллярной проницаемости. Основным фактором, ответственным за образование отеков при нефротическом синдроме считается снижение онкотического давления плазмы, обусловленное прежде всего гипоальбуминемией. Онкотический эффект глобулинов из-за большего размера их молекул значительно меньше, чем альбуминов. Поэтому гиперглобулинемия не может компенсировать сниженную концентрацию альбуминов. Следовательно, гипоальбуминемия приводит к снижению онкотического давления независимо от изменений концентрации глобулина в плазме крови. Как правило, клинические отеки не обнаруживаются до тех пор, пока концентрация альбуминов в плазме не упадет до 20 г/литр, однако этот показатель может значительно варьировать (А.Robson, 1987). Патогенез отека при остром диффузном гломерулонефрите, сопровождающимся поражением клубочкового аппарата, связан с нарушением кровообращения в корковом слое почек, что обусловливает усиление секреции ренина юкстагломерулярными клетками. В связи с этим «включается» осмотический фактор развития отека, связанный с активацией РААС, усилением секреции АДГ, приводящим к положительному балансу натрия и воды (В.В. Падалко, 1992). Поскольку, для диффузного гломерулонефрита характерно повреждение мембран не только микрососудов почек, но всех тканей и органов, повышение капиллярной проницаемости также является существенным фактором патогенеза нефритического отека. Схема патогенеза развития нефритического и нефротического отеков см. раздел: «Нарушения водного обмена». ПРАКТИЧЕСКАЯ РАБОТА: Методы оценки функционального состояния почек Исследование функции почек начинается с определения диуреза. Диурез (синоним - мочевыделение) - общее количество мочи, выделяемое человеком в сутки. Колеблется от 1000 до 1800мл, снижаясь при ограничении поступления воды и повышаясь при приеме больших количеств жидкости. Нарушения диуреза проявляются полиурией, олигоурией, анурией. Полиурия - увеличение выделения мочи (для взрослого человека) свыше 1800мл за сутки. Причинами полиурии могут быть избыточное поступление воды, нарушения водно-солевого обмена и его регуляции (экстраренальная полиурия), патологические процессы в почках (ренальная полиурия). Механизм полиурии любого происхождения связан с уменьшением реабсорбции в канальцах почек профильтрованных веществ и воды, или только воды. В первом случае полиурия обусловлена осмотическим диурезом (или солурезом), во втором - водным диурезом. Полиурия может достигать 10-30 литров и может быть причиной летальной дегидратации (Ю.В. Наточин, 1983). Олигоурия - выделение мочи менее 500 мл/сутки, т.е. меньше того облигатного количества мочи, которое необходимо для выведения 600-700 мосмолей осмотически активных веществ, образующихся при нормальной диете и метаболизме в условиях максимальной осмолярности мочи, которая у человека редко превышает 1200 мосмоль/кг (S. Klahr, 1987). Патогенетически различают ренальную и экстраренальную олигоурию, которая в свою очередь может быть пре- и постренальной. В клинике олигоурия является одной из стадий развития острой почечной недостаточности и проявляется в терминальном периоде хронической почечной недостаточности. Анурия – означает снижение суточного объема мочи менее 100мл. Среди различных почечных функций, исследуемых в клинике, наиболее важное значение имеют (И.М. Кутырина, 1995): Определение скорости клубочковой фильтрации; Определение способности почек к осмотическому концентрированию и разведению мочи; Исследование способности почек к ацидофикации мочи. I. Определение СКФ по клиренсу креатинина Задание 1. Определение клиренса вещества (мочевины) Клиренс вещества – представляет собой тот объем плазмы, из которого выводится данное вещество в единицу времени.Поэтому значение клиренса выражается в единицах объема в единицу времени (мл/мин). Клиренс вещества зависит от скорости фильтрации и (или) секреции данного вещества в первичную мочу и от последующей реабсорбции в почечных канальцах. Например: 100 мл плазмы содержит 100 мг вещества Х. Содержание вещества Х в 1 мл плазмы, т.е. его концентрация [X] = 1 мг/мл. За 1 минуту профильтровалось 100 мл плазмы. Соответственно, в первичной моче оказалось 100 мг вещества Х. Подверглось реабсорбции в почечных канальцах 30 мг вещества Х. Соответственно, с мочой за 1 минуту будет выведено (100-30) = 70 мг вещества Х. Для определения клиренса вещества Х необходимо выяснить, в каком количестве плазмы содержится 70 мг этого вещества. Поскольку в 1 мл плазмы его содержится 1,0 мг, то для расчета количества плазмы, освобожденного от данного вещества необходимо: 70мг : 1мг/мл = 70 мл Т.о. клиренс вещества Х при данных условиях равен 70 мл/мин. Или (что одно и то же) 70мл плазмы очищаются от вещества Х за 1 минуту. Исходя из изложенного очевидно, что для определения клиренса вещества необходимо знать 2 параметра: Экскрецию данного вещества с мочой за единицу времени, которая представляет собой произведение концентрации вещества в моче (Ux) на объем мочи за единицу времени (V); (Ux V) Концентрацию вещества в плазме (Px). Тогда общая формула для определения клиренса любого вещества имеет следующий вид: Сх = (Ux V) : Рх (1) Рассчитайте клиренс мочевины если известно, что ее концентрация в крови составляет 140 мг/л, с мочой выводится примерно 50% от общего количества фильтруемой мочевины, а суточное количество мочи составляет 1800 мл. Решение: 1. Определим суммарное количество мочевины, фильтруемое за сутки, исходя из общего суточного объема гломерулярного фильтрата = 180 л. 140 мг/л 180 л = 25200 мг/сутки = 25,2 г/сутки 2. Определим количество мочевины, экскретируемое за сутки с мочой (50% от фильтруемого количества): 25200 : 2 =12500 мг/сутки = 12,5 г/сутки 3. Определим концентрацию мочевины в моче (Uх) 12500 мг : 1800 мл = 6,9 мг/мл 4. Определим количество мочи (V), выделяемое за 1 минуту, имея в виду, что в сутках (24ч 60 мин) = 1440 мин: 1800 мл : 1440 мин = 1,25 мл/мин 5. Рассчитаем клиренс мочевины Сх = (Ux V) : Рх: (6,9 мг/мл 1,25 мл/мин) : 0,14 мг/мл 62 мл/мин Задание 2. Определение скорости клубочковой фильтрации (СКФ) по клиренсу креатинина. СКФ – количество первичной мочи, образовавшейся за 1 минуту в результате ультрафильтрации (по существу – количество плазмы, профильтрованной за 1 минуту. Показатель фильтрационной способности клубочков. В норме 120-125 мл/мин. Если некое вещество является беспороговым, т.е. не подвергается реабсорбции, очевидно, что его клиренс определяется лишь скоростью поступления в просвет канальцев. И если известно, что такое поступление обеспечивается лишь путем фильтрации, также очевидно, что клиренс данного вещества будет равен скорости клубочковой фильтрации (СКФ). Таким беспороговым веществом, используемым для определения СКФ, является креатинин. Креатинин образуется в организме в результате обмена креатининфосфата в мышцах, а его количество, в основном, соотносится с массой мышц человека и в меньшей степени (чем, например, мочевина) обусловлено потреблением в этот день мясной пищи. Поэтому количество образующегося креатина для каждого человека изо дня в день представляет собой весьма постоянную величину. В норме концентрация креатинина в крови составляет 0,062-0,123 ммоль/л или около 1мг % (т.е. 1мг в 100мл крови). Ожидаемая скорость нормального выделения креатинина составляет 20-25 мг/кг массы тела в сутки для мужчин и 15-20 мг/кг массы тела в сутки для женщин (D. Kershaw, 1999). Определение СКФ по клиренсу креатинина может проводиться с использованием нагрузочной пробы или по клиренсу эндогенного креатинина. Рассчитайте СКФ по клиренсу креатинина при проведении нагрузочной пробы Реберга больному, у которого после приема per os 5,0 г креатинина за час собрано 90 мл мочи, содержащей 380 мг креатинина, при его концентрации в крови 6 мг% (0,06 мг/мл). Определим концентрацию креатинина в моче (Ux): 380 мг : 90 мл = 4,2 мг/мл Определим количество мочи, выделяемое за 1 минуту (V): 90 мл : 60 мин = 1,5 мл/мин 3. Определим клиренс креатинина Сх = (Ux V) : Рх: (4,2 мг/мл 1,5 мл/мин) : 0,06 мг/мл =105 мл/мин Но поскольку клиренс креатинина равен СКФ, приходим к заключению, что СКФ, определенное по данному показателю также равно 105 мл/мин. Рассчитайте СКФ по клиренсу эндогенного креатинина, если известно, что его содержание в суточной порции мочи, равной 1,0л, составляет 1500мг, а его концентрация в плазме крови - 2мг% (0,02 мг/мл). Определим концентрацию креатинина в моче (Ux): 1500 мг : 1000 мл = 1,5 мг/мл Определим количество мочи, выводимое за 1 минуту (V): 1000 мл : 1440 мин = 0,7 мл/мин 3. Определим клиренс креатинина Сх = (Ux V) : Рх: (1,5 0,7) : 0,02 = 52,5 мл/мин Соответственно, СКФ = 52,5 мл/мин, т.е. значительно снижен, поскольку клиренс эндогенного креатинина составляет 97-137мл/мин х 1,73м2 для мужчин и 18-128мл/мин х 1,73м2 у женщин (И.М. Кутырина, 1995). Патофизиологические механизмы, определяющие снижение СКФ при почечной патологии представлены в табл. Табл. Патофизиологические механизмы снижения СКФ при почечной патологии (по И.М. Кутыриной, 1995)
* Коэффициент ультрафильтрации (К1) представляет собой произведение гидравлической проницаемости почечных мембран и площади поверхности, доступной для фильтрации. Вместе с эффективным фильтрационным давлением этот показатель определяет скорость фильтрации (FR) - J.A. Shayman (1999). Значительно реже при патологических процессах в почках выявляется повышение СКФ. Его патофизиологическую основу составляют: 1. Увеличение давления ультрафильтрации; 2. Увеличение коэффициента ультрафильтрации; 3. Увеличение почечного кровотока. Эти факторы определяют механизм повышения СКФ на ранних стадиях сахарного диабета, гипертонической болезни, СКВ, в начальном периоде нефротического синдрома, а также в оставшихся нефронах частично резицированной (ремнантной) почки - И.М. Кутырина, 1995. II. Определение способности почек к осмотическому концентрированию и разведению мочи В клинической практике для характеристики осморегулирующей функции почек наиболее часто используют метод определения относительной плотности мочи, которая у здорового человека может колебаться в значительных пределах (1,002-1,030), что зависит от количества выпитой жидкости, пищевого рациона, интенсивности потоотделения. При выявлении плотности мочи более 1,020 в утренней, наиболее концентрированной порции мочи, функциональное состояние почек характеризуется как сохранное. Нарушения относительной плотности мочи определяются понятиями гиперстенурии, гипостенурии, изостенурии и астенурии. Гиперстенурия - повышение относительной плотности мочи. Гиперстенурия не связана с нарушением концентрационной способности почек и встречается при таких состояниях, как некомпенсированный сахарный диабет, гиперпродукция антидиуретического гормона, лихорадка, потеря больших количеств воды (рвота, понос и т.д.). Гипостенурия - выделение мочи постоянно низкого удельного веса. В происхождении гипостенурии имеют значение нарушения процессов концентрирования мочи, зависящие от состояния канальцевого аппарата и интерстиция почки, а также от повышенной концентрации осмотически активных веществ в первичной моче, которые препятствуют реабсорбции воды (В.В. Сура, Н.А. Мухин, 1977). Изостенурия - состояние, характеризующееся выраженным ограничением концентрационной функции почек, при котором удельный вес мочи становится равным относительной плотности безбелкового фильтрата плазмы (1,010-1,012). Имеет тот же механизм развития, что и гипостенурия. Астенурия - состояние, при котором фактически полностью нарушается концентрационная способность почек и удельный вес мочи не превышает 1,001 (В.А. Алмазов с соавт., 1999). Снижение относительной плотности мочи наблюдается (Л.В. Козловская, 1995) при старении, избыточном потреблении жидкости, малосолевой и бедной белком диете, при применении диуретиков, при снижении продукции АДГ, при почечных канальцевых дисфункциях (калийпеническая почка, синдром Фанкони, почечный несахарный диабет), при тубулоинтерстициальном нефрите, гидронефрозе, поликистозе почек. Длительное выделение мочи относительно низкой плотности (при исключении вышеперечисленных причин) свидетельствует о хронической почечной недостаточности. Задание 3. Определение осмолярного клиренса, клиренса осмотически свободной воды и реабсорбции осмотически свободной воды. Простота выполнения и доступность способствовали широкому распространению метода определения относительной плотности мочи. Вместе с тем этот метод менее точен по сравнению с исследованием осмолярности мочи, т.к. на значения относительной плотности влияют не только осмотически активные вещества, но и содержание в моче белка, сахара, контрастных веществ, при которых этот показатель значительно возрастает. Поэтому важное диагностическое значение приобретает определение показателей, характеризующих осмолярный клиренс, а также клиренс осмотически свободной воды и реабсорбцию осмотически свободной воды. Для определения осмолярного клиренса используется приводимая выше формула определения клиренса любых веществ (1): Сх = (Ux V) : Рх В данном случае она приобретает вид: Сосм = (Uосм V) : Росм Т.е. для определения осмолярного клиренса необходимо знать показатели осмолярности мочи, плазмы крови и объема мочи, выводимого за единицу времени. Осмолярный клиренс характеризует количество воды, необходимое для выведения всех осмотически активных веществ мочи в связанном с водой состоянии. Клиренс осмотически свободной воды и реабсорбция осмотически свободной воды рассчитываются как разность между диурезом (в единицу времени) и осмолярным клиренсом. V – Cосм При этом возможны три варианта. Первый из них может характеризоваться отсутствием различий между этими показателями. Это означает, что в почках осуществляется реабсорбция воды только в связанном с осмотическими веществами состоянии и при этом работы по концентрированию или разведению мочи не происходит. В том случае, если эта величина положительная, она характеризует собой клиренс осмотически свободной воды (СН2О), т.е. воды, не содержащей растворенных веществ или воды, дополнительно выделяемой почками из организма, сверх того объема, который необходим для экскреции осмотически активных веществ, извлекаемых из плазмы. Клиренс осмотически свободной воды характеризует интенсивность процесса разведения мочи в разводящих сегментах нефрона (в кортикальном отделе восходящего колена петли Генле, дистальных извитых канальцах и кортикальных отделах собирательных трубок) в условиях отсутствия секреции АДГ. В том случае, если эта величина отрицательная, она характеризует собой реабсорбцию осмотически свободной воды (ТсН2О), т.е. удержание почками части свободной воды в организме, при участии антидиуретического гормона (АДГ), сопровождающееся концентрированием осмотически активных веществ (в медулярном отделе собирательных трубок) в выводимом объеме мочи. Иными словами, это тот объем воды, который следовало бы добавить к моче, чтобы осмоляльность последней соответствовала осмоляльности плазмы. а)Рассчитайте значения осмолярного клиренса и клиренса свободной воды у больного Х, если известно, что Росм = 285 мосм/л, Uосм = 400мосм/л, суточный диурез 1,2 л. Определим величину диуреза (V) за 1 минуту: 1200 мл : 1440 мин = 0,83 мл/мин Определим величину осмолярного клиренса: Сосм = (Uосм V) : Росм: Сосм = (400 мосм/л 0,83 мл/мин) : 285 мосм/л = 1,16 мл/мин Определим клиренс свободной воды: (V-Cосм): 0,83 мл/мин - 1,16 мл/мин = - 0,33 мл/мин Таким образом, у данного больного клиренс свободной воды отсутствует. Имеет место задержка свободной воды, что характерно в ситуациях, связанных, например, с обезвоживанием организма. б)Рассчитайте значения осмолярного клиренса и клиренса свободной воды у больного Y, если известно, что Росм = 285 мосм/л, Uосм = 200мосм/л, суточный диурез 1,2 л. 1. Определим величину диуреза (V) за 1 минуту: 1200 мл : 1440 мин = 0,83 мл/мин 2. Определим величину осмолярного клиренса: Сосм = (Uосм V) : Росм: Сосм = (200 мосм/л 0,83 мл/мин) : 285 мосм/л = 0,58 мл/мин 3. Определим клиренс свободной воды: (V-Cосм): 0,83 мл/мин - 0,58 мл/мин = + 0,25 мл/мин Таким образом, у данного больного имеет место клиренс свободной воды, составляющий 0,25мл/мин. Т.е. происходит дополнительное разведение осмотически активных веществ, извлекаемых из плазмы, что характерно в ситуациях, связанных, например, с гипергидратацией организма (как компенсаторная реакция для освобождения от избытка воды) или при нарушении способности почек к концентрированию мочи. III. Исследование функции почек по регуляции кислотно-основного состояния В клинической практике для оценки этой функции почек исследуют рН мочи, экскрецию гидрокарбоната, титруемую кислотность и экскрецию аммиака. У здорового человека рН мочи колеблется от 4,5 до 7,5 и находится чаще в пределах от 5,5 до 6,5. Кислотность мочи зависит от особенности питания: снижается при использовании растительной пищи и повышается при употреблении мясной пищи. Экскреция гидрокарбоната в нормальных условиях невелика и составляет 1-2 ммоль/сутки. Титруемая кислотность мочи - количество щелочи, пошедшей на титрование мочи при доведении ее рН до значения рН крови. Характеризует процесс ацидогенеза в дистальных канальцах, обеспечивающий связывание нелетучих кислот с НРО42-. В норме составляет 10-30 ммоль/сутки. Секреция аммиака - отражает функцию аммониегенеза в дистальных канальцах, заключающуюся в связывании NH3 ионов водорода нелетучих кислот и их выведение в виде ионов аммония. У здорового человека этот показатель равен 30-60 ммоль/сутки. Таким образом, вместе с ацидогенезом общая экскреция почками нелетучих кислот составляет 40-90 ммоль/сутки при отношении суточного выделения аммония к титруемой кислотности мочи, равному 1,0-2,5. Нарушения участия почек в регуляции КОС могут быть обусловлены: Неспособностью почек к выведению нормальной эндогенной нагрузки нелетучих кислот (ХПН, ОПН). Развивается метаболический ацидоз. Снижению способности нефроцитов дистальных канальцев к секреции Н+ ионов в просвет канальца либо (что, вероятно, встречается чаще) - возрастание проницаемости нефронов для секретированных ионов водорода. Развивается дистальный почечный канальцевый ацидоз I типа. Почечной потерей гидрокарбоната из организма при поражении проксимальых канальцев Развивается дистальный почечный канальцевый ацидоз II типа. Злоупотреблением диуретиками, ингибиторами карбоангидразы. Развивается метаболический ацидоз. Злоупотреблением диуретиками, тормозящими реабсорбцию натрия и воды в области петли Генле. Развивается метаболический алкалоз. Повышением почечной продукции ренина при стенозе почечной артерии, синдроме Бартера, гиперренинемической гипертензии. Контрольные вопросы: 1. Общая этиология и патогенез нарушений функций почек. 2. Изменения диуреза почечного и непочечного происхождения. Понятия «олигоурия», «анурия». 3. Основные синдромы, характерные для патологии почек: мочевой, гипертензивный, нефротический, отечный. 4. Проявления мочевого синдрома: протеинурия, лейкоцитурия, цилиндрурия, гематурия. Определение понятий. 5. Гематурия почечного и непочечного происхождения. Основные причины. 6. Протеинурия. Характеристика основных типов и механизмов развития патологической протеинурии 7. Гипертензивный синдром. Почечные механизмы развития гипертензивного синдрома. 8. Нефротический синдром. Определение понятий. Последствия потери белка при нефротическом синдроме. 9. Отечный синдром. Механизмы его развития при патологии почек. Патогенез отеков при нефротическом синдроме и остром диффузном гломерулонефрите. 10. Нарушение концентрационной способности почек. Понятия «гиперстенурия», «гипостенурия», «изостенурия», «астенурия». 11. Клиренс вещества. Определение понятия. Решение типовых задач по определению СКФ по клиренсу креатинина. 12.Виды патологии кислотно-основного состояния, связанные с нарушением участия почек в его регуляции. ПАТОЛОГИЯ МОЧЕОБРАЗОВАНИЯ И МОЧЕОТДЕЛЕНИЯ ТЕМА: ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ. ХРОНИЧЕСКАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ. УРЕМИЧЕСКИЙ СИНДРОМ. ОСТРЫЙ ДИФФУЗНЫЙ ГЛОМЕРУЛОНЕФРИТ Цель занятия: Сформировать представления о патогенезе развития острой и хронической почечной недостаточности, сопутствующих им нарушениях водно-электролитного обмена. Уяснить понятие уремии. Определить основные этиологические факторы и патогенетические механизмы, лежащие в основе острого диффузного гломерулонефрита. I. Острая почечная недостаточность Острая почечная недостаточность (ОПН) - потенциально обратимое, быстрое (развивающееся в течение нескольких часов или дней) нарушение гомеостатической функции почек, чаще всего ишемического или токсического генеза(В.М. Ермоленко, 1995). Это нарушение распознается по повышению концентрации азота мочевины крови, креатинина и обычно по снижению выделения мочи. Общепринято подразделять ОПН на преренальную, связанную с недостаточным кровообращением почек, ренальную, вызываемую поражением собственной почечной паренхимы и постренальную, обусловленную препятствием оттоку мочи. Табл. Дифференциально-диагностические признаки преренальной и ренальной острой почечной недостаточности* (no J.A. Shayman, 1999; К. Martin, 1987; В.М. Ермоленко, 1995)
*Диагностическая ценность критериев снижается у престарелых больных, при приеме диуретиков, при циррозе печени, при развитии ОПН на фоне острого гломерулонефрита, васкулита, при использовании некоторых лекарственных препаратов (St.B. Miller, 1995). Табл. Стадии развития острой почечной недостаточности (K. Martin, 1987; В.М. Ермоленко, 1995)
* у 30-40% больных с острым некрозом канальцев олигурия отсутствует: диурез превышает 500 мл/сутки. Поэтому диурез не может и не должен рассматриваться как точное отражение СКФ при развитии острого некроза канальцев (J.A. Shayman, 1999). ** у некоторых больных снижение СКФ от легкой до умеренной степени сохраняется. Могут также персистировать клинически незначительные отклонения в способности почек к концентрации и разведения мочи, а также ацидогенезу (К. Martin, 1987). Этиологические факторы (гипотензия - ишемия - нефротоксины) Активация ПОЛ   Острый тубулярный некроз      Нарушение реабсорбции натрия в проксимальных канальцах   Слущивание эпителия почечных канальцев Утечка канальцевого содержимого в почечный интерстиций   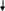 Повышенное поступление натрия в дистальный отдел Внутриканальцевая обструкция эпителием Сдавление почечных канальцев  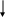 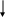 Повышение внутриканальцевого давления Раздражение рецепторов macula densa 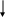 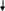 Активация ЮГА Снижение эффективного фильтрационного давления и транскапиллярного транспорта Падение СКФ 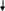 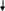  Стимуляция продукции ренина 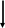   Спазм vas afferens Падение кровотока в капиллярах клубочка Олигурия   Падение периканальцевого кровотока  Рис. Схема патогенеза формирования олигурии при острой почечной недостаточности II. Хроническая почечная недостаточность Хроническая почечная недостаточность (ХПН). Этим термином обозначают конечные стадии многих почечных и системных заболеваний, для которых общим характерным признаком является необратимое значительное уменьшение массы действующих нефронов в почках. Важнейшим отличием ХПН от ОПH является cnocобность почек при хронической почечной недостаточности поддерживать внешний баланс воды и электролитов, что позволяет организму существовать в условиях нормального уровня поступления пищи и воды (Б.И. Ткаченко, 1999) в течение иногда значительного периода времени. Табл. Периоды развития хронической почечной недостаточности
Основные патогенетические механизмы снижения почечных функции при хронической почечной недостаточности (по Ф. Гоффстен, С. Клар, 1987) • Уменьшение количества функционирующих нефронов • Значительное снижение СКФ в каждом отдельном нефроне без уменьшения их количества • Сочетание обоих механизмов ХРОНИЧЕСКАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
