10. Адсорбция на твердых сорбентах. Занятие (4часа) адсорбция на твердых сорбентах теоретическое пояснение
 Скачать 130.36 Kb. Скачать 130.36 Kb.
|
19,20-занятие (4-часа)АДСОРБЦИЯ НА ТВЕРДЫХ СОРБЕНТАХ Теоретическое пояснение: твердое тело или жидкость, на поверхности которых происходит адсорбция, называется адсорбентом, а адсорбирующееся вещество – адсорбатом или адсорбтивом. Процесс самопроизвольного накопления вещества на границе раздела фаз называется адсорбцией (Г). Она выражается количеством вещества, адсорбированного единицей поверхности или массы (моль/м2 , моль/г). Адсорбция, осуществляющая под действием сил Ван-дер-Ваальса и водородных связей, называется физической, а адсорбция, в основе которой лежит возникновение ковалентных связей между молекулами адсорбента и адсорбтива, называется химической или хемосорбцией. Физическая адсорбция представляет обратимый процесс и сопровождается десорбцией (освобождением поверхности от адсорбированного вещества). Между адсорбцией и десорбцией устанавливается динамическое равновесие, положение которого зависит от температуры. Повышение температуры понижает физическую адсорбцию и усиливает химическую адсорбцию. Десорбция осуществляется разрушением адсорбента, изменением температуры и снижением сил адсорбционного взаимодействия. Последняя широко используется в виде элюции. Элюция – это смена граничащей с адсорбентом фазы, например раствора, в целях десорбции вещества. При элюции адсорбированное вещество вытесняется с адсорбента молекулами нового растворителя или в результате понижения адсорбционного сродства веществами, растворенными в новом растворе (чаще всего путем изменения заряда молекул адсорбента и адсорбтива вследствие изменения рН или ионной силы раствора). Характерным признаком адсорбции является её избирательность (специфичность). Это означает, что каждый адсорбент адсорбирует одно или несколько определенных веществ. Избирательность адсорбции предполагает случайное совпадение в распределении электронной плотности молекул адсорбента и адсорбтива по типу «ключ – замок», т.е. химическое сродство между адсорбентом и адсорбтивом. Адсорбция на твердой поверхности имеет некоторых особенностей. Твердая поверхность физически неоднородна. На ней имеются активные центры (выступы, углубления), на которых протекает адсорбция молекул газа или жидкости. Твердая поверхность молекулярно неподвижна и поверхностное натяжение на твердой поверхности невозможно измерить. По своей природе адсорбция на поверхности твердого тела полимолекулярна, т.е. поверх первого слоя адсорбированных молекул могут адсорбироваться несколько слоев их. Однако при небольшой концентрации адсорбируемого вещества образуется только один слой адсорбированных молекул. Ленгмюр считал, что адсорбция на твердой поверхности имеет мономолекулярную природу, т.е. адсорбция продолжается до тех пор, пока поверхность не будет полностью покрыта адсорбированными молекулами. Дополнительная адсорбция, т.е. образование 2-го, 3-го или большего количества слоев невозможно. Исходя из этих представлений он вывел количественную зависимость между величиной адсорбции и концентрацией адсорбтива при постоянной температуре: 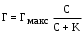 , , где Г – величина адсорбции, т.е. разность концентраций вещества на поверхности и в прилегающем (жидком или газофазном) слое; Гmaкс – предельная величина адсорбции, достигаемая при плотном заполнении мономолекулярного слоя; С – равновесная концентрация; К – константа равновесия, равная отношению констант скоростей десорбции и адсорбции. Адсорбция из растворов на твердой поверхности играет важную роль в процессах образования, разрушения и устойчивости коллоидных систем. С ней связаны процессы очистки и рекуперации, извлечения из растворов ценных примесей, усвоения живыми организмами питательных веществ и др. Экспериментально количество адсорбированного вещества на твердой поверхности определяют путем измерения концентрации раствора до адсорбции (Со) и равновесной концентрации после адсорбции (Ср): 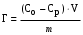 , ммоль/г, , ммоль/г,где V – объем раствора; m – масса адсорбента. В случае адсорбции на пористых адсорбентах было установлено отклонение адсорбции от уравнения Ленгмюра. Для такой адсорбции Фрейндлихом было предложено эмпирическое уравнение: Г = KС1/n, где Г = v(X)/m – величина адсорбции (отношение количества вещества к массе адсорбента), ммоль/г; С – равновесная концентрация, ммоль/л; K и n – эмпирически подобранные константы. По уравнению Фрейндлиха адсорбция возрастает без предела, но оно не дает точных значений величин адсорбции в области низких и больших концентраций. Уравнение применяется для описания адсорбции в области средних концентраций растворов или давлений в случае адсорбции из газовой фазы. АДСОРБЦИЯ НА ПОВЕРХНОСТИ ЖИДКОСТИ Теоретическое пояснение: на поверхности жидкости обычно адсорбируются растворенные в ней вещества. Вещество, молекулы которого сильнее взаимодействуют друг с другом, чем с молекулами жидкости, вытесняется из среды жидкости и накапливается на поверхности (подвергается положительной адсорбции). Попав на поверхность жидкости, молекулы вещества частично компенсируют втяжение поверхностных молекул жидкости нижележащими молекулами. Поэ-тому молекулярное давление и поверхностное натяжение жидкости понизятся (рис.1). Вещества, понижающие поверхностное натяжение раствора, называются поверхностно-активными (ПАВ). Молекулы ПАВ обладают дифильной природой, т.е соединения состоящие из полярных и неполярных групп. Полярными свойствами обладают такие атомные группировки, как −COOH, −OH, −NH2, −NO, −CHO, −SO3H. Эти группы способны гидратации и являются гидрофильными. Они обеспечивают растворимость ПАВ. 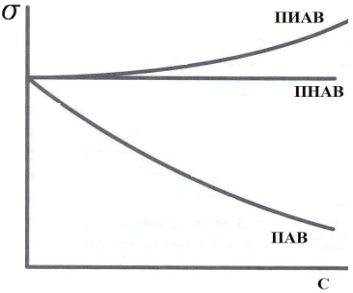 Рис.1. Изотерма поверхностного натяжения Неполярными группами являются различные алифатические и ароматические углеводородные радикалы. Их называют гидрофобными, или липофильными группами. Неполярные группы плохо взаимодействуют с водой, что обуславливает невысокую растворимость ПАВ в воде. В зависимости от длины липофильной группы различают коротко- и длинно-цепочечные ПАВ. Короткоцепочечным ПАВ относят соединения с небольшой молекулярной массой, например, низшие жирные кислоты, низшие спирты (масляная кислота, амиловый спирт). Короткоцепочечные ПАВ в растворах находятся в виде молекул и ионов, т.е. образуют истинные растворы. Длинноце-почечными ПАВ являются соединения с сравнительно большой молекулярной массой (высшие спирты, жирные кислоты, алкилсульфонаты, полиоксиэтилированные фенолы, мыла, большинство синтетических ПАВ, применяемых в про-мышленности и в быту). Они являются полуколлоидами и в растворе находятся в виде молекул, ионов и скоплений молекул (мицелл). В связи с этим их называют коллоидными (мицеллярными) ПАВ. Если молекулы вещества, сильнее взаимодействуют с молекулами жидкости, чем друг с другом, то они сольватируются и они не могут попасть на поверхность жидкости (подвергаются отрицательной адсорбции). Молекулы таких веществ усиливают втяжение поверхностных молекул жидкости внутрь её, следовательно, молекулярное давление и поверхностное натяжение раствора может незначительно увеличиваться. Вещества, повышающие поверхностное натяжение растворов, называются поверхностно-инактивными (ПИАВ). Поверхностно-инактивными веществами в водных растворах являются хорошо раство-римые полярные вещества, чаще всего электролиты: соли, низшие спирты, углеводы, аминокислоты. Вещества, которые не изменяют поверхностное натяжение жидкости называются поверхностно-неактивными. Примерами таких веществ являются сахароза, бензол и др. Исходя из термодинамических представлений, Д.Гиббс вывел зависимость между адсорбцией и поверхностным натяжением, т.е. уравнение изотермы адсорбции на жидкой поверхности:
где Г − величина адсорбции (моль/м2), т.е. разность концентраций (количеств) адсорбируемого вещества (абсорбтива) на единице поверхности и в обьеме раствора такой же толщины; |
| Кислота | Поверхностная активность |
| Масляная кислота СН3-СН2-СН2-СООН | 1 |
| Валериановая кислота СН3-СН2-СН2-СН2-СООН | 3 |
| Капроновая кислота СН3-СН2-СН2-СН2-СН2-СООН | 9 |
Поверхностную активность определяют по графику зависимости поверхностного натяжения от концентрации раствора. При этом поверхностную активность выражают как тангенс угла между касательной к изотерме (при концентрации М) и осью абсцисс при данной температуре, т.е. практически определяют как отношение катетов (рис. 2):
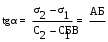 .
.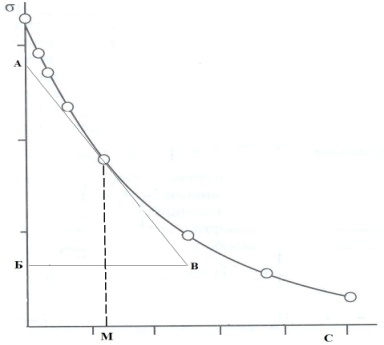
Рис.2. Графическое определение поверхностной активности
Снижение поверхностного натяжения в растворах ПАВ обусловлено нерав-номерным распределением их молекул между поверхностным слоем и глубиной раствора. Благодаря дифильному строению ПАВ их молекулы самопроизвольно образуют ориентированный монослой на поверхности раздела фаз: полярные группы молекул (кружки – “головы”) распологаются в водной (полярной) фазе, а гидрофобные радикалы (хвосты) вытесняются из водной среды и переходят в неполярную (менее полярную) фазу (например, в воздух).
При повышении концентрации ПАВ количество адсорбированных молекул возрастает, что вызывает их переориентацию. При плотной упаковке слоя липо-фильные группы располагаются вертикально, в направлении от поверхности раствора к прилегающей гидрофобной фазе (например, воздуху) и образуют упорядоченную структуру. Эту структуру называют «частоколом Лэнгмюра».
Адсорбционный слой на поверхности жидкости имеет динамический характер: адсорбированные молекулы десорбируются и и переходят в раствор, а на их место из раствора адсорбируются новые молекулы. Этот процесс продолжается до наступления динамического равновесия.
Адсорбция на поверхности жидкости происходит в соответствии с теорией мономолекулярной адсорбции Лэнгмюра. Величина адсорбции на поверхности жидкости возрастает до тех пор, пока вся поверхность не покроется одним слоем адсорбированных молекул. При этом достигается максимальное понижение молекулярного давления и поверхностного натяжения раствора.
Зависимость поверхностного натяжения от концентрации растворенного вещества при постоянной температуре называют изотермой поверхностного натяжения (рис.1). С повышением концентрации ПАВ в растворах поверхностное натяжение раствора снижается до поверхностного натяжения чистого ПАВ, а величина адсорбции достигает предела (Гмах). Изотерма адсорции на жидкой поверхности зеркально обратна изотерме поверхностного натяжения, т.к. обе они характеризуют образование одного процесса − процесса образования мономолекулярного слоя адсорбированных молекул.
Поверхностное натяжение растворов определяют различными методами: капиллярного поднятия, сталагмометрический (метод счета капель), отрыва кольца от жидкости, определения наибольшого давления пузырьков (метод Ребиндера).
Из них прост и достаточно точен сталагмометрический метод. Он основан на том, что в момент отрыва под действием силы тяжести от конца капилляра капли жидкости, её вес практически равен силе поверхностного натяжения, приложенной к окружности капилляра. Для разбавленных растворов, плотность которых мало отличается от плотности воды, поверхностное натяжение можно вычислить по уравнению:
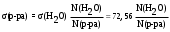 , мДж/м2.
, мДж/м2.Поскольку адсорбция на поверхности жидкости подчиняется уравнению Ленгмюра, максимальную величину адсорбции (Гмах) можно определить расчетным или графическим методом (как котангенс угла наклона прямой на графике 1/Г = f(1/С), см. рис.4). По величине максимальной адсорбции можно рассчитать площадь поверхности, занятой одной молекулой в мономолекулярном слое, длину молекулы (она равна толщине монослоя).
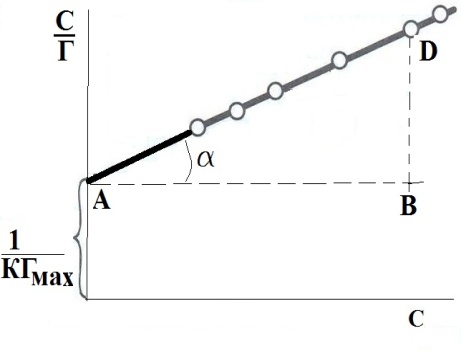
Рис.4. Определение констант в уравнении Лэнгмюра
Учитывая, что на поверхности площадью 1м2 в полностью заполненном мономолекулярном слое количество адсорбированного вещества равно Гмах , а число молекул на 1м2 равно NA. Гмакс, площадь, занимаемая одной молекулы равна:
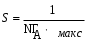 , м2.
, м2.Для установления длины молекулы достаточно определить массу вещества, адсорбированного на 1м2 поверхности. Зная, что масса равна произведению обьема монослоя площадью 1м2 на плотность вещества (V.d), а обьем – произведению длины молекулы на площадь 1м2 (1l ) можно записать, что: m = l.d. Массу вещества в монослое площадью 1м2 можно определить как произведение максимальной величины адсорбции на молекулярную массу ПАВ, т.е. m = Гмакс.М(Х). Отсюда, приравнивая значения масс, можно установить длину молекулы ПАВ:
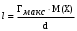 , м.
, м.Оказывается площадь, занимаемая молекулами ПАВ гомологического ряда при плотном заполнении адсорбционного слоя, одинакова. Так, например, площадь, занимаемая молекулами жирных кислот равна 2,1.10−15 см2. Это связано тем, что, независимо от длины углеводородных радикалов, полярные группы молекул разных ПАВ одного гомологического ряда, имеют одинаковую ориентацию к поверхности. Длина же молекул ПАВ, оказалось разной. На одно звено –СН2− прирост толщины монослоя составляет 1,4.10−8 см.
Примеры решения задач
Пример 1.
Предельная адсорбция ПАВ некоторым адсорбентом составляет 0,005 моль/г. Вычислите массу адсорбированного ПАВ из раствора равновесной концентрацией 0,1 моль/л адсорбентом массой 2 г. Относительная молекулярная масса ПАВ равна 60, а константа равновесия 0,06 моль/л.
Решение:
| Дано: Гмакс = 0,005 моль/г С = 0,1 моль/л K = 0,06 моль/л m(адсорбента) = 2 г m(ПАВ) − ? | величина адсорбции вычисляем по уравнению Ленгмюра: 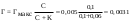 (моль/г) (моль/г)2) количество ПАВ, адсорбированное двумя граммами адсорбента будет 2 раза больше: v(ПАВ) = 2Г = 0,0062 моль 3) вычисляем массу ПАВ: m(ПАВ) =v(ПАВ).М = 0,0062.60 = 0,37 г. Ответ: 0,37 г. |
Пример 2.
Определить адсорбцию масляной кислоты при 290 K, если для её растворов при концентрации 0,0103 кмоль/м3 значение поверхностного натяжения равно 65,45.10−3 Дж/м2, а при 0,0206 кмоль/м3 – 59,78.10−3 Дж/м2.
R =8,314.103Дж/(кмоль.К).
Решение:
| Дано: T = 290 K C1 = 0,0103 кмоль/м3 s1 = 65,45.10−3 Дж/м2 C2 = 0,0206 кмоль/м3 s1 =59,78.10−3 кмоль/м3 R = 8,314.103Дж/(кмоль.К) Г − ? | адсорбция жидкости на жидкой поверхности вычисляется по уравнению Гиббса: 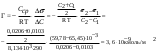 Ответ: 3,6.10−9 кмоль/м2 |
Пример 3.
Для проведения адсорбции к 50 мл раствора уксусной кислоты внесено 2 г активированного угля. Температура опыта 25оС. Объемы 0,1 М раствора NaOH, израсходованных на титрование 20 мл растворов кислоты до и после адсорбции составили 2,6 и 0,6 мл. Вычислите величину адсорбции.
Решение:
| Дано: m(адсорбента) = 2 г V1(CH3COOH) = 50 мл V2(CH3COOH) = 20 мл C(NaOH) = 0,1 моль/л V1(NaOH) = 2,6 мл V2(NaOH) = 0,6 мл Г − ? | адсорбция жидкости на твердой поверхности вычисляется по уравнению: 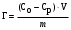 1) вычисляем концентрации кислоты до и после адсорбции по закону эквивалентов: 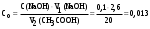 моль/л моль/л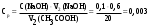 2) вычисляем адсорбцию: 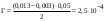 моль/г моль/гОтвет: 0,25 ммоль/г. |
Пример 4.
Величина предельной адсорбции бутанола составляет 7,69.10−6 моль/м2. Вычислите площадь, занимаемой одной молекулой и длину молекулы бутанола. Плотность бутанола равна 0,809 г/мл, молярная масса 74 г/моль.
Решение:
| Дано: Гмакс = 7,69.10−6 моль/м2 d = 0,809 г/мл M(C4H9OH) = 74 г/моль NA = 6,02.1023 S −? l − ? | 1) площадь, занимаемой одной молекулой в плотном мономолекулярном слое вычисляем по формуле: 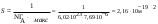 2) длину молекулы рассчитываем по формуле: 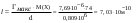 Ответ: S = 2,16.10−19 м2; l = 7,03.10−10 м. |
Вопросы и задачи для самоподготовки
Что такое абсорбция, адсорбция, адсорбент, адсорбтив? Какие силы могут действовать между молекулами или ионами адсорбента и адсорбтива? Основные виды адсорбции.
Объясните физический смысл динамического адсорбционного равновесия. Какие воздействия могут изменять это равновесие?
В чём заключается и чем объясняется избирательность адсорбции на твердой поверхности? Правило Панета Фаянса для эквивалентной адсорбции.
Смысл теории мономолекулярной адсорбции Лэнгмюра? Уравнение и изотерма адсорбции Лэнгмюра. Их физический смысл.
Уравнение и кривая адсорбции Фрейндлиха. Как определяют константы, входящие в уравнение? Для каких случаев адсорбции оно применимо?
В чём смысл теории полимолекулярной адсорбции Поляни? Изотерма адсорбции БЭТ для полимолекулярной адсорбции (объясните ход кривой).
Эквивалентная адсорбция. Правило Панета-Фаянса.
Ионообменная адсорбция. Что такое ионообменники, какова их структура, как они различаются по основности. Применение ионообменников.
Будет ли происходить адсорбция ионов на частицах сульфата бария в растворе хлористого натрия? Обосновать ответ.
Будет ли происходить адсорбция ионов на частицах хлорида серебра в растворе хлористого калия? Ответ обосновать.
Будут ли обмениваться гидрокарбонат ионы на ионообменике с кар-боксильными функциональными группами? Обосновать ответ.
Будут ли обмениваться ионы натрия на ионообменнике с карбоксильными функциональными группами. Обосновать ответ.
Будут ли обмениваться ацетат ионы на ионообменнике, функциональными группами которого являются аминогруппы? Ответ обосновать.
Будут ли обмениваться ионы аммония на ионообменнике, функцио-нальными группами которого являются аминогруппы? Ответ обосновать.
Привести примеры адсорбции на твердой поверхности в организме. Объясните физиологическое значение адсорбции в каждом случае.
Как используется адсорбция при лечении больных? Что такое адсорбционная терапия и гемосорбция?
Привести уравнения, определяющие величину адсорбции на поверхности жидкости. Указать границы их применимости.
Какие общие черты характерны для структуры молекул ПАВ (объяснить, привести примеры)? Что такое гидрофильно-липофильный баланс (ГЛБ)?
Как зависит поверхностная активность ПАВ от структуры их молекул? В чем состоит правило Дюкло-Траубе? Объяснить, привести примеры.
Какие существуют виды ПАВ, чем они отличаются (привести примеры)?
Как располагаются молекулы ПАВ на поверхности жидкости? Какова структура образуемого ими адсорбционного слоя?
Назовите наиболее важные естественные ПАВ, действующие в организме, объясните их функции.
Использование ПАВ в быту, технике, в клинической практике и в фармации.
Как и во сколько раз изменится поверхностная активность растворённого вещества, если вместо раствора масляной кислоты С3Н7СООН взять раствор уксусной кислоты СН3СООН той же концентрации? Ответ обосновать.
Вычислите величину и определите тип адсорбции масляной кислоты на границе её 0,04 М раствора с воздухом при 293 K, если поверхностное натяжене этого раствора 65,56 мДж/м2. Поверхностное натяжение воды в тех же условиях 74,01 мДж/м2. Универсальная газовая постоянная равна 8,31 кДж/моль.град. Ответ: 217,3.10−4 моль/л.
При уменьшении концентрации новокаина в растворе с 0,2 М до 0,15М поверхностное натяжение возросло с 6,9.10-2 Дж/м2 до 7,1.10-2Дж/м2, а в случае растворов кокаина с 6,5.10-2 Дж/м2 до 7.10-2 Дж/м2. Сравните величины адсорбции при 293 K двух веществ в данном интервале концентраций. Ответ: адсорбция кокаина 2,5 раза больше.
Емкость адсорбента АДБ по холестерину (предельная адсорбция) составляет 0,7 мкмоль/г. Вычислите величину адсорбции холестерина из плазмы крови, содержащей 4,8 мкмоль/мл холестерина, если константа равновесия составляет 2 мкмоль/мл. Ответ: 0,494 мкмоль/г.
Концентрация холестерина в плазме крови после проведения гемосорбции снизилась с 4,8 до 4,0 мкмоль/мл. Чему равна емкость данного адсорбента (адсорбция) по холестерину (в мкмоль/г), если объем плазмы равен 1 л, а масса сорбента равна 10 г? Ответ: 80 мкмоль/г.
Концентрация кетоновых тел, накапливаемых в крови больных сахарным диабетом в течение суток (равновесная концентрация), достигает 0,2 моль/л.
Какое количество кетоновых тел адсорбируется из крови при гемосорбции, если емкость адсорбента (предельная адсорбция) равна 3.10-3 моль/г, а константа равновесия 6.10-2 моль/л? Ответ: 2,3.10−3 моль/г.
Экспериментально установлено, что величина максимальной адсорбции пропионовой кислоты на угле составляет 3 ммоль/г, а K = 6.10-2 моль/л. Пользуясь уравнением Ленгмюра установите, какая масса кислоты (ММ = 74 г/моль) адсорбировалась на 1 г адсорбента из раствора, в котором установилась равновесная концентрация 0,1 моль/л? Ответ: 138 мг.
Рассчитайте площадь, занимаемую одной молекулой бутанола в мо-номолекулярном адсорбционном слое на поверхности раствора, если предельная величина адсорбции Гмах= 1.10-9 моль/см2. Ответ: 1,66.10−15 см2.
Определите предельную величину адсорбции бутанола на поверхности раствора, если площадь поперечного сечения его молекулы составляет 1,66.10-15 см2. Ответ: 1.10−9 моль/см2.
Найдите площадь, приходящуюся на одну молекулу олеиновой кислоты в насыщенном адсорбционном слое, если предельная величина адсорбции составляет 7,42.10-9 моль/см2. Ответ: 2,24.10−16 см2.
Определите предельную величину адсорбции масляной кислоты на поверх-
ности раствора, если площадь поперечного сечения её молекул составляет 2,22.10-15 см2. Ответ: 7,48.10−10 моль/см2.
Определите предельную величину адсорбции изопенталола на поверхности раствора, если площадь приходящаяся на одну молекулу в насыщенном адсорбционном слое составляет 2,2.10-15 см2. Ответ: 7,55.10−10 моль/см2.
Рассчитайте площадь, приходящуюся на одну молекулу анилина и толщину мономолекулярного слоя, если предельная величина адсорбции Гмах= 6.10-9 моль/см2, d = 1,022 г/см3, ММ = 93 г/моль. Ответ: 2,77.10−16 см2; 5,46.10−7 см.
Вычислите длину молекулы масляной кислоты, если площадь, занимаемая одной молекулой в поверхностном слое раствора составляет 2,22.10-15 см2, плотность масляной кислоты 0,96 г/см3, молярная масса 88 г/моль. Ответ: 6,86.10−8 см.
Вычислите длину молекулы масляной кислоты, если предельная величина адсорбции её составляет 7,48.10-10 моль/см2, молярная масса кислоты 88 г/моль, плотность 0,96 г/см3. Ответ: 6,86.10−8 см.
Рассчитайте длину молекулы бутанола, если предельная величина адсорбции его на поверхности раствора составляет 1.10-9 моль/см2. Молярная масса бутанола 74 г/моль, плотность 0,81 г/см3. Ответ: 9,136.10−7 см.
Определите поверхностную активность этилацетата по следующим данным, полученным при 298К:
С, моль/л 0,0078 0,0156 0,03120 0,06250 0,1250 0,2500 0,5000
s, мДж/м2 69,6 68,0 65,1 61,5 56,2 49,7 41,5
Построить изотерму адсорбции Гиббса. s(Н2О) = 72,56 мДж/м2.
Определите поверхностную активность додецилсульфата натрия по следующим данным, полученным при 20оС:
С, ммоль/л 2,16 3,96 6,6 8,3 9,3 9,8 10,2 11,2
s, мДж/м2 62 54 47 43 42 41 41 41
Построить изотерму адсорбции Гиббса. s(Н2О) = 72,56 мДж/м2.
Пользуясь уравнением Фрейндлиха вычислите равновесную концентрацию раствора уксусной кислоты, если 1 г угля адсорбировал 3,76 ммоль её. К= 0,12; n = 0,5. Ответ: 5,6 ммоль/л.
По уравнению Фрейндлиха вычислите равновесную концентрацию ацетона, если 1 г угля адсорбировал 1,772 ммоль его. K = 0,1585; n = 0,5. Ответ: 3,34 ммоль/л.
Рассчитайте величину адсорбции уксусной кислоты на твердом адсорбенте,
если в медико-биологических исследованиях была установлена равновесная концентрация, равная 0,22 моль/л, а константы в уравнении Фрейндлиха: K = 0,1585; n = 0,5. Ответ: 7,67.10−3 моль/г.
Какова масса уксусной кислоты, адсорбированной 1,5 г угля, если концентрация её в растворе до адсорбции составляла 0,1 моль/л, а после адсорбции из 50 мл раствора − 0,07 моль/л? Ответ: 0,09 г.
Для проведения адсорбции к 50 мл раствора уксусной кислоты внесено 2 г активированного угля. Температура опыта 25оС. Объемы 0,1 М раствора NaOH, израсходованных на титрование 20 мл растворов кислоты до и после адсорбции составили 4,1 и 1,5 мл. Вычислите величину адсорбции. Ответ: 0,325 ммоль/г.
Для проведения адсорбции к 50 мл раствора уксусной кислоты внесено 2 г активированного угля. Температура опыта 25оС. Объемы 0,1 М раствора NaOH, израсходованных на титрование 20 мл растворов кислоты до и после адсорбции составили 11,2 и 4,4 мл. Вычислите величину адсорбции. Ответ: 0,85 ммоль/г.
В 50 мл раствора уксусной кислоты с концентрацией 0,1 моль/л поместили активированный уголь массой 2 г и взбалтывали смесь до достижения адсорбционного равновесия. После этого раствор отфильтровали. На титрование 10 мл фильтрата пошло 15 мл раствора титранта с концентрацией KOH, равной 0,05 моль/л. Вычислите величину адсорбции. Ответ: 0,625 ммоль/г.
В 60 мл 0,44 М раствора некоторого вещества поместили активированный уголь массой 3 г. Раствор с адсорбентом взбалтывали до установления адсорбционного равновесия, в результате чего концентрация вещества снизилась до 0,35 моль/л. Вычислите величину адсорбции. Ответ: 1,8 ммоль/г.

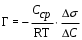
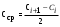 − равновесная концентрация раствора;
− равновесная концентрация раствора;