Зависимость активности ферментов от температуры
 Скачать 2.67 Mb. Скачать 2.67 Mb.
|
|
1.Основные свойства ферментов. Примеры. Зависимость активности ферментов от температуры. Температура может влиять по-разному на активность фермента. При высоких значениях температуры может происходить денатурация белковой части фермента, что негативно сказывается на его активности. При определенных (оптимальных) значениях температура может влиять на скорость образования фермент-субстратного комплекса, вызывая увеличение скорости реакции. Температура, при которой каталитическая активность фермента максимальна, называется температурным оптимумом фермента. Различные клеточные ферменты имеют собственные температурные оптимумы, которые определяются экспериментально. Для ферментов животного происхождения температурный оптимум находится в интервале 40 - 50°С Зависимость активности фермента от рН-среды.Большинство ферментов проявляет максимальную активность при значениях рН, близких к нейтральным. Лишь отдельные ферменты "работают" в сильно кислой или сильно щелочной среде. Например, активность пепсина - фермента, гидролизующего белки в желудке, - максимальна при рН 1,5 - 2,5. В щелочной среде "работают" ферменты, локализованные в кишечнике. Изменение оптимального для данного фермента значения рН-среды может привести к изменению третичной стурктуры фермента, что скажется на его активности. С другой стороны, при изменении рН может измениться ионизация субстрата,что повлияет на образование фермент-субстратного комплекса. Специфичность действия ферментов -одно из главных их свойств. Специфичность- это избирательность фермента по отношению к субстрату (или субстратам). Специфичность действия ферментов объясняется тем, что субстрат должен подходить к активному центру как "ключ к замку". Это образное сравнение сделано Э.Фишером в 1894 г. Он рассматривал фермент как жесткую структуру, активный центр которой представляет собой "слепок" субстрата. Однако этой гипотезой трудно объяснить групповую специфичность ферментов, т.к. конфигурация "ключей" (субстратов), подходящих к одному "замку", слишком разнообразна. Такое несоответствие получило объяснение в 50-е гг. XX в. в гипотезе Д. Кошланда. Она получила название гипотезы "вынужденного соответствия". По гипотезе Д. Кошланда, молекула фермента не жесткая, а гибкая, эластичная, поэтому информация фермента и его активного центра может изменяться при присоединении субстрата или других лигандов. В момент присоединения (рис. 10) субстрат "вынуждает" активный центр фермента принять соответствующую форму. Это можно сравнить с "перчаткой" и "рукой". Гипотеза "вынужденного соответствия" получила экспериментальное подтверждение. Эта гипотеза позволяет также объяснить причину превращения близких аналогов субстратов. Различают несколько видов специфичности. Стереохимическая субстратная специфичность-фермент катализирует превращение только одного стереоизомера субстрата. Например, фумаратгидратаза катализирует присоединение молекулы воды к кратной связи фумаровой кислоты, но не к ее стереоизомеру - малеиновой кислоте. Абсолютная субстратная специфичность-фермент катализирует превращение только одного субстрата. Например, уреаза катализирует гидролиз только мочевины. Групповая субстратная специфичность-фермент катализирует превращение группы субстратов сходной химической структуры. Например, алкогольдегидрогеназа катализирует превращение этанола и других алифатических спиртов, но с разной скоростью. Влияние на активность ферментов активаторов и ингибиторов.К числу факторов, повышающих активность ферментов, относятся катионы металлов и некоторые анионы. Чаще всего активаторами ферментов являются катионы Mg2+, Mn2+, Zn2+, K+ и Со2+, а из анионов - Сl-. Катионы действуют на ферменты по-разному. В одних случаях они облегчают образование фермент-субстратного комплекса, в других - способствуют присоединению кофермента к апоферменту, либо присоединяются к аллостерическому центру фермента и изменяют его третичную структуру, в результате чего субстратный и каталитический центры приобретают наиболее выгодную для осуществления катализа конфигурацию. 2.Дайте определение изоформентам. Диагностическое значение определения активности изоферментов. Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.Они катализируют одну и ту же реакцию, но отличаются по некоторым функциональным свойствам в силу отличий по: - аминокислотному составу; - электрофоретической подвижности; - молекулярной массе; - кинетике ферментативных реакций; - способу регуляции; - стабильности и др. Примеры изоферментов: глюкокиназа и гексокиназа. Изучение появления изоферментов ферментов в сыворотке крови может представлять интерес в диагностике органических и функциональных поражений органов и тканей. По изменению содержания изоферментов в сыворотке крови можно судить как о топографии патологического процесса, так и о степени поражения органа или ткани. 3 Строение ферментов. Каталитический, адсорбционный и аллостерический центры. Механизм действия ферментов. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом. Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные.Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром.Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты). 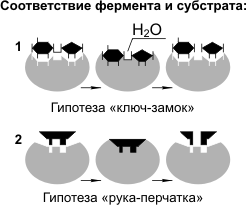 Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.). Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком». Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия. В составе как простого, так и сложного фермента, выделяют субстратный, аллостерический и каталитический центры. Каталитический центрпростого фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, расположенных на разных участках полипептидной цепи. Образование 47 каталитического центра происходит одновременно с формированием третичной структуры белковой молекулы фермента. Чаще всего в состав каталитического центра простого фермента входят остатки серина, цистеина, тирозина, гистидина, аргинина, аспарагиновой и глутаминовой кислот. Субстратный центрпростого фермента - это участок белковой молекулы фермента, который отвечает за связывание субстрата. Субстратный центр образно называют "якорной площадкой", где субстрат прикрепляется к ферменту за счет различных взаимодействий между определенными боковыми радикалами аминокислотных остатков и соответствующими группами молекулы субстрата. Субстрат с ферментом связывается посредством ионных взаимодействий, водородных связей; иногда субстрат и фермент связываются ковалентно. Гидрофобные взаимодействия также играют определенную роль при связывании субстрата с ферментом. В простых ферментах субстратный центр может совпадать с каталитическим; тогда говорят об активном центрефермента. Так, активный центр амилазы - фермента, гидролизующего α-1,4-гликозидные связи в молекуле крахмала - представлен остатками гистидина, аспарагиновой кислоты и тирозина; ацетилхолинэстеразы, гидролизующей сложноэфирные связи в молекуле ацетилхолина, остатками гистидина, серина, тирозина и глутаминовой кислоты. В активном центре карбоксипептидазы А, гидролизующей определенные пептидные связи в молекуле белка, локализованы остатки аргинина, тирозина и глутаминовой кислоты. Аллостерический центрпредставляет собой участок молекулы фермента, в результате присоединения к которому какого-то низкомолекулярного вещества изменяется третичная структура белковой молекулы фермента, что влечет за собой изменение его активности. Аллостерический центр является регуляторным центром фермента. В сложных ферментах роль каталитического центра выполняет кофермент, который связывается с апоферментом в определенном участке - кофермент связывающем домене. Понятия субстратного и аллостерического центров для сложного фермента и для простого аналогичны. Мультимолекулярные ферментные системы. Их роль . Примеры  5.Физический смысл константыМихаэлиса Основной физический смысл константы Михаэлиса - в определении скорости биохимической (ферментативной) реакции (сродство фермента к субстракту) . Эта зависимость снижается при повышении кислотности среды и температуры. Оптимум рН для большинства ферментов находится между 5,0 и 9,0. Скорость превращения субстрата с образованием продукта Р пропорциональна концентрации фермент-субстратного комплекса [ES]. При малых концентрациях субстрата в растворе имеется некоторое число свободных молекул фермента Е, не связанных в комплекс ES. Поэтому при увеличении концентрации субстрата концентрация комплексов растет, следовательно, растет и скорость образования продукта. При больших концентрациях субстрата все молекулы фермента связаны в комплекс ES (явление насыщения фермента) , поэтому дальнейшее повышение концентрации субстрата практически не увеличивает концентрацию комплексов и скорость образования продукта остается постоянной. Таким образом, становится ясен физический смысл максимальной скорости ферментативной реакции. Vmax - это скорость, с которой реагирует фермент, полностью существующий в виде фермент-субстратного комплекса. Константа Михаэлиса численно соответствует такой концентрации субстрата, при которой стационарная скорость равна половине максимальной. Данная константа характеризует константу диссоциации фермент-субстратного комплекса: Физический смысл константы Михаэлиса в том, что она характеризует сродство фермента к субстрату. Кт имеет малые значения, когда k1 > (k2+ k3), т. е. процесс образования комплекса ES преобладает над процессами диссоциации ES. Следовательно, чем меньше значения Кт, тем сродство фермента к субстрату больше. И, наоборот, если Кт имеет большое значение, то (k2 + k3) > k4 и процессы диссоциации ES преобладают. В этом случае сродство фермента к субстрату небольшое 6.Определение активности органоспецифических ферментов для диагностики заболеваний Примеры. Определение активности ферментов наиболее широко используется при диагностике как первичных врожденных ферментопатий, так и вторичных, т.е. развивающихся в результате патологических нарушений на клеточном и субклеточном уровнях. Изменение активности одних и тех же ферментов может наблюдаться при самых различных заболеваниях и, следовательно, не является специфичным для какой-либо патологии. В связи с этим определение активности ферментов имеет диагностическую значимость только при сопоставлении с изменениями других показателей и клинической картиной заболевания в целом. Чаще всего для определения активности ферментов в клинико-диагностических лабораториях используют плазму. Ферменты, выявляемые в плазме, условно делятся на три группы: - собственные ферменты плазмы, выполняющие свои функции только в сосудистом русле (ферменты свертывания крови, холинэстераза, церулоплазмин); - экскреторные ферменты, попавшие в плазму из секретов (дуоденального сока, слюны); -клеточные ферменты, попавшие в плазму из поврежденного органа. Появление, степень, длительность сдвига ферментативной активности ферментов в плазме или сыворотке крови обусловлены несколькими причинами: размерами и степенью повреждения клеток, величиной молекул фермента, его внутриклеточной локализацией, прочностью связей со структурными элементами клеток, влиянием разных факторов на активность и скорость деградации фермента в клетках. Каждый орган в организме имеет определенный спектр ферментовЯндекс.Директ Его характеристикой может быть более или менее типичная группа ферментов, типичная энзиматическая констелляция. Это позволяет с помощью определения группы органоспецифических ферментов получать сведения о функциях отдельных органов организма. Обычно ферментодиагностика — это определение ряда ферментов. Моноорганоспецифических ферментов практически не существует. Измеряемая в сыворотке крови активность ферментов — результат совместной и согласованной работы клеточных структур (процессов синтеза и распада ферментов), функции мембран, скорости инактивации. Кроме того, на активность ферментов в крови значительное влияние оказывает продолжительность жизнедеятельности. Для основного числа ферментов период полураспада составляет от 10 до 120 ч. При этом ферменты с коротким периодом полураспада лучше отражают процессы, протекающие в органе. При заболеваниях печени, в частности при вирусном гепатите (болезнь Боткина), в сыворотке крови значительно увеличивается активность АлАТ и АсАТ, сорбитолдегидрогеназы, глутаматдегидрогеназы и некоторых других ферментов. Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности, относится γ-глутамилтранспептидаза, или γ-глутамилтрансфе-раза (ГГТ). Данный фермент – высокочувствительный индикатор при заболеваниях печени 7) Лекарственные препараты как ингибиторы ферментов. Лекарства как обратимые и необратимые ингибиторы, механизм действия. Ингибитором называется вещество(лекарстова), вызывающее специфичное снижение активности фермента -по прочности связывания фермента с ингибитором(лекарством) ингибирование бывает обратимым и необратимым. Необратимое ингибирование При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности. -пример : ингибирование ацетилсалициловой кислотой (аспирином) ключевого фермента синтеза простагландинов – циклооксигеназы. Эта кислота входит в состав противовоспалительных средств и используется при воспалительных заболеваниях и лихорадочных состояниях. Присоединение ацетильной группы к гидроксильной группе серина в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов. Обратимое ингибирование При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность фермента постепенно восстанавливается. -Примером обратимого ингибитора может служить прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС 8) Механизмы регуляции ферментов. Физиологическое значение Примеры. Одним из механизмов регуляции метаболизма служит регуляция активности ферментов. Существует несколько способов такой регуляции 1.Аллостерическая регуляция. К такой регуляции подвержены Аллостериеские ферменты, которые содержат 2 субъеденицы ( каталитическая и регуляторная, содержащая аллосторической центр). Эффекторы присоединяюся к к регуляторному центру (аллосторической) тем самым меняют конформацию регуляторной субъединицы и каталитической субьединицы ( каталического активного центра) и активность фермента тем самым снижается. Пример: Метаболический путь синтеза УТФ включает восемь реакций. Первая реакция катализируется ферментом карбамоилфосфатсинтетазой П. Продукт реакции — карбамоилфосфат — образуется из диоксида углерода, амидной группы глутамина и фосфатного остатка АТФ; АТФ служит также источником энергии. Карбамоил-фосфатсинтетаза II — это аллостерический фермент; конечный продукт метаболического пути (УТФ) является его аллостерическим ингибитором. Чем больше концентрация УТФ, тем меньше скорость первой реакции, а значит, и всех остальных реакций, поскольку для них образуется мало субстратов. Таким способом скорость синтеза УТФ уравнивается со скоростью его расходования 2. Регуляция ферментов путем их фосфорилирования — дефосфорилирования Например, в клетках жировой ткани есть липаза, существующая в двух формах — фосфопротеина и простого белка. Регуляция ферментов путем их фосфорилирования — дефосфорилирования Эти формы могут превращаться друг в друга. Фосфопротеин образуется в результате действия протеинкиназы и может вновь превращаться в простой белок при действии фосфопротеинфосфатазы — фермента, гидролитически отщепляющего фосфорную кислоту от фосфопротеинов Фосфорилированная липаза обладает значительно более высокой активностью, чем нефосфорилированная. 3.Регуляция ферментов белками-модуляторами Регуляция протеинкиназы А: Протеинкиназа А представляет собой белок их одной полипептидной цепи(субьединица С, каталитическая) В клетке имеется белок (субъеденица R, регуляторная) способный соединяться с белком С, образуя комплекс R2C2, который не обладает ферментативной активностью. В этом случает субъеденица R является белком модулятором который ингибирует Протеинкиназу А, но его активация происходит при действии цАМФ. 4. Активация частичным протеолизом Механизм активации частичным протеолизом наиболее хараетерен для протеолитических ферментов (пептидгидролаз). Это связано с тем, что белки, явяющиеся субстратами пептидогидролаз, составляют основу структурно-функционального аппарата клетки. Нерегулироемое действие пептидгидролаз могло бы быть опасным для клетки. 9) Номенклатура ферментов. Пример и описание шифра фермента. Исторически возникшие (тривиальные) названия ферментов часто строятся по названию субстрата с изменением суффикса на -аза (фумараза, гистидаза, аргиназа и т. п.). Комиссия по ферментам Международного биохимического союза разработала правила рациональной номенклатуры ферментов. Согласно этим правилам в названии фермента указываются его субстраты и основной класс, к которому принадлежит фермент. Каждый фермент обозначается специальным шифром, указывающим номер класса, подкласса, подподкласса и номер фермента в подподклассе. Например , 2.6.1.2 — аланин:оксоглутарат-аминотрансфераза; 4.3.1.3. — гистидин-аммиак-лиаза (гис тидаза); 1.1.1.28 — лактат; НАД-оксидоредуктаза (лактатдегидрогеназа). Рациональные названия без дополнительных объяснений позволяю т представить реакцию, которую катализирует данный фермент. |
