Зависимость активности ферментов от температуры
 Скачать 2.67 Mb. Скачать 2.67 Mb.
|
|
2  V При повышении температуры до 40 градусов, скорость реакции увеличивается, а затем, при еще более повышенной температуре происходит тепловая денатурация и скорость реакции уменьшается. 3)График зависимости скорости ферментативной реакции от температуры. И объяснить его. Опт. t  t   Тепловая денатурация 2 При постоянной концентрации субстрата, будет увеличиваться и скорость и концентрация действующего энзима. График имеет прямопропорциональную зависимость. 4) График зависимости скорости ферментативной реакции от концентрации действующего энзима. Объяснить его.  V  [E]  При [S] const. 25. График зависимости скорости ферментативной реакции от концентрации субстрата. Объяснить. Важной особенностью ферментативных реакций, связанных с явлением насыщения фермента субстратом является то,что при низкой концентрации субстрата зависимость скорости реакции от концентрации субстрата (см рисунок) является почти линейной и это есть реакция первого порядка (скорость реакции S -> P(продукт)прямо пропорциональна концентрации субстрата). При высокой концентрации субстрата скорость реакции максимальна, становится постоянной и не зависит от концентрации субстрата. Реакция соответствует реакции нулевого порядка (полное насыщение фермента субстратом) и определяется концентрацией фермента. Также имеются реакции второго порядка, их скорости пропорциональны произведению концентраций двух реагирующих веществ. При нарушении этой пропорциональности возникает реакция смешанного порядка (На рисунке "б"). При постоянной концентрации фермента скорость реакции увеличивается, достигая максимума ( см рис ), тогда дальнейшее увеличение количества субстрата почти не оказывает влияния на скорость ферментативной реакции. То есть субстрат находится в избытке и фермент насыщен полностью, значит все молекулы фермента связаны с субстратом. А фермент-это одна из реагирующих молекул в химической реакции и при взаимодействии с субстратом образует промежуточный фермент-субстратный комплекс, который потом распадается на продукт и свободный фермент (см реакцию 1) 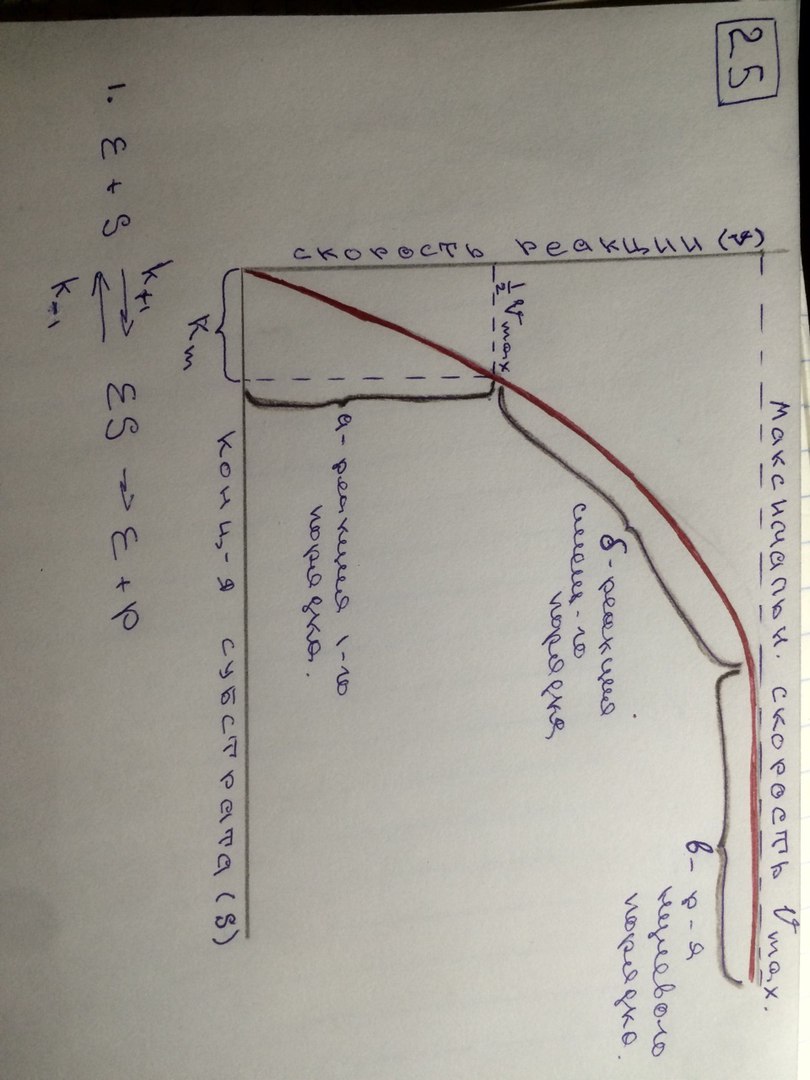 26. График зависимости скорости ферментативной реакции от рН среды. Объяснить. Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Обычно ферменты более активны в пределах зоны концентрации ионов водорода (узкая зона), соответствующей значениям pH среды 6,0-8,0. На графике представлена колоколообразной формы кривая, где имеется опр точка, где фермент проявляет наибольшую активность-точка оптимума (стрелочка на рисунке). ***Влияние изменений pH среды на фермент заключается в воздействии на состояние и степень ионизации кислотных и основных групп ( COOH; SH группы цистеина,NH2 гр лизина и др.). При резких сдвигах от оптимума pH среды ферменты могут подвергаться конфирмационным изменениям и это приведёт к потере активности из за денатурации или изменения заряда молекулы фермента. При разных значениях pH среды активный центр фермента может находиться в частично ионизированной или неионизированной форме, а это сказывается на третичной структуре белка, а значит и на формировании активного фермент-субстратного комплекса ( смвопр 25). 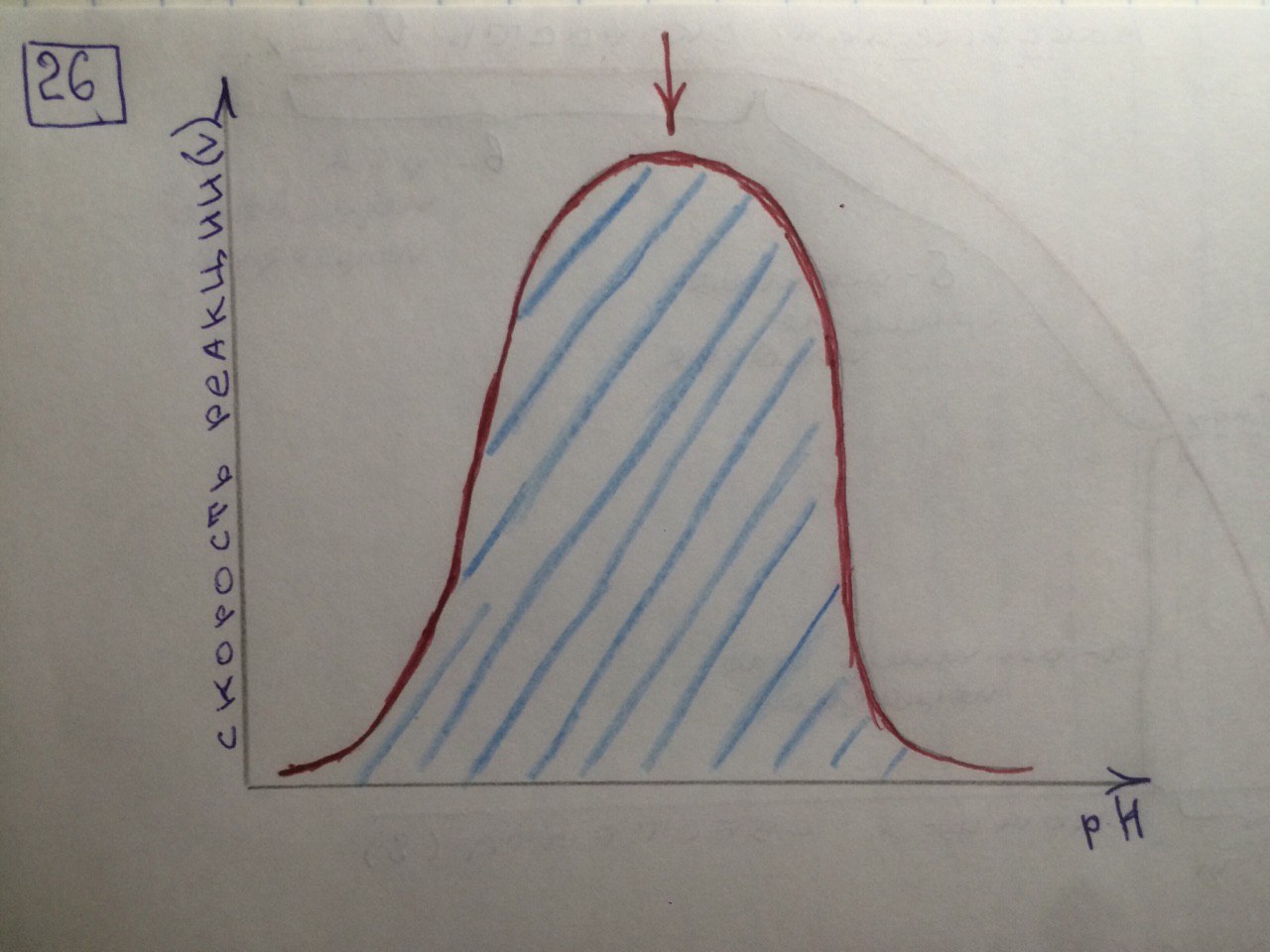 · 27 уравнение ферментативной кинетики - уравнение Михаэлиса-Ментен, привести график к нему и уравнение катализируемой химической реакции. Объяснить, что означают входящие в него величины, для чего служит это уравнение. Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата. Уравнение названо в честь физикохимиков Леонора Михаэлиса и Мод Леоноры Ментен. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса: 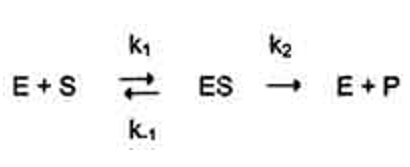 Уравнение имеет вид: 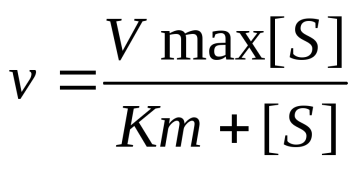 где v – наблюдаемая скорость реакции при данной концентрации субстрата [S] Ks – константа Михаэлиса. По определению  , где к-1 есть константа скорости реакции распада фермент-субстратного комплекса на фермент и исходный субстрат, к1 есть константа скорости реакции образования фермент-субстратного комплекса и к2 есть константа скорости реакции распада фермент-субстратного комплекса на фермент и продукт. Константа Михаэлиса численно равна концентрации субстрата, при которой скорость реакции составляет половину от максимальной , где к-1 есть константа скорости реакции распада фермент-субстратного комплекса на фермент и исходный субстрат, к1 есть константа скорости реакции образования фермент-субстратного комплекса и к2 есть константа скорости реакции распада фермент-субстратного комплекса на фермент и продукт. Константа Михаэлиса численно равна концентрации субстрата, при которой скорость реакции составляет половину от максимальнойVmax – максимальная скорость реакции при полном насыщении фермента субстратом 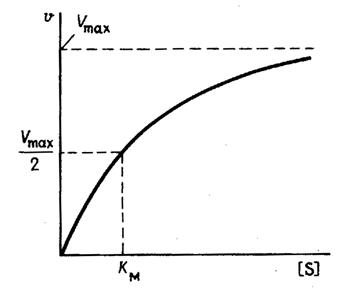 Км – характеризует сродство фермента к субстрату: чем меньше значение К.М., тем сильнее связывание фермента с субстратом. Определение константы Михаэлиса имеет важное значение при выяснении механизма действия эффекторов на активность ферментов 28. Формула восстановленного KoQ (убихинона). Какова его роль в митохондриальном окислении? К какому классу веществ относится КоQ?  Убихиноны — это жирорастворимые коферменты, представленные преимущественно в митохондриях эукариотических клеток. Убихинон является компонентом цепи переноса электронов и принимает участие в окислительном фосфорилировании. Функции убихинола как переносчика электронов и антиоксиданта основаны на возможности отдавать и вновь присоединять два электрона,окисляясь до убихинона и восстанавливаясь до убихинола 29. 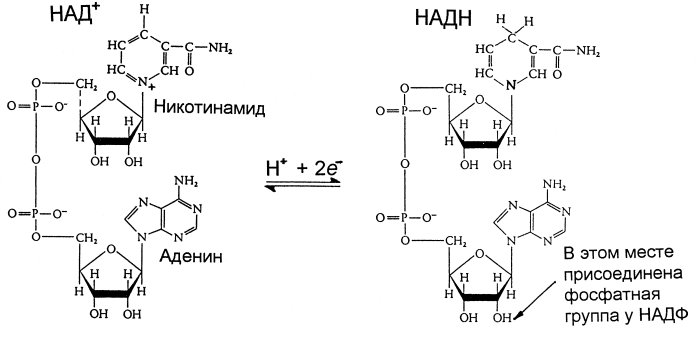 В состав НАД Н входит витамин никотинамид (Витамин РР). В митохондриальном окислении выполняет роль промежуточного переносчика электронов и протонов между окисленным субстратом и флавиновыми ферментами. 30. 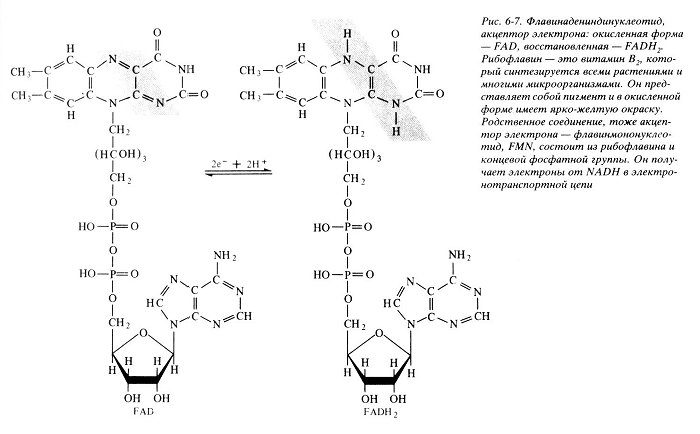 В состав входит витамин рибофлавин (B2) В состав входит витамин рибофлавин (B2) Молекула FADH2 - основной переносчик электронов при окислении. является переносчиком энергии и восстановленный кофермент может быть использован как субстрат в реакции окислительного фосфорилирования в митохондрии. 31. Простетической группы цитохрома. Какова его роль в митохондриальном окислении? Цитохром представляет собой гемопротеин, он осуществляет перенос электронов. Комплекс I II, включающий цитохромы b, c 1 функционирует как QH2-дегидрогеназа :он осуществляет перенос электронов с QH2 на Цитохром с, комплекс цитохромов переносит электроны с цитохрома с на кислород. Кислород, поступающий в митохондрии из крови, связывается с атомом железа в цитохрома а3, в форме молекулы О2. 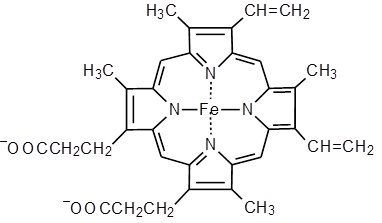 32. Написать формулу окисленного ФМН. Какова его роль в митохондриальном окислении? Какой витамин входит в его состав?Коферментная группировка ФМН представляет собой витамин рибофлавин, фосфорилированный по спиртовой группе пятого углеродного атома рибита, а в составе ФАД к ФМН путем взаимодействия фосфатных остатков присоединяется нуклеотидный радикал аденозин-монофосфата (АМФ). 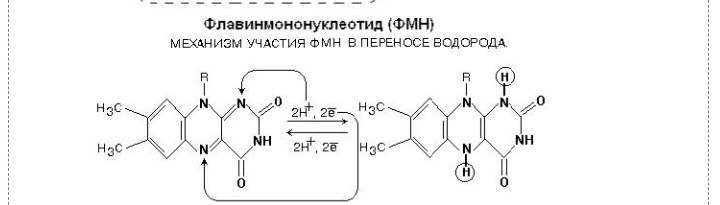 33. Записать формулу АТФ. Какова ее роль в митохондриальном окислении? 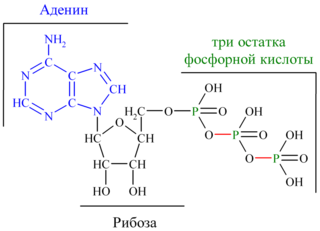 Основная роль АТФ в митохондриальной окислении - обеспечение энергией процесса синтеза АТФ. 34. Записать формулу ативной части КоQ в переносе атомов водорода (напишите формулы и их превращения). 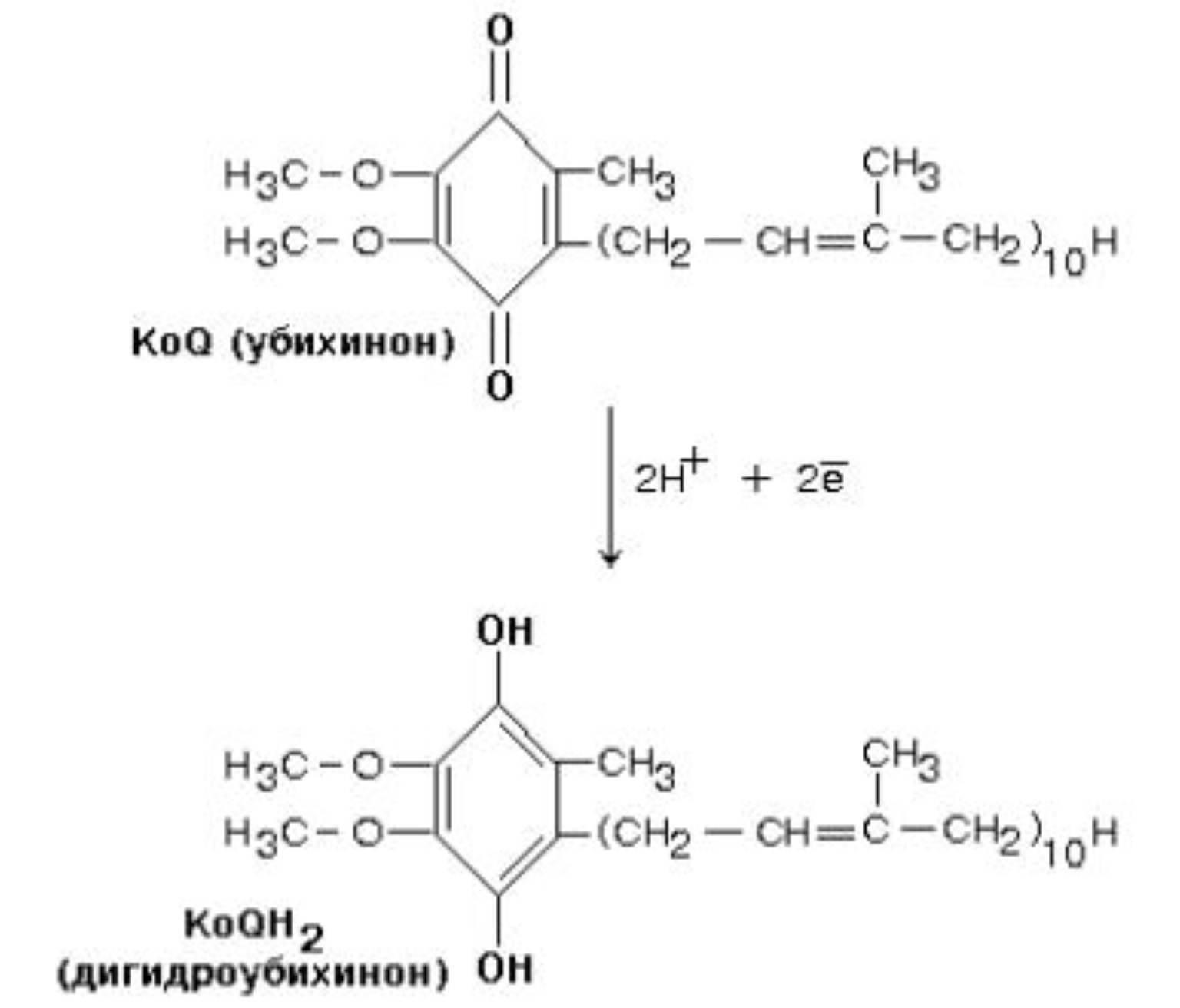 35. Формула НАДФ. Какой витамин входит в его состав? 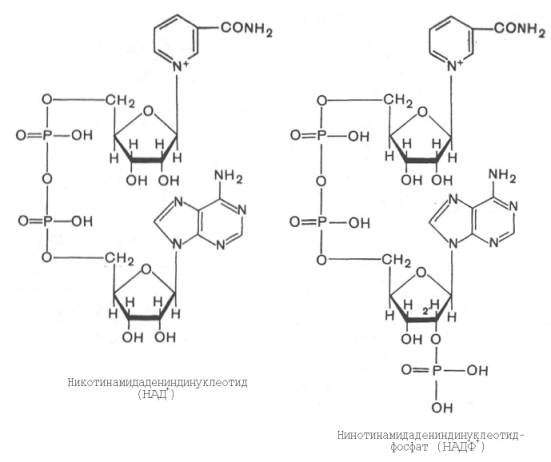 Витамин РР (В3). 36. Рабочая часть ФМН а окис. И вост-ом виде. Ферменты дыхательной цепи, коферментом которого является ФМН. Лекарственные препараты ингибиующие этот фермент?? 1. Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2 (см. раздел 2). Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит изоаллоксазиновая сопряжённая циклическая система (рис. 6-6). FAD служит акцептором электронов от многих субстратов в реакциях типа: R-CH2-CH2-R1 + Е (FAD) ↔ R-CH=CH-R1 + Е (FADH2), где Е - белковая часть фермента. 2. NADH-дегидрогеназа (I ферментный комплекс) 3. Транквилищаторы и нейролептики (тизерцин, метеразин, аминазин, пропазин, терален) 37. К какому классу ферментов относится каталаза крови? Какую реакцию она катализирует? Какова ее биологическая роль? Чему равны показатель каталазы и каталазное число в норме? К классу оксидоредуктаз. Она катализирует разложение образовавшегося в процессе биологического окисления пероксида водорода на воду и молекулрный кислород. Биологическая роль заключается в разрушении этого пероксида водорода, образующийся в клетках при воздействии флавопротеиновых оксидаз, который может разрушить клеточные структуры. В норме показатель каталазы в пределах от 2,96 до 4, 97, а каталазное число в норме от 12 до 22. 38 Принцип количественного определения активности каталазы крови по Баху и Зубковой. Записать реакцию каталазы, к какому классу ферментов она относится? Принцип основан на измерении количества пероксида водорода, которое может быть разрушено ферментов в определённых условиях за заданное время. Доля разложившейся перекиси водорода определяется по разности между количеством ее, взятым для опыта(контрольная проба) и оставшимся после действия каталазы(опытная проба) путём титрования перманганатом калия в кислой среде. Относится к классу оксидоредуктаз. 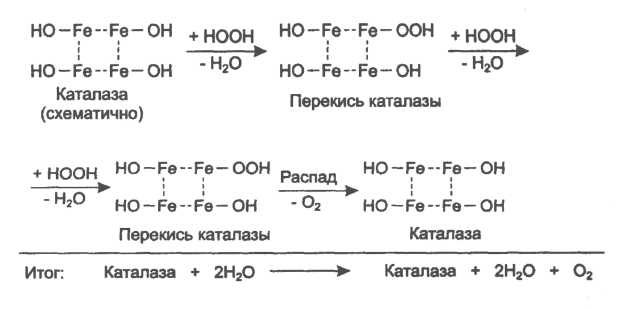 это из учебника  упрощённо так 39.Как можно доказать специфичность действия альфа-амилазы слюны? Специфический субстрат для а-амилазы -полисахариды: крахмал (и гликоген). Доказательство: 1.проба Троммера с крахмалом отрицательна, т.к. нет свободных кетонных и альдегидных групп. 2.р-р крахмала+разбавл.р-р слюны, Т=37'С на 10 минут. 3.+проба Троммера. Положительная. Происходит восстановление гидрата окиси меди, можно сделать вывод, что крахмал гидролизовался. 4. При проведении аналогичного опыта с сахарозой -проба Троммера отрицательна на начало и на конец эксперимента, т.е. под воздействием а-амилазы она не гидролизуется. 40.Что лежит в основе количественного определения активности альфа-амилазы слюны по Вольгемуту и в чем она выражается? Вольгемута метод — определение активности амилазы в биологических жидкостях (слюне, моче, крови и др.). Активность фермента измеряется амилазными единицами, т. е. числом миллилитров 0,1% раствора крахмала, расщепленного в течение 30 мин. при t° 45 1 мл исследуемого раствора. Например, в норме активность амилазы в моче равна 16—64. Повышенные значения наблюдаются при панкреатите, заболеваниях желчных путей и др., пониженные значения вплоть до нуля — при почечной недостаточности. За выработку альфа-амилазы отвечают поджелудочная железа (этот тип амилазы является одним из компонентов пищеварительного сока) и слюнные железы. Амилаза активна только в ЖКТ и условиях узкого оптимума рН. Основная функция амилазы заключается в гидролизе крахмала. 41 Каким опытом можно обнаружить ферментативную активность амилазы слюны (из практики)? Гидролиз крахмала α-амилазой слюны. Она гидролизует α-1,4-глюкановые связи в крахмале, гликогене, олигосахаридах. Нерасщепленный крахмал дает синее окрашивание. Постепенно при гидролизе идет его распад до амилодекстринов(синее окрашивание), эритродекстринов (красно-бурое окрашивание), ахро- и мальтодекстрины(йодом не окрашиваются). Также о гидролизе можно судить по пробе Троммера. С крахмалом она отрицательная, начиная с амилодекстринов – положительная. Это свидетельствует о гидролизе крахмала и появлении альдегидных групп, которые в крахмале недоступны. 42 Как можно доказать термолабильность фермента сахаразы дрожжей? Какую реакцию она катализирует? К какому классу относится этот фермент? Сахараза относится к классу гидролаз. Она катализирует гидролиз сахарозы, разлагая ее до глюкозы и фруктозы. Прокипяченный раствор сахаразы дрожжей не сможет гидролизовать сахарозу, проба Троммера будет отрицательной, т к при повышении температуры фермент теряет свою структуры и не может разложить сахарозу до мономеров с альдегидными и кетонными группами. Этим доказывается термолабильность сахаразы. После повышения температуры она не может выполнять гидролиз, т е свои функции 43 К какому классу ферментов относится сахараза? Какую реакцию она катализирует? Как можно доказать термолабильность этого фермента? Сахараза относится к классу гидролаз. Она катализирует гидролиз сахарозы, разлагая ее до глюкозы и фруктозы. Прокипяченный раствор сахаразы дрожжей не сможет гидролизовать сахарозу, проба Троммера будет отрицательной, т к при повышении температуры фермент теряет свою структуры и не может разложить сахарозу до мономеров с альдегидными и кетонными группами. Этим доказывается термолабильность сахаразы. После повышения температуры она не может выполнять гидролиз, т е свои функции ЦЕПЬ ДЫХАНИЯ: 44 А.Изобразить полную схему митохондриальной цепи переноса электронов с указанием отдельных ее звеньев и пунктов сопряжения с фосфорилированием. Какие ферменты (названия) и какого класса по классификации ферментов работают в ней? Какие используются коферменты, производными каких витаминов являются эти коферменты? Чем обусловлено движение протонов и электронов в дыхательной цепи? ОТВЕТ: КАКИЕ ФЕРМЕНТЫ ?Ферментные комплексы дыхательной цепи (обозначены участки сопряжения окисления и фосфорилирования): Дыхательная цепь включает множество белков-переносчиков Всего цепь переноса электронов (англ. electron transport chain) включает в себя около 40 разнообразных белков, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ. Блок-схема дыхательной цепи Строение ферментативных комплексов дыхательной цепи 1 комплекс. НАДН-КоQ-оксидоредуктаза Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа. Функция 1. Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). 2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 2 комплекс. ФАД-зависимые дегидрогеназы Данный комплекс как таковой не существует, его выделение условно. Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию). Функция 1. Восстановление ФАД в окислительно-восстановительных реакциях. 2. Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q. 3 комплекс. КоQ-цитохром с-оксидоредуктаза По другому данный комплекс называется цитохром с редуктаза. В его составе имеются цитохром b и цитохром c1, 2 железо-серных белка. Всего в нем насчитывается 11 полипептидных цепей общей молекулярной массой около 250 кДа. Функция 1. Принимает электроны от коэнзима Q и передает их на цитохром с. 2. Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 4 комплекс. Цитохром с-кислород-оксидоредуктаза В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди. Функция 1. Принимает электроны от цитохрома с и передает их на кислород с образованием воды. 2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 5 комплекс Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы: * одна группа формирует субъединицу Fо(произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс. * другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ. Упрощенно считают, что для синтеза 1 молекулы АТФ необходимо прохождение через АТФ-синтазу приблизительно 3-х ионов Н+, и еще один ион H+используется для транспорта неорганического фосфата в матрикс митохондрии. 14.1.3. В качестве промежуточных переносчиков электронов выступают убихинон (коэнзим Q) и цитохром с. Убихинон (KoQ) – жирорастворимое витаминоподобное вещество, способен легко диффундировать в гидрофобной фазе внутренней мембраны митохондрий. Биологическая роль коэнзима Q – перенос электронов в дыхательной цепи от флавопротеинов (комплексы I и II) к цитохромам (комплекс III). Цитохром с – сложный белок, хромопротеин, простетическая группа которого – гем – содержит железо с переменной валентностью (Fe3+ в окисленной форме и Fe2+ в восстановленной форме). Цитохром с является водорастворимым соединением и располагается на периферии внутренней митохондриальной мембраны в гидрофильной фазе. Биологическая роль цитохрома с – перенос электронов в дыхательной цепи от комплекса III к комплексу IV. Коферменты - Промежуточными переносчиками в дыхательной цепи у высших организмов являются коферменты: NAD+ (никотинамид-адениндинуклеотид), FAD и FMN (флавинадениндинуклеотид и флавинмононуклеотид), кофермент Q (CoQ), семейство гемсодержащих белков - цитохромов (обозначаемых как цитохромы b, С1, С, А, А3) и белки, содержащие негеминовое железо. Все участники этой цепи разделены на четыре окислительно-восстановительные системы, связанные убихиноном (CoQ) и цитохромом С. Процесс начинается с переноса протонов и электронов от окисляемого субстрата на коферменты NAD+ или FAD. Это определяется тем, является ли дегидрогеназа, катализирующая первую стадию, NAD - зависимой или FAD - зависимой. Если процесс начинается с NAD+ , то следующим переносчиком будет FMN. Полный процесс представляет собой цепь последовательных окислительно-восстановительных реакций, в ходе которых происходит взаимодействие между переносчиками. Каждый промежуточный переносчик вначале выступает в роли акцептора электронов и протонов и из окисленного состояния переходит в восстановленную форму. Затем он передает электрон следующему переносчику и снова возвращается в окисленное состояние. На последней стадии переносчик передает электроны кислороду, который затем восстанавливается до воды. ЧЕМ ОБУСЛ ДВИЖ ПРОТ И ЭЛ - В электроно-транспортной цепи происходит движение как электронов, перемещающихся от донора к акцептору, так и протонов, движущихся через мембрану. В этих процессах участвуют и растворимые, и связанные с белками транспортные молекулы. В митохондриях перенос электронов в межмембранном пространстве осуществляется водорастворимым белком-переносчиком цитохромом с[10]. Этот белок переносит исключительно электроны, а перенос осуществляется за счёт окисления и восстановления атома железа, который располагается в гемовой группе белка. Перенос электронов между белками обусловлен их переносом между флавиновыми кофакторами, железо-серными кластерами. 45 Б.В чем заключается современная теория, объясняющая образование АТФ в результате функционирования митохондриальной дыхательной цепи, кто ее автор? Указать величину коэффициента полезного действия при этом процессе. Напишите полную схему цепи переноса электронов, укажите все возможные пункты ее сопряжения с фосфорилированием. Сколько H+ передается в межмембранное пространство митохондрии при переносе 2-х КоQH2 на внешнюю сторону внутренней мембраны? ОТВЕТ : СМ ВОПРОС 44+ кто ее автор? Указать величину коэффициента полезного действия при этом процессе. Автор - Окислительное фосфорилирование открыл в 1931 г. выдающийся русский биохимик В.А. Энгельгардт . А вообще автор новой теории Вроде - МИТЧЕЛЛ !!? Количество синтезированных молей АТФ на моль окисленного субстрата зависит от его вида (белка, жира, углевода) и от величины коэффициента фосфорилирования. Этот коэффициент, обозначаемый как Р/О, равен количеству синтезированных молекул АТФ в расчете на один атом кислорода, потребленный при окислении восстановленных органических соединений в процессе дыхания. При переносе каждой пары электронов по дыхательной цепи от НАД • Н до 02 величина Р/О = 2. Для субстратов, окисляемых НАД • Н2-зависимыми ферментами, Р/О = 1,3. Эти соотношения Р/О отражают энергетические затраты клетки на синтез АТФ в митохондриях и транспорт макроэрга против химического градиента из митохондрий к местам потребления. Таким образом, одна часть аккумулированной как я поняла, это) При полном окислении 1 г смеси углеводов пищи выделяется 4 ккал тепла. В процессе окисления в организме 1 г углеводов синтезируется 0,13 моля АТФ. Если считать, что энергия пирофосфатной связи в АТФ равна 7 ккал/моль, то при окислении 1 г углеводов лишь 0,91 (0,13 х 7) ккал энергии будет запасено в организме в синтезированной АТФ. Остальные 3,09 ккал будут рассеяны в виде тепла (первичная теплота). Отсюда можно рассчитать коэффициент полезного действия синтеза АТФ и аккумулирования в ней энергии химических связей глюкозы: к.п.д. = (0,91 : 4,0) х 100 = 22,7 %. Из приведенного расчета видно, что только 22,7 % энергии химических связей глюкозы в процессе ее биологического окисления используется на синтез АТФ и вновь запасается в виде химической макроэргической связи, 77,3 % энергии химических связей глюкозы превращается в первичную теплоту и рассеивается в тканях. 46 В.Что такое биологическое окисление и каковы его отличия от окисления в неживой природе? Где оно происходит, что в нем окисляется и для чего используется высвобождающаяся энергия? Кто является отечественным основоположником теории окислительного фосфорилирования и в чем она заключается НЕ НАШЛА ОТВЕТ ? Дайте определение термину «окислительное фосфорилирование». Привести схему митохонд-риальной дыхательной цепи с учетом группировки ферментов и коферментов в комплексы. Сколько молей АТФ фактически образуется при переносе протонов и электронов с НАДН2 на кислород? ОТВЕТ ; 44+ Биологическое оскисление это - окислительно-восстановительные реакции, протекающие в клетках организма, в результате которых сложные органические вещества окисляются при участии специфических ферментов кислородом, доставляемым кровью. Конечными продуктами биологического окисления являются вода и двуокись углерода. Освобождающаяся в процессе биологического окисления энергия частично выделяется в виде тепла, основная же ее часть идет на образование молекул сложных фосфорорганических соединений (главным образом аденозинтрифосфата — АТФ), которые являются источниками энергии, необходимой для жизнедеятельности организма. Различие: между био окисл и в неживой природе. 2) био ло ги че ское окисление про ис хо дит медленно, по сле до ва тель но в про цес се нескольких реакций, а го ре ние – быст рый процесс в виде одной реакции; 3) при го ре нии вся энер гия выделяется в виде тепла, а при био ло ги че ском окислении часть энер гии аккумулируется в мо ле ку лах АТФ в виде энер гии химических связей. Окисли́тельное фосфорили́рование — метаболический путь, при котором энергия, образовавшаяся при окислении питательных веществ, запасается в митохондриях клетокв виде АТФ. Сколько молей АТФ фактически образуется при переносе протонов и электронов с НАДН2 на кислород? Не точно..... Например, если донором водорода для дыхательной цепи является молекула НАДН, то электроны от донора (НАДН) к акцептору (кислород) проходят 3 участка сопряжения окисления и фосфорилирования (I, III и IV ферментные комплексы дыхательной цепи). Таким образом, максимально может образоваться 3 молекулы АТФ (3 АДФ + 3 Н3РО4 → 3 АТФ). Затрачивается 1 атом кислорода (2 Н + О → Н2О). Значение коэффициента Р/О = 3/1 = 3.  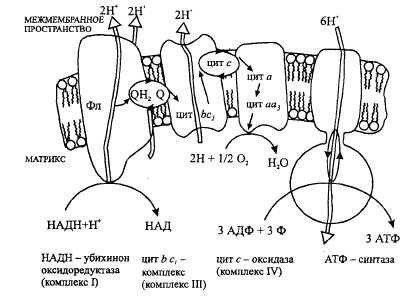 |
