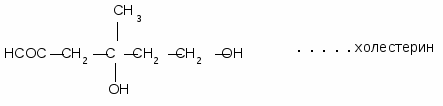|
|
биохимия. Значение изучаемой темы
Тема № 5. Липидный обмен. Биохимическая диагностика атеросклероза: определение общего холестерина, холестерина липопротеинов высокой плотности. Расчет коэффициента атерогенности

Значение изучаемой темы: Липиды – это вещества, которые объединены в один класс одним их свойством. Они не растворяются в воде и в основном имеют биологическое происхождение. Разнообразие веществ этого класса определяет разнообразие их функций. Нарушение этих процессов может привести к гипоэнергетическому состоянию, в одних случаях, или к ожирению, в других. Атеросклероз – заболевание, осложнения которого являются причиной инвалидности или смерти большого количества людей в развитых странах. Поэтому будущему специалисту необходимо знать биохимические причины возникновения атеросклероза, факторы риска для его развития, биохимическую диагностику и лечения этого заболевания.
1. Основные понятия и положения темы
Липиды – это органические вещества, нерастворимые в воде, но растворимые в неполярных органических растворителях.
1.1.Функции липидов Функции жира
Энергетическая: при окислении 1 г жира выделяется около 9,3 ккал энергии.
В сутки человек в среднем потребляет 60-80 г жира, что составляет 35-40% суточного калоригенеза.
Резерв эндогенной воды (1 г жира при окислении дает 1,07 г воды).
Жир необходим для растворения и всасывания жирорастворимых витаминов.
4. Защитный барьер, предохраняющий от термических и механических воздействий.
Функции липоидов
Мембранная:
обеспечивают избирательную проницаемость;
участвуют в активном транспорте;
необходимы для упорядочения ферментативных цепей;
необходимы для создания биопотенциалов не только на нейронах, но и мембранах митохондрий;
входят в состав рецепторов для гормонов и обеспечивают механизм усиления эффектов.
Специфические функции:
обеспечивают устойчивость эритроцитов;
ганглиозиды связывают токсины и яды.
Энергетическая (не имеет большого значения).
Функции биологически активных липидов
Регуляторная
стероидные гормоны (половые и гормоны коры надпочечников);
гормоны, производные полиненасыщенных жирных кислот.
2. Витаминная
витамины А, Е, К, Q (производные изопрена);
витамин Д (производное холестерина).
Переваривание жира (триацилглицеринов - ТГ)
Переваривание жира происходит под действием ферментов липаз (класс гидролаз), которые расщепляют сложноэфирные связи.
Переваривание жира в ротовой полости не происходит. Установлено, что в слизистой корня языка синтезируется так называемая лингвальная липаза, активность которой не может проявиться в полости рта, и основным местом ее действия является желудок. Оптимум рН для этой липазы находится в области рН 4 – 4,5. Она действует на ТГ, содержащие жирные кислоты (ЖК) с короткой и средней длиной цепи, что характерно для ТГ молока. Таким образом, лингвальная липаза имеет большое значение у грудных детей. Активность этого фермента у взрослых крайне низкая.
В желудке синтезируется собственная липаза, значение которой у взро-слыхнезначительно, так как содержание этой липазы в желудочном соке невелико. Кроме того, рН желудочного сока далек от оптимума (рН 5,5-7,5); в желудке нет условий для эмульгирования жира, а липаза может активно действовать только на эмульгированные ТГ. В отличие от взрослых у грудных детей в желудке умеренная кислотность (рН 5,0), жир молока эмульгирован, липаза синтезируется в достаточном количестве и активна. Таким образом, переваривание жира в желудке в основном происходит удетей.
Главным местом переваривания ТГ у взрослых является тонкий кишечник.
На ТГ действует липаза поджелудочного сока. Панкреатическая липаза является гликопротеидом с оптимумом рН 8-9, поступает в верхний отдел тонкой кишки в неактивном состоянии в виде пролипазы. Превращение пролипазы в активный фермент происходит при участии желчных кислот и колипазы (пептид с М.м. 10 кДА). Колипаза присоединяется к пролипазе, что активирует ее и делает устойчивой к действию трипсина. Липаза расщепляет ТГ, находящиеся в эмульгированном состоянии. Панкреатическая липаза отщепляет жирные кислоты, находящиеся в -положении. Продуктами переваривания жира в кишечнике являются: глицерин, жирные кислоты, а также моноглицерины.
Роль желчных кислот в переваривании жира
1. Активируют панкреатическую липазу.
2. Эмульгируют жир.
3. Необходимы для всасывания продуктов переваривания жира.
Всасывание продуктов переваривания жира
Глицерин и жирные кислоты с короткой цепью хорошо растворимы в воде, поэтому легко всасываются стенкой кишечника. Жирные кислоты с длинной цепью сначала нужно перевести в растворимую форму. Для этого жирные кислоты связываются с желчными кислотами (1:3), образуя холеиновые комплексы, которые легко всасываются. В виде холеиновых комплексов всасываются моно-, ди- и триацилглицерины (последние в небольших количествах). Внутри эпителиальных клеток кишечника происходит ресинтез жирав основном из моноацилглицеринов и жирных кислот.
Ресинтез жира – это синтез жира, свойственного данному организму. Не все жирные кислоты могут этерифицироваться. В неизменном виде они поступают в кровь, где связываются с альбуминами и в таком виде разносятся кровью органам и тканям. Свободные жирные кислоты называются неэстерифицированными или НЭЖК.
Хиломикроны и пути их использования
Образованные в эпителиальных клетках ТГ покрываются оболочкой из белка и фосфолипида. В результате образуются хиломикроны (ХМ). ХМ – это микроскопические липопротеидные частицы диаметром около 500 нм.
В составе ХМ 1-2% белка и 98-99% липидов, из которых 88% ТГ, 8% - ФЛ (фосфолипидов) и 4% ХС (холестерина). 90% ТГ пищевого происхождения транспортируется в виде ХМ, оставшиеся 10% поглощаются в виде жирных кислот. НЭЖК переносятся в печень, там они либо окисляются, либо идут на синтез липидов. Печень характеризуется ограниченной способностью к запасанию ТГ и даже небольшой их избыток секретируется в виде ЛПОНП (липопротеидов очень низкой плотности). В отличие от ХМ ЛПОНП содержат 10% белка и 90% липидов.
Таким образом, ХМ и ЛПОНП являются транспортными формами. ХМ транспортируют экзогенные липиды, а ЛПОНП – липиды, синтезированные в печени. 70% ХМ поступает в лимфу, а 30% - прямо в кровеносные капилляры. Появление "молочного" вида у плазмы крови после приема жирной пищи обязано наличию в ней ХМ (т.н. хилезная кровь).
Пути использования хиломикронов
ХМ расщепляются липопротеинлипазой (ЛПЛ-аза), которая действует на триглицеридную часть. Этот фермент располагается в поверхностном слое эндотелиальных клеток капилляров, особенно жировой ткани, лактирующей молочной железы, скелетной и сердечной мышц. ТГ хиломикронов расщепляются на глицерин и жирные кислоты. В ХМ липида становится меньше, плотность такой частицы повышается, она превращается в, так называемый, остаточный ХМ. Липопротеидлипаза активируется гепарином. Остаточный ХМ переносится в печень, где метаболизируется. Выделяющиеся из ХМ НЭЖК поступают в клетки сердца и мышц, где окисляются.
Содержание липидов в кровотоке может понижаться вследствие откладывания их в различных тканях. Способность откладывать жир характерна для всех тканей, кроме мозга. Главную роль в обмене липидов играют жировая ткань и печень. Примерно 65% веса жировой ткани приходится на ТГ. Количество жировой ткани нарастает с возрастом. Различают белую жировую ткань (подкожная жировая ткань и сальник) и бурую жировую ткань (находится в межлопаточной области). Белый жир является источником глицерина и жирных кислот. Бурый жир выполняет термогенную функцию, так как в нем жир сгорает с образованием воды, углекислого газа и тепла. Много бурого жира у новорожденных и у зимоспящих животных.
Липолиз
Липолиз – это расщепление жира до глицерина и жирных кислот. Катализируется триглицеридлипазой, диглицеридлипазой и моноглицеридлипазой, которые действуют соответственно на ТГ, ДГ и МГ. Триглицеридлипаза является лимитирующим ферментом липолиза. Она имеет две формы: фосфорилированную (активную) и нефосфорилированную (неактивную).
Превращение неактивной формы в активную происходит под влиянием протеинкиназы. Протеинкиназа, в свою очередь, активируется в результате присоединения к ее аллостерическим центрам цАМФ.
Регуляция липолиза происходит под действием гормонов.
Активируют липолиз: катехоламины, глюкагон, СТГ, АКТГ, тироксин, липотропин гипофиза, цАМФ. Ингибирует липолиз инсулин.
Липогенез
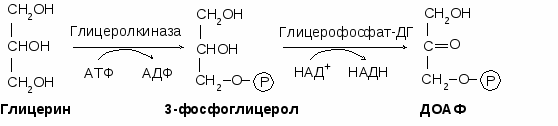
Липогенез – это синтез жира. Для синтеза жира необходимы глицерин и жирные кислоты в активных формах. Активной формой глицерина является
3-фосфоглицерол (α-глицерофосфат). Активной формой жирной кислоты является ацил-КоА.
В жировой ткани 3-фосфоглицерол образуется из ДОАФ (метаболит гликолиза) путем гидрирования под действием глицерофосфатдегидрогеназы с затратой НАДН. Таким образом, синтез жира в жировой ткани происходит из углеводов. В печени и почках 3-фосфоглицерол образуется путем фосфорилирования глицерина под действием глицеролкиназы с затратой АТФ.
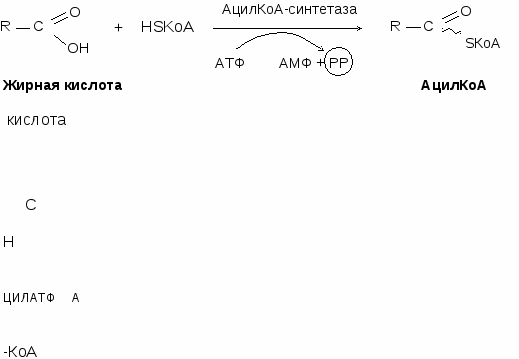
Ацил-КоА образуется при взаимодействии жирной кислоты с НSКоА с затратой АТФ под влиянием ацил-КоА-синтетазы.
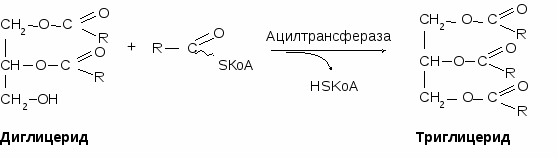
Сборка триглицерида происходит из 3-фосфоглицерола и ацилов-КоА под действием ацилтрансферазы.

Ингибируют липогенез КА, СТГ, ЙТ, АКТГ, АДФ. Активируют – инсулин, эстрогены и АДФ.
Обмен глицерина
В зависимости от типа ткани, в которую он поступает, глицерин может:
- окисляться до СО2 и Н2О с образованием 21 АТФ (см лекцию);
- использоваться в синтезе липидов (ТГ и ФЛ);
- использоваться на синтез глюкозы в глюконеогенезе.
О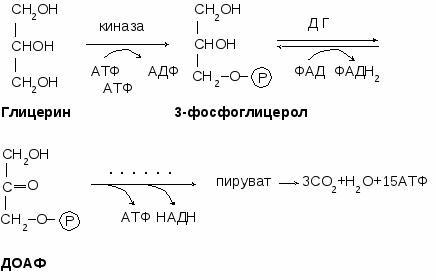 кисление глицерина кисление глицерина
Окисление жирных кислот. Регуляция
Происходит в митохондриях. Активная форма жирных кислот ацил-КоА образуется в цитоплазме под действием ацил-КоА-синтетазы.
 Жирная кислота + НSКоА + АТФ Ацил-КоА + АМФ + РР Жирная кислота + НSКоА + АТФ Ацил-КоА + АМФ + РР
Мембрана митохондрий не пропускает жирные кислоты. Для переноса жирных кислот в митохондрии существует специальный переносчик – карнитин. С помощью фермента карнитинацилтрансферазы-1 остаток жирной кислоты (ацил) переносится на карнитин, в результате образуется ацилкарнитин, способный проникать в митохондрии. В митохондриях комплекс ацилкарнитин распадается, освободившийся ацил присоединяется к НSКоА с образованием ацил-КоА с помощью карнитинацилтрансферазы-2.
Карнитин возвращается в цитоплазму за новой молекулой жирной кислоты. Легче всего окисляют жирные кислоты те ткани, где много карнитина, например, в таких органах, как сердце, скелетные мышцы, почки.
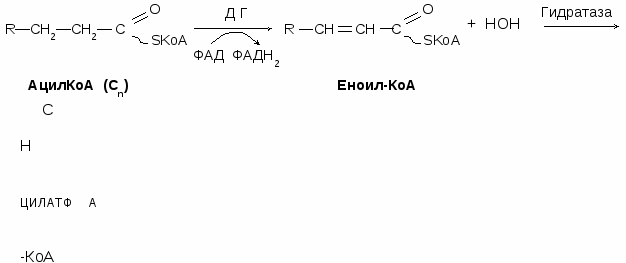
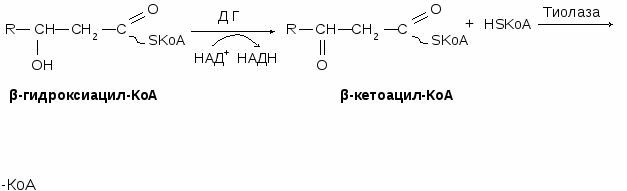
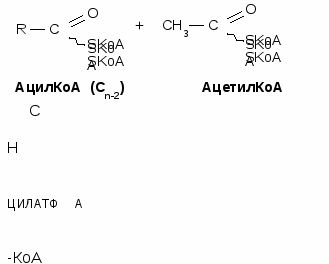
Окисление жирных кислот является циклическим процессом. В результате одного цикла (витка) жирная кислота укорачивается на два углеродных атома, при этом в ходе окислительно-восстановительных реакций образуются НАДН и ФАДН2. Количество витков рассчитывается по формуле: количество атомов углерода в кислоте делят на 2 и отнимают 1
Энергетическая роль жирных кислот в разных тканях различна. Так, для миокарда окисление жирных кислот дает 70% энергии, для мышечной ткани – 50%, в головном мозге они не окисляются.
Регуляция β-окисления жирных кислот
Ключевым процессом является поступление жирных кислот в митохондрии. Карнитинцилтрансфераза-1 является аллостерическим ферментом, аллостерическим ингибитором которого является малонил-КоА. КА, СТГ – активируют, инсулин – тормозит окисление жирных кислот.
Синтез жирных кислот. Регуляция
Происходит главным образом в жировой ткани, молочной железе и печени. Местом синтеза жирных кислот является цитоплазма. Для синтеза жирных кислот необходимы СО2, ацетил-КоА, АТФ и НАДФН. Синтез жирных кислот происходит циклически. В начале каждого цикла из ацетил-КоА и углекислого газа с затратой АТФ образуется малонил-КоА.
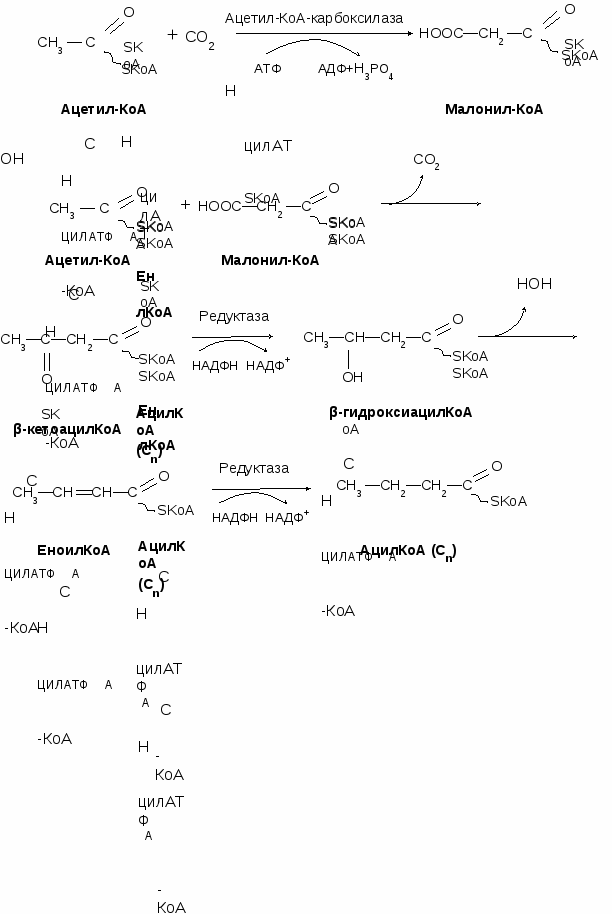
Итак, для синтеза одной молекулы С16 потребуется 8 молекул ацетил-КоА, (из которых 7 проходят стадию образования малонил-КоА), 7 АТФ и 14 НАДФН.
Регуляция синтеза жирных кислот
Лимитирующим ферментом является ацетил-КоАкарбоксилаза. Аллостерические активаторы – АТФ и цитрат, ингибиторы – жирные кислоты с длинной цепью. Инсулин, эстрогены активируют, катехоламины и стресс ингибируют синтез жирных кислот.
1.2.Обмен ацетил-КоА Пути образования ацетил-КоА
1. Из пирувата в ходе пируватдегидрогеназной реакции. Этот путь преобладает при кратковременной и напряженной мышечной работе.
2. β-окисление жирных кислот. Преобладает в следующих ситуациях: длительная мышечная работа, холод, голод, беременность, сахарный диабет.
Пути использования ацетил-КоА
Ацетил-КоА окисляется в цикле Кребса, используется в синтезе жирных кислот и идет на синтез холестерина и кетоновых тел. Путь использования ацетил-КоА зависит от энергообеспеченности и потребности организма в этих веществах.
Кетоновые тела и их функции
Под кетоновыми телами понимают три вещества: ацетоацетат, β- гидроксибутират и ацетон.
А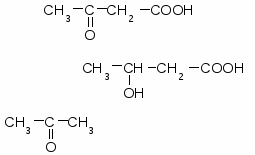 цетоацетат цетоацетат
3-гидроксибутират
Ацетон
Кетоновые тела образуются в печени и выполняют следующие функции:
1.Энергетическая. Скелетная и сердечная мышцы, мозг и другие внепеченочные ткани обеспечивают значительную долю своих энергетических потребностей за счет катаболизма кетоновых тел. Печень не может окислять кетоновые тела.
2. Кетоновые тела необходимы для образования миелиновых оболочек нервов и белого вещества головного мозга.
Накопление кетоновых тел в организме называется кетозом. Кетоз сопровождается кетонемией и кетонурией. Кетоз бывает физиологическим и патологическим. Физиологический кетоз возникает при голодании, длительной мышечной работе и у новорожденных, патологический – при сахарном диабете.
Накоплению кетоновых тел способствуют катехоламины и СТГ. Инсулин снижает синтез кетоновых тел.
Обмен холестерина
Источники холестерина:
- пищевые продукты (желток куриного яйца, головной мозг, печень, сливочное масло и др.);
- синтез из ацетил-КоА .
Синтез холестерина
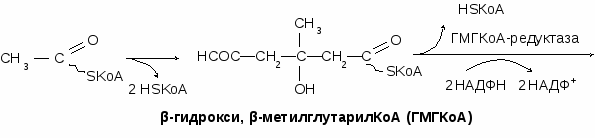
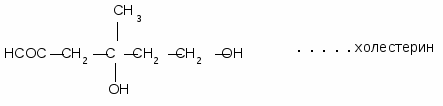
Всасывание холестерина из кишечника происходит с участием желчных кислот. После всасывания большая часть холестерина этерифицируется жирными кислотами с образованием стеридов, которые входят в состав липопротеинов.
Синтез холестерина происходит из ацетил-КоА с затратой НАДФН и АТФ. 80% холестерина синтезируются в печени, 10% - в тонком кишечнике, 5% - в коже. Лимитирующим ферментом синтеза холестерина является ГМГКоА-редуктаза. Активируют синтез: КА, СТГ, ГКС, андрогены, насыщенные жирные кислоты, любые виды стресса, пища, богатая углеводами. Снижают синтез холестерина: инсулин, тироксин, эстрогены, холестерин, полиненасыщенные жирные кислоты, мышечная работа.
Роль холестерина в организме
1. Входит в состав всех клеточных мембран и обеспечивает их теку-честь.
2. В печени используется для синтеза желчных кислот.
3. В коже под действием ультрафиолета из него образуется витамин D.
4. В эндокринных железах используется на синтез стероидных гормонов (половые, минералокортикостероиды, глюкокортикостероиды).
1.3. Липопротеины
Содержат гидрофобное ядро (ТГ и холестериды) и гидрофильную оболочку (холестерин, фосфолипиды, белки).
Классификация липопротеинов основана на различной их плотности (чем больше липидов, тем меньше плотность).
Классы липопротеинов:
хиломикроны (ХМ) содержат 1% белка и 99% липидов. Это самые гидрофобные липопротеины, имеют наименьшую плотность, не обладают электрофоретической подвижностью. Образуются в стенке кишечника. Являются главной формой транспорта пищевых липидов. Это самые крупные частицы. Исчезают из кровяного русла через 5 часов после еды. Метаболизируются липопротеинлипазой.
пре β-липопротеины (или ЛПОНП). Содержат 10% белка, 90% липидов. Образуются в печени и очень мало – в тощем кишечнике, являются транспортной формой эндогенных липидов в жировую ткань. Те из них, которые не попадают в жировую ткань, превращаются в липопротеины низкой плотности (ЛПНП), богатые эфирами холестерина. Это превращение катализируется липопротеинлипазой.
β-липопротеины (ЛПНП). Содержат около 25% белка и 75% липидов. Главным компонентом является холестерин (примерно 50%) в виде эфиров с линолевой кислотой и фосфолипиды. У здоровых людей до 2/3 всего холестерина плазмы находится в составе ЛПНП. Они являются главным поставщиком холестерина в ткани. ЛПНП регулируют синтез холестерина de novo. Большинство ЛПНП являются продуктами расщепления ЛПОНП липопротеинлипазой. На клеточных мембранах имеются рецепторы для ЛПНП. В клетки ЛПНП проникают путем эндоцитоза.
α-липопротеины (ЛПВП) содержат 50% белков, 25% фосфолипидов, 20% эфиров холестерина и очень мало триацилглицеринов. Образуются главным образом в печени. ЛПВП образуют комплексы с ферментом лецитинхолестеролацилтрансферазой (ЛХАТ). С помощью этого фермента свободный холестерин ЛПВП превращается в эфир (холестерид). Холестерид является гидрофобным соединением, поэтому перемещается в ядро ЛПВП. Источником жирной кислоты для этерификации холестерина является лецитин (фосфатидилхолин). Таким образом, ЛПВП, благодаря ЛХАТ, забирают холестерин от других липопротеинов и транспортируют его в печень, предотвращая накопление его в клетках. ЛПОНП и ЛПНП считают атерогенными, то есть вызывающими атеросклероз. ЛПВП - антитиатерогенными.
Липопротеины в крови имеются постоянно, но их концентрация меняется в зависимости от ритма питания. После приема пищи концентрация липопротеидов повышается, достигая максимума через 4-5 часов. Через 10-12 часов в крови здоровых людей отсутствуют ХМ, обнаруживаются ЛПОНП (15%), ЛПНП (60%), ЛПВП (25%). Повышение липопротеидов называется гиперлипопротеидемией. Главная опасность этого состояния связана с тем, что повышается вероятность возникновения атеросклероза. Вероятность заболевания тем выше, чем больше отношение ЛПНП к ЛПВП в крови.
Патология липидного обмена Атеросклероз
Это патология, которая характеризуется отложением, главным образом, холестерина в стенке крупных сосудов (аорта, коронарные сосуды, сосуды мозга и т.д.) с образованием вначале пятен, полосок. Затем на их месте образуются утолщения (атеросклеротические бляшки). Эти липидные бляшки являются своеобразным инородным телом, вокруг которого развивается соединительная ткань, затем наступает кальцификация пораженного участка сосуда. Сосуды становятся неэластичными, плотными, ухудшается кровоснабжение ткани, а на месте бляшек могут возникать тромбы. В стенке сосудов есть два защитных механизма от избыточного отложения холестерина:
1. Работа липопротеинлипазы, которая расщепляет жир липопро-теидов, делает их меньше по размеру;
ЛПВП, которые уносят холестерин.
Биохимические причины атеросклероза
Увеличение атерогенных липопротеидов (ЛПОНП и ЛПНП).
Снижение ЛПВП.
Снижение активности липопротеинлипазы, в результате которого липопротеиды не расщепляются и накапливаются в сосуде.
Снижение количества рецепторов к ЛПНП. Эти рецепторы находятся в основном в печени. Когда их мало, ЛПНП не захватываются печенью и остаются в кровотоке.
Факторы риска для развития атеросклероза
1. Курение.
2. Стресс.
3. Переедание (пища, богатая насыщенными жирными кислотами и углеводами).
4. Эндокринные факторы:
гипотиреоз;
сахарный диабет;
андрогены;
климакс;
гиперфункция гипофиза;
гиперфункция надпочечников.
5. Хронические гипоксии.
6. Гиподинамия.
7. Семейно-наследственные факторы.
Степень развития атеросклероза можно оценить по коэффициенту атерогенности:
о
бщий холестерин – холестерин ЛПВП
холестерин ЛПВП
У здоровых людей это соотношение не должно превышать 3. Если выше – имеется риск ИБС.
Ожирение
У нормально упитанного человека жиры составляют около 15% массы тела. При сбалансированном питании количество жира в организме не изменяется. При этом жиры жировой ткани все время обновляются, то есть одновременно идут липолиз и липогенез с равными скоростями. В результате жиры жировой ткани за несколько дней обновляются полностью. При длительном голодании и физических нагрузках липолиз идет с большей скоростью, чем липогенез. В результате количество депонированного жира уменьшается. Если липогенез опережает липолиз, наступает ожирение. Наиболее частой причиной ожирения является несоответствие между количеством потребляемой пищи и энергетическими тратами организма. Такое несоответствие возникает при переедании (особенно углеводов, так как они легко переходят в жиры), при гиподинамии (при этом мобилизация жира идет с более низкой скоростью) и, особенно, при сочетании этих факторов. Кроме того, ожирение является характерным признаком многих эндокринных заболеваний. Люди, страдающие ожирением, в 7 раз чаще болеют диабетом, атеросклерозом, гипертонией и желчнокаменной болезнью.
Липидозы
Липидозы – это наследственные заболевания, связанные с отсутствием генов, отвечающих за синтез ферментов, расщепляющих сложные липиды.
Болезнь Гоше (цереброзидоз)
Нет фермента, расщепляющего глюкоцереброзид. В результате в лизосомах печени, селезенки и костного мозга накапливаются глюкоцереброзиды.
Болезнь Нимана-Пика
При этой болезни в лизосомах печени и селезенки накапливаются лецитины и сфингомиелины. У детей наблюдается умственная отсталость и ранняя смерть.
Болезнь Тей-Сакса
Накапливаются ганглиозиды в мозге, меньше в других тканях.
2ринцип метода. Определение холестерина в сыворотке крови основано на использовании сопряженных ферментативных реакций. При гидролизе эфиров холестерина холестеролэстеразой образуется свободный холестерин. Образовавшийся и имеющийся в пробе холестерин окисляется кислородом воздуха под действием холестеролоксидазы с образованием эквимолярного количества пероксида водорода. Под действием пероксидазы пероксид водорода окисляет хромогенные субстраты с образованием окрашенного продукта, интенсивность окраски которого пропорциональна концентрации холестерина в пробе.
2.3.2. Определение холестерина липопротеинов высокой плотности (-холестерин)
Принцип метода. Липопротеины низкой и очень низкой плотности образуют нерастворимые комплексы с гепарином в присутствие ионов марганца. После осаждения этих комплексов в надосадочной жидкости остаются липопротеины высокой плотности, в которых определяют -холестерин по реакции Илька или ферментативным методом.
Нормальное содержание -холестерина в сыворотке – 0,91-1,95 ммоль/л.
Расчет коэффициента атерогенности
Коэффициент атерогенности (К) используют при оценке вероятности заболевания атеросклерозом.
К= (общий холестерин --холестерин)/-холестерин
В норме К = 3-4. При возрастании коэффициента риск заболевания увеличивается.
Диагностическое значение определения холестерина
Общий холестерин. Гиперхолестеринемия наблюдается при атеросклерозе, сахарном диабете, гипотиреозе, механической желтухе, нефрозах, болезни Иценко-Кушинга. Гипохолестеринемия обнаружена при гипертиреозе, туберкулезе, анемии, голодании, паренхиматозной желтухе, при аддисоновой болезни, врожденных гемолитических анемиях, острых панкреатитах, полиневритах, колитах, при расстройствах питания. При заболеваниях печени снижается количество эфирносвязанного холестерина. При этом падение пропорционально степени нарушения функции печени.
-холестерин. Снижение концентрации холестерина липопротеинов высокой плотности наблюдается у лиц с ишемической болезнью сердца, обусловленной коронарным атеросклерозом. Каждый из известных факторов риска атеросклероза и ИБС сопряжен со снижением -холестерина. У лиц с наследственной гипер--холестеринемией реже, чем у остальных наблюдается инфаркт миокарда и ИБС.
б) Ситуационные задачи
У больного при зондировании 12-перстной кишки установлена задержка оттока желчи из желчного пузыря. Влияет ли это на переваривание жиров?
В крови пациента отмечено повышение содержания липидов. Как называется это состояние? Не может ли оно зависеть от нарушения правил взятия крови на анализ?
Какие липиды и в какой форме можно обнаружить в крови человека через 5 часов после того, как он съел жирные котлеты?
В молоке жир эмульгирован, желудочная липаза у детей активна. Нужны ли в этих условиях желчные кислоты?
В организме человека примерно 4 г желчных кислот. За сутки они совершают в среднем 6 оборотов между печенью и ЖКТ. За каждый оборот реабсорбируется примерно 96% желчных кислот. Сколько граммов желчных кислот синтезируется ежедневно?
У больного вследствие хронической недостаточности печени и кишечника, нарушено всасывание липидов. Какие сопутствующие гиповитаминозы отягощают состояние больного?
Состав жирных кислот жиров, транспортируемых из кишечника в составе хиломикронов, отличается от состава жиров пищи. Для объяснения этого:
а) опишите превращения пищевых жиров в полости и в клетках слизистой оболочке тонкой кишки;
б) опишите превращение незрелых хиломикронов в зрелые.
У пациента обнаружена стеаторея (выведение непереваренных жиров с фекалиями). Опишите причины и последствия стеатореи. Для этого:
а) напишите реакции, происходящие при переваривании жиров;
б) составьте схему превращения пищевых жиров;
в) объясните роль поджелудочной железы и желчи в переваривании жиров;
г) перечислите рекомендации по питанию, которые необходимо дать больному.
Сколько АТФ потребуется для синтеза трипальмитина из глицерина и пальмитиновой кислоты?
Экспериментально доказано, что жирные кислоты – естественное энергетическое "горючее" для сердца. Подсчитайте и сравните энергетический эффект аэробного окисления глюкозы и пальмитиновой кислоты.
Синтезируйте бутановую кислоту. Сколько и каких веществ для этого потребуется?
Сколько молекул ацетил-КоА надо окислить до углекислого газа и воды, чтобы покрыть энергетические затраты на синтез 3 молекул стеариновой кислоты?
У пациента в крови и моче резко повышено содержание кетоновых тел. Какие данные необходимы для уточнения причин этого повышения?
Можно ли снижением потребления холестерина вызвать снижение его концентрации в крови?
При скармливании животным пищи, содержащей олеил-холестерин, все углеродные атомы которого были радиоактивными, через 2 часа удалось обнаружить метку в составе хиломикронов сыворотки крови. Однако, при этом радиоактивность обнаруживалась не только в холестерине и его эфирах, но и во фракциях триацилглицеринов. Объясните результаты опытов, вспомнив и записав в тетради:
а) превращение, которому подвергаются эфиры холестерина пищи в тонком кишечнике;
б) вещества, участвующие в процессе всасывания продуктов гидролиза;
в) превращения, которым подвергается холестерин и высшие жирные кислоты в эпителиальных клетках кишечника;
г) липопротеиды, в составе которых экзогенный холестерин и его эфиры поступают в кровь.
Животному ввели меченую по углероду глюкозу. Метка была обнаружена в молекуле холестерина. Покажите схематично основные этапы участия глюкозы в синтезе холестерина.
Для чего больному атеросклерозом при выписке из больницы рекомендуют диету, стимулирующую отток желчи и усиление перистальтики кишечника?
|
|
|
 Скачать 1.04 Mb.
Скачать 1.04 Mb.





 кисление глицерина
кисление глицерина Жирная кислота + НSКоА + АТФ Ацил-КоА + АМФ + РР
Жирная кислота + НSКоА + АТФ Ацил-КоА + АМФ + РР
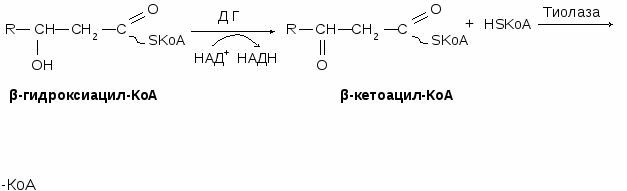


 цетоацетат
цетоацетат