1.Кристаллография как наука. Понятие о кристал, аморф сост в-в. Основные с-ва кристалл сост.
Кристаллография-наука , которая изучает структуру идеальных кристаллов.
Кристаллами обычно назт тв.тела, которые вырастают в природных или лабор. условиях в виде выпуклых многогранников с плоскими гранями и прямолине ребрами. Структура отвечает за свой-ва изучаемых вещ-в, а свойствами определяется область прим в народном хозяйстве.
Кристалл тела — это такие тела, атомы и молекулы -х расположены в опр порядке, и этот порядок сохр на достаточно большом расстоянии.
Аморфными называют в-ва, у к отсутствует порядок расположения атомов и молекул по всему объему этого в-ва. В отличие от кристалл вещ-в аморфные вещества изотропны. Это значит, что свойства одинаковы по всем направлениям. Переход из аморфного состояния в жидкое происходит постепенно, отсутствует опр температура плавл. Аморфные тела не облад упругостью, они пластичны. В аморфном состоянии нах-ся различные в-ва: стекла, смолы, пластмассы и т. п.
Основные свой-ва кристаллического состояния: 1.Однородность- кристалл наз-ся однородным, если для любой точки,взятой внутри него найдется др. такая точка , в к-х сво-ва совершенно одинак., причем они отстоят др. от др. на некотором конечном состоянии 0,5нм.
2.Анизотропия – это количеств различие свой-в кристаллов в разных направлениях.
3.Самоограняемость-способ-ть кристаллов, образовывать плоские грани при кристаллизации.
4.Симметрия- все кристаллы симметричны.
5.Только кристаллы обладают темпр. плавления и min внутр.энергией.
____________________________________________
6. 32класса симметрии. Вывод и описание. Теоремы о сложении элементов симметрии.
Всего сущ. 32 кл. симм., с помощью к. опис-ся симм-сть и физ. св-ва крист. При выводе за основной эл. берется ось симм., затем к ней поочер. + др. эл. симм.
Средняя катег. делится на тригон.,тетрагон. и гексагон.Каждая сист. подразд-ся на классы. Тригон.:
1)класс-примитив., ось симм.-L3.2)класс центральный-к оси симм. + центр симм. = 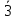 (L3C).3)класс планальный - +вертик. пл-сть = 3m(L33P).По 3 теореме 3 пл-сти 4 класс-аксиальный, + ось симметрии ⟂-ую и получаем 32(L33L2).из теор.4-в классе планаксиальном + центр симметрии и получаем (L3C).3)класс планальный - +вертик. пл-сть = 3m(L33P).По 3 теореме 3 пл-сти 4 класс-аксиальный, + ось симметрии ⟂-ую и получаем 32(L33L2).из теор.4-в классе планаксиальном + центр симметрии и получаем 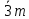 (L33L23PC).По следствию из теории при наличии центра симм. кол-во четных осей = числу пл-стей. (L33L23PC).По следствию из теории при наличии центра симм. кол-во четных осей = числу пл-стей.
Тетрагон.: 1 класс(примитив.), где ось симм. L4; 2 класс – к оси симм. + центр симм. 4/m (4PC), по теор. 2а появ-ся пл-сть симметрии;3 класс - +вертик. пл-сть 4mm (L44P) по теор. 3 появ-ся 4 плос-ти симметрии;4 класс(аксиальный) - + ось симм. ⟂ и получ. 422(L44L2) (из теор. 4); 5 класс(планаксиальный) - + центр симм. получ. 4/mmm (L44L25PC) по следств. из теор. число пл-стей 5;6 класс (инверсионно-примитив.) – инверс. ось 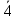 ( (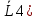 . .
Сред.катег.гексагон.система:
1 класс(примитив.) – присут. ось симм.L6; 2 класс(централный) – где к оси + центр симм – 6/m (L6PC) по теор. 2а появ. пл-сть симм.;3 класс (планальный) - + вертик. пл-сть = 6mm (L66P) из теор. 3 появл. 6 пл-стей симм.;4 класс(аксиальн.) - + ось симм. ⟂ = 622 (L66P) из теор. 4; 5 класс(планаксиальн.) - + центр симм. = 6/mmm (L66L27PC) по следств. из теор. число пл-стей 7;6 класс (инверс.-примит.) – инверс. ось 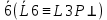 . .
Теоремы о сложении элементов симметрии С,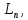 P, P,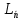 -элементы симметрии; Вершина грань ребро – элементы огранения кристалла -элементы симметрии; Вершина грань ребро – элементы огранения кристалла
Эти эл-ты симметрии могут складываться м/д собой. Сложение этих эл. симметрии приводит к появлению равнодействующего элемента.
Теоремы:
1)Линии персеч. двух пл-стей симм-ии яв-ся осью симм., причем угол поворота вокруг этой оси в 2 раза больше угла м/у пл-ми.
2)а)Т. пересеч. четной оси симм. с ⟂ей пл-стью есть центр симм.(если есть четн. ось и на ней лежит центр симм., то ⟂ этой оси проходит пл-сть симм-ии. б)Если есть центр симм. и ч-з него прох-т пл-сть, то ⟂ этой пл-сти проходит четная ось симм)
3)Если есть ось n-ого порядка и ч-з нее проходит пл-сть, то таких осей n. Ln nP
4)Если есть ось n-ого порядка и ⟂ ей проходит ось 2-ого порядка, то таких осей n.
СЛЕДСТВИЕ-при наличии С кол-во четных осей=числу пл-ей__________
10. Кристаллическая структура. Ионные, металлические кристаллы. Особенности координирования в них СЕ. Примеры.
Под крист структ понимают пространственное расположение всех материальных частиц – атомов, ионов, молекул.
Структура – конкретное расположение материальных частиц в пространстве.
Ионные крист обладают преимущественно ионной хи связью. Галогениды щелочных и щелочноземе мет являются типичными примерами ионных кристаллов.
Осуществляется электростатическим взаим-м м-у положит и отрицат ионами, которые образ из-за изб или недостатка электронов у атома.
Ионная связь малонаправленная и ненасыщенная (как и металлическая связь).
Ненаправленность опр тем, что каждый ион имеет сферическую форму электронного поля и может притягивать ионы противопол знака по любому направлению.
Ненасыщенность объясняется тем, что взаим-ие ионов противопол знака не приводит к компенсации силовых полей и у них сохраняется способность притягивать ионы противоположного знака.
вокруг каждого иона располагается ограниченное число противоионов, это связано с координационным числом.
Свойства:
А) К.ч.=6-8
Б) Плотнейшая упаковка
В) Для ионных структур характерны диэлектрические св-ва, низкая электро- и теплопроводность, хрупкость.
Г) Электропроводность осуществляется движением ионов.
Энергия связи около 180 ккал/моль
Металлические кристаллы. Металлы демонстрируют высокую тепло- и электропроводность, свидетельствует о наличии свободных электронов.
Метал свзязь характерна для элементов 1-х групп периодической системы и для интерметаллов.
Она осуществляется вз-ем свободных электронов и положит заряженных атомных ядер.
Все атомы отдают свои валентные электроны в общее пользование, т.е. свободные электроны обобществляются и легко перемещ м-у атомными ядрами, представляя своеобразный электронный газ.
Только металлы имеют к.ч.=12.
Основные свойства Ме:
А) Имеют большие к.ч. (8, 12)
Б) Плотнейшая упаковка.
В) Все металлы обладают высокой тепло- и электропроводностью.
Г) Обладают ковкостью.
Д) Цвет, блеск.
Энергия крист-1 решетки 10-20 ккал/моль.
|
2.Структура. Кристаллическая (пространственная) решетка. Элементарная ячейка, её параметры. Построение пространственной решетки.
Структуру можно представить в виде рядов, которые образ. сетки(плоскости), а совокупность сеток дает нам кристаллич. решетку.
Параметры рядов кристаллической решетки (период, элементная трансляция) – кратчайшее расс-ие в ряду крист. решетки м/д одинак. атомами.
Построение кристаллической решетки: строим оси координат x,y,z на них откладываем отрезки абс и строим элемент ячейку
Кристаллическая решетка- совокупность элементарных ячеек, которые соединяются м/д собой параллельн. гранями.
Правило выбора элемент. ячейки:
1.Элементарный объем
2.max возможное кол-во прямых углов 90 градусов
3.Симметрия элемент. ячейки совпадает с симметрией всей кристалл. решетки
____________________________________
7.Симметрия структуры кристаллов. Решетки Бравэ. Распределение элементарных ячеек по сингониям. Координационные числа структурных единиц. Координационные многогранники. Число атомов в ячейке. Определение стехиометрической формулы вещества.
Бравэ (14 решеток)доказал,что все кристалл. вещ-ва можно описать 14 решетками Бравэ:
Решетки Бравэ - элементарные ячейки, с помощью которых мы представляем себе распределение материальных частиц.
Выбор решеток Бравэ:
1.Симметрия решетки Бравэ должна соответсвовать симметрии кристалла.
2.Решетка должна иметь max возможное кол-во прямых углов или равных углов(ромбоэдр).
3.Минимальный объем.
По расположению материал. частиц все решетки подразделяются на 4 типа:
P(примитивная) C(базоцентрированная) F(гранецентрированная) I(объемоцентрованная)
7 систем:
Системы
|
P
|
C
|
F
|
I
|
Параметры эл.яч.
|
Триклинная
|
+
|
|
|
|
|
Моноклинная
|
+
|
+
|
|
|
|
Ромбическая
|
+
|
+
|
+
|
+
|
|
Тригональная
|
+
|
|
|
|
|
Тетрагональная
|
+
|
|
|
+
|
|
Гексагональная
|
+
|
|
|
|
|
Кубическая
|
+
|
|
+
|
+
|
|
Симметричное расположение материал.частиц в элемент.ячейке характеризуют с помощью след элементов симметрии: С,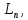 P, P,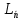 (трансляция,винтовая ось симметрии, плоскость скользящего отражения). Трансляция –это бесконечно повторяющийся параллельный перенос на некоторое опред.расс-ие (a,b,c). Сочетание трансляции с плоскостями и осями симметрии дают 2 основных элемента симметрии:винтовые оси симметрии и плоскость скользящего отражения.ПГС – это полный набор элементов симметрии структур. (трансляция,винтовая ось симметрии, плоскость скользящего отражения). Трансляция –это бесконечно повторяющийся параллельный перенос на некоторое опред.расс-ие (a,b,c). Сочетание трансляции с плоскостями и осями симметрии дают 2 основных элемента симметрии:винтовые оси симметрии и плоскость скользящего отражения.ПГС – это полный набор элементов симметрии структур.
Координационное число- это число ближайших соседних атомов.
к.ч. к.м.
2 прямая
3 треугольник
4 тетраэдр
6 октаэдр
8 куб
12 кубооктаэдр
Координационный многогранник – соединяем центры соседних атомов прямыми линиями.
По подсчету кол-ва атомов мы пишем хим. формулу вещ-ва: z-число формульных единиц
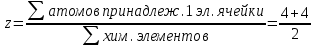 =4 =4 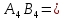 AB 4Na+4Cl=4NaCl AB 4Na+4Cl=4NaCl
______________________________________________________
13. Изоморфизм. Разновидности их и условия проявления. Твердые растворы (замещения и внедрения, вычитания).
Изоморфизм – это свойство химически и геометрически близких атомов, ионов и их сочетаний замещать друг друга в кристаллической решетке, образуя кристаллы переменного состава.
Химически близкие атомы – это атомы, которые обладают одинаковой валентностью, одинаковым типом химической связи, одинаковой поляризацией.
Под изоморфизмом в современном смысле понимают способность веществ образовывать ограниченные или непрерывные ряды твердых растворов (смешенных кристаллов) независимо от того изоструктурные исходные компоненты или нет.
Изоструктурными называются вещества с одинаковой кристаллической структурой.
Условия изоморфных превращений –это близость размеров материальных частиц, которые заменяют друг друга.
Различают совершенный изоморфизм, если разница структурных единиц не превышает 15%.
КCl и KBr: 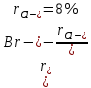
Ограниченный изоморфизм, если разница в размерах частиц будет больше 15%.
KCl и KI: 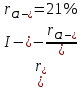
Изоморфизм отсутствует если больше 21%.
KCl и NaCl: 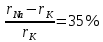 - изоморфизм отсутствует. - изоморфизм отсутствует.
Явления изоморфизма нельзя рассматривать без термодинамических условий (температура, давление).
Изоморфизм бывает изовалентный и гетеровалентный.
Ферсман заметил, что способность к гетеровалентному изоморфизму проявляют элементы,расположенные впериодической системе на диагоналях, направленных из левого верхнего угла вправый нижний.
Эти ионы имеют почти одинаковые размеры. Это явление было названо правилом диагональных рядов Ферсмана.
Твердый раствор – это однородные кристаллические фазы переменного состава.
Твердый раствор – это твердое тело имеющее однородную кристаллическую структуру в которых некоторые эквивалентные позиции заняты различными ионами.
Твердые растворы бывают:
1. Твердые растворы замещения. В этих твердых растворах атомы основного вещества замещаются на внедряющиеся атомы.
2. Твердые растворы внедрения. При их образовании внедряющиеся атомы располагаются в междоузлиях решетки.
3. Твердые растворы вычитания. В них остаются не заполненные структурные позиции.
|
3. Элементы симметрии. Единичные и эквивалентно-равные направл. в кристаллах.
Симметрией называется св-во повторять свои одинаковые части, при воздействии на это тело какими-то операциями.
К элементам симметрии относят: Ось симметрии, центр симметрии, плоскость симметрии, инверсионные оси симметрии.
1.Поворот или вращение
Ось симметрии( - это прямая линия, проходящая ч/з многогранник, при повороте вокруг которой на некоторый угол - это прямая линия, проходящая ч/з многогранник, при повороте вокруг которой на некоторый угол  ,одинак. части фигуры совмещаются др. с др. ,одинак. части фигуры совмещаются др. с др.
Оси симм проходят через все элементы огранения кристалла: через центры граней, через две вершины, через середины ребер.
2.Точка внутри многогранника
С-центр симметрии –это точка внутри многогранника,которая делит центр симметрии пополам.
Практическое определение С:
Кладем фигуру на стол и верх. грань ,если она параллельна, то в этой фигуре есть центр симметрии.
3.Деление фигуры на равные части-P-плоскость симметрии, она делит фигуру на две равные зеркальные части.
Плоскость проходит либо вдоль ребер, либо перпендикулярно им.
4.Инверсионные оси симметрии образ. в результате 2-х операций:а)поворот или вращение б)отражение точки.
Мы знаем, что свойства кристаллов различны по разным направлениям (анизотропия кристаллов). Но если данное направление размножается элементами симметрии кристалла, значит, для этого направления есть эквивалентные направления, в которых свойства будут такими же. Направления, связанные элементами симметрии, называются симметрично-равными. С другой стороны, в кристалле возможны направления, которые не размножаются элементами симметрии, им нет эквивалентных, симметрично-равных направлений. Единичное направление- единственное направление в кристалле
______________________________________________
12. Элементы симметрии кристаллических структур. 230 пространственных групп симметрии.
Симметрия – это свойство тел повторять свои одинаковые части, при воздействии на это тело какими-то операциями.
|
 Скачать 0.84 Mb.
Скачать 0.84 Mb.