1. Способы выражения концентрации раствора
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
Предисловие. Будучи огорчен качеством преподавания химии в РНИИМУ, и тем более способом последующего контроля качества образования – тестами, я решил оказать посильную помощь студентам в сдаче оных. Пособие представляет собой краткую, насколько возможно, инструкцию, как, минимально загрузив голову, таки сдать этот окаянный тест. Я исследовал большое их количество, обобщил результаты. Вопросы были мной разделены на темы в таком порядке, в каком вы их изучали или якобы изучали, кому как повезло. На каждый вид вопросов я постарался дать ответ, в меру научный, чтобы все-таки не слишком уйти от своих химических корней, но и достаточно ясный, чтобы он мог быть воспринят среднестатистическим студентом РНИИМУ. Теперь я представляю свой труд на суд и пользование широкой общественности, надеюсь, моё творение сможет послужить к чьей-нибудь пользе. Заранее благодарен за адекватные комментарии, дополнения и исправления к тексту. Текст создан исключительно из гуманных соображений и распространяется безвозмездно. Удачи, ни пуха ни пера, дорогие любители химии. Федоров Алексей, «Леша-химик» 15.01.2015 1 модуль, общая, неорганическая и физическая химия. Тема 1. Способы выражения концентрации раствора. Введение. Весьма полезно будет иметь под рукой таблицу из голубой методички. Там есть, в случае чего и определений молярности-моляльности, и формулы этих ваших моляльностей. Типичные вопросы:
Пример: 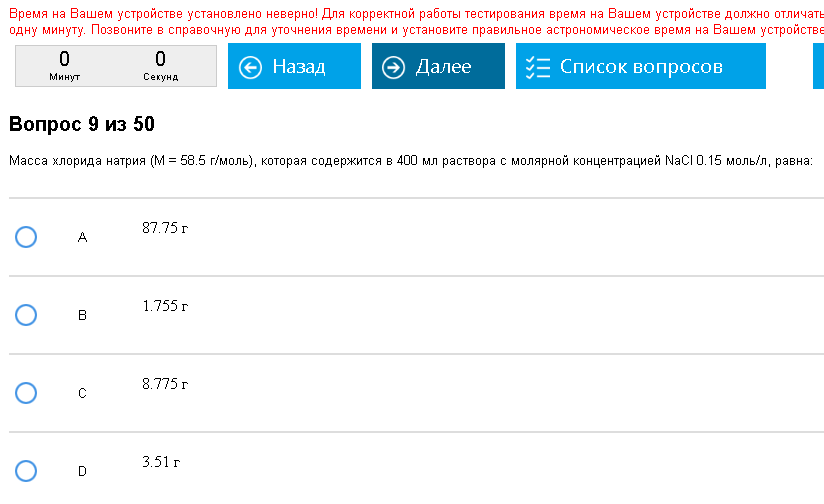 Внезапная задача. Как с этим бороться: Формула с=n/V, где c-молрная концентрация, моль/л, n-количество вещества, моль, V- объем, обязательно в л (!). Среднестатистический вопрос – необходимо вычислить массу растворенного вещества, если известно с и V, причем объем обычно в мл. Сначала из первой формулы вычисляем количество вещества, умножаем объем на молярность, (объем нужно перевести в литры, для этого мили литры делят на 1000). Затем по известной формуле n=m/M находят массу, умножают молярную на количество вещества. Можно все сразу объединить в одну формулу, m=cVM, просто все перемножить, только объем в литры все равно надо перевести. Встречаются более редкие вариации этой задачи, например найти количество моль, это даже легче, решается в одно действие.
Пример:  Ответ D, догадались же? Как с этим бороться: Масса (m), плотность (ρ) и объем (V) раствора (внимание, НЕ растворенного вещества) связаны соотношениями: m=Vρ, V=m/ρ, ρ=m/V, с чем мы вас и поздравляем.
Пример: ? Не помню, еще перед новым годом находил один какой то вопрос. Как с этим бороться: Растворимость газов увеличивается с увеличением давления и уменьшением температуры, там вроде про это было.
Пример:  Массовая доля - %! Ура, товарищи! Как с этим бороться: Вы таки долго будете смеяться, но масса измеряется в граммах и килограмах, объем в милилитрах и литрах, плотность в г/мл. Остальные размерности концентраций, как например моляльность моль/кг растворителя, могут быть найдены в методичке.
Пример:  Примерчик. Как с этим бороться: Массовая доля ω, масса растворенного вещества m(X) и масса раствора m (р-р) связаны нехитрым соотношением ω=m(X)/m(р-р), из чего следует, что m(X)= ω·m(р-р), а m(p-p) = m(X)/ω. Чего же вам еще более? Из сложного, периодически встречались в 1 модуле хитровыкрученные задачи, где требовалось узнать массу воды, которую надо добавить к раствору с известной массой и массовой долей, чтобы разбавить его до тоже известной массовой доли. Ну, например от 15% до 10%. Решались проще всего подбором. Находим, сколько растворенного вещества в 15% растворе, затем прибавляем 1ое количество воды к нему (растворенное вещество остается той же массы, а вот масса раствора увеличивается за счет долитой воды) и смотрим, получилось 10% или нет. И так далее. Но в итоговом я таких не видел. Математика все таки великая вещь.
Пример: ? Неизвестен. Как с этим бороться: Пока непонятно. Тема 2. Термодинамика. Введение: Крайне зловещая и непонятная тема, впрочем, в физической химии понятных и нет. Оперирует страннымы бессмысленными функциями – энтальпией, энтропией и энергией Гиббса. Типичные вопросы:
Пример: 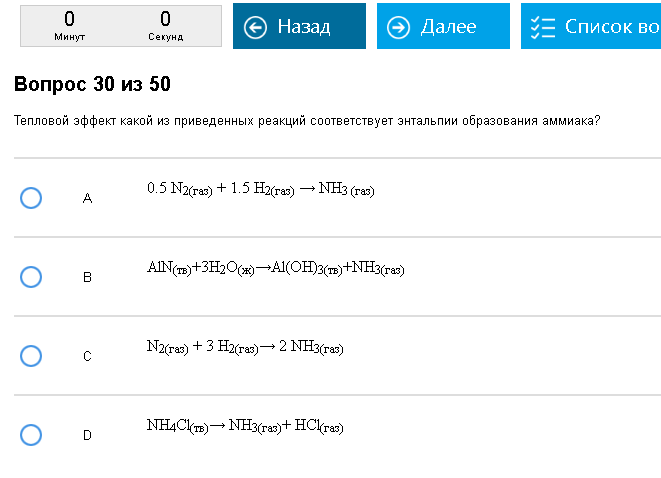 Путаный вопрос. Правильно – А, С не правильно потому, что образуется 2 молекулы аммиака, остальное неправильно потому, что аммиак получают не из простых веществ. Как с этим бороться: Надо осознать, что энтальпия образования этого вещества относится к реакции образования 1 молекулы (1 моля) этого вещества из простых веществ. То есть энтальпия образования метана, например, относится к реакции С + 2Н2 = СН4, и никаких других реакций. Реакции могут получаться очень странные, если кто-нибудь хорошо помнит ЕГЭ, то может заметить, что некоторые из этих реакций противоречат тому, чему учат в школе, и невозможны в жизни. Не надо смущаться этим, у термодинамики – своя атмосфера. Энтальпия реакции сгорания вещества относится к реакции сгорания 1 молекулы этого вещества до СО2, Н2О, SO2, N2 и других оксидов, если в веществе были другие атомы. Внимание на определения, молекула и в сгорании и в образовании должна быть только одна, это важно.
Пример: 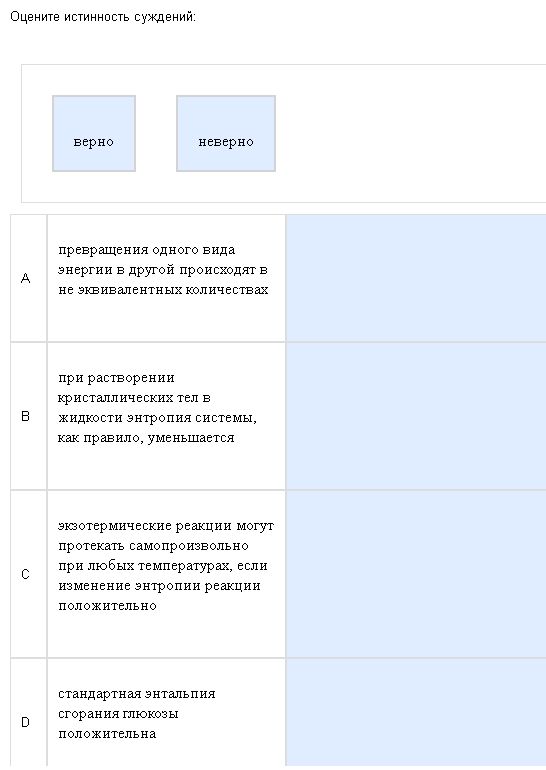 Жестокая, жестокая термодинамика… Как с этим бороться: Никак, смиритесь, это безнадежно. Не рассчитывайте даже на интуицию, если хоть одна из 4 формулировок будет с ошибкой, вам не зачтут вопрос, но надо быть минимум победителем «Битвы экстрасенсов», чтобы угадать все 4. Кратко отвечу на то, что нашел. А-неверно, виды энергии превращаются как раз в эквивалентных количествах, В-неверно, при растворении энтропия возрастает, С-верно, смотреть ниже, D-неверно, все энтальпии сгорания, и энтальпия нейтрализации отрицательны. Есть легенда, что должно быть 2 верных и 2 неверных ответа, но я считаю, что это неправильно, бывает всякое. Еще есть подозрение, что кое-где ответы перепутаны, и даже если ответить правильно с точки зрения химии, то нет уверенности, что это будет правильно с точки зрения кафедры.
Пример:  Пример переформатирования в сторону усложнения. Читаем слитно условие+А, получается Н=0, S<0, возможен при любой температуре. Сравниваем с таблицей ниже, понимаем, что получили неверное утверждение, при таких функциях процесс невозможен. Повторяем, читаем слитно условие+В, и так далее, до тех пор, пока не получим верного утверждения. Варианты, где есть G, могут рассматриваться отдельно от условия, потому что с G все просто, см. ниже. Как с этим бороться: Исходная предпосылка всех этих вопросов – Второй Закон Термодинамики, говорящий, что в закрытой системе возможен только процесс, в котором ΔG<0, а процесс ΔG>0, естественно невозможен при любых температурах. Изначально все запросто сводилось к таблице вида:
*-при условии, что обе функции не равны нулю. Сейчас все несколько сложнее, нужно просто прочитать вопрос слитно вместе с вариантом ответа, и оценить, верное ли получилось суждение.
Пример: ? Где то потерялся. Как с этим бороться: Перед Новым годом видел такие вопросы, но не заскринил, а сейчас не могу найти. Вроде ничего особенного не было. См выше. Возможен только процесс, в котором ΔG<0, а процесс ΔG>0, естественно невозможен
Пример: ? Нету. Как с этим бороться: Пока неизвестно. Тема 3. Химическое равновесие. Введение. Простая по сути, но удивительно занудная тема. Перепутать уменьшение с увеличением, а сдвиг равновесия влево со сдвигом вправо и зафейлить то, что вы поняли – пустяковое дело. Будьте бдительны! Надо отметить на всякий случай, как влияют разные факторы на сдвиг равновесия. Условные знаки: ↑-увеличивается, ↓- уменьшается, →-смещается вправо, ←-смещается влево, Кс – константа химического равновесия, Т- температура, Р – давление, с – концентрация.
А) Если реакция ΔН>0 эндотермическая, то при ↑Т равновесие → и Кс↑ при ↓Т равновесие ← и Кс ↓ Б) Если реакция ΔН<0 экзотермическая, то при ↑Т равновесие ← и Кс ↓ при ↓Т равновесие → и Кс↑
А) При ↑Р равновесие смещается в сторону образования меньшего количества газов. Например, для реакции N2 (газ) + 3 H2 (газ) = 2 NH3 (газ), с ↑ давления равновесие смещается вправо, потому что слева 4 молекулы газов (3+1), а справа только 2. Б) При ↓Р равновесие сместится в сторону образования большего количества газов. Внимание! Жидкости и твердые вещества не считаются за газы! Неожиданно, правда? Если газов в разных частях реакции поровну, тогда давление не будет влиять на такую реакцию. Р не влияет на Кс вообще никогда, иногда задают такой вопрос.
При ↑с(исх веществ) равновесие → При ↓с(исх веществ) равновесие ← При ↑с(продуктов) равновесие ← При ↓с(продуктов) равновесие → Концентрция не влияет на Кс
Не влияет на сдвиг равновесия и Кс Типичные вопросы:
Пример:  Самая жесть этой темы. Обратите внимание, концентрации твердых веществ не даны, потому что они не ставятся в формулу, а в жизни не имеют смысла. Концентрация может применяться только к растворенному веществу, а твердое вещество – не растворено. Пс=0,01/0,05=0,2. Пс<Кс, ну и вывод…? Как с этим бороться: Самый сложный вопрос. Алгоритм действий подробно описан в голубой методичке, могу его только просто повторить. 1. Рассчитываем 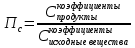 , то есть концентрации продуктов, в степенях, равных коэффициентам, разделить на концентрации исходных веществ, тоже в степенях, равных коэффициентам. Например, для реакции 2 NO + O2 = 2 NO2 оно будет рассчитываться так: Пс=с(NO2)2/ с(NO)2с(О2). Внимание, концентрации даны дурацким способом, не перепутайте, где чья концентрация. Внимание! Степени не потеряйте! Потом сравниваем рассчитанное Пс с данным Кс. Если Пс>Kc то реакция идет влево, если Пс , то есть концентрации продуктов, в степенях, равных коэффициентам, разделить на концентрации исходных веществ, тоже в степенях, равных коэффициентам. Например, для реакции 2 NO + O2 = 2 NO2 оно будет рассчитываться так: Пс=с(NO2)2/ с(NO)2с(О2). Внимание, концентрации даны дурацким способом, не перепутайте, где чья концентрация. Внимание! Степени не потеряйте! Потом сравниваем рассчитанное Пс с данным Кс. Если Пс>Kc то реакция идет влево, если Пс
Пример: 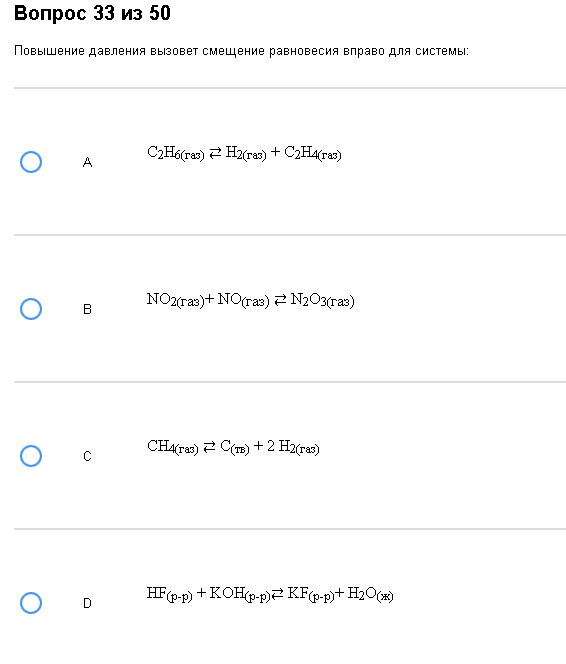 Геморрой. Верно – В. Обратите внимание на D, там вообще нет газов. Как с этим бороться: Все описано во введении, главное не перепутайте повышение и понижение давление, а из веществ смотрите только на газы.
Пример:  Пример как раз обратного рассуждения, если при ↑Т Кс↑, то реакция…? Как с этим бороться: Опять же, все описано во введении. Верны будут как прямые суждения, типа «для экзотермической реакции при повышении температуры константа равновесия уменьшается», так и обратные типа «если для реакции при повышении температуры константа равновесия уменьшается, то реакция экзотермическая». Чтобы жизнь не казалась слишком легкой, придумали такое усложнение: иногда спрашивают про энтальпию не прямой, а обратной реакции. Например, для некоей обратимой реакции с ростом температуры константа равновесия увеличивается. Ежу понятно, прямая реакция эндотермическая. А вот обратная реакция – экзотермическая. Будьте бдительны, враг не дремлет.
Пример: Сорян, забыл заскринить. Как с этим бороться: См. введение, тут вроде бы без переподвыподвертов.
Пример: нету Как с этим бороться: Пока неизвестно. Тема 4. Осмос. Введение. Очень легкая тема. Расчеты строятся на формуле сосм=i·c, где сосм – осмолярность, c – молярная концентрация, а i – изотонический коэффициент Вант-Гоффа, собственно самая соль этой темы. i равен количеству ионов, на которые распадается электролит при диссоциации. Например, для NaCl i=2, для CaCl2 i=3 (кальций и два иона хлора), для Na2SO4 тоже i=3, для K3PO4 i=4. Для слабых электролитов (HNO2, CH3COOH) i является дробным числом больше одного но меньше 2, приблизительно 1,3. Для неэлектролитов (С6Н12О6, сахароза, мочевина (NH2)2CO) i=1. Чем больше с и i, тем больше осмолярность. Осмотическое давление рассчитывается π=сосмRT, где π – осмотическое давление, кПа, R=8,31, Т = температура в градусах Кельвина. Типичные вопросы:
Пример: 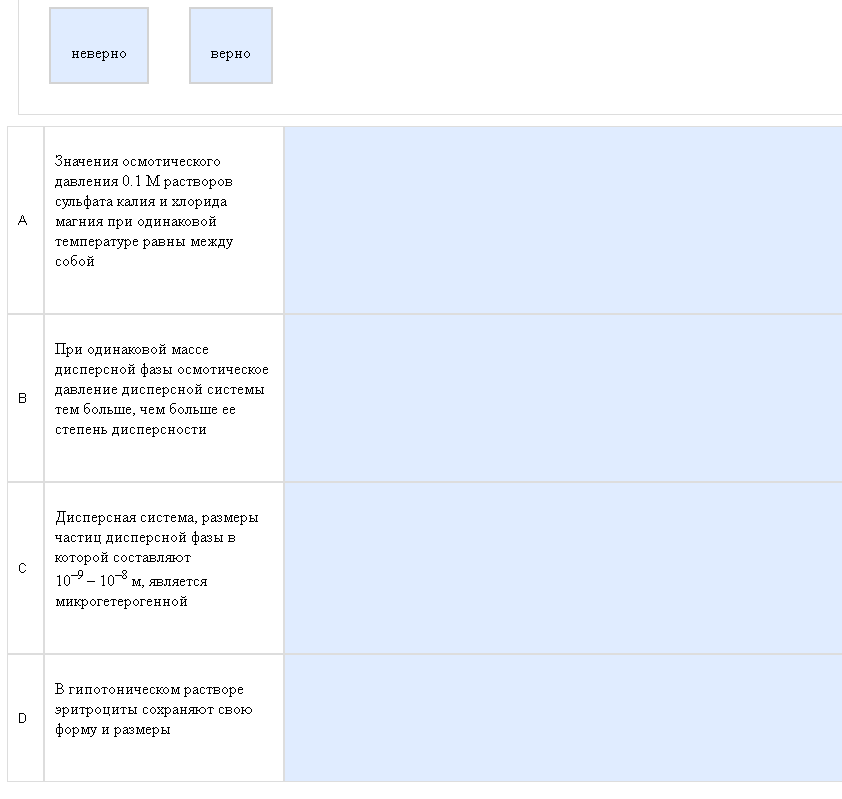 Очередная угадайка. Как с этим бороться: Никак. Как всегда никак. По примеру: А-верно, если прочитать введение, следующий вопрос и подумать, то можно догадаться почему, В-верно, часто это вижу, и таки да, чем больше степень дисперсности, тем больше осмотическое давление. Аналогично еще попадаются гидролизующийся белок, там с течением времени осмотическое давление возрастает и полимеризующаяся какая то фигня, там наоборот, осмотическое давление падает. С-неверно, такие размеры у ультрамикрогетерогенных систем, микрогетерогенные 10-4 – 10-5. D-неверно, в изотоническом растворе эритроциты сохраняют форму и размер. В гипотоническом они набухают (лизис), в гипертоническом сморщиваются (плазмолиз). Зато все остальное – элементарно.
Пример: 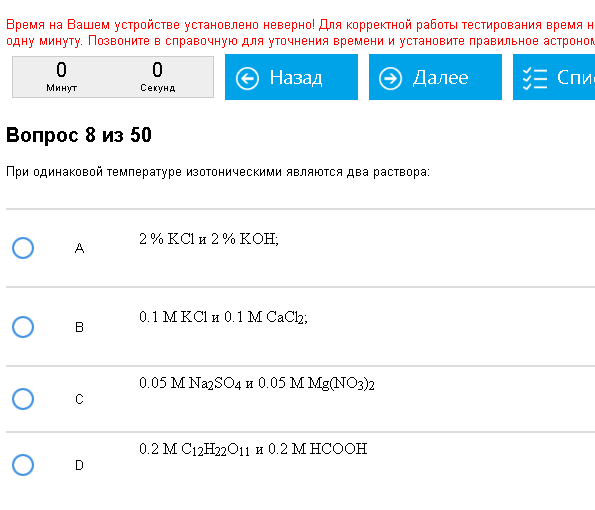 Верно – С. 0,05*3=0,05*3. Как с этим бороться: Изотонические растворы – растворы с одинаковой осмолярностью. Если у одного раствора давление больше то он гипертонический, а у другого раствора меньше и он гипотонический. В основном стоит задача найти пару изотонических растворов. Лихо определяем коэффициенты i для приведенных веществ, перемножаем их на данные концентрации (цифры там обычно такие, что все это можно и в уме сделать), получаем осмолярности, сравниваем, находим два одинаковых – ура-ура.
Пример:  Коэффициенты i по веществам равны 1, 2 и3, ряд осмолярностей получается 0,2*1<0,2*2<0,2*3, возрастает. Как с этим бороться: Полный аналог предыдущего по способу решения, чуть иная форма. Определяем коэффициенты i, перемножаем их на концентрации и смотрим, как меняется осмолярность в полученном ряду.
Пример: ? нету. Как с этим бороться: Пока неизвестно. |
