Ферментативный катализ. 1. строение ферментов механизм действия ферментов
 Скачать 25.63 Kb. Скачать 25.63 Kb.
|
|
Содержание Введение 1. СТРОЕНИЕ ФЕРМЕНТОВ 2. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ 3. КИНЕТИКА ФЕРМЕНТАТИВНОГО КАТАЛИЗА 4. РЕГУЛЯЦИЯ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ 5. НОМЕНКЛАТУРА ФЕРМЕНТОВ Заключение Список литературы Введение Катализ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами.Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными. Каталитические реакции - реакции, протекающие в присутствии катализаторов. Положительным называют катализ, при котором скоость реакции возрастает, отрицательным(ингибированием) - при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного - снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия. Катализаторы, замедляющие химическую реакцию, называются ингибиторами. В зависимости от того, находится катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. Ферментативный катализ используется людьми тысячи лет, задолго до появления самого понятия «катализ». Получение молочно-кислых продуктов, сыра, приготовление теста, вина, красителей и др. продуктов включало применение ферментативных процессов. Технология этих процессов передавалась из поколения в поколение и была эмпирически отработана до совершенства. Считают, что в эволюции жизни и появлении сложных биологических систем (включая человека) важную роль сыграл ферментативный катализ. 1. СТРОЕНИЕ ФЕРМЕНТОВ Участок молекулы фермента, на котором происходит катализ, получил название «активный центр». Если фермент по строению является Простым белком, то его активный центр формируется только остатками 1 ккал = 4,18 кДж. аминокислот, которые обычно находятся в разных участках одной и той же полипептидной цепи или же в разных полипептидах, но пространственно сближены. Другими словами активный центр образуется на уровне третичной структуры белка-фермента. У ферментов - сложных белков в состав активного центра часто входит их простетическая группа. Образование активного центра из функциональных групп, довольно далеко отстоящих друг от друга в полипептидных цепях, но совмещенных пространственно в активном центре (т. е. на уровне третичной структуры белка), позволяет ферменту за счет конформационных изменений обеспечивать необходимое соответствие между активным центром и молекулами реагирующих веществ (их обычно называют субстратами). Благодаря изменению конформации фермента происходит как бы «приспособление», «подгонка» активного центра к структуре молекул, превращение которых ускоряется данным ферментом. Изменение конформации молекулы фермента является также одним из механизмов регуляции скорости ферментативных реакций. В активном центре обычно выделяют два участка - адсорбционный и каталитический. Адсорбционный участок (центр связывания) по своему строению соответствует структуре реагирующих соединений, и поэтому к нему легко присоединяются молекулы субстрата. Каталитический участок активного центра непосредственно осуществляет ферментативную реакцию. Большинство ферментов содержат в своей молекуле только один активный центр. У некоторых ферментов может иметься несколько активных центров. 2. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ В любом катализе, осуществляемом ферментами, можно обнаружить три обязательные стадии. На первой стадии молекулы реагирующих веществ (субстрата) присоединяются к адсорбционному участку активного центра фермента за счет слабых связей. Образуется фермент-субстратный комплекс, который может легко распадаться снова на фермент и субстрат, т. е. первая стадия ферментативного катализа полностью обратима. На этой стадии с помощью активного центра возникает благоприятная ориентация реагирующих молекул, что способствует их дальнейшему взаимодействию. На второй стадии с участием каталитического участка активного центра и молекул субстрата происходят различные реакции, характеризующиеся низкой величиной энергии активации и поэтому протекающие с большой скоростью. В результате этих реакций в конечном счете образуется либо продукт реакции, либо почти готовый продукт. На третьей стадии происходит отделение продукта реакции от активного центра с образованием свободного фермента, способного присоединять к себе новые молекулы субстрата. Если на второй стадии был получен почти готовый продукт, то он предварительно превращается в продукт, который затем отделяется от фермента. Схематично стадии ферментативного катализа можно представить следующим образом: I стадия I стадия 11 стаДия 1 . а Е + S ES ^ГГ ES' Е + Р Фермент Субстрат Фермент- Химически Продукт субстратный преобразованный комплекс фермент-субстратный комплекс (S' - продукт или почти готовый продукт) В клетках ферменты, катализирующие многостадийные химические процессы, часто объединяются в комплексы, называемые мультиферментными системами. Эти комплексы структурно связаны с органоидами клеток или же встроены в биомембраны. Объединение отдельных ферментов в единый комплекс позволяет одновременно ускорять все последовательные стадии превращения какого-либо субстрата. В некоторых случаях в катализе наряду с белком-ферментом еще участвует низкомолекулярное (небелковое) соединение, называемое коферментом. Большинство коферментов в своем составе содержат витамины. 3. КИНЕТИКА ФЕРМЕНТАТИВНОГО КАТАЛИЗА Скорость ферментативных реакций существенно зависит от многих факторов. К ним относятся концентрации участников ферментативного катализа (фермента и субстрата) и условия среды, в которой протекает ферментативная реакция (температура, рН, присутствие ингибиторов и активаторов). Зависимость скорости ферментативной реакции от концентрации фермента Для большинства ферментов зависимость скорости реакции от концентрации фермента (при постоянной концентрации субстрата) носит прямолинейный характер (рис. 2).  Рис. 2. Зависимость скорости ферментативной реакции от концентрации фермента Такой характер зависимости скорости от концентрации фермента объясняется тем, что концентрация любого фермента на несколько порядков ниже концентрации субстрата. Поэтому практически при любом Увеличении количества фермента субстрата всегда будет достаточно Для взаимодействия с ферментом. Зависимость скорости ферментативной реакции от концентрации субстрата Пропорциональная зависимость скорости реакции от концентрации субстрата наблюдается лишь при его низких концентрациях, затем постепенно прирост скорости реакции начинает отставать от роста концентрации субстрата, и в конце концов увеличение концентрации субстрата перестает вызывать возрастание скорости реакции. Скорость ферментативных реакций при высоких концентрациях субстрата приближается к определенному пределу, который называется максимальной скоростью - Vmax (рис. 3). 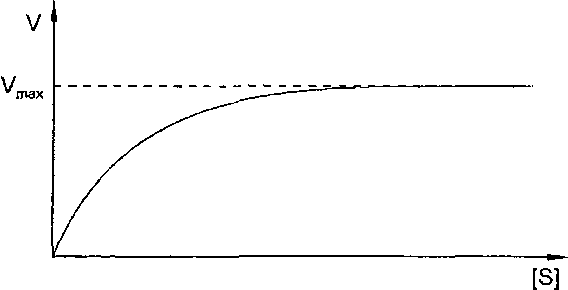 Рис. 3. Зависимость скорости ферментативной реакции от концентрации субстрата Физический смысл этого явления заключается в следующем: при очень низких концентрациях субстрата скорость реакции зависит от скорости поступления молекул субстрата на активный центр фермента. По мере роста концентрации субстрата количество свободных активных центров уменьшается, так как фермент переходит в фермент- субстратный комплекс и лимитирующей стадией катализа теперь будет не присоединение субстрата к активному центру фермента, а дальнейшие превращения фермент-субстратного комплекса. При очень высоких концентрациях субстрата свободного фермента больше не будет, он весь находится в составе фермент-субстратного комплекса. В этом случае скорость ферментативной реакции станет максимальной и будет обусловлена концентрацией фермент-субстратного комплекса, т. е. концентрацией фермента. Зависимость скорости ферментативной реакции от температуры График зависимости скорости ферментативной реакции от температуры имеет колоколообразный характер (рис. 4). Вначале повышение температуры вызывает возрастание скорости ферментативной реакции, затем скорость реакции достигает максимума, и при дальнейшем увеличении температуры скорость реакции снижается вплоть до ее прекращения. Температура, при которой отмечается наибольшая скорость реакции, называется температурным оптимумом реакции - t°opt. 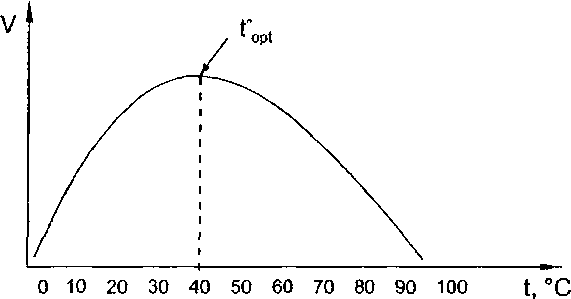 Рис. 4. Зависимость скорости ферментативной реакции от температуры Возрастание ферментативной активности при повышении температуры от низких величин до температурного оптимума (левая ветвь кривой на рис. 4) объясняется увеличением среднего энергетического уровня и числа столкновений реагирующих молекул с ростом температуры. Согласно правилу Вант-Гоффа, повышение температуры на 10 °С вызывает увеличение скорости химической реакции в 2-4 раза. Это правило относится ко всем химическим реакциям, в том числе к ферментативным. Снижение активности ферментов при повышении температуры выше температурного оптимума (правая ветвь кривой на рис. 4) объясняется тепловой денатурацией ферментного белка, которая при высоких температурах (80-100 °С) вызывает полную потерю каталитической активности фермента. Для большинства ферментов температурный оптимум равен 37-40 °С, т. е. соответствует температуре тела. В очень коротких опытах температурный оптимум может быть более высоким, так как за очень малое время Денатурация фермента произойти не успевает. Как видно на рис. 4, при очень низких (ниже 0 °С) и высоких (80- 100 °С) температурах активность ферментов равна нулю. Однако при низких температурах ферменты сохраняют свою нативность и при повышении температуры у них вновь появляется каталитическая активность. В настоящее время ферменты выделяют из растворов путем лиоф ильной сушки, т. е. сушки в замороженном состоянии при очень низком давлении. Полученные таким образом лиофилизированные ферментные препараты хорошо сохраняются в течение длительного времени даже при комнатной температуре. Действие же высоких температур приводит к необратимой потере ферментами способности ускорять химические реакции, так как в этом случае происходит их необратимая денатурация. Поэтому на практике для подавления ферментативной активности (например, ферментов микробов, вызывающих порчу пищевых продуктов) обычно используется термическая обработка. Зависимость скорости ферментативной реакции от рН Скорость ферментативных реакций значительно зависит от кислотности среды, в которой они протекают. Для каждого фермента имеется определенное значение рН, при котором наблюдается наибольшая скорость реакции — рН-оптимум. При отклонении в любую сторону от этого значения рН резко уменьшается ферментативная активность. Важно подчеркнуть, что величина рН-оптимума у разных ферментов колеблется в большом диапазоне значений рН, в то время как температурный оптимум для большинства ферментов составляет 37-40 °С. В качестве примера можно привести значения рН-оптимума следующих ферментов (рис. 5): пепсин желудочного сока - 1,0-2,0 амилаза слюны - 6,8-7,0 щелочная фосфатаза плазмы крови - 9,0-10,0 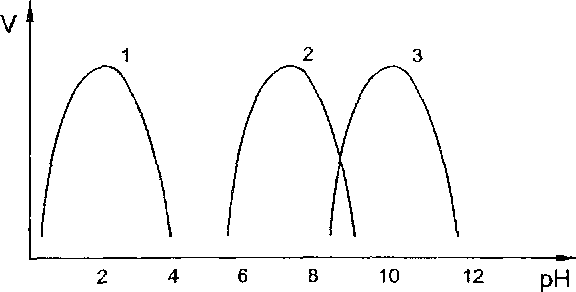 Рис. 5. Зависимость скорости ферментативной реакции от рН (1 - пепсин, 2 - амилаза, 3 - щелочная фосфатаза) Влияние кислотности среды на скорость ферментативных реакций обусловлено тем, что при изменении кислотности меняется конформация всей белковой молекулы фермента, в том числе изменяется конформация активного центра и его способность осуществлять катализ. При рН-оптимуме фермент находится в оптимальной для проявления каталитических свойств конформации. При небольшом отклонении величины кислотности от рН-оптимума наблюдается незначительное изменение конформации, носящее обратимый характер. При значитель- н0м отклонении от рН-оптимума (в сильнокислой и сильнощелочной среде) происходит необратимая денатурация ферментного белка, приводящая к полной утрате каталитической активности. При работе с ферментами в лабораторных условиях в реакционную среду вводят буферные растворы, рН которых соответствует рН-оптимуму изучаемых ферментов. 4. РЕГУЛЯЦИЯ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ При уменьшении выработки ферментов их концентрация в клетках постепенно снижается, что сопровождается падением скорости катализируемых ими реакций. Изменение скорости синтеза ферментов обычно происходит под влиянием гормонов, которые ускоряют или замедляют первый этап синтеза ферментных белков - считывание генетической информации - транскрипцию. Поэтому данный механизм регуляции часто называется регуляцией на генетическом уровне. Модификация ферментов. Под модификацией понимается незначительное изменение химического состава молекулы фермента, приводящее к изменению каталитической активности. Модификация может быть обратимой и необратимой. В первом случае изменение строения фермента носит обратимый характер и фермент может многократно менять свою активность. Например, некоторые ферменты содержат в своей молекуле остаток фосфорной кислоты. При отщеплении фосфатного остатка у одних ферментов каталитическая активность снижается; при включении его снова в состав ферментов активность их возрастает. У других же ферментов фосфорилированная форма (содержащая фосфат), наоборот, малоактивна. Отщепление фосфорной кислоты от таких ферментов ведет к повышению их активности. Примером необратимой модификации служит активация пищеварительных ферментов, действующих на пищевые белки. Так, в составе желудочного сока содержится белок пепсиноген, не обладающий каталитической активностью. В полости желудка под действием соляной кислоты от этого белка отщепляется небольшой полипептид и образуется очень активный фермент, расщепляющий в пищевых белках пептидные связи, - пепсин. (Белки, являющиеся предшественниками ферментов, называются проферментами.) Изменение конформации ферментов. Изменение конформации, т. е. пространственного строения ферментного белка, происходит под действием неконкурентных ингибиторов и активаторов, которыми могут быть гормоны, промежуточные и конечные продукты ферментативных реакций, ионы металлов, лекарства (см. выше). Изменение конформации ферментов возможно и при изменении условий среды, например при повышении или снижении кислотности. 5. НОМЕНКЛАТУРА ФЕРМЕНТОВ Название фермента, как правило, состоит из двух частей. Первая часть является названием субстрата, превращения которого катализируется данным ферментом. Вторая часть названия, имеющая окончание «-аза», указывает природу реакции. Например, фермент, отщепляющий от лактата (молочная кислота) атомы водорода, называется лактатде- гидрогеназа; фермент, катализирующий изомеризацию глюкозо-6- фосфата в фруктозо-6-фосфат, имеет название глюкозофосфатизомера- за, а фермент, участвующий в синтезе гликогена, - гликогенсинтетаза. Заключение Ферментативный катализ играет огромную роль во всех проявлениях жизни, где речь идет о живых существах. Для повышения жизнедеятельности организма и улучшения обмена веществ создано много ферментных препаратов, используемых в качестве лекарственных средств. Широкое распространение получили ферментные препараты при нарушениях функции желудочно-кишечного тракта, связанных с недостаточной выработкой пищеварительных ферментов. Так, при некоторых формах гастрита применяются препараты пепсин или панкреатин. Успешно применяются ферменты и в тех случаях, когда необходимо разрушить накопившиеся в большом количестве белковые образования (при ожогах, гнойных ранах, гнойно-воспалительных заболеваниях легких и т.д.). В этих случаях применяются протолитические ферменты, приводящие к быстрому гидролизу белков и способствующие рассасыванию гнойных скоплений. Для лечения рада инфекционных заболеваний используют препараты лизоцима, которые разрушают оболочку некоторых болезнетворных бактерий. Очень важны ферменты, которые рассасывают тромбы (сгустки крови внутри кровеносных сосудов). Это плазмин, содержащийся в крови; ферменты поджелудочной железы -- трипсин и химотрипсин. На их основе с разными добавками созданы лекарственные ферментые препараты -- стрептокиназа, стрептаза и др. применяемые в медицине. Список литературы 1. Эмануэль Н.М., Кнорре Д.Г. Курс химической кинетики: Учебник для хим. фак. тов. —4-е изд., перераб. и доп. —М.: Высш. шк., 1984 463 с, ил.Стромберг А.Г., Семченко Д.П. 2. Стромберг А.Г., Семченко Д.П. Физическая химия: Учеб. для хим. спец. вузов/Под ред. А.Г.Стром-берга. - 4-е изд., испр. - М.: Высш.шк., 2001. - 527 с: ил. 3. Глесстон С, Лейдлер К.» Эйринг Г. Теория абсолютных скоростей реакций — М.: ИЛ, 1948, 576 с. 4. Михайлов С.С. Спортивная биохимия: Учебник для вузов и колледжей физической культуры. - 2-е изд., доп. - М.: Советский спорт, 2004. - 220 е.: ил. |
