КУРСОВОй. 1 Теоретическая часть 1 Промышленные методы получения формальдегида 6
 Скачать 109.67 Kb. Скачать 109.67 Kb.
|
 Содержание Введение 5 1 Теоретическая часть 1.1 Промышленные методы получения формальдегида 6 1.2 Характеристика исходного сырья, материалов и продуктов 7 1.3 Характеристика готовой продукции 9 1.4 Применение готового продукта в народном хозяйстве 11 1.5 Описание технологического процесса 13 1.6 Химизм и стадии процесса. Закономерности основной стадии 14 1.7 Описание технологической схемы 16 2 Расчетная часть 18 2.1 Материальный баланс 18 2.4 Расчет основных расходных коэффициентов 23 2.5 Технологический расчет основного оборудования 23 2.6Тепловой расчет 24 3 Охрана труда 28 4 Охрана окружающей среды 33 Заключение 35 Список литературы 36 Приложение А 37 Приложение Б 38 Введение Формальдегид является одним из важнейших по значению и масштабам производства органическим продуктом, выпускаемым химической промышленностью. Формальдегид, выпускаемый в нашей стране применяется повсеместно, расходуется не только на внутреннем рынке, но и идет на экспорт в страны ближнего и дальнего зарубежья: Китай, Тайвань, Словакию, Венгрию, Финляндию, Украину, Белоруссию, Эстонию. Бурный рост производства формальдегида обусловлен постоянно возрастающим многообразием сфер его применения. Он является сырьем для получения таких продуктов, как изопрен (около 50% от всего выпускаемого карбинола), синтетический каучук (11%), уротропин, будандиол, метилметакрилат, пентаэритрит, фенолформальдегидные смолы. Его используют в производстве взрывчатых веществ, полимерных материалов, карбамидных и ионообменных смол, красителей и полуфабрикатов. В большом количестве формальдегид потребляют для получения различных химикатов, инсектицидов, консервантов, дубящих веществ. Значение формальдегида, как сырья для производства множества важных органических продуктов, велико. Несмотря на достигнутые успехи, производство его продолжает совершенствоваться. Разрабатываются более активные и селективные катализаторы, методы получения и подготовки исходного технологического сырья, аппаратурное оформление процесса, более полное использование тепла, выделяющегося при синтезе. Все это и многое другое приводит к увеличению производительности в десятки, а то и согни раз. И как следствие, требуется проведение исследований процессов получения формальдегида в промышленных условиях. 1 Теоретическая часть 1.1 Промышленные методы получения формальдегида. Основной производственный метод получения формальдегида во всём мире уже много лет – каталитическое взаимодействие метанола с кислородом воздуха: СН3ОН + 1/2О2 = СН2О + Н2О Этот процесс часто называют окислением метанола, хотя в соответствии с принятыми представлениями об окислении, как о реакции присоединения кислорода, это название следовало бы заменить на окислительное дегидрирование. С учетом того, что на практике при взаимодействии метанола с кислородом протекают также реакции обычного дегидрирования, и некоторые другие, правильнее, по-видимому, говорить об окислительной конверсии метанола в формальдегид. В общем, формальдегид получают из метанола, диметилового эфира, природного и попутных газов (газа коксохимического производства и нефтепереработки). Промышленно освоенные способы получения формальдегида: 1) Каталитическое окисление метанола на металлических катализаторах. 2) Каталитическое окисление метанола на оксидных катализаторах. 3) Окисление природного газа и низших парафинов. Сравнительная характеристика производства формальдегида Сравнительная характеристика производства формальдегида представлена в таблице 1. Таблица1 - Сравнительная характеристика производства формальдегида
Сравнивая экономические и производственные затраты, а также объем продукции для нужд формальдегидо потребляющего производства – выбираем метод производства по окислительному дегидрированию метанола на серебряном катализаторе Характеристика исходного сырья, материалов и полупродуктов Характеристика исходного сырья, материалов и полупродуктов представлена в таблице 2. Таблица 2 – Характеристика исходного сырья, материалов и полупродуктов
Продолжение таблицы 2
Характеристика готовой продукции Физико-химические характеристики готовой продукции представлены в таблице 3. Таблица 3 - Физико-химические характеристики готовой продукции
Физические свойства технического формалина зависят от содержания в нем формальдегида и метанола и меняются в пределах: Плотность, кг/м3 1077 – 1116 Температура кипения, о С 98,9 Удельная теплоёмкость, Дж/(кг К) 3352 Вязкость, сП 2,45 - 2,58 Растворимость в воде 100 г/100 мл Выпускаемый готовый продукт - формалин технический. Предусмотрен выпуск товарного формалина, с массовой долей формальдегида 37 %, соответствующего ГОСТ 1625-89, а также концентрированного формалина, с массовой долей формальдегида до 50 %, используемого для внутреннего потребления в производстве карбосмол. Формалин является водным раствором формальдегида и метанола в воде. Эмпирическая формула формальдегида: СН2 О. Структурная формула формальдегида:О Молярная масса 30 кг/моль. При охлаждении газообразный формальдегид переходит в жидкость, которая кипит при -19°С, а при -118°С замерзает, превращаясь в твердое кристаллическое вещество. Формалин — водный раствор, содержащий 40 % формальдегида, 8 % метилового спирта и 52 % воды. . Формальдегид - горючий и токсичный газ. Предел взрыва ёмкости смесей с воздухом 7-73% (по объему). Формальдегид оказывает раздражающее действие на слизистые оболочки глаз, верхние дыхательные пути, вызывает дерматит. Формальдегид оказывает также общетоксическое, аллергическое и мутагенное действие на организм человека. Смертельная доза 37% водного раствора формальдегида (формалина) составляет 10-50 г. Формальдегид является крайне реакционным химическим соединением, и в чистом молекулярном виде он практически недоступен. Токсичен, ПДК составляет 0,05 мг/м3. 1.4 Применение готового продукта в народном хозяйстве Товарный продукт выпускается обычно в виде 37% -ого водного раствора (формалин), в котором формальдегид содержится в форме гидрата НСНОН2О и низкомолекулярных полимеров — полиоксиметиленгликолей. Для предотвращения глубокой полимеризации формальдегида и выпадения осадка, который может отлагаться в аппаратуре, вформалин добавляется 6—15% объема метанола. Поскольку мономерный формальдегид из-за его высокой реакционной способности трудно хранить и транспортировать, он обычно используется в химически связанной форме и может быть легко выделен непосредственно в момент реакции. Наиболее часто употребляют водный раствор формальдегида - формалин. Кроме этого применяют параформальдегид − низкомолекулярный твердый полимер формальдегида, а также гексаметилентетрамин – уротропин и карбамидоформальдегидный концентрат (КФК). В небольших масштабах производят α-полиоксиметилен − более высокомолекулярный, чем параформальдегид, линейный полимер формальдегида и триоксан. Перспективно применение формалина с концентрацией до 55%, выпуск которого в России начался в 2006 году. Исключительная реакционная способность сделали формальдегид ценным полупродуктом для различного рода синтезов. Формальдегид находит широкое применение в промышленности и сельском хозяйстве для самых разнообразных целей. Формальдегид широко применяется при изготовлении пластмасс (таких, как фенопласты и аминопласты), искусственных волокон, он является одним из компонентов, необходимых для производства бутадиена. Методом конденсации с ацетальдегидом из него получают пентаэритрит (сырьё для производства взрывчатых веществ и пластификаторов), при взаимодействии с аммиаком – уротропин. Формальдегид свёртывает белки, поэтому он применяется для дубления желатина при производстве кинофотоплёнки, для консервации биологических материалов, а также как антисептик. Основная часть формальдегида используется для получения карбамидоформальдегидных смол (КФС), которые применяются для изготовления древесностружечных материалов. КФК имеет всего два направления использования – производство КФС и обработка карбамида против слеживаемости. В области производства карбамидоформальдегидных смол КФК более перспективен в плане транспортировки, времени производственного цикла, экологии, чем формалин. Однако активное внедрение КФК не означает, что от формалина в скором времени в производстве КФС полностью откажутся, однако, в ближайшее время произойдут дальнейшие структурные изменения, в процессе которых объем использования формалина сократится. Формалин с концентрацией 37% будет замещаться, с одной стороны, КФК в производстве карбамидоформальдегидных смол, с другой – формалином более высокой концентрации в большинстве остальных направлений использования. Формальдегид широко используется в различных областях органического синтеза, а также в качестве дезинфицирующего и дезинсекционного средства. Широкое применение находит: - в бумажной промышленности для улучшения прочности и качества бумаги; - в кожевенной — для дубления кожи; - в текстильной — для повышения сопротивляемости изделий к сминанию и усадке; - в сельском хозяйстве — для обработки семян и корнеплодов, дезинфекции почвы и животноводческих помещений; - в медицине — в качестве дезинфицирующего средства. Описание технологического процесса Метод производства формалина из метанола состоит в получении формальдегида на катализаторе "серебро на носителе" при температуре (550-700) °С с последующей абсорбцией его водой и ректификацией. Окислительное дегидрирование метанола представляет гетерогенно-каталитический процесс, протекающий в газовой фазе на твердом катализаторе Получение формальдегида путем совмещенного дегидрирования и окисления паров метанола на твердом катализаторе представляет химический процесс со сложной последовательно-параллельной реакцией. Кроме основной реакции протекают побочные реакции более глубокого окисления, дегидрирования и гидрирования, ведущие к образованию оксидов углерода, муравьиной кислоты, воды и метана. Окислительное дегидрирование проводят при недостатке кислорода, поэтому глубокое окисление не получает значительного развития. В то же время само дегидрирование, инициируемое кислородом, протекает быстрее, и все ранее упомянутые побочные реакции не так заметны. Это позволяет проводить реакцию при более высокой температуре (500 - 600°С), большой скорости и времени контакта 0,01 - 0,03 с. Выход формальдегида достигает 80-85% при степени конверсии метанола 85-90%. Катализаторами синтеза формальдегида этим методом служит металлическая медь или серебро, осажденное на Al2O3. Последний катализатор оказался более эффективным и широко применяется в промышленности. Процесс получения формалина для одной технологической нитки состоит из следующих стадий: - получение метаноло – воздушной смеси, - синтез формальдегида -абсорбция формальдегида с получением "формалина-сырца", - ректификация "формалина-сырца". Общими для всех ниток узлами являются: -сбор и переработка некондиционных и дренируемых продуктов, -очистка газовых выбросов, -сжигание абгазов на факельной установке -теплоснабжение, сбор и перекачка конденсата Вспомогательными узлами являются: - приготовление катализатора, - складирование и отгрузка формалина, - термическое обезвреживание отходов. 1.6 Химизм и стадии процесса. Закономерности основной стадии. Образование формальдегида происходит при прохождении метаноло -воздушной смеси через слой катализатора "серебро на носителе" при температуре в зоне контактирования:(550-600) °С при работе в "мягком" режиме, (660-700) °С при работе в "жестком" режиме. Образование формальдегида осуществляется в результате протекания параллельных реакций простого и окислительного дегидрирования метанола: СН3 ОН → СН2 О + Н2 - 93,4 кДж/моль (1) СН3 ОН + 1/2 О2 → СН2 О + Н2 О + 147,4 кДж/моль (2) Наряду с этими реакциями в системе протекает целый комплекс побочных превращений. СН3 ОН + 2/3 О2 → СО2 + 575,1 кДж/моль (3) СН2 О + 1/2 О2 → НСООН + 270,4 кДж/моль (4) НСООН + 1/2 О2 → СО2 + Н2 О + 14,5 кДж/моль (5) НСООН → СО + Н2О - 53,7 кДж/моль (6) СН2 О → СО + Н2 + 1,9 кДж/моль (7) 2 СН2 О + Н2 О → СН3 ОН + НСООН + 122,0 кДж/моль (8) Н2+ 1/2 О2 → Н2 О + 241,8 кДж/моль (9) 2 СН3 ОН → СН2 (ОСН3 )2 + Н2 О + 131,0 кДж/моль (10) СО + 1/2 О2 → СО2 + 283,0 кДж/моль (11) 2 СО → СО2 + С + 172,5 кДж/моль (12) Реакции (3) и (4) являются равновесными. Доля метанола израсходованного по реакции (4) составляет около 60 %, а остальное, по реакции (3). Превращение метанола в формальдегид происходит в результате контакта молекул спирта с кислородом, хемосорбированным на атомах серебра, т.е. активными центрами катализатора являются поверхностные окислы серебра. Процесс получения формальдегида в целом сопровождается выделением тепла, за счет которого поддерживается необходимая температура в зоне контактирования и равновесие реакции дегидрирования смещается вправо. Побочные реакции снижают выход формальдегида и определяют состав выхлопных газов (абгазов). Для подавления которых в метанол вводится до 10% воды. Во избежание глубокого окисления метанола процесс окислительного дегидрирования проводится при недостатке кислорода. В то же время реакция дегидрирования (е) инициируется кислородом, что позволяет уменьшить удельный вес побочных реакций. Процесс окислительного дегидрирования проводится при температуре 500—600°С и времени контактирования около 0,02 с. В этих условиях выход формальдегида в расчете на пропущенное сырье составляет 80—85% при степени контактирования 0,85—0,90. 1.7 Описание технологической схемы Технологическая схема производства формальдегида окислительным дегидрированием метанола изображен6а на рис. 1. Метанол, содержащий 10 - 12 % воды, из напорного бака 1 непрерывно поступает в испаритель 2. Туда же через распределительное устройство подают воздух, очищенный от пыли и других загрязнений. Воздух барботирует через слой водного метанола в нижней части испарителя и насыщает его парами. В 1 л образующейся паровоздушной смеси должно содержаться приблизительно 0,5 г метанола. Поддержание такого состава смеси очень важно для обеспечения взрывобезопасности и нормального протекания процесса. Поэтому работа испарительной системы полностью автоматизирована: поддерживают постоянные уровень жидкости в испарителе, ее температуру (48 - 50°С) и скорость подачи воздуха, благодаря чему обеспечиваются необходимые температурный режим и степень конверсии в адиабатическом реакторе. Паровоздушная смесь проходит брызгоуловитель, находящийся в верхней части испарителя, затем перегреватель 3 и поступает в реактор 4, в средней части которого находится катализатор. Реакционные газы сразу же попадают в подконтактный холодильник 5 (смонтирован вместе с реактором), где происходит быстрое охлаждение смеси и предотвращает распад формальдегида. В разных системах охлаждение осуществляют проточной водой или паровым конденсатом, когда холодильник играет роль генератора пара низкого, среднего или даже высокого давления. Полученный пар (или горячая вода) служит для перегрева поступающей смеси в перегреватель 3 и для обогрева испарителя 2. Охлажденные реакционные газы поступают в абсорбер 6, выполненный в виде тарельчатой колонны, жидкость на тарелках охлаждают внутренними или выносными холодильниками. Абсорбер орошают таким количеством воды, чтобы в кубе получился 36 - 37% формалин. Стадии абсорбции и разделения продуктов оформляют двумя разными способами. По одному из них в абсорбере поглощают как формальдегид, так и непревращенный метанол, который содержится в продуктах реакции в количестве, достаточном для стабилизации формальдегида. В этом случае верхнюю тарелку абсорбера охлаждают рассолом, а колонна 7 служит лишь для санитарной очистки газа, в то время как для получения безметанольного формалина необходима установка для отгонки метанола. При втором способе в абсорбере поглощают преимущественно формальдегид, тогда скруббер 7 служит для абсорбции метанола, который отгоняют от воды и возвращают на реакцию. В обоих случаях формалин из куба абсорбера 6 охлаждают в холодильнике 8 и собирают в сборнике 9 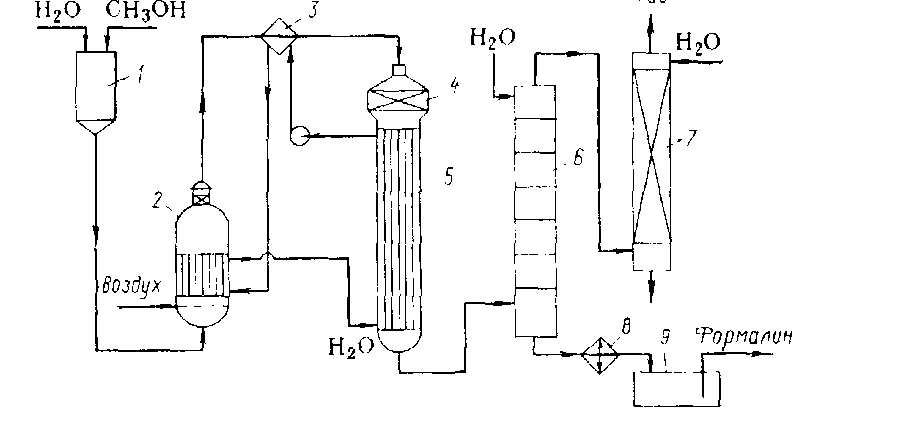 Рисунок 1 - Технологическая схема производства формалина: 1) напорный бак; 2) испаритель; 3) перегреватель; 4) реактор; 5,8) холодильник; 6) абсорбер; 7) скруббер; 9) сборник. Расчетная часть Материальный баланс Часовая производительность агрегата: по формалину: 74000*1000/8400 = 8809 кг/ч; по формальдегиду: 8809*37/100 = 3259 кг/ч или 3259/30 = 108,633 кмоль/ч. С учетом потерь на стадии рекификации необходимо получить в контактном аппарате формальдегида: 108,633*1,03 = 111,891кмоль/ч или 3357 кг/ч. Протекающие реакции: CH3OH ⇄ CH2O + H2, CH3OH + 0,5O2 ⇄ CH2O + H2O, CH3OH + 1,5O2 ⇄ CO2 + 2H2O, CH3OH ⇄ CO + 2H2. Расхд метанола по реакциям 1 и 2: 111,891 кмоль/ч или 3581 кг/ч. Расход метанола по реакции 1-4: 111,891/(0,27+0,60) = 128,610 кмоль/ч или 416 кг/ч, где 0,27 и 0,60 – доля метанола, превращенного в формальдегид по реакциям 1 и 2. Подают метанола с учетом степени конверсии: 128,610/0,55 = 233,836 кмоль/ч или7483 кг/ч. Количество воды в техническом метаноле: 7483*0,1/99,9 = 7 кг/ч или 0,388 кмоль/ч. Остается метанола в контактном газе: 233,836-128,610 = 105,226 кмоль/ч или 3367 кг/ч. По реакции 1 расходуется метанола: 128,610*0,27 = 34,724 кмоль/ч или 1111 кг/ч; образуется: формальдегида: 34,724 кмоль/ч или 104 кг/ч; водорода: 34,724 кмоль/ч или 69 кг/ч. По реакции 2 расходуется: метанола: 128,610*0,60 = 77,166 кмоль/ч или 2469 кг/ч; кислорода: 77,166*0,5 = 38,583 кмоль/ч или 1235 кг/ч. По реакции 3 расходуется: метанола: 128,610*0,11 = 14,147 кмоль/ч или 453 кг/ч; кислорода: 14,147*1,5 = 21,220 кмоль/ч или 679 кг/ч; образуется: диоксида углерода: 14,147 кмоль/ч или 622 кг/ч; водяного пара: 14,147*2 = 8,294 кмоль/ч или 509 кг/ч. По реакции 4 расходуется: метанола: 128,610*0,02 = 2,572 кмоль/ч или 82 кг/ч; образуется: оксида углерода: 2,572 кмоль/ч или 72 кг/ч; водорода: 2,572*2 = 5,144 кмоль/ч или 10 кг/ч. Всего образуется: водорода: 34,724+5,144 = 39,868 кмоль/ч или 80 кг/ч; водяного пара: 77,166+28,294 = 105,460 кмоль/ч или 1898 кг/ч. Общий расход кислорода: 38,583+21,220 = 59,803 кмоль/ч или 1914 кг/ч. Молярное отношение O2 : CH3OH равно: 59,803/233,836 = 0,255. Расход сухого воздуха: 59,803/0,21 = 284,776 кмоль/ч, где 0,21 – объемная (молярная) доля кислорода в сухом воздухе. Количество азота а аоздухе: 284,776-59,803 = 224,973 кмоль/ч или 6299 кг/ч. Объемная доля водяных паров в воздухе: 3230*100/(0,17*106) = 1,90%, где 3230 – парциальное давление водяных паров в воздухе при температуре 250С; 0,17*106 – общее давление воздуха, Па. Количество водяных паров в воздухе: 284,776*1,90/(100-1,90) = 5,515 кмоль/ч или 99 кг/ч. Суммарное количество водяных паров: в спиртовоздушной смеси: 0,388+5,515 = 2,139 кмоль/ч или 38 кг/ч; в контактном газе: 2,139+105,460 = 107,599 кмоль/ч или 1937 кг/ч. Составляем материальный баланс стадии контактировани в соответствии таблицей 4. Таблица 4 - Материальный баланс стадии контактирования.
Объемная (молярная) доля метанола в спиртовоздушной смеси (44,6%) соответствует оптимальному технологическому режиму. В выхлопные газы абсорбционной колонны переходят полностью оксид и диоксид углерода, азот, водород, суммарное количество которых составляет 232,150 кмоль/ч. Объемная доля водяных паров в выхлопных газах: 1740*100/(0,13*106) = 1,34%, где 1740 – парциальное давление водяных паров при температуре 150С, Па; 0,13*106 – общее давление выхлопных газов, Па. Количество водяных паров в выхлопных газах: 232,150*1,34/(100,00-1,34) = 3,153 кмоль/ч или 57 кг/ч. Количество формалина-сырца: 3357/0,29 = 11576 кг/ч, где 0,29 – массовая доля формальдегида в формалине-сырце. Количество воды в формалине-сырце: 11576-3357-3367 = 4852 кг/ч или 269,555 кмоль/ч. Следовательно, на орошение абсорбционной колонны необходимо подать воды: 4852+69-1937 = 2984 кг/ч. Состав формалина-сырца и выхлопных газах на выходе из абсорбционной колонны в соответствии таблицей 5. Таблица 5 - Состав формалина-сырца и выхлопных газах на выходе из абсорбционной колонны.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
