Экзаменационные билеты по химии. 36. Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Способы выражения концентраций растворов
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
36. Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Способы выражения концентраций растворов. Раствором – гомогенная (однофазовая) система, состоящая из 2-х или более независимых компонентов (растворитель и растворённое(ые) вещество(а)), а также продуктов их взаимодействия. Растворитель – компонент, количество которого в системе преобладает, либо не меняет своего агрегатного состояния. В зависимости от цели для описания концентрации растворов используются разные физические величины. Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить ещё некоторое его количество. Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе. Пересыщенный раствор (изредка используется термин перенасыщенный) — раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе. Пересыщенные растворы неустойчивы, избыток вещества легко выпадает в осадок. Такой раствор нельзя получить путём растворения в нормальных условиях, обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре (пересыщение). Концентрированный раствор — раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества. Деление растворов на концентрированные и разбавленные не связано с делением на насыщенные и ненасыщенные. Так насыщенный 0,0000134М раствор хлорида серебра является очень разбавленным, а 4М раствор бромида калия, будучи очень концентрированным, не является насыщенным. Разбавленный раствор — раствор с низким содержанием растворённого вещества. Отметим, что не всегда разбавленный раствор является ненасыщенным — например, насыщенный 0,0000134М раствор практически нерастворимого хлорида серебра является очень разбавленным. Граница между разбавленным и концентрированным растворами весьма условна.  Концентрация – это количественный состав растворенного вещества (в конкретных единицах) в единице объема или массы. Обозначили растворенное вещество - Х, а растворитель - S. Чаще всего использую понятие молярности (молярная концентрация) и мольной доли. Способы выражения концентрации растворов. 1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:  , ,где: ω – массовая доля растворенного вещества; mв-ва – масса растворённого вещества; mр-ра – масса растворителя. Массовую долю выражают в долях от единицы или в процентах. 2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V: где: C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl); n – количество растворенного вещества, моль; V – объём раствора, л. Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества. 3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m: где: С(x) – моляльность, моль/кг; n – количество растворенного вещества, моль; mр-ля – масса растворителя, кг. 4. Титр – содержание вещества в граммах в 1 мл раствора: где: T – титр растворённого вещества, г/мл; mв-ва – масса растворенного вещества, г; Vр-ра – объём раствора, мл. 5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе: где: N – мольная доля растворённого вещества; n – количество растворённого вещества, моль; nр-ля – количество вещества растворителя, моль.  ω(X) - массовая доля растворенного вещества, в %; М(Х) – молярная масса растворенного вещества; ρ= m/(1000V) – плотность раствора.6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора. Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту. Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях. Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н. где: СН – нормальная концентрация, моль-экв/л; z – число эквивалентности; Vр-ра – объём раствора, л. 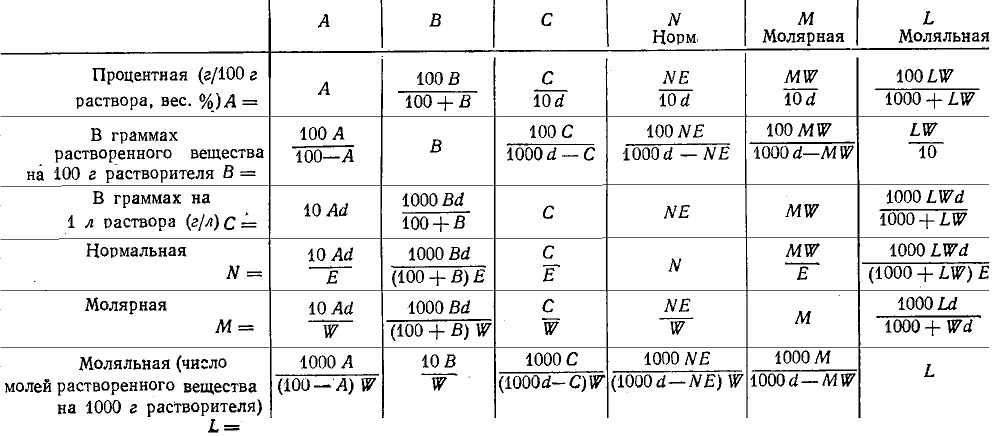  37. Растворимость. Произведение растворимости. Изменение энтальпии и энтропии при растворении. Растворимость – количественная характеристика соотношения компонентов насыщенного раствора. Растворимость веществ зависит: от природы реагирующих веществ; от концентрации раствора; от температуры; присутствия других веществ в растворе; от давления (для газообразных веществ). Растворимость веществ бывает: неограниченная (Примеры: вода и спирт; калия хлорид и калия бромид; калий и рубидий) – эти вещества смешиваются в любых соотношениях. ограниченная (Пример: вода и соль поваренная) – определенное количество растворенного вещества По степени растворимости все вещества делятся: Хорошо растворимые (растворимость при 200С более 1 г) Хорошо растворимым считается вещество, если более 10 г его хорошо растворяется в 100 г воды. Малорастворимые (растворимость при 200С от 0,01до 1,0 г) Малорастворимым называют вещество, если в 100 г воды его растворяется менее 1 г. Нерастворимые (растворимость при 200С не более 0,01 г) И нерастворимые – это такие вещества, менее 0,01 г которых переходит в раствор. В насыщенных водных растворах малорастворимых соединений устанавливается равновесие:  которое описывается константой равновесия, называемой произведением растворимости (ПР). Величина ПР равна:  Понятие ПР используется только при описании гетерогенных равновесий в насыщенных растворах малорастворимых сильных электролитов и их твердых фаз. Растворимость вещества равна его концентрации в насыщенном растворе. Насыщенный раствор находится в равновесии с кристаллической фазой. ПР связано с изменением энергии Гиббса процесса уравнением:  ΔGоT = – RT lnПР, ΔGоT = – RT lnПР, которое используется для расчетов ПР по термодинамическим данным. Чем меньше величина ПР, тем в меньшей степени осуществляется переход вещества в раствор. Осаждать металл лучше из менее растворимого вещества. Растворимость симметричных электролитов (содержащих равнозарядные ионы, например, AgCl, BaSO4, AlPO4) рассчитывается как корень квадратный из ПР. В общем же случае для электролита КnАm растворимость Р находится по формуле:  Изотерма Вант-Гоффа для процесса растворения имеет вид  В состоянии равновесия (ΔG = 0)  Тогда для изотермы имеем  ПК – произведение концентраций ионов в степенях, соответствующих стехиометрическим коэффициентам для системы в неравновесном состоянии. Зная ПК и сравнив его с ПР, можно установить, растворится или выпадет осадок при данной температуре: Если ПК = ПР, ΔG = 0 – система находится в состоянии равновесия (раствор насыщенный). Если ПК <ПР, ΔG < 0 – самопроизвольно протекает процесс растворения осадка. Если ПК >ПР, ΔG > 0 – возможен только обратный процесс – выпадение осадка. Изменение энтальпии и энтропии при растворении. Движущей силой образования растворов является уменьшение энергии Гиббса системы: ΔG = ΔH – T ·ΔS < 0, (1) то есть при растворении изменяются энтропийный и энтальпийный факторы (здесь и далее предполагается, что растворение протекает в изобарно-изотермических условиях). Растворение рассматривается как совокупность физических и химических процессов, включающих три основные стадии: 1). Разрушение вещества до уровня молекул или ионов. Этот процесс является эндотермическим (ΔH1 > 0), так как требует затраты энергии на разрыв всех видов химического взаимодействия между частицами в растворяемом веществе; 2). Взаимодействие молекул растворителя с частицами растворенного вещества с образованием новых соединений, называемых сольватами (или гидратами, если растворителем является вода); этот процесс называется сольватацией (гидратацией). Поскольку протекает взаимодействие, то энергия системы понижается, то есть сольватация (гидратация) является экзотермическим процессом и протекает с выделением энергии (ΔH2 < 0). Предположение о существовании в водных растворах гидратов высказано и обосновано Д. И. Менделеевым, который считал, что растворение не только физический, но и химический процесс, что вещества, растворяющиеся в воде, образуют с ней соединения. Об этом свидетельствует изучение тепловых эффектов при растворении. Подтверждением протекания химических процессов при растворении является также то, что многие вещества, выделяются из водных растворов в виде кристаллов, содержащих кристаллизационную воду, так называемых кристаллогидратов: CuSO4.5H2O (медный купорос), Na2SO4.10H2O (сода) и др; 3). Самопроизвольное перемешивание раствора и равномерное распределение сольватов (гидратов) в растворителе. связанное с диффузией и требующее затраты энергии (ΔH3 > 0). Суммарный тепловой эффект процесса растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение: ΔH = ΔH1 + ΔH2 + ΔH3 и может быть положительным (эндотермическое растворение) и отрицательным (экзотермическое растворение). Если в воде растворяются газы или жидкости, то энергия ΔH1, затрачиваемая на разрыв межмолекулярных связей, невелика и процесс растворения часто сопровождается выделением теплоты (ΔH < 0). Если растворяется кристаллическое вещество, разрушение кристаллической решетки требует значительной затраты энергии. Поэтому растворение твердых веществ в воде часто происходит с поглощением теплоты (ΔH > 0) и является эндотермическим процессом. При растворении газов в жидкости энтропия всегда уменьшается (ΔS < 0), а растворение кристаллического вещества сопровождается возрастанием энтропии (ΔS > 0), вследствие разупорядочивания системы. Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. При этом независимо от знака энтальпии при растворении всегда ΔG < 0. Для жидких растворов процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и растворяемым веществом. Растворение газов в воде идет с выделением теплоты (ΔH < 0) и убылью энтропии (ΔS < 0). Согласно уравнению (1) самопроизвольному растворению газов в воде способствуют низкие температуры. Чем выше температура, тем более вероятно, что величина T·ΔS достигнет значения ΔH, а равенство ΔH= T·ΔS отвечает равновесию процесса растворения (ΔG = 0). Растворение кристаллических веществ часто идет с поглощением теплоты (ΔH > 0) и обычно сопровождается ростом энтропии (ΔS > 0). Согласно уравнению (1) самопроизвольному растворению кристаллических веществ в воде способствуют высокие температуры. При низких температурах возможно, что величина T·ΔS достигнет значения ΔH, а равенство ΔH= T·ΔS отвечает равновесию процесса растворения (ΔG = 0). 38.Физические и химические процессы при растворении. Растворимость твёрдых тел и жидкостей в жидкостях. Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты — в зависимости от природы вещества.    Физические и химические процессы при растворении: Физико-химическая теория растворов. Физическая теория растворов – идея индифферентности и подобия газовым системам (Я.Вант-Гофф): Процесс растворения является результатом диффузии, т.е. проникновением растворенного вещества в промежутки между молекулами растворителя, т.е. физическое явление. Раствор – механическая смесь: • переменность состава • непрерывная, плавная зависимость свойств от состава. Химическая теория (Д.И.Менделеев): Растворение является результатом химического взаимодействия растворенного веществас молекулами растворителя, т.е. химическое явление. Раствор – химическое соединение: • однородность состава по всей фазе • наличие теплового эффекта при образовании. Растворимость вещества, в случае если оно газообразно, является функцией не только температуры но и давления газа над раствором. Чаще всего растворимость твердых веществ при повышении температуры увеличивается, а в жидких и газообразных - уменьшается. Растворимость твердых веществ в жидкостях: Влияют: • природа реагирующих веществ • температура Для идеальных растворов справедливо уравнение Шредера– Ле Шателье: 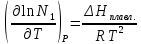 Процесс растворения: Процесс растворения: 1. Плавление твердого вещества. 2. Смешение жидкого вещества с идеальным раствором Растворимость жидкостей в жидкостях: Влияют: • природа реагирующих веществ •температура • давление Неограниченная растворимость – жидкости смешиваются в любых пропорциях. Растворимость до известного предела – имеет место расслаивание. Качественная зависимость: подобное растворяется в подобном. 39.Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.   Закон Генри: При постоянной температуре растворимость газа прямо пропорциональна его парциальному давлению над раствором. (Закон Генри справедлив лишь для случая, когда паровая фаза подчиняется законам идеальных газов, в частности закону Дальтона) 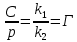 ; ; 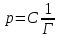 ; ;k – константы скорости p – давление газа над раствором с – молярная концентрация Г – константа Генри Закон Дальтона: Растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси. Pi = Pобщ χ(Xi) Pi – парциальное давление компонента Xi Pобщ – общее давление газовой смеси χ(Xi) – молярная доля i-того компонента Закон распределения Если какое-либо вещество растворимо в двух несмешивающихся жидкостях, то при его растворении в смеси двух таких жидкостей оно само распределяется между ними. Отношение, в котором происходит это распределение, определяется законом распределения. Он утверждает, что растворимое вещество распределяется между двумя несмешивающимися жидкостями в постоянном отношении концентраций, не зависящем от количества добавляемого растворимого вещества. • Не зависит от количества растворенного вещества в обеих жидкостях. • Зависит от природы растворителей, природы растворенного вещества, температуры. 40.Законы Рауля Первый закон Рауля Связывает давление насыщенного пара над раствором с его составом. Парциальное давление насыщенного пара компонентараствора прямопропорционально его мольной доле врастворе, причём коэффициентпропорциональностиравен давлению насыщенного пара над чистымкомпонентом.  Для бинарного раствора, состоящегоиз компонентов А и В, где компонент А – растворитель,удобнее использовать другую формулировку: 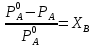 О 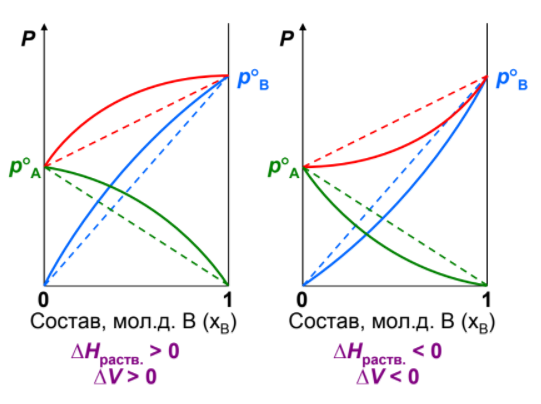 тносительное понижение парциальногодавления пара растворителя надрастворомне зависит от природы растворённого вещества и равно его мольной доле в растворе. тносительное понижение парциальногодавления пара растворителя надрастворомне зависит от природы растворённого вещества и равно его мольной доле в растворе.Причиной отклонений от закона Рауля является то обстоятельство, что однородные частицы взаимодействуют друг с другом иначе, чем разнородные (сильнее в случае положительных и слабее в случае отрицательных отклонений) Второй закон Рауля Понижение температуры замерзания раствораи повышениетемпературы его кипенияпрямо пропорциональномоляльной концентрации раствора.  ; ;  Кэ и Ккр – эбулиоскопическая и криоскопическая константы, характеризующие растворитель. Эбулиоскопия — метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым растворителем. Криоскопия — метод исследования растворов, в основе которого лежит измерение понижения точки замерзания раствора  T не зависит от природы растворенного вещества,а определяется природой растворителя и моляльностью,т.е. числом молекул, растворенных в определенном количестве растворителя. T не зависит от природы растворенного вещества,а определяется природой растворителя и моляльностью,т.е. числом молекул, растворенных в определенном количестве растворителя.Повышение температуры кипения и понижение температуры замерзания зависят только от числа частиц растворенного вещества, но не от их природы. Коллигативные свойства («зависят от количества»).   |
