ДНК-вакцины. ДНК-вакцины.Современное_состояние_и_перспективы. днквакцины. Современное состояние и перспективы
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
Министерство здравоохранения и социального развития Российской Федерации Федеральное государственное бюджетное образовательное учреждение Высшего профессионального образования Первый Московский Государственный Медицинский Университет имени И.М. Сеченова Кафедра: «Микробиология, вирусология, иммунология» Доклад на тему: «ДНК-вакцины. Современное состояние и перспективы» Выполнила студентка 3 курса Медико-профилактического факультета Группы 03 Кузьмичёва Яна Владиславовна Москва, 2016 г Содержание работы Введение Чем же ДНК-вакцины хороши? (Положительные моменты) Но ДНК-вакцины имеют также свои недостатки. (Отрицательные моменты) Строение и получение ДНК-вакцин Способы введения ДНК-вакцин Помощники генетических вакцин Генотерапия наследственных заболеваний Современное состояние ДНК-вакцинологии Перспективы Вывод ДНК-вакцины. Современное состояние и перспективы. ДНК-вакцины относятся к типу принципиально новых биологических препаратов. С их разработкой связывают большие надежды на повышение эффективности профилактики не только заболеваний бактериальной, вирусной и паразитарной природы, но и аллергических, аутоиммунных и даже онкологических болезней. Более двадцати лет назад возникла идея использовать гены возбудителей заболеваний для активации защитных механизмов. Более сотни лет прошло с введения Л. Пастером термина «вакцина» и более двух сотен - с легендарных экспериментов Э. Дженнера по прививанию коровьей оспы ребенку с целью предупреждения развития опасного человеческого варианта болезни. Принцип защитного действия введенных в организм ослабленных инфекционных агентов или их частей объяснили уже в XX веке: безопасный чужеродныйантигенучит иммунную систему в дальнейшем быстро распознавать и уничтожать активного и опасного возбудителя с точно такими же антигенами. Процесс часто сравнивают с раздачей фоторобота преступника сотрудникам полиции. Уже научились создавать вакцины из убитых возбудителей, недавно начали использовать рекомбинантные вакцины, содержащие один или несколько антигенов (обычно белковых), синтезированных генно-инженерным путем. И вот появляется - вакцина из нуклеиновых кислот. Начало ДНК-вакцинологии связывают с работами, в которых была показана способность плазмидной ДНК, экспрессирующей гормон роста человека, индуцировать выработку антител. В классическом варианте такие вакцины состоят из плазмидных ДНК, содержащих гены возбудителей инфекционных заболеваний (целевые гены или иммуногены). Продукты данных генов способны вызывать развитие защитных реакций организма, выступая в этом случае в роли антигенов. Доставку ДНК в макроорганизм первоначально осуществляли в комплексе с катионными липидами, однако эффект от введения препарата чистой нуклеиновой кислоты оказался более выраженным. Введенная в организм ДНК проникает в клеточное ядро, превращая клетку в «завод» по производству вакцины. Такая ДНК длительное время существует вне хромосом без репликации, транскрибируется за счет ферментов хозяйской клетки и экспрессирует соответствующие гены, продукты которых вызывают формирование иммунитета. (рис.1) 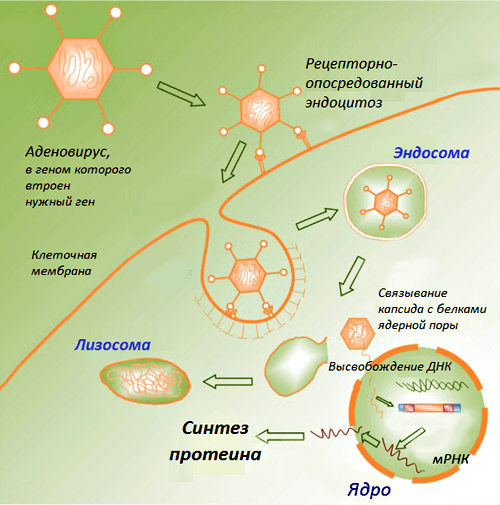 ДНК-вакцины сохраняются в организме 3-4 недели. За это время они успевают индуцировать Т- и В-клеточный иммунитет (рис. 2).  Прогресс в различии кодирующих антигены нуклеотидных последовательностей, в оптимизации состава (в том числе включение молекулярных адъювантов), в совершенствовании форм и физических методов доставки позволил второму поколению ДНК-вакцин преодолеть такие проблемы первого поколения, как низкий уровень трансфекции (процесс искусственного переноса генетической информации в эукариотические клетки с помощью чужеродной очищенной ДНК с использованием разнообразных приемов) и недостаточная иммуногенность. Сейчас разработки в области генетических вакцин проводятся во многих странах мира. В настоящее время сконструированы экспериментальные ДНК-вакцины для профилактики инфекционных заболеваний: - паразитарной (шистосомоз,лейшманиоз), - бактериальной (хламидиоз, сибирская язва, микоплазмозы) - вирусной (бешенство, лихорадки Западного Нила и Эбола) природы. Чем же ДНК-вакцины хороши? (Положительные моменты)индуцируют гуморальный (образование антител) и клеточный (активация цитотоксических Т-лимфоцитов) иммунные ответы; активируют систему интерферонов; могут избирательно воздействовать на различные субпопуляции лимфоцитов. Принципиально возможна разработка ДНК-вакцин, которые избирательно активируют разные типы Т-хелперных лимфоцитов. Благодаря этому могут быть созданы генные вакцины для лечения лиц с аутоиммунными или аллергическими заболеваниями, патогенез которых связан с нарушением различных звеньев иммунной регуляции; способствуют формированию длительного иммунитета; отсутствует присущий живым вакцинам риск реверсии вирулентности; могут производить одновременно несколько антигенов; обладают широкими возможностями модификации (сайт-специфический мутагенез, включение различных регуляторных последовательностей); отличаются высокой стабильностью. Они способны выдерживать низкие и высокие температуры (немногим ниже температуры кипения воды) и разные условия влажности. Поэтому ДНК-вакцины не требуют организации «холодовых цепочек» (комплекса мероприятий, обеспечивающих хранение вакцин в холодильных установках на всем пути от места производства до конечного потребителя). Таким образом, стоимость транспортировки и хранения ДНК-вакцин значительно ниже. Но ДНК-вакцины имеют также свои недостатки. (Отрицательные моменты)более низкая по сравнению с живыми вакцинами эффективность и потому необходимость многократной иммунизации; отсутствие эффективной доставки в антигенпрезентирующие клетки; формирование иммунитета только в отношении протеиновых компонентов болезнетворных микроорганизмов, поскольку целевые гены кодируют белки. ДНК-вакцины не могут заменить препараты, действие которых основано на использовании антигенных молекул другой природы, например капсульных антигенов, представленных полисахаридами (полисахаридные пневмококковые, менингококковые, брюшнотифозные вакцины и др.); вероятность биохимических изменений (например, гликозилирования) антигенов в эукариотических клетках; возможность ослабления иммунного ответа на целевой антиген из-за иммуногенности вирусных компонентов; отсутствие данных о безопасности таких вакцин, т.к. не изучены последствия, к которым приводит длительная экспрессия в макроорганизме чужеродной генетической информации; возможность развития нежелательных иммунологических реакций в виде хронических воспалительных процессов или генерализованной иммуносупрессии из-за пролонгированной экспрессии антигена в макроорганизме. Строение и получение ДНК-вакцинСоздание ДНК-вакцин стало возможным благодаря разработке вирусных векторных систем. Новое направление в иммунопрофилактике называют «генетической иммунизацией» или «иммунизацией нуклеиновыми кислотами. Новый принцип иммунизации состоит в том, что в организм вводят не вирусный антиген, а ДНК, кодирующую синтез этого антигена (белка). Оказалось, что вирусная ДНК сама по себе может быть использована как вакцина. Конструкция ДНК-вакцин проста: главные компоненты в ней - вектор и целевой иммуноген. ДНК-вакцины обычно содержит плазмиду E.coli с сильным промотором и репортерный ген. Плазмида амплифицируется обычно в E.coli, очищается, в буферном растворе превращается в суспензию, а затем просто вводится в организм. Рекомбинантные плазмиды представляют собой конструкции, содержащие гены, способные экспрессировать нужные вирусные антигены. Клетки организма в месте инъекции трансформируются плазмидой, ДНК транспортируется к ядру, где транслируется интересующий (репортерный) белок. Из числа вирусных векторов, обеспечивающих более высокий уровень экспрессии целевого антигена, чаще всего используются: дефектный по репликации аденовирус, ортопоксвирусы и модифицированные вирусы осповакцины, альфавирусы. Аденовирусный вектор обладает высокой эффективностью трансфекции - до 100 %, в него можно включать до 8 т.п.н. ДНК. Отрицательный момент - синтез собственных белков, способных индуцировать иммунный ответ. Элементы конструктора: 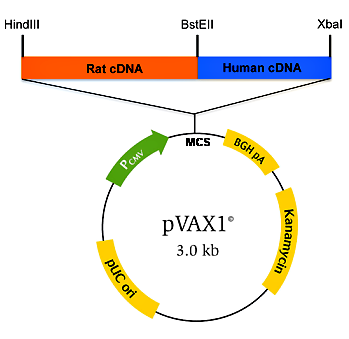 Конструкция ДНК-вакцины на основе вектора pVAX1 с химерным геном (Rat cDNA, Human cDNA). Pcmv — цитомегаловирусный промотор; MCS — сайт для множественного клонирования генов;BGH pA — терминатор с сигналом полиаденилирования гена гормона роста быка; Kanamycin — ген устойчивости к канамицину; pUC ori — участок начала репликации плазмид группы pUC; HindIII, BstEII, XbaI — сайты рестрикции. Чтобы пригодиться для создания ДНК-вакцин, каждый вектор должен содержать необходимые конструкционные элементы. Структуры, обеспечивающие репликацию плазмиды и сайты рестрикции. Селективные маркеры: гены устойчивости к антибиотикам (но не к пенициллину и другим β-лактамным антибиотикам). СpG-мотивы бактерий, которые способны усиливать иммунную реакцию. Данный принцип лежит в основе разработки универсальной вакцины и подразумевает использование не генов, кодирующих белки-антигены микробов, а бактериальных последовательностей CG в качестве активного компонента вакцины. Последовательность Козак - консенсусная последовательность, окружающая старт-кодон, которая играет важную роль в инициации трансляции у эукариот. Промотор для экспрессии целевого гена в клетках эукариот. Наиболее часто используют промоторы вируса SV40, цитомегаловируса, промотор бета-актина, промоторы, специфичные для определенных видов ткани (например, промотор гена десмина для экспрессии в миоцитах, промотор гена гидроксилазы витамина D3 - в кератиноцитах, альбуминовый - в гепатоцитах). Целевой ген, кодирующий белок патогена. После целевого гена следуют сигналы полиаденилирования, например, вируса SV40, гена β - глобина кролика или гормона роста быка. Замыкают эту цепочку стоп-кодоны, причем часто используются двойные или тройные терминирующие последовательности (TAGTGATGA). Экспрессия репортерных генов обнаружена в мышцах, селезенке, печени, коже, легких и мозге. Наиболее выраженная экспрессия обнаружена в мышцах. Ее можно было обнаружить в течение минуты после инъекции. Она максимально проявлялась через 1-2 недели, а затем постепенно снижалась. Внутримышечная иммунизация оказалась наиболее эффективной. Иммунизация именно ДНК имеет некоторые преимущества перед иммунизацией очищенными вирусными антигенами. Наиболее важным преимуществом является то, что вирусные антигены, такие как вирусные гликопротеины, могут экспрессироваться на поверхности трансфецированных клеток и представляться иммунной системе в нативном виде. В процессе очистки вирусных белков, сборки и очистки вирусных частиц или химической инактивации вирусов, структура эпитопов на протективных белках может быть нарушена и вызовет ослабление иммуногенности. Преимущества ДНК-вакцин заключаются в чистоте, физико-химической стабильности, относительно низкой стоимости производства, простоте доставки, включении в одну плазмиду генов, кодирующих множество антигенов, и экспрессии антигенов в их нативной форме (что облегчает процессинг и презентацию иммунной системе). Повторное введение сопровождается гуморальным и клеточным ответом. Одна из особенностей ДНК-иммунизации состоит в том, что она эффективна в присутствии материнских антител. Главным недостатком ДНК-вакцин является возможная опасность, связанная с введением чужеродной генетически измененной ДНК, интеграция которой в хромосомную ДНК может привести к мутагенезу или онкогенезу, индукцией аутоиммунного состояния или толератности. Плазмиды используют из-за отсутствия репликации и, более того, отсутствия саморепликации ДНК при использовании ее в качестве вакцины. Плазмиды, содержащие вирусную ДНК, конструируются без последовательностей, которые способны интегрировать ее в хромосомальную ДНК. Способы введения ДНК-вакцин Парентеральный способ введения (самый простой), который заключается в инъекции ДНК-вакцин в солевом растворе. При этом большая часть ДНК поступает в межклеточное пространство и только потом включается в клетки. Использование генного пистолета. Для этого ДНК фиксируют на микроскопических золотых гранулах (около 1-2 мкм), затем с помощью устройства, приводимого в действие сжатым гелием, гранулы «выстреливают» непосредственно внутрь клеток. Для данного способа доставки требуется значительно меньшее количество вводимого материала, чем для внутримышечной инъекции. 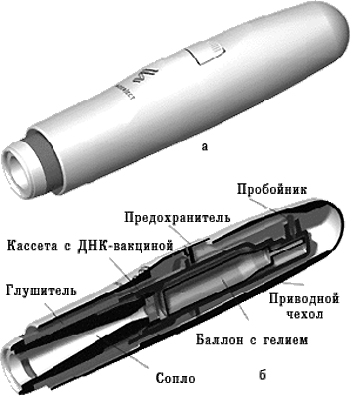 Одноразовый генный пистолет компании PowderJect. а — внешний вид; б — в разрезе. Электропорация - техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной мембране и доставлять ДНК непосредственно в клетки. Микроконтейнеры из полиматериалов. Московские ученые, например, создали пористую микросферу из карбоната кальция, покрытую несколькими слоями полисахаридов, в которую упаковывается молекула ДНК. Помещая микросферу в подкисленный раствор, внутри останется только ДНК, подлежащая транспортировке. Есть зарубежные аналоги, в которых оболочка капсулы выполнена из полимолочной кислоты. На их основе создают вакцины против гепатита и даже СПИДа. Средний диаметр микрокапсул для доставки ДНК-вакцин всего 1-2 микрона. Такие микрокапсулы можно ввести подкожно или даже в кровь. Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке. ДНК-вакцины можно вводить перорально с использованием бактериальных носителей. Для этих целей применяются, например, модифицированные бактерии Shigella flexneri. Мутантные бактерии растут in vitro на среде с диаминопимелиновой кислотой и, проникая в эукариотические клетки, не размножаются в них, а продуцируют закодированные в плазмиде антигены. Для перорального введения создан вектор на основе ослабленного штамма Salmonella, который способен к самоуничтожению в организме через определенный период времени после выполнения иммунизационных задач. После того как в клетках, зараженных генно-инженерным штаммом Salmonella, заканчивается запас специфического сахара, поставляемого вместе с вакциной, бактерии не способны сохранить целостность своих клеточных стенок, что приводит к их гибели. Оригинальная система доставки ДНК с помощью «теней» - неживых клеток грамотрицательных бактерий, лишенных цитоплазматического содержимого, но сохраняющих морфологию и антигенные структуры, включая адгезивные факторы. «Тени» обладают тропностью к антигенпрезентирующим клеткам макроорганизма и адъювантными свойствами, усиливающими иммунный ответ. Разработана технология доставки ДНК-вакцин с использованием бактериофагов. В данном случае вакцинная ДНК встраивается в геном вектора-бактериофага, которым затем иммунизируют макроорганизм. Помощники генетических вакцин Для усиления иммунного ответа, вызванного ДНК-вакцинами, совместно с ними вводят различные адъюванты, например, плазмиды, кодирующие синтез цитокинов, гранулоцитарно-макрофагального колониестимулирующего фактора. Генотерапия наследственных заболеваний - возможности, перспективы Еще в 30-е годы С.Н.Давиденков указал на ошибочность точки зрения о неизлечимости наследственных болезней. Он исходил из признания роли факторов внешней среды в проявлении наследственной патологии. В настоящее время, несмотря на успехи генетики и прогресс теоретической и клинической медицины, успешно лечатся очень немногие наследственные болезни - методом пересадки генов или тканей. Выделяют 3 подхода к лечению наследственных болезней и болезней с наследственным предрасположением: • этиологический, • патогенетический, • симптоматический. Этиологическими факторами большинства моногенных болезней являются мутации генов. В связи с этим радикальным способом лечения является генная терапия. В упрощенном виде - это своеобразная хирургическая операция по замене дефектного гена на нормальный, что должно привести к излечению от наследственного заболевания. Однако для реализации подобной операции необходимо преодолеть множество препятствий. - Необходимо знать точную локализацию генных дефектов, вызывающих наследственное заболевание на определенной хромосоме. -Установить характер и тип точковых мутаций. -Нужно синтезировать вводимый ген, осуществить его клонирование, создать банк данных (клонотеки), осуществить встраивание гена в хромосому и добиться его функционирования. Введение генов с лечебной целью используется в настоящее время не только для лечения моногенных болезней, но и других заболеваний (злокачественные опухоли, СПИД, вирусные инфекции и др.). Поэтому генную терапию в широком смысле можно определить как способ лечения наследственных заболеваний путем введения генов в клетки больных с целью направленного изменения генных дефектов или придания клеткам физиологических функций. Первая попытка использования генной терапии была предпринята М.Клайном в 1983 году у больных с бета-талассемией, когда было осуществлено введение нормального бета-глобинового гена. У детей впервые генотерапия была использована 14 сентября 1990 г. у 4-летней девочки из г.Бетезда (США) для лечения тяжелой иммунологической недостаточности, которая была связана с мутацией гена аденозиндезаминидазы (АДА). Были взяты лимфоциты больной девочки, в них введены нормальные гены АДА с помощью ретровирусного вектора и затем вновь пересажены в ее организм. Был получен положительный лечебный эффект, восстановление активности этого энзима, и достигнутый результат сохранялся в течение нескольких месяцев. Больная после подобной генотерапии смогла вести нормальный образ жизни. Процедура повторялась каждые 3-6 месяцев. Девочка продолжает жить до настоящего времени. Успех первых положительных клинических испытаний генной терапии привел к быстрому развитию новых генных технологий для лечения других моногенных заболеваний. Так, если к 1994 году на стадии клинических испытаний находилось пять моногенных болезней (фенилкетонурия, болезнь Гоше, муковисцидоз, семейная гиперхолестеринемия, иммунодефицитное состояние, связанное с дефицитом аденозиндезаминидазы), то к середине 2003 года уже существует 636 протоколов клинических испытаний или экспериментальных разработок геннотерапевтических способов коррекции различных заболеваний. Большая часть протоколов приходится на онкологические заболевания (60 %), незначительная часть - на моногенные болезни (12 % протоколов), а остальные протоколы посвящены испытанию генно-инженерных способов коррекции сердечно-сосудистых заболеваний, созданию вакцин, лечению СПИДа, туберкулеза и других заболеваний. Ряд моногенных заболеваний, по которым проводятся клинические испытания или экспериментальные разработки, приведены в таблице.  При проведении клинических испытаний на людях необходимы четкие разработки, организация и прогнозирование последствий. В целом, генная терапия имеет в применяемом объеме низкий процент осложнений. Широкое распространение генной терапии в настоящее время сдерживается, главным образом, двумя обстоятельствами - чрезвычайно высокой стоимостью проведения всех фаз испытаний и недостаточной эффективностью доставки генных конструкций. Проблема эффективной доставки генетического материала к клеткам-мишеням - одна из ключевых в генной терапии. Разработаны способы эффективной доставки генов в органы и ткани для лечения классических наследственных заболеваний и дефектов (муковисцидоз, гемофилия) и ряда полигенных заболеваний (рак, артрит, болезнь Альцгеймера, болезнь Паркинсона, СПИД и др. Находятся в стадии экспериментальных разработок методы генной терапии эмфиземы легких, фенилкетонурии, респираторного дистресс-синдрома, хронического грануломатоза, метахроматической лейкодистрофии, синдрома Леша-Нихана и др.  Современное состояние ДНК-вакцинологииВ настоящее время в разработке находится около 420 ДНК-вакцин против заболеваний различной этиологии как человека, так и животных. Большая часть разрабатываемых противоинфекционных терапевтических ДНК-вакцин нацелена на ВИЧ. Существенные успехи достигнуты в активной иммунизации против вируса папилломы человека. Некоторые вакцины находятся на стадии клинических испытаний и, возможно, в скором времени будут введены в обязательную практику. Так, американская компания Inovio, специализирующаяся на разработке ДНК-вакцин, создала препарат против цервикальной дисплазии, который проходит вторую фазу клинических испытаний. В 2013 г. эта вакцина удостоилась награды «Лучшая терапевтическая вакцина» на Всемирном конгрессе по вакцинам. В I или II фазах клинических испытаний находятся: вакцины против гепатита С, цервикального рака, рака головы и шеи, СПИДа, гриппа. Также ведется активная разработка вакцин против лихорадки Эбола и рака простаты. Разработке способов вакцинотерапии онкологических заболеваний при помощи рекомбинантных ДНК большое внимание уделяют и другие организации. Так хорошую эффективность показала ДНК-вакцина против лейкемии, созданная в Саутгемптонском университете (но вводимая с помощью электропоратора всё той же Inovio). Вакцина направлена на подавление в организме активности гена WT1 (Wilms tumor gene). Именно повышенная активность этого гена отмечается в опухолевых клетках различных видов. В ходе I фазы клинических испытаний у пациентов наблюдалось развитие иммунного ответа, в том числе активация Т-киллеров и выработка антител; была также доказана безопасность новой вакцины. Испытания перешли в фазу II, однако из-за проблем с финансированием организаторы пока не могут увеличить число участников. Животные нуждаются в такой же защите, как и люди. В связи с этим для ветеринарии разрабатываются ДНК-вакцины против бычьего и лошадиного герпесвирусов, собачьего вируса чумы, вируса классической свиной лихорадки, кроличьей папилломы, ящура, вируса инфекционного гемопоэтического некроза, вируса гриппа, вируса японского энцефалита, вируса бешенства, вируса везикулярного стоматита и т.д. Много ДНК-вакцин создается для борьбы с вирусными, бактериальными и эукариотическими патогенами рыб. Из множества разработанных ДНК-вакцин на сегодняшний день лицензировано всего несколько, причем повезло в этом плане, только животным.
Перспективы развития ДНК - вакцинологии Кандидатами для генной терапии или заболеваниями, при которых будет продолжаться разработка генно-инженерных методов коррекции дефектов, на ближайшие годы планируются следующие заболевания: • семейная гиперхолестеринемия - заболевание, которое рано приводит к развитию у молодых людей инфаркта миокарда и тяжелого прогрессирующего атеросклероза. Оно обусловлено отсутствием на мембранах клеток рецепторов для липопротеинов низкой плотности и сопровождается высоким уровнем холестерина в крови. Геном-кандидатом является ген рецептора липопротеинов низкой плотности, а клетками-мишенями - гепатоциты. Поскольку на мембранах покоящихся печеночных клеток отсутствуют рецепторы, прибегают вначале к частичной гепатоэктомии. С помощью ретровирусов ген рецептора низкой плотности вводится в печеночные клетки, после чего клетки печени инъецируются в полую вену. Это приводит к отчетливому (на 30-45 %) снижению показателей холестерина в крови. Сложность технологии препятствует пока ее широкому распространению в практике; • болезнь Гоше (сфинголипидоз), при которой кандидатом для генотерапии служит ген бета-глюкоцереброзидазы, а клетками-мишенями - макрофаги и стволовые клетки; • наследственные формы низкорослости, связанные с дефицитом гормона роста. Ген гормона роста удалось ввести в миоциты, которые начинали продуцировать гормон роста; • муковисцидоз (кистофиброз) - тяжелое заболевание, связанное с поражением дыхательных путей и кишечника, и нередко заканчивающееся летально. В качестве векторов для введения гена муковисцидоза чаще всего используются аденовирусы а клеток-мишеней - эпителий бронхов; • различные формы рака. Разработки ведутся по различным направлениям. Одно из направлений генной терапии рака состоит в том, чтобы с помощью генно-инженерных методов ввести в опухолевые клетки гены (например, ген интерферона), экспрессирующие чужеродные для реципиента белки. Иммунная система будет распознавать их как антигены и уничтожать. Другое направление предусматривает разработку технологии повышения эффективности противовирусных препаратов, используемых в лечении раковых. В России исследования по разработке физических и биологических векторов доставки генов в клетки млекопитающих проводятся в Институте молекулярной биологии им. В.А. Энгельгардта РАН (г. Москва), химических - в НИИ биомедицинской химии РАМН (г. Москва), генных конструкций для генотерапии атеросклероза - в НИИ экспериментальной медицины РАМН (г. Санкт-Петербург). Вывод: Таким образом, с помощью ДНК-вакцин можно сформировать устойчивый иммунитет против инфекционных агентов различной природы. Хотя, их разработкой уже более 20 лет занимаются в различных лабораториях мира, несмотря на это, такие вакцины практически не используются в клинической практике. Это связано с тем, что пока нет ответов на ряд вопросов, касающихся в первую очередь безопасности ДНК-вакцин. Хотя эти препараты не опаснее многих факторов, воздействию которых человек сознательно подвергает себя ежедневно. ДНК-вакцины вполне могут оказаться чудесным открытием, которое спасет многие жизни. На разных стадиях доклинических и клинических испытаний находятся генетические вакцины против вирусов гриппа, гепатитов А и В, герпеса, кори, геморрагических лихорадок, ВИЧ, собачьей чумы, ящура, папилломавирусов, цитомегаловирусов. Столь интенсивное развитие данного направления вакцинологии, вероятно, уже в ближайшей перспективе обеспечит реальный выход в виде эффективных и безопасных вакцинных препаратов, рекомендованных для применения в здравоохранении и ветеринарии. В перспективе методы генной терапии постоянно совершенствуются и будут находить все более широкое применение в практике лечения наследственных болезней. В ряде случаев они могут оказаться единственным способом коррекции генных дефектов. Кроме преодоления технических трудностей, внедрение генной терапии в широкую практику потребует разработки превентивных мер, направленных на обеспечение безопасности клинических испытаний на людях - этических, социальных, юридических. Список литературы Зверев В.В. (2006). Вакцинопрофилактика: прошлое, настоящее, будущее. Вестник биотехнологии; Попов Ю.А., Микшис Н.И. (2010). Генетические (ДНК) вакцины. Проблемы особо опасных инфекций; Стародубова Е.С., Исагулянц М.Г., Карпов В.Л. (2010). Регуляция процессинга иммуногена: сигнальные последовательности и их использование для создания нового поколения ДНК-вакцин. Интернет – ресурсы: http://meduniver.com/Medical/Microbiology/999.html http://biomolecula.ru/content/1630 http://medicalplanet.su/genetica/genoterapia_nasledstvennix_boleznei.html | ||||||||||||||||||||||||||||||||||||||||||||||||
