химия. Электролитическая диссоциация
 Скачать 64.65 Kb. Скачать 64.65 Kb.
|
|
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ Электролиты – это вещества, растворы и расплавы которых проводят электрический ток. Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов. Ионы – это заряженные частицы. Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Электролитическая диссоциация – это процесс распада электролита на ионы при его растворении или плавлении. Разделяют вещества – электролиты и неэлектролиты. К неэлектролитам относятся простые вещества, все оксиды, большинство органических веществ (кроме карбоновых кислот, их солей, фенолов). К электролитам относят кислоты, гидроксиды, соли. В чем же суть процесса электролитической диссоциации? Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло? Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na+ и Cl-. В воде этот кристалл распадается на структурные единицы – ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na+ и Cl- вступают во взаимодействие с молекулами воды (рис. 1). В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением (1):
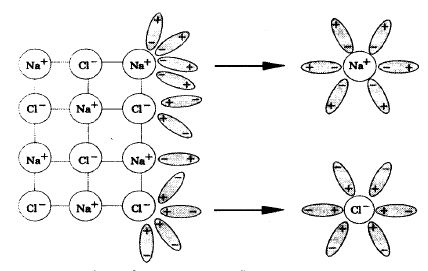 Рисунок 1 – Механизм электролитической диссоциации хлорида натрия При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе (рис. 2). Например, соляная киcлота диссоциирует на ионы так (2):
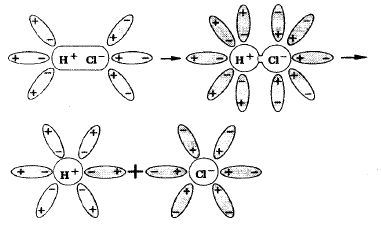 Рисунок 2 – Механизм электролитической диссоциации соляной кислоты При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов. Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества. Степень диссоциации – это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита (3). Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс – это число продиссоциировавших молекул, Nисх – это исходное число молекул. По степени диссоциации электролиты делят на делят на сильные и слабые. Сильные электролиты (α≈1): 1. Все растворимые соли (в том числе соли органических кислот – ацетат калия CH3COOK, формиат натрия HCOONa и др.) 2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.; 3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2. Слабые электролиты (α<1): 1. Слабые кислоты, в т.ч. органические: H2S, H3PO4, H2CO3, HNO2, H2SiO3 и др.; 2. Нерастворимые основания, амфотерные гидроксиды: Mg(OH)2,Fe(OH)2, Zn(OH)2 – и гидроксид аммония NH4OH; 3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости); 4. Вода. Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание – при диссоциации в растворе образуются только устойчивые ионы (4, 5). Самые распространенные ионы можно найти в таблице растворимости. Степень диссоциации сильных электролитов примерно равна 1.
Диссоциация слабых электролитов: многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота (6, 7):
Гидроксид магния диссоциирует также в 2 ступени (8, 9):
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия (10, 11) и гидроксохлорид магния (12, 13):
Основные положения теории электролитической диссоциации, таким образом: 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы. 2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем. 3. Под действием внешнего электрического поля положительно заряженные ионы двигаются к положительно заряженному электроду – катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами. 4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов. 5. Электролиты могут в разной степени диссоциировать на ионы – в зависимости от внешних условий, концентрации и природы электролита. 6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации. Практическое задание 1. Напишите уравнения электролитической диссоциации следующих электролитов: сульфид натрия, дигидроортофосфат калия, гидроксид алюминия, гидроксокарбонат кальция, сернистая кислота. 2. Напишите уравнения электролитической диссоциации: 1) хлорид железа(III); 2) сульфат калия; 3) нитрат бария; 4) фосфорная кислоты; 5) гидроксид натрия. 3. Напишите уравнения электролитической диссоциации: а) гидроксид кальция; б) хлорид меди (II); в) соляная кислота; г) сульфат железа(III); д) нитрат калия. |

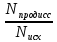 , где
, где
 CO
CO