Гетерофункциональные соединения гидроксикислоты гидроксикислоты
 Скачать 34.77 Kb. Скачать 34.77 Kb.
|
|
ГИДРОКСИКИСЛОТЫ ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ: ГИДРОКСИКИСЛОТЫ Гидроксикислоты – это органические соединения, в молекулах которых содержатся функциональные группы двух типов: гидроксильная и карбоксильная. Простейшие гидроксикислоты называют одноосновными двухатомными. Основность считают по числу карбоксильных групп, атомность – по числу гидроксильных групп, включая гидроксил карбоксильной группы. Так, например: молочная кислота СН3 – СН(ОН) – СООН является одноосновной и двухатомной; винная кислота НООС – СН(ОН) – СН(ОН) – СООН является двухосновной, четырёхатомной. НОМЕНКЛАТУРА И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ГИДРОКСИКИСЛОТ
В зависимости от взаимного расположения ОН и СООН-групп различают α, β, γ и другие гидроксикислоты. Гидроксикислоты встречаются в природе, особенно в растительном мире. Их остатки входят в состав сфинголипидов животных и растений. Гликолевая кислота обнаружена в свёкле, винограде. Молочная кислота является метаболитом в процессе обмена веществ (образуется при распаде глюкозы), в частности, накапливается в мышцах во время физической нагрузки. Она также является продуктом жизнедеятельности некоторых бактерий. Молочная кислота издавна использовалась в качестве консервирующего средства: с процессами молочно-кислого брожения сахаров связаны квашение молока, капусты, яблок; засолка огурцов, помидоров и т.п. Яблочная кислота содержится в рябине, незрелых плодах яблок. Винную кислоту также обнаруживают во многих фруктах. Она осаждается в виде кислой виннокаменной соли в бродящим вине. Лимонная кислота (помимо лимона) обнаружена в ботве хлопчатника. Получается она также при лимоннокислом брожении глюкозы. Ряд природных кислот применяется в кулинарии, пищевом производстве. Некоторые гидроксикислоты играют важную роль в обмене веществ. Лимонная и яблочная кислоты являются ключевыми в процессах клеточного дыхания, принимая непосредственное участие в цикле трикарбоновых кислот. β- и ω-Гидроксикислоты являются промежуточными продуктами метаболизма жирных кислот. Гидроксикислоты – это в основном кристаллические вещества. Ряд низших кислот представляют собой густые, сиропообразные жидкости (из-за сильной гигроскопичности), хорошо смешивающиеся с водой. КИСЛОТНЫЕ СВОЙСТВА ГИДРОКСИ КИСЛОТ В гидроксикислотах (оксикислотах) обе функциональные группы –ОН и –СООН сохраняют в общих чертах свои свойства. Однако в ряде случаев наблюдается их сильное взаимное влияние. Если ОН-группа находится в α-положении к –СООН, то кислотные свойства усиливаются (см. таблицу). Ярко выраженные кислотные свойства гидроксикислот можно считать первой особенностью этих кислот. Если уксусная и пропионовая кислоты имеют константы кислотной диссоциации в воде 1,8∙10-5 и 1,3∙10-5, то гликолевая и молочная и β-оксипропионовая имеют Кa = 15∙10-5, 14∙10-5 и 3∙10-5 соответственно. Повышение кислотных свойств является следствием отрицательного индуктивного влияния гидроксигруппы: СН2 ← С+δ = О СН2 – Сδ+ = О ↓ ↑ δ+ > δ1+ │ │ ОН О ← Н Н О - Н -IOH IH = 0 Гидроксиуксусная кислота Уксусная кислота ХИМИЧЕСКИЕ СВОЙСТВА ГИДРОКСИКИСЛОТ (ОКСИКИСЛОТ) Гидроксикислоты проявляют химические свойства, характерные для каждой из присутствующих функциональных групп. Для гидрокси- кислот характерны типичные реакции карбоновых кислот: ионизация карбоксильной группы, солеобразование, этерификация, получение производных; также гидроксикислотам свойственны типичные реакции спиртов, протекающие по гидроксильной группе: ацилирование, нуклеофильное замещение на атом галогена, окисление. Приведём реакций на примере молочной кислоты: а) реакции по СООН-группе:
│ Калия лактат ОН
│ Этиллактат ОН
│ Хлорангидрид ОН молочной к -ты б) реакции по ОН-группе
│ │ 2-бромпропановая к-та ОН Br
│ │ │ ОН Cl O – CH(CH3) - COOH Лактилпропионат
│ 2-оксопропановая кислота ОН Второй особенностью гидроксикислот является отношение к нагреванию. Однако в зависимости от удаления ОН-группы от карбоксильной группы оксикислоты ведут себя по-разному. α-Гидроксикислоты. При близком расположении функциональных групп реакция дегидратации проходит межмолекулярно, при этом α-гидроксикислоты при нагревании в результате межмолекулярной этерификации образуют циклические сложные эфиры – лактиды (от лат. Acidumlacticum – молочная 4кислота): O = C –[OH H]O O = C - O │ │ │ │ R – CH CH – R 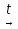 R – CH CH – R + 2H2O R – CH CH – R + 2H2O│ │ │ │ O[H HO] – C = O O – C = O ЛАКТИД Как сложные эфиры лактиды при кипячении с водой или растворами щелочей легко гидролизуются с образованием исходных гидроксикислот. Например: СН2 – С = О │ │ О О + 2NaOH = 2H2C – C = O │ │ │ │ О = С – Н2С HO Ona β-Гидроксикислоты. Для β-гидроксикислот наиболее характерны реакции элиминирования (Е), протекающие при незначительном нагревании или под действием минеральных кислот, в результате чего образуются α, β-ненасыщенные карбоновые кислоты. Реакции дегидратации β-гидроксикислот протекают по схеме R – CH – CH – COOH 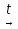 R – CH = CH – COOH + H2O R – CH = CH – COOH + H2O│ │ [OH H] 3-Гидроксимасляная Бутен-2-овая кислота (кротоновая) кислота Большую роль в метаболизме гидроксикислот играют реакции окисления, приводящие к образованию соответствующих оксокислот, например: СН3 – СН – СН2 – СООН 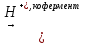 СН3 – С – СН2 – СООН СН3 – С – СН2 – СООН│ || ОН О β-Гидроксимасляная кислота Ацетоуксусная кислота γ-Гидроксикислоты. Значительная удалённость функциональных групп друг от друга в молекуле (в γ- и δ-положении) способствует возможности осуществления внутримолекулярной реакции дегидратации. Такое протекание реакции является более выгодным энергетически, поскольку приводит к замыканию термодинамически устойчивых пяти- и шестичленных циклических соединений; кроме того, внутримолекулярнной реакции дегидратации способствует сближенность в пространстве функциональных групп за счёт нелинейной конформации молекулы. В результате реакций дегидратации образуются циклические продукты – циклические эфиры лактоны: СН2 – С = О CH2 − C = O | | = | | + Н2О | [ОН CH2 – CH2-O СН2 – О[Н γ-Бутиролактон γ-Гидроксимасляная кислота По номенклатуре ИЮПАК лактоны, полученные в результате внутримолекулярной этерификации из алифатических гидроксикислот, называют, добавляя суффикс «-олид» к названеию углеводорода с тем же числом атомов углерода. Цифрой обозначают место замыкания цикла, начиная нумерацию от карбонильного атома углерода. Так, представленный выше лактон получает систематическое название 4-бутанолид. Реакции циклизации также имеют большое значение для полифункциональных соединений, при этом сохраняется общая закономерность: при близком расположении функциональных групп преобладает межмолекулярный механизм реакций, а при удалённом – внутримолекулярный. Так, глутаровая и фталевая кислоты при нагревании образуют циклические ангидриды: При нагревании янтарная (бутандиовая) кислота образует циклический ангидрид: При дегидратации 1,2-диолов реакция протекает межмолекулярно, что приводит к образованию циклического диэфира. Например, этиленгликоль образует циклический эфир 1,4-диоксан: СН2 – О ┼ Н НО ┼ СН2 СН2 - О – СН2 │ + │ → │ │ + 2Н2О СН2 – О ┼ Н НО ┼ СН2 СН2 – О - СН2 В более сложных условиях в результате межмолекулярной дегидратации этиленгликоля образуются макроциклические полиэфиры (краун-эфиры). Внутримолекулярная дегидратация этиленгликоля с образованием оксида этилена (эпоксида) не происходит. | |||||||||||||||||||||||||||||||||||||||||||||||

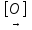 СН3 – С(O) – СООН
СН3 – С(O) – СООН