цвффцвфцвфцв. Гидролиз солей
 Скачать 28.59 Kb. Скачать 28.59 Kb.
|
|
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «Ижевский государственный технический университет имени М.Т. Калашникова» (ФГБОУ ВО «ИжГТУ имени М.Т. Калашникова») Факультет «Химия и химическая технология» Институт строительства и архитектуры имени В.А. Шумилова Лабораторная работа №4 Тема: «Гидролиз солей» Выполнил: Студент группы Б20-500-3 Е.А. Бушмелева Проверил: к.т.н., доцент ХиХТ Н.В.Семакина Ижевск 2020 Цель работы Научиться определять характер среды в растворах различных солей Изучить влияние различных факторов на гидролиз Научиться оценивать степень гидролиза Теоретическая часть 1 Гидролиз солей - взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. 2 По отношению к гидролизу соли разделяют на 4 типа: 1)Соли, образованные катионом сильного основания и анионом сильной кислоты (например, NaCl). в водных растворах данные соли заметному гидролизу не подвергаются. 2)Соли, образованные катионом слабого основания и анионом сильной кислоты (как NH4NO4 или CuCl2 ), они подвергаются гидролизу по катиону. 3) Соли, образованные катионом сильного основания и анионом слабой кислоты (например, NaCN или Na2SO3 ), гидролизуются по аниону. 4)Соли, образованные катионом слабого основания и анионом слабой кислоты, (например, CH3COONH4 ) гидролизуются одновременно и по катиону, и по аниону. 3 Особые случаи гидролиза - случаи необратимого гидролиза, например: Гидролиз гидридов NaH+HOH→NaOH+H Гидролиз пероксидов. Na2O2+2H2O→2NaOH+H2O2 Гидролиз нитридов. Ca3N2+6HOH→3Ca(OH)2+2NH3↑ Гидролиз фосфидов. K3P+3HOH→3KOH+PH3↑ 4 Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. 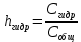 Константа равновесия гидролиза – величина, показывающая способность вещества к электролитической диссоциации. Чем больше значение константы, тем активнее протекает реакция. 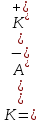 Экспериментальная часть Опыт 1. Реакции среды в различных растворах солей В четыре пробирки до 1/3 их объема налил нейтральный раствор лакмуса, добавил по одному микрошпателю кристаллов следующих солей: в первую – ацетат натрия, во вторую – хлорид алюминия, в третью – карбонат натрия, в четвертую – хлорид калия. Размешал растворы, по изменению окраски лакмуса сделал вывод о реакции среды в растворе каждой соли. Полученные результаты свел в таблицу.
NaCH3COO + H2O = CH3COOH + NaOH простой гидролиз CH3COO- + Na+ + H2O = CH3COOH + Na+ + OH- CH3COO- + H2O ⇄ CH3COOH + OH- AlCl3 + H2O ⇄ AlOHCl2 + HCl Al3+ + 3Cl- + H2O ⇄ AlOH2+ + 2Cl- + H+ + Cl- ступенчатый гидролиз Al3+ + H2O ⇄ AlOH2+ + H+ Na2CO3 + H2O ⇄ NaHCO3 + NaOH ступенчатый гидролиз 2Na+ + CO32- + H2O ⇄ Na+ + HCO3- + Na+ + OH- CO32- + H2O ⇄ HCO3- + OH- Реакция среды в растворах солей образованных: 1)Сильным основанием и слабой кислотой – щелочная 2)Слабым основанием и сильной кислотой – кислая 3)Слабым основанием и слабой кислотой – щелочная 4) Сильным основанием и сильной кислотой - нейтральная Опыт 2 Случаи полного гидролиза В две пробирки внес по 8 капель хлорида алюминия. В одну пробирку добавил такой же объем раствора сульфида аммония, а в другую – раствор карбоната натрия. Отметил выделение сероводорода в первой пробирке и пузырьков диоксида углерода во второй. В осадок выпал гидроксид алюминия. 2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2 + 6NaCl 2Al3+ + 3CO32- + 3H2O → 2Al(OH)3 + 3CO2 2AlCl3 + 3(NH4)2S + 6H2O → 2Al(OH)3 + 3H2S + 6NH4Cl 2Al3+ + 3S2- + 6H2O → 2Al(OH)3 + 3H2S Опыт 3 Факторы, влияющие на степень гидролиза солей Влияние силы кислоты и основания, образующих соль, на степень ее гидролиза. В две пробирки до 2/3 их объема налил дистиллированной воды. В одну пробирку внес один микрошпатель кристаллов сульфита натрия, а во вторую – столько же кристаллов карбоната натрия. В каждую пробирку добавил по одной капле фенолфталеина. Na2SO3+H2O→SO2+ 2NaOH 2Na+ + SO32- + H2O = SO2 + 2NaOH Na2CO3 + H2O ⇄ NaHCO3 + NaOH 2Na+ + SO32- + H2O ⇄ Na+ + HCO3- + NaOH Окраска фенолфталеина в растворе Na2CO3 более интенсивная чем в растворе Na2SO3 – это означает, что Na2CO3 подвергается гидролизу в большей степени, чем Na2SO3. Докажем теоретически, рассчитав степени гидролиза солей: 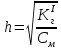 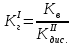 Для Na2CO3 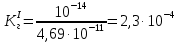 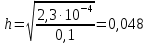 Для Na2SO3 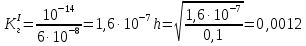 Вывод: Степень гидролиза Na2CO3 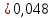 больше, чем у Na2SO3 больше, чем у Na2SO3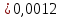 , это подтверждает, что Na2CO3 подвергается гидролизу в большей степени, чем Na2SO3. , это подтверждает, что Na2CO3 подвергается гидролизу в большей степени, чем Na2SO3. |
