Химия БАВ. Классификация методов выделения бав
 Скачать 187.6 Kb. Скачать 187.6 Kb.
|
Все существующие способы экстрагирования по характеру протекания процесса классифицируют на: статические и динамические. В статических методах сырье периодически заливают экстрагентом и настаивают определенное время. В динамических – предусматривается постоянная смена экстрагента либо сырья и экстрагента. По периодичности процесса выделяют периодические – когда подача сырья (экстрагента и/или растительного материала) в экстракционные аппараты осуществляется периодически и непрерывные (с непрерывной подачей сырья). По достижению состояния равновесия – равновесные и неравновесные. По количеству ступеней равновесия различают одноступенчатые и многоступенчатые методы. По направлению потока экстрагента и сырья – прямоточное (экстра- гент и материал в одном потоке) и противоточное (активное движение навстречу друг к другу экстрагента и растительного материала)экстрагирование. По законченности цикла:с законченным и незаконченным циклом. По делению сырья:с равными делением ЛРС и неравным делением. По скорости процесса и экстрагируемости сырья – быстротекущие и медленнотекущие методы. К статическим периодическим методам относятся одноступенчатые –мацерация, и многоступенчатые – ремацерация, циркуляция с периодическим сливом (многоступенчатые прямоточные), а также – реперколяция с периодическим сливом по Чулкову (многоступенчатые противоточные). К динамическим периодическим способам относятся одноступенчатые –перколяция и многоступенчатые – реперколяция с законченным и незаконченным циклами, циркуляционное экстрагирование. Среди динамических методов особо выделяют непрерывные – прямоточные и противоточные. Выбор метода экстрагирования определяется эффективностью производства и зависит от свойств экстрагента и растительного материала.
Экстракция – один из древнейших методов выделения биологически активных веществ (БАВ) из природных растительных источников и в настоящее время остается основным методом при получении БАВ. В научной лаборатории многообразие видов экстрагируемых органических веществ способствовало созданию и развитию большого разнообразия методов экстракции, которые применяют не только для выделения БАВ из растительного сырья, но и для разделения смеси веществ и очистки индивидуальных органических соединений от примесей. Для выделения БАВ из растительного сырья используют весь спектр методов экстракции. Как правило, первым этапом при предподготовке сырья к экстракции БАВ является удаление липидов. Однако, если липиды являются искомым объектом исследования, то для полноты их извлечения используют различные растворители или смеси растворителей: хлороформ, гексан, диэтиловый эфир, ацетон, спирты и их смеси. Первым этапом является разрушение ткани путем измельчения сухого сырья, следующим – экстракция нейтральных липидов, затем экстракция суммы фосфо- и гликолипидов с последующим фракционированием и выделением чистых веществ. Полноту извлечения липидов обеспечивает максимальное размельчение материала. Полярные растворители, такие, как метанол и этанол, которые разрушают водородные связи и ослабляют электростатическое взаимодействие липидов с белками, наиболее эффективно экстрагируют липиды. Использование спиртов для экстракции фосфолипидов удобно и тем, что они дезактивируют большинство липолитических ферментов, которые в активной форме вызывают деградацию липидов. Длительность экстракции и полноту экстрагирования, а также способ и условия проведения экстракции определяют в каждом конкретном случае.
Одним из наиболее чувствительных методов разделения и определения чистоты небольших (миллиграммовых) количеств природных и синтетических органических соединений является противоточное распределение. Новые методы противоточной экстракции с большой разделительной способностью в настоящее время непосредственно связаны с развитием хроматографических методов: экстракция твердого вещества жидкостью – с адсорбционной хроматографией, экстракция жидкости жидкостью – с распределительной хроматографией. Метод мацерации заключается в том, что вещество в твердой фазе в измельченном растительном источнике экстрагируют многократно при нормальной температуре небольшими порциями растворителя. Дигерирование отличается от мацерации лишь тем, что экстракция проводится при нагревании. При использовании метода перколяции вещество в твердой фазе экстрагируют растворителем при нормальной температуре противоточным методом. Простое экстрагирование заключается в том, что вещество экстрагируют из раствора одной порцией растворителя. Если экстракция повторяется несколько раз, то это повторное и/или фракционное экстрагирование. Если вещество непрерывно экстрагируют растворителем из раствора, то такой метод носит название перфорация. При использовании противотока процесс называется противоточной перфорацией.
В последнее время частично в промышленных условиях, частично в камеральных и заводских проводятся работы по экстракции растительных масел этиловым спиртом, изопролиловым спиртом, ацетоном, сжиженными газами (пропаном, бутаном и т. п.). Проводятся опыты по экстракции жира из растительного сырья также импульсным методом и с применением ультразвука. Преимущество использования спирта заключается в том, что он, растворяя масло в горячем состоянии, при охлаждении отслаивается от него, таким путем масло можно отделить в сравнительно чистом виде. Растворимость масла в спирте повышается при повышении давления с доведением температуры экстракции до 120°. Вместе с маслом спирт при экстракции извлекает и значительное количество нежировых веществ. Ацетон считается одним из лучших растворителей в силу того, что он не образует азеотропных смесей с водой и его регенерация в производстве не составляет особого труда. Его полная смешиваемость с водой позволяет проводить регенерацию простой промывкой, а также противодействовать воспламенению. Скрытая теплота испарения ацетона ниже, чем спирта. Применение ацетона — растворителя одновременно липофильного и гидрофильного — для экстракции хлопковых семян даёт возможность вместе с маслом извлекать госсипол и другие нежировые вещества. Способ получения растительных масел экстракцией сжиженными газами отличается тем, что в качестве растворителей применяют сжиженный бутан, пропан, их смесь или более многокомпонентную смесь газообразных углеводородов, получаемых из естественных нефтяных газов, попутных газов крекинг-процессов и процессов получения искусственного горючего из углей. Опыты показывают, что такой способ, экстракции:
Флавоноиды - многочисленная группа природных биологически активных соединений, в основе которых лежит дифенилпропановый скелет (С6-С3-С6), различной степени окисленности и замещения. Флавоноиды — крупнейший класс растительных полифенолов. С химической точки зрения, флавоноиды представляют собой гидроксипроизводные флавона (собственно флавоноиды), 2,3-дигидрофлавона (флаваноны) изофлавона (изофлавоноиды), 4-фенилкумарина (неофлавоноиды), а также флавоны с восстановленной карбонильной группой (флаванолы). Зачастую к флавоноидам относят и другие соединения С6-С3-С6 ряда, в которых имеются два бензольных ядра, соединенных друг с другом трёхуглеродным фрагментом — халконы, дигидрохалконы и ауроны. Свое название эти вещества получили от латинского слова flavus - желтый - в 1895 г. химиком Костанецким, поскольку первые выделенные флавоноиды имели желтую окраску.
В основе классификации лежит:
Флавоноиды объединены общностью путей биосинтеза в растениях.
По расположению кольца B выделяют следующие основные подгруппы флавоноидов:
К собственно флавоноидам относятся:
Изофлавоноиды с фенильным радикалом в положении 3: ИЗОФЛАВАН, ИЗОФЛАВОН. ИЗОФЛАВАНОН и др. Неофлавоноиды с фенильным радикалом у С4: 4-БЕНЗОКУМАРИН,4-БЕНЗОХРОМАН (неофлаван) Бифлавоноиды; БИФЛАВОН Кроме мономерных флавоноидов существуют димерные формы - флавоноиды могут конденсироваться между собой углерод-углеродными связями и другими фенольными соединениями: фенолкарбоновыми и оксикоричными к-тами, лигнанами, с изопреноидами и алкалоидами. В растениях большинство флавоноидов присутствует в виде гликозидов (кроме катехинов и лейкоантоцианов). В качестве углеводной части могут быть моносахариды: D-глюкоза, D-галактоза, D-ксилоза, L-рамноза и др. В некоторых случаях встречаются специфические дисахариды: рутиноза (рамноза и глюкоза), софороза (2 молекулы глюкозы). Сахара могут присоединяться к агликону в 3, 7, 3', 4' и др. положениях. Для флавоноидов характерно гидроксилирование. Оно возможно почти во всех положениях. У некоторых флавоноидов гидроксилы метилированы. Основную группу флавоноидов составляют О-гликозиды; в меньшей степени распространены С-гликозиды, где углеводные компоненты связаны с агликоном через углеродный атом в 6 или 8 положениях. Известны также ацилированные гликозиды, содержащие ацильные остатки в агликоновой или в углеводной части молекулы. Ацилирующими агентами могут быть бензойная, уксусная, протокатеховая, кофейная и др. кислоты. О-гликозиды в зависимости от числа остатков сахара, положения и порядка их присоединения делятся на монозиды, биозиды, триозиды и дигликозиды. В дигликозидах моносахара присоединяются в двух разных положениях флавоноидного ядра.
1. Большинство флавоноидов - твердые кристаллические вещества с определенной температурой плавления, не имеющие запаха. 2. Окрашены в желтый цвет (флавоны, флавонолы, халконы, ауроны) или бесцветные (катехины, лейкоантоцианидины, флаваноны, изофлавоны). Наиболее яркие оттенки свойственны антоцианам, которые придают растительным тканям красную или синюю окраску в зависимости от рН среды. В кислой среде они имеют красный цвет (соли катионов), в щелочной - синий (соли анионов). 3. Гликозиды (содержащие более трех остатков сахара) растворимы в воде, водно-спиртовых смесях, в спиртах при нагревании, этилацетате и нерастворимы в органических растворителях (петролейном и диэтиловом эфирах, дихлорэтане, ССl4). Агликоны хорошо растворимы в низших спиртах (метиловом и этиловом), органических растворителях (диэтиловом эфире, ацетоне, бензоле) и в растворах щелочей. Нерастворимы в воде. 4. Гликозиды обладают оптической активностью. 5. О-гликозиды при действии разбавленных минеральных кислот и ферментов легко гидролизуются до агликона и углеводного остатка. С-гликозиды с трудом расщепляются под действием концентрированных кислот (HCl или СН3СООН) или их смесей при длительном нагревании. 6. Катехины и лейкоантоцианидины, как правило, гликозидных форм не образуют. Они легко окисляются в присутствии кислорода, под действием света и щелочей. Остальные флавоноиды более устойчивы к окислению. 7. Флавоноиды флуоресцируют в УФ-свете: при этом флавоны, флавонол-3-гликозиды, флаваноны, халконы обнаруживаются на хроматограммах в виде коричневых пятен, флавонолы и их 7-гликозиды - в виде желтых или желто-зеленых пятен. 8. Свободная ОН-группа 7 положения способна диазотироваться. 9. Благодаря карбонильным и фенольным оксигруппам флавоноиды способны образовывать комплексы с солями металлов различной степени устойчивости. 10. Флавоноиды способны восстанавливаться атомарным водородом в кислой среде в присутствии магния или цинка. 11. Флавоноиды взаимодействуют со щелочами с образованием фенолятов желтой окраски, которая при нагревании изменяется до оранжевой или коричневой. Локализация флавоноидов в растениях В растениях флавоноиды локализуются в различных органах и частях растений: - бутонах (софора японская), - цветках, обуславливая окраску лепестков (бессмертник песчаный, василек синий, пижма обыкновенная), - траве (горцы: птичий, почечуйный, перечный; хвощ полевой), - плодах (боярышники, софора японская), - корнях (стальник пашенный, шлемник байкальский). В клетках растений флавоноиды накапливаются в форме гликозидов, главным образом в вакуолях, а в свободном состоянии - в специальных образованиях, зачастую имеющих довольно сложное строение - смоляных и эфирномасличных ходах, канальцах, вместилищах, железках и т.д. В надземных частях растений более 85% суммы флавоноидов локализуется в клетках эпидермы и только 15% - в остальных тканях. Биологическая роль флавоноидов в жизни растений:
Для флавоноидов не существует универсального метода выделения из растительного сырья. В каждом конкретном случае учитываются свойства выделяемых веществ, сопутствующие вещества и особенности растительного сырья. Для выделения флавоноидов проводят экстрацию ЛРС одним из подходящих растворителей: этанолом, метанолом, горячей водой или спирто-водной смесью. Для очистки и разделения используют: 1) избирательную экстракцию; 2) осаждение солями тяжелых металлов; 3) хроматографические методы. Заготовку надземных частей проводят в фазу бутонизации или начала цветения, подземных - в конце вегетации. Сырье необходимо сушить вскоре после сбора, т.к. флавоноидные гликозиды под влиянием ферментов в присутствии влаги легко гидролизуются на сахар и агликон, а свободные агликоны могут окисляться. Сушить сырье следует в тени или в сушилках при температуре 50-60°С (не выше 90°С). Медленная сушка, особенно на солнце, ведет к разрушению флавоноидов. Хранить сырье необходимо в упакованном виде в сухом проветриваемом помещении, без доступа прямых солнечных лучей.
Кумарины — кислородсодержащие гетероциклические соединения. В основе структуры их молекул лежит бензо-а-пирон — лактон цис-орто-оксикоричной кислоты (у хромонов — бензо-у-пирон). Хромоны - это природные фенольные гетероциклические соединения, производные бензо-гамма-пирона. По своей структуре хромоны близки к кумаринам и флавоноидам, но в природе встречаются реже. В настоящее время известно более 50 производных хромона. Подобно кумаринам, хромоны могут образовывать гидрокси-, метоксипрозводные. При конденсации с бензольным, пирановым или фурановым кольцами образуют разнообразные производные (соответственно бензо-, пирано- или фуранохромоны). Медицинское значение из производных хромонов имеют пока только фуранохромоны.
Все известные кумарины в зависимости от их химической структуры делят на следующие группы: 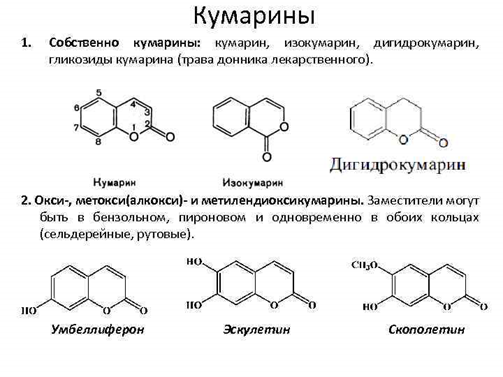 1. Простые кумарины и их гликозиды (содержатся в траве донника лекарственного и донника рослого). 2. Гидрокси-, метокси- (алкокси-) и метилендигидроксикумарины и их гликозиды. Заместители могут быть в бензольном или пироновом кольце, а также в обоих кольцах одновременно. 3. Фурокумарины. Соединения, которые образуются в результате конденсации кумаринов с фурановым циклом. В зависимости от расположения фуранового кольца делятся на производные псоралена (фурановое ядро сконденсировано с кумарином в 6,7-положении) и производные ангелицина (изопсоралена), у которых фурановое кольцо сконденсировано с кумарином в 7,8-положении. Фурокумарины — самая многочисленная группа, широко представленная в семействах зонтичных и бобовых. 4. Пиранокумарины. Содержат ядро пирана, сконденсированное с кумарином в 5,6-, 6,7-, 7,8- положениях, имеют заместители в пирановом, бензольном или пироновом кольце. 5. Бензокумарины. Содержат бензольное кольцо, сконденсированное с кумарином в 3,4- положении. Занимают промежуточное положение между кумаринами и гидроксибензойными кислотами. Эллаговая кислота является структурным элементом гидролизуемых дубильных веществ. Содержится в растениях семейства розоцветных (кровохлебка лекарственная, лапчатка прямостоячая). 6. Куместаны. Кумарины, содержащие систему бензофурана, сконденсированную с кумарином в 3,4-положении (содержится в траве клевера лугового, обладает эстрогенной активностью). 7. Более сложные соединения, в состав которых входит система кумарина. Кумарины широко распространены в растительном мире, особенно среди представителей семейств зонтичных, бобовых, рутовых. В природе чаще всего встречаются наиболее простые производные кумарина и фурокумарина. Основное количество представителей соединений этой группы найдено в свободном состоянии и лишь незначительное число в виде гликозидов.
1) Простые хромоны и их производные 2) Фуранохромоны 3) Пиранохромоны 4) Бензохромоны
Роль кумаринов в жизнедеятельности растений еще недостаточно выяснена. Согласно существующим в настоящее время теориям одни кумарины являются стимуляторами роста растений, другие, наоборот, ингибиторами роста. Считают также, что кумарины защищают растения от некоторых вирусных заболеваний, а также от чрезмерного солнечного облучения. Кумарины локализуются в различных органах растений, чаще всего в корнях, коре, плодах. Содержание кумаринов в разных растениях колеблется от 0,2 до 10 %, причем часто можно встретить 5-10 кумаринов различной структуры в одном растении. Качественный и количественный состав кумаринов различен у разных видов внутри одного рода; он изменяется также в онтогенезе растения. Физические свойства. Выделенные в индивидуальном состоянии кумарины представляют собой кристаллические вещества, бесцветные или слегка желтоватые. Они обладают приятным запахом, напоминающим запах свежего сена. Кумарины хорошо растворимы в органических растворителях: хлороформе, эфире диэтиловом, спиртах этиловом и метиловом, а также жирах и жирных маслах. В воде кумарины в большинстве случаев нерастворимы; гликозиды же их, как правило, растворимы в воде и нерастворимы в органических растворителях. При нагревании до 100 ºС кумарины возгоняются с образованием игольчатых кристаллов. Многие кумарины проявляют очень характерную флуоресценцию (голубую, синюю, фиолетовую, зеленую или желтую) в УФ-свете в нейтральных спиртовых растворах, растворах щелочей и кислоте серной концентрированной. Флуоресценция усиливается при обработке щелочами или парами аммиака. Особенно интенсивно флуоресцируют производные умбеллиферона (7-гидроксикумарина), проявляя ярко-голубую флуоресценцию, что связано с образованием хиноидной структуры в щелочной среде. В УФ- и ИК-областях имеют характерные спектры поглощения. Химические свойства обусловлены наличием бензольного и лактонного (пиронового) колец. Кумарины вступают в реакции: 1. Реакция разрыва лактонного кольца (лактонная проба). Основана на разрыве лактонного кольца под действием щелочи с образованием солей кислоты орто-гидроксикоричной (орто-кумаровой), растворимых в воде, которые легко окисляются до соединений хиноидной структуры, имеющих желтый цвет. Реакция обратима, т.е. под действием кислот лактонное кольцо вновь замыкается, образуя исходный кумарин. Лактонное кольцо не раскрывается при кипячении с водой и при воздействии карбонатов щелочных металлов. Это одна из наиболее характерных реакций на кумарины, которая используется как для обнаружения кумаринов в сырье, так и для их очистки. 2. Реакция азосочетания с солями диазония. Продукты щелочного гидролиза (после раскрытия лактонного кольца) образуют в слабощелочной среде соли кислоты цис-орто-гидроксикоричной (кумаринаты), фенольный гидроксил которой ориентирует азогруппу ворто- илипара-положение 6 или 8 с образованием азокрасителя. При избытке диазореактива образуются бидиазосоединения. Окраска азокрасителя зависит от заместителей в исходном кумарине и может варьировать от коричнево-красной до вишневой. 3. Реакция сплавления со щелочью. При сплавлении с кристаллическим натрия гидроксидом происходит разрыв лактонного кольца с образованием простых фенолов (например, резорцина). 4. При повышенном давлении и в присутствии катализатора возможно присоединение водорода в положении 3,4 и гидрирование двойных связей в ароматическом кольце. Физические свойства. Фуранохромоны — белые или желтоватые кристаллические вещества без запаха, горького вкуса. Нерастворимы в воде, хорошо растворимы в органических растворителях (эфир, хлороформ, метанол, этанол). Большинство хромонов флуоресцируют в УФ-свете желтым или желто-зеленым цветом. Интенсивность флуоресценции усиливается под воздействием паров аммиака или после обработки спиртовыми растворами щелочей. В отличие от кумаринов, хромоны усиливают флуоресценцию в УФ-свете после обработки кислотой серной. Также отличаются от кумаринов по спектрам поглощения. Химические свойства обусловлены наличием в структуре бензольного кольца игамма-пиронового цикла. Специфические качественные реакции: 1. Реакция с 0,1 % раствором уранилацетата. При взаимодействии с 0,1 % водным раствором уранилацетата хромоны, в зависимости от структуры, образуют окрашенные растворы (оранжевые, красные, фиолетовые) или желтый осадок. 2. Борно-лимонная реакция. Хромоны, в отличие от флавоноидов, не дают реакцию со смесью кислот борной и лимонной.
Для выделения кумаринов и хромонов из растительного сырья используются преимущественно органические растворители: этиловый спирт, хлористый метилен, хлороформ, диэтиловый и петролейный эфиры, а также сжиженные газы: жидкая двуокись углерода и хладон-12 (фреон). Из сконцентрированных экстрактов ацилкумарины выделяются индивидуально с применением кристаллизации, а оставшееся в маточном растворе вещество выделяют с применением адсорбционно-хроматографических методов. Этот способ в сочетании с качественным хроматографическим анализом позволяет разделять сложные смеси близких по свойствам веществ и выделять их в индивидуальном состоянии. Сорбентами для выделения и очистки кумаринов и хромонов являются алюминия оксид I, II, III групп активности и силикагель. Далее эфирное извлечение обрабатывают 0,5 % водным раствором КОН на холоде, водную фазу вновь выбрасывают. Затем эфирную фазу обрабатывают 10 % водно-спиртовым раствором КОН при слабом нагревании. Происходит разрыв лактонного кольца, и образуются кумаринаты, которые переходят в водный слой. В слое органического растворителя остаются балластные вещества (смолы, стерины, спирты), органическую фазу выбрасывают. Водно-щелочной слой подкисляют разбавленой НО: происходит замыкание лактонного кольца с образованием кумаринов, извлекаемых органическим растворителем. Органический растворитель отгоняют и получают сумму кумаринов, которую разделяют хроматографически на селикагеле или оксиде алюминия. Кумарины, содержащие ОН-группы (спиртовые или фенольные), сильнее адсорбируются на оксиде алюминия, чем на силикагеле, причем адсорбционное сродство кумаринов к оксиду алюминия усиливается с увеличением числа ОН-групп. Затем из колонки кумарины элюируют большим объемом полярных растворителей, подобных спирту. На хроматограмме флуоресцирующие пятна кумаринов обводят карандашом и проявляют диазотированным сульфаниламидом, от действия которого кумарины (в зависимости от структуры) окрашиваются в оранжевый, красный и фиолетовый цвета, видимые при дневном свете.
Антраценпроизводные- производными антрацена (или антраценпроизводными) называют природные соединения, в основе структуры которых лежит ядро антрацена различной степени окисленности по кольцу В (среднему).
В зависимости от строения углеродного скелета можно разделить на 3 основные группы: 1) соединения, молекулы которых содержат одно ядро антрацена – мономеры; 2) соединения с двумя ядрами антрацена – димеры; 3) конденсированные антраценпроизводные. Мономеры, в зависимости от степени окисленности среднего кольца (В) подразделяют на: А) окисленные формы – производные 9,10-антрахинона; Б) восстановленные формы – производные антранола, антрона, оксиантрона Восстановленные формы антраценпроизводных очень лабильны и легко окисляются кислородом воздуха до антрахинонов. В растениях могут присутствовать как восстановленные, так и окисленные формы. От характера и расположения заместителей, окисленные формы подразделяют на: - производные хризацина (1, 8-дигидрооксиантрахинона) – табл. 1, - производные ализарина (1, 2-дигидрооксиантрахинона) – табл. 2. Производные хризацина широко представлены в растениях: эмодины, реин, хризафанол. Эмодины различаются положением заместителей: гидроксильных, метильных, карбоксильных групп. Название эмодина изменяется в зависимости от того, в каком растении оно находится, в крушине и жостере – франгуло-эмодин, в ревене и щавеле – реум-эмодин, в алоэ – алоэ-эмодин. Производные ализарина содержатся в марене красильной. Димерные антраценпроизводные образуются при соединении двух мономеров. Чаще встречаются димеры восстановленных форм, которые соединены в димеры по среднему кольцу в γ-положении; окисленные же формы могут быть соединены в α- и β-положениях. При конденсации одинаковых мономеров образуется соединение, называемое диантроном (диантрахинон), если разных – гетеродиантроном (гетероантрахинон). Примером диантрона может быть сеннозид А или диреин, то есть диантрон реина. Молекулы могут быть симметричны и состоять из одинаковых стереоизомеров, – например, сеннозиды А и В, или состоять из разных, несимметричных остатков, – например, вассианин Концентрированные антраценпроизводные состоят из двух мономеров 1,8-дигидроксиантрахинонов, соединенных в α- и γ-положениям. Примером может служить гипероцин (зверобой). В ЛРС антраценпроизводные могут находиться как в свободном состоянии (в форме агликонов), так и в виде гликозидов. Углеводный фрагмент антраценгликозидов может быть представлен глюкозой, рамнозой, ксилозой и арабинозой и присоединен к агликону через гидроксил в α- и β-положениях. Чаще всего это О-гликозиды (например, сенпозиды А и В). Реже встречаются С-гликозиды, у которых сахара присоединяются через углерод в γ-положении – например, барабалоин из растений алоэ. Антраценгликозиды большей частью являются моно- или биозидами (то есть с 1 или 2 сахарными остатками); реже число сахарных остатков составляет 3 и более.
По физико-химическим свойствам антраценпроизводные – кристаллические вещества желтого, оранжево-красного и коричневого цвета, но встречаются и бесцветные антранолы (восстановленные формы). Имеют определенную температуру плавления. Большинство флуоресцируют в УФ-свете, причем: - антрахиноны- оранжевым, розовым, красным, огненно-красным и коричневым - антроны и антранолы – желтым, голубым и фиолетовым цветом. При нагревании до 210°С – сублимируются. Это свойство часто используется для извлечения их из ЛРС. По растворимости агликоны и гликозиды различаются. Антраценгликозиды растворимы в воде, этаноле, водно-спиртовых смесях, но нерастворимы в органич неполярных р-лях: диэтиловом эфире, хлороформе, бензоле. Агликоны, наоборот, растворимы в хлороформе, спиртах, но нерастворимы в воде. В щелочах раствор агликоны и гликозиды, образуя вишнево-красные феноляты. Гликозиды под действием ферментов и кислот гидролиз: агликон и сахарную часть. Характерным свойством всех антраценпроизводных является устойчивость их ядра. С ионами щелочных металлов антраценпроизводные образуют соли. С солями тяжелых Ме (Fe, Al, Cr, Sn) –устойчивые соли или комплексы (лаки). Гликозиды антраценпроизводные обладают оптической активностью. Восстановленные формы антраценпроизводных окисляются кислородом воздуха, пергидролем (Н2О2). Окисленные производные антрацена по-разному относятся к щелочам: - имеющие в качестве заместителя карбоксильную группу растворяются в водных растворах карбонатов, гидрокарбонатов и гидроксидов щелочей, образуя окрашенные в красный цвет соли; - имеющие гидроксил в β-положении образуют феноляты с водными растворами карбонатов и гидроксидов щелочных металлов; - имеющие гидроксилы в α-положении образуют феноляты только с гидроксидами щелочей, т.к. α-гидроксилы образуют внутримолекулярную водородную связь с соседней карбонильной группой, поэтому ОН-группа в α-положении менее реакционно способна, чем ОН-группа в β-положении. Это свойство используют для уточнения химической структуры антраценпроизводных, извлеченых из ЛРС.
Выделение антраценпроизводных из ЛРС. Способы извлечения антраценпроизводных из ЛРС, в связи с тем, что большинство этих соединений присутствует в растительных тканях виде гликозидов, основано на использовании полярных растворителей: метанола, этанола, их водных растворов или горячей воды. Для получения агликонов вначале проводят ферментативный или кислотный (с помощью HCl, CH3COOH) гидролиз суммарного препарата антраценгликозидов, затем свободные антраценпроизводные извлекают органическими растворителями: этиловым эфиром, хлороформом, бензолом и др. Разделение антраценпроизводных ведут на хроматографических колонках с полиамидным сорбентом. Элюирование отдельных веществ с колонки проводят органическими растворителями с возрастающей полярностью: петролейным эфиром, ацетоном, хлороформом, этанолом, водными растворами спирта. Первыми вымываются агликоны, последними – антраценпроизводные с гликозидными остатками.
Дубильными веществами, или таннидами, называется комплекс высокомолекулярных природных полифенольных соединений, способный превращать сырые шкуры животных в прочный, Дубильными веществами, или таннидами, называется комплек гниению продукт - кожу. Термин "дубильные вещества" был впервые использован французским исследователем Сегеном в 1796 г. Дубильные вещества (ДВ) получили свое название из-за способности дубить шкуры и делать их непроницаемыми для воды. Обычно для этой цели использовали кору дуба, отсюда и процесс назвали дублением, а вещества - дубильными. Дубление - сложный физико-химический процесс образования устойчивой структуры за счет возникновения водородных, ковалентных и электровалентных связей между молекулами коллагена и фенольными группами дубильных веществ. Но такие связи могут образовываться только тогда, когда молекулы достаточно велики. В процессе дубления участвуют вещества с молекулярной массой от 500 до 3000. Низкомолекулярные соединения имеют только вяжущий вкус, но не способны к дублению.
Согласно классификации К.Фрейденберга, дубильные вещества подразделяют на две большие группы: I. Гидролизуемые ДВ при действии кислоты или ферментов подвергаются гидролизу на составные части. К ним относят: 1. галлотаннины; 2. эллаготаннины; 3. несахаридные эфиры карбоновых кислот или депсиды. II. Конденсированные ДВ при действии кислот подвергаются дальнейшему уплотнению и конденсации, а образующиеся красно-коричневые продукты конденсации называют флобафенами. Они представлены полимерами: 1. катехинов (флаван-3-олов); 2. лейкоантоцианидинов (флаван-3,4-диолов); 3. гидроксистильбенов. 1. Галлотаннины - сложные эфиры гексоз (обычно D-глюкоза) и галловой кислоты. Встречаются моно-, ди-, три-, тетра-, пента- и полигаллоильные эфиры. Представителем этой группы является китайский таннин. 2. Эллаготаннины - сложные эфиры D-глюкозы и гексагидроксидифеновой, хебуловой и других кислот, имеющих биогенетическое родство с эллаговой кислотой. Эллаготаннины найдены в корке плодов гранатника, кожуре грецкого ореха, коре дуба, соплодиях ольхи. В растениях присутствует не эллаговая кислота, а гексагидроксидифеновая. При кислотном гидролизе дубильных веществ происходит ее превращение в дилактон - эллаговую кислоту. 3. Депсиды представляют собой эфиры галловой кислоты с хинной, хлорогеновой, кофейной, гидроксикоричной кислотами, а также флаванами. Эфиры галловой кислоты и катехинов находятся в листьях чая. Из листьев зеленого чая выделен теогаллин. Преимущественно гидролизуемые ДВ содержат: скумпия кожевенная, сумах дубильный, горец змеиный, бадан толстолистный, кровохлебка лекарственная, ольха черная и серая. Конденсированные дубильные вещества представляют собой олигомеры и полимеры катехинов, лейкоантоцианидинов и гидроксистильбенов, где все фрагменты связаны друг с другом углерод-углеродными связями (С - С) в положениях С2 - С6; С2 - С8; С4 - С8; С5' - C2'; C2' - C6' и др. Например, образование конденсированных дубильных веществ происходит в результате окислительной конденсации катехинов. При этом пирановое ядро катехиновой молекулы разрывается и С2-атом соединяется углерод - углеродной связью с С6-атомом другой молекулы.
Локализация. В большом количестве они накапливаются: - в подземных органах - лапчатка прямостоячая, бадан толстолистный, кровохлебка лекарственная; - в коре - дуб обыкновенный. Могут накапливаться: - в листьях - сумах дубильный, скумпия кожевенная; - в траве - зверобой продырявленный; - в плодах - черника обыкновенная, черемуха обыкновенная, ольха клейкая и серая. Наибольшее содержание ДВ в галлах (патологические наросты на листьях) турецких, китайских, фисташковых, где содержание достигает до 60-80%. |