глава 12. Гетероциклические соединения
 Скачать 2.57 Mb. Скачать 2.57 Mb.
|
|
Глава 12. гетероциклические соединения Гетероциклические соединения — это вещества, молекулы которых содержат циклы, построенные из атомов разных химических элементов. Обычно такими гетероатомами являются азот, кислород, сера, но могут быть фосфор, кремний, селен, бор и др. Циклы могут быть ароматическими, насыщенными и ненасыщенными. Гетероциклические соединения чрезвычайно распространены как в животном, так и в растительном мире. Очень многие биологически важные вещества содержат в своём составе гетероциклические фрагменты. 12.1. классификация и номенклатура Гетероциклические соединения могут быть классифицированы:
Тривиальные названия здесь широко распространены. Примерами гетероциклических соединений (и их тривиальных названий), относящихся к разным группам, являются следующие вещества:  пиррол пирролидин тиофен имидазол  пиридин пиразин пиперазин морфолин Согласно номенклатурным правилам ИЮПАК (номенклатура гетероциклических соединений) присутствие гетероатома в цикле указывается приставками окс(а)- (О), ти(а)- (S), селен(а)- (Se), аз(а)- (N), фосф(а)- (Р), арс(а)- (As), сил(а)- (Si). (Буква «а» может быть опущена для благозвучия.) Число одинаковых гетероатомов обозначается количественными приставками ди-, три-, тетра- и т.д. Если в гетероцикле несколько разных гетероатомов, то их называют в определённой последовательности: окса-, тиа-, селена-, аза-, фосфа-, арса-, сила-. Размер цикла обозначается с помощью корня слова: трёхчленные циклы — -ир, четырёхчленные — -ет, пятичленные — -ол, шестичленные — -ин, семичленные — -епин. В названии гетероциклических соединений отражают и степень гидрирования (насыщенности) атомов гетероцикла. Основное название (без суффиксов) относится к соединению с максимально возможным числом двойных связей в цикле, но исключение составляют трёхчленные циклы — для обозначения их ненасыщенности добавляется суффикс -ен (для азотосодержащих — -ин). Полностью гидрированное соединение обозначают суффиксами -идин (для азотосодержащих гетероциклов) или -ан (для кислородо- и серосодержащих гетероциклов), но для циклов с числом атомов 6 и более может быть использована приставка пергидро-. Для частично гидрированных соединений используют приставки дигидро-, тетрагидро-, при этом цифровыми локантами указываются атомы цикла, к которым присоединены атомы водорода. Если водородный атом присоединён только к одному из гетероатомов, это обозначается буквой Н и цифрой, указывающей гидрированный атом. Для названия производных гетероциклических соединений необходимо пронумеровать атомы цикла. Обычно нумерация начинается с гетероатома. Если имеется несколько гетероатомов, то используют ряд убывающего старшинства: O, S, Se, Te, N, P, As, Sb, Bi, Si, Ge, Sn, Pb, B, Hg. Для некоторых гетероциклических соединений сохраняется особый вид нумерации. Примеры названий некоторых соединений: 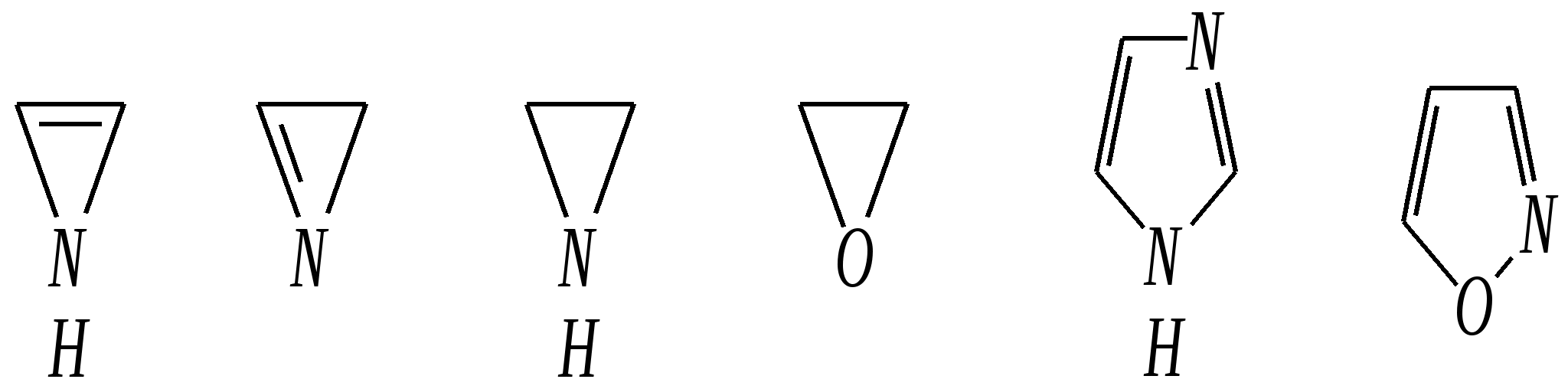 азирин 2Н-азирин азиридин оксиран 1,3-диазол 1,2-оксазол 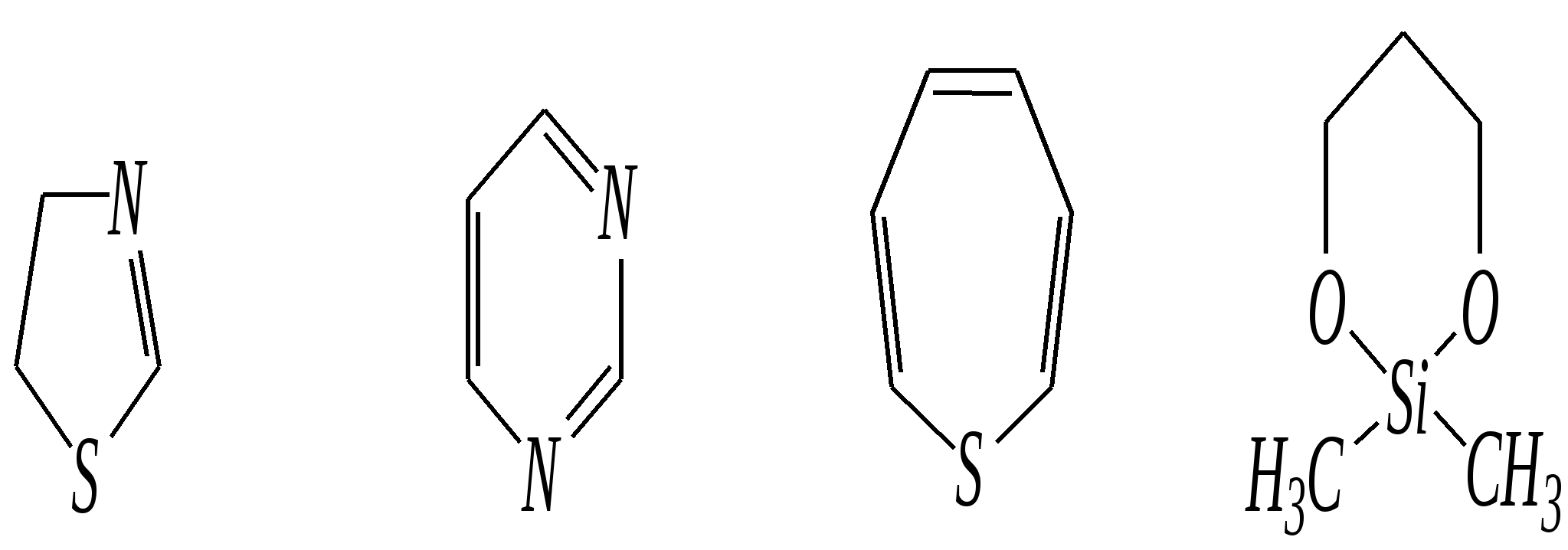 4,5-дигидро-1,3-тиазол 1,3-диазин тиепин 2,2-диметилпергидро- -1,3,2-диоксасилин Гетероциклы могут быть названы и по заменительной номенклатуре. При этом заменительные приставки окса-, тиа-, аза- и др. присоединяются к названию карбоциклического соединения, например:  1-азациклопропен-2 1-азациклобутадиен-1,3 1-тиациклопентадиен-2,4 Названия гетероциклических соединений с двумя и более конденсированными циклами строятся по следующим правилам. 1. Выбирают главный цикл. При этом старшинство циклических систем определяется по следующим критериям (в порядке убывания приоритета): а) при наличии карбоциклической и гетероциклической систем выбирается цикл, содержащий гетероатом; б) при наличии гетероциклов с разными гетероатомами выбирается цикл, содержащий наиболее электроотрицательный гетероатом; в) если циклы имеют разный размер, выбирается цикл большего размера; г) если гетероциклы содержат разное число гетероатомов, выбирается цикл, содержащий наибольшее число гетероатомов. 2. Для указания места сочленения циклов в главном цикле связи обозначают буквами a, b, c, d и т.д., начиная со связи гетероатом—углерод. В младшем цикле место сочленения циклов указывается с помощью цифровых локантов. Например: 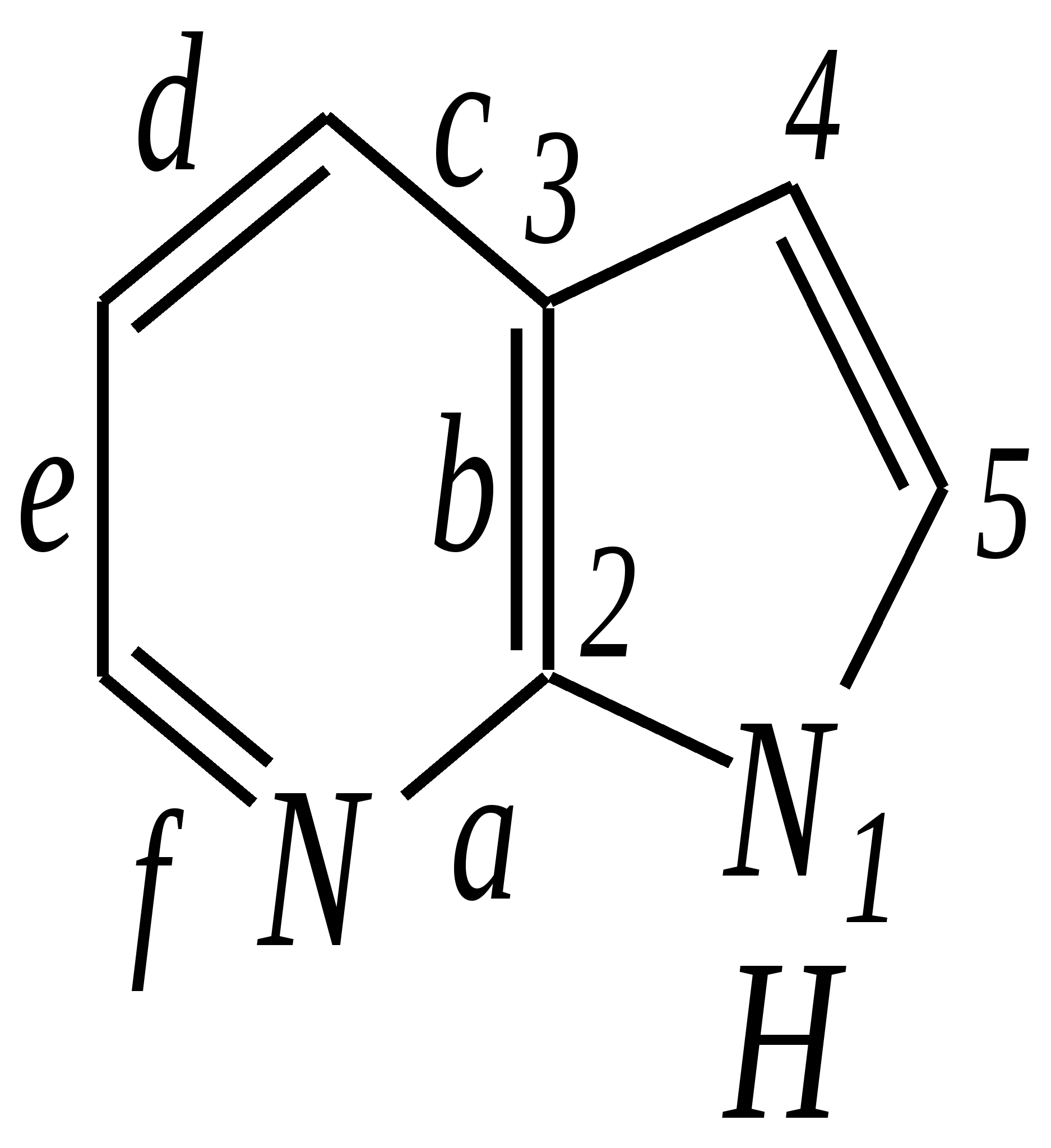 3. Название младшего цикла даётся приставкой бензо-, пирро-, имидазо- и др. по названию бензольного, пиррольного или имидазольного циклов соответственно. Примеры названий конденсированных систем (часто используются тривиальные названия циклов): 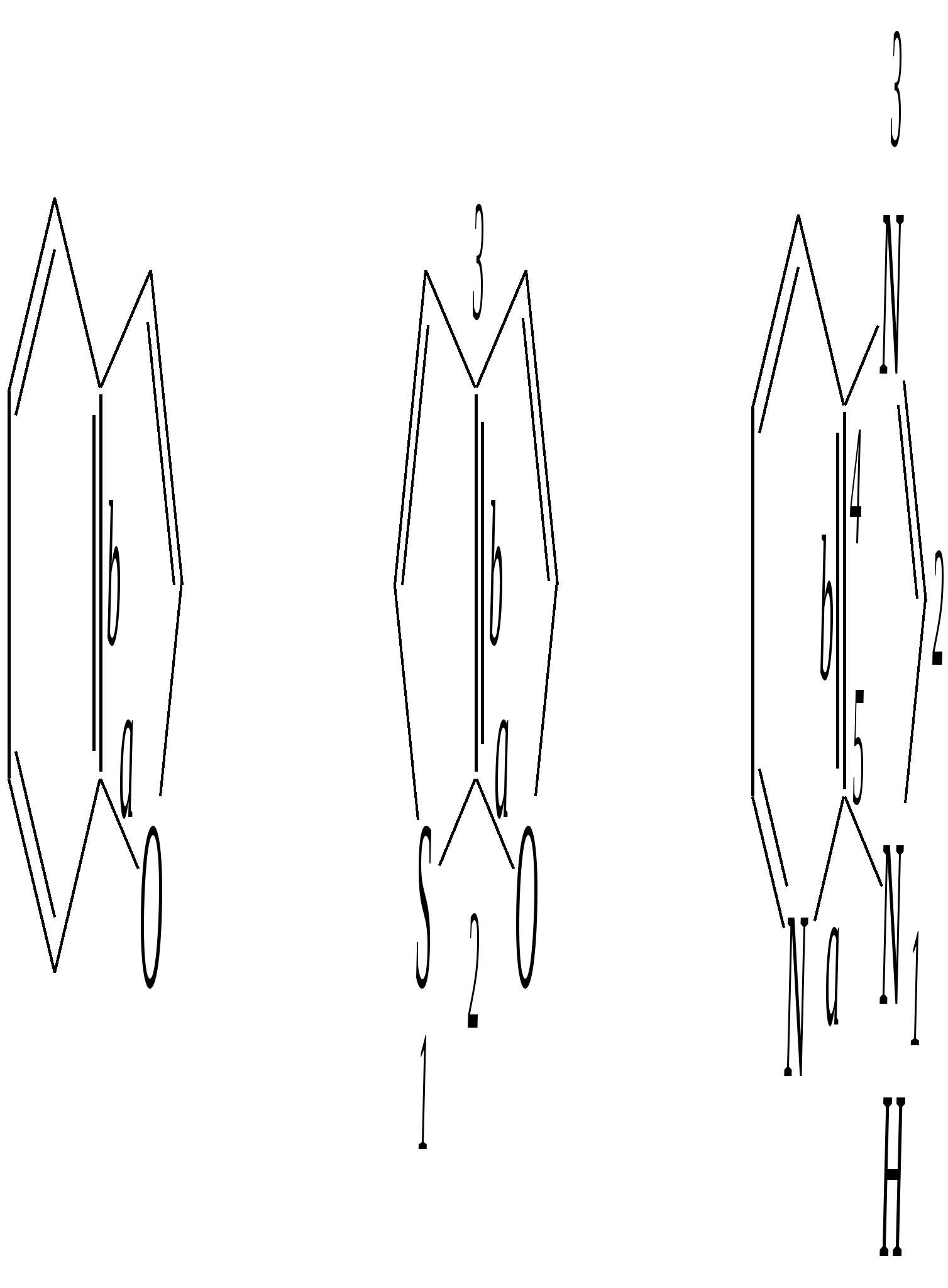 бензо[b]фуран тиено[2,3-b]фуран имидазо[4,5-b]пиридин 12.2. пятичленные гетероциклические соединения с одним гетероатомом Наиболее важны в практическом отношении такие пятичленные гетероциклы, как пиррол, фуран, тиофен и конденсированные системы на их основе: индол, кумарон и карбазол.  пиррол фуран тиофен  индол кумарон карбазол 12.2.1. номенклатура пиррола, фурана и тиофена и их производных Пиррол, фуран и тиофен могут иметь систематические названия по номенклатуре гетероциклов азол, оксол и тиол соответственно или по заменительной номенклатуре 1-азациклопентадиен-2,4, 1-оксациклопентадиен-2,4, 1-тиациклопентадиен-2,4 соответственно. Но систематические названия практически не используются. Положение заместителей указывается греческими буквами или цифровыми локантами:  Например:  2-бром-5-метилпиррол 2-фуранкарбальдегид 2,4-диметилтиофен -бром-’-метилпиррол -фуранкарбальдегид ,’-диметилтиофен фурфурол Радикалы, образованные от пиррола, фурана, тиофена и их производных, имеют следующие тривиальные названия:  -пиррил -пиррил -тиенил -тиенил  -фурил -фурил фурфурил 12.2.2. строение пиррола, фурана и тиофена Молекулы пиррола, фурана и тиофена содержат систему сопряжённых связей и атом с неподелённой электронной парой. В результате образуется циклическая сопряжённая система с шестью -электронами (четыре -электрона от двух двойных связей и два — от гетероатома). Поэтому можно считать, что эти соединения имеют ароматический характер. За счёт неподелённой электронной пары гетероатом в этом кольце является электронодонором, поэтому на углеродных атомах электронная плотность повышена (по сравнению с бензолом) и пятичленные гетероциклы в целом являются -избыточными ароматическими системами. Циклическую делокализацию неподелённой пары электронов гетероатома можно показать с помощью граничных структур:  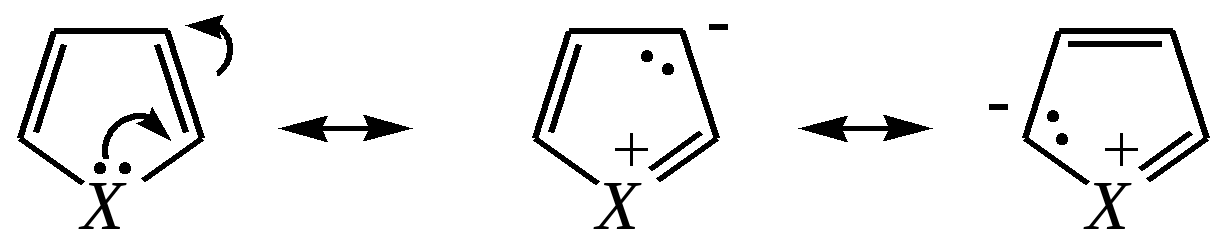 Квантово-химическими расчётами показано, что величина электронной плотности в -положении больше, чем в -положении. В пространстве молекула такого соединения представляет плоский пятиугольник, однако длины связей и валентные углы неодинаковы. Это связано с неравномерностью распределения -электронной плотности в кольце и зависит от природы гетероатома. Чем электроотрицательнее гетероатом, тем более неравномерно распределена электронная плотность и, следовательно, меньшей ароматичностью обладает система. Поэтому ряд уменьшения ароматичности (по сравнению с бензолом) можно показать следующим образом (в скобках приведена энергия делокализации ароматической системы в кДж/моль): бензол (151) > тиофен (122) > пиррол (90) > фуран (68). 12.2.3. физические и химические свойства пиррола, фурана и тиофена Пиррол, фуран и тиофен являются бесцветными жидкостями с приятным запахом, практически нерастворимы в воде. Химические свойства пятичленных гетероциклических соединений определяются как наличием ароматического цикла, так и наличием гетероатома. 12.2.3.1. Кислотно-оснόвные свойства Пиррол, фуран и тиофен взаимодействуют с сильными кислотами. В случае пиррола, фурана и их алкилпроизводных обычно происходит «осмоление» (олигомеризация и полимеризация), тиофеновое кольцо к разрушению под действием холодных кислот устойчиво. Данное свойство пиррола, фурана и отчасти тиофена и их производных называется ацидофобностью. Ацидофобность связана с присоединением протона в большинстве случаев к -углеродному атому, разрушением ароматической системы и дальнейшим превращением активной диеновой системы: 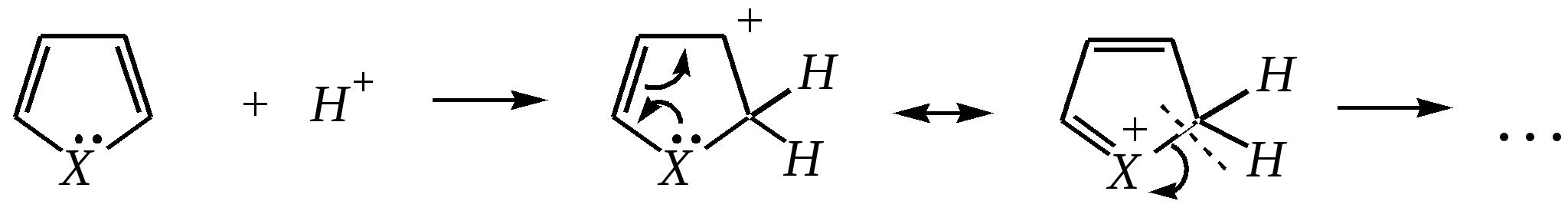 Наибольшей основностью обладает пиррол, он легче всего протонируется. Самым слабым основанием из рассматриваемых гетероциклов является тиофен, он наиболее трудно протонируется, поэтому он наименее ацидофобен. Введение в молекулу электроноакцепторных заместителей уменьшает электронную плотность на ароматическом кольце и тем самым снижает ацидофобность. При наличии сильных электроноакцепторов в гетероциклическом кольце соединение может и вовсе быть устойчиво к действию кислот, как, например, молекула пирослизевой кислоты: 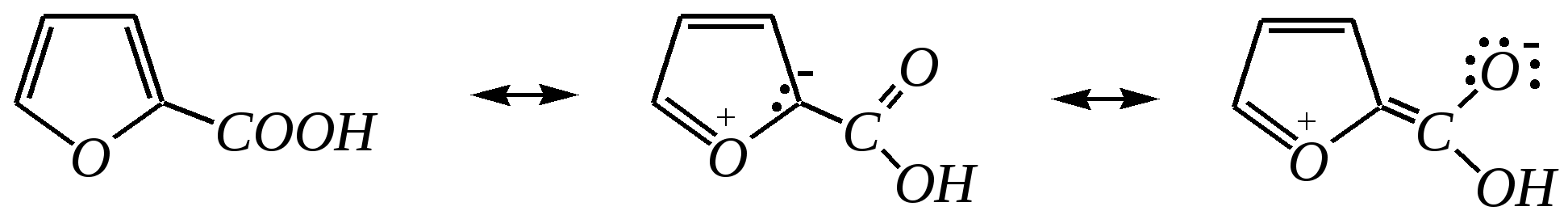 пирослизевая кислота К действию оснований фуран и тиофен устойчивы, так как не содержат подвижных атомов водорода, а пиррол является слабой NH-кислотой (рКа = 17.5) и при сплавлении со щелочами образует соли:  пиррил-калий По кислотности пиррол сравним со спиртами, и поэтому для получения его солей могут использоваться также алкоголяты или металлорганические соединения, как, например, при взаимодействии с реактивом Гриньяра: 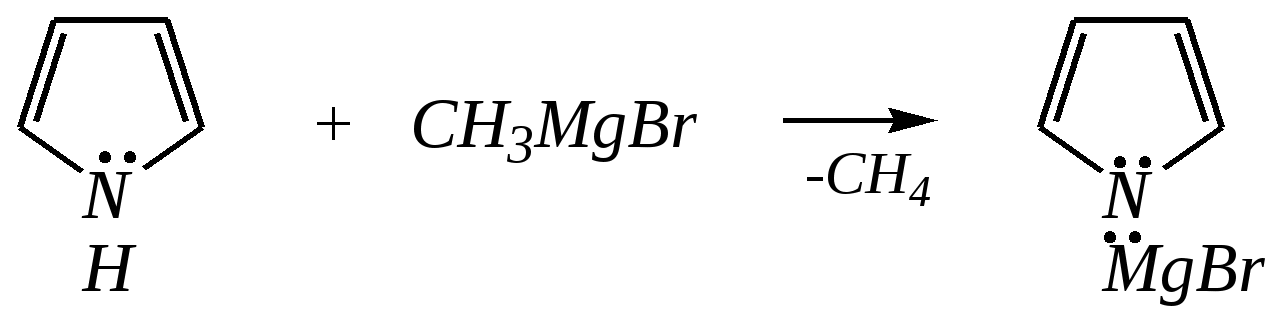 бромид N-пиррилмагния Соли пиррола используются для алкилирования (и ацилирования) молекулы пиррола соответствующими алкилгалогенидами (или ацилгалогенидами). Реакция протекает по азоту или по -углеродному атому: 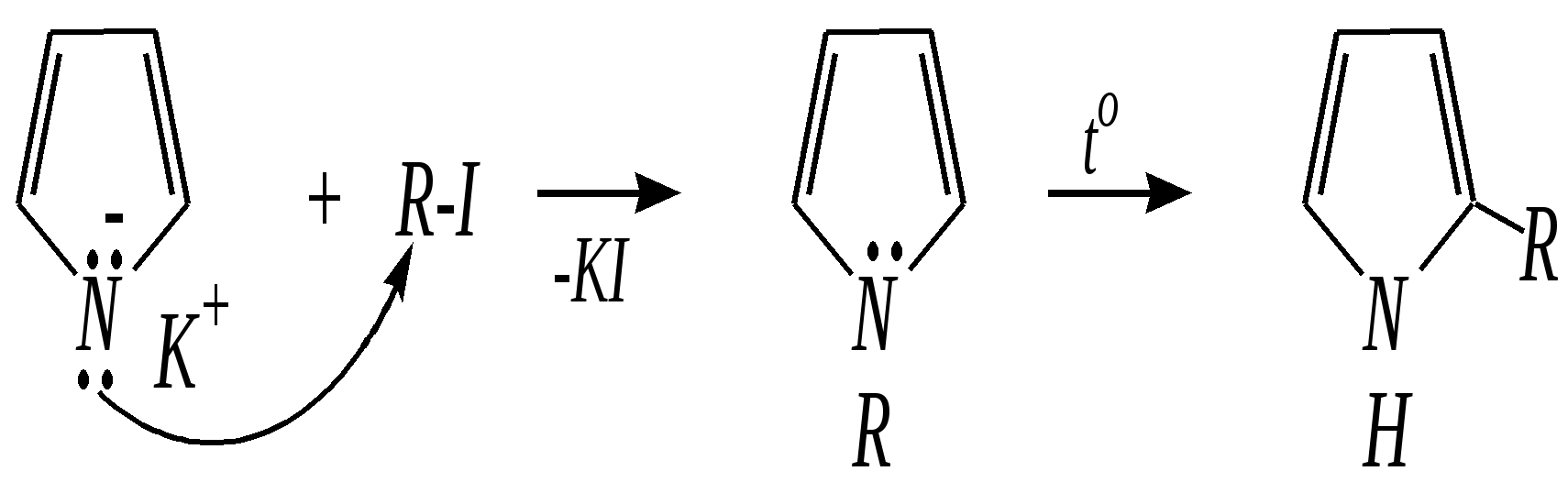 12.2.3.2. Реакции электрофильного замещения В общем случае электрофильное замещение для пиррола, фурана и тиофена протекает легче, чем для бензола в связи с большей величиной -электронной плотности в молекуле гетероциклов. При этом на атомах углерода в наибольшей степени повышена электронная плотность в кольце пиррола по причине большего +М-эффекта атома азота по сравнению с другими гетероатомами. Поэтому реакционная способность по отношению к электрофилам будет увеличиваться в ряду: бензол < тиофен < фуран < пиррол. Электрофильное замещение в пирроле, фуране и тиофене протекает селективно в -положение, но когда оно занято, то реакция идёт по -углеродному атому. Направление реакции в -положение объясняется сравнением устойчивости образующихся -комплексов (и подтверждается квантово-химическими расчётами):  Влияние заместителей в гетероциклическом кольце на направление электрофильного замещения проявляется только в том случае, если оба -положения заняты, либо оба -положения свободны, а заместитель находится в -положении. В этих случаях электрофильная атака протекает в соответствии с влиянием заместителей на распределение электронной плотности в данном ароматическом кольце. Например:  Для нитрования пиррола, фурана и тиофена азотная кислота не используется по причине ацидофобности этих соединений. Нитрование фурана и тиофена проводят ацетилнитратом CH3COONO2, для чего используют раствор азотной кислоты в уксусном ангидриде:  , ,хотя возможно использование и других смешанных ангидридов или эфиров азотной кислоты. При этом фуран первоначально образует продукт присоединения ввиду своего выраженного диенового характера, а затем отщепляет молекулу уксусной кислоты (обычно под действием органического основания) и превращается в продукт замещения: 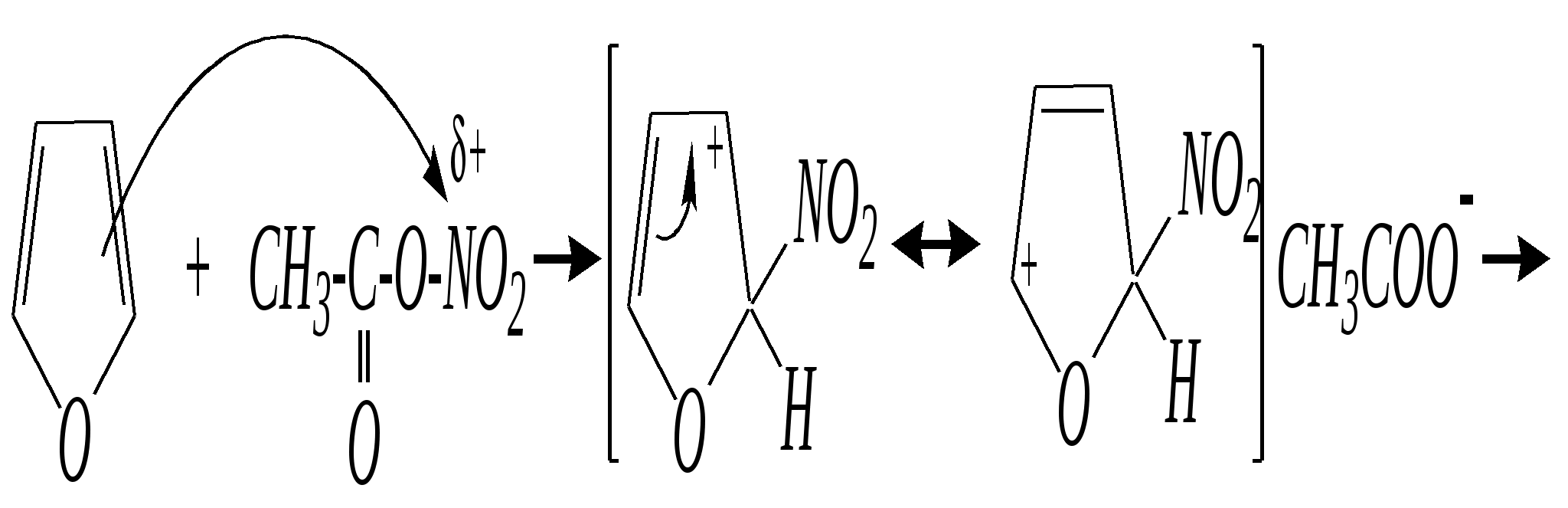 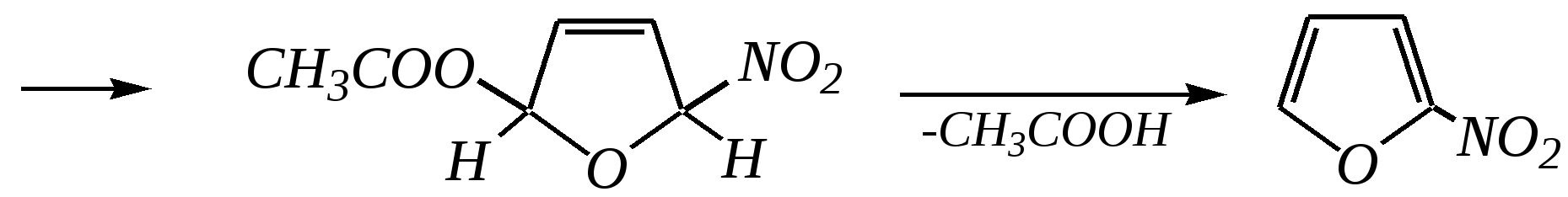 2-нитрофуран -Нитропиррол в отличие от нитропроизводных фурана и тиофена получают через соли пиррола. Например, при использовании этилнитрата:  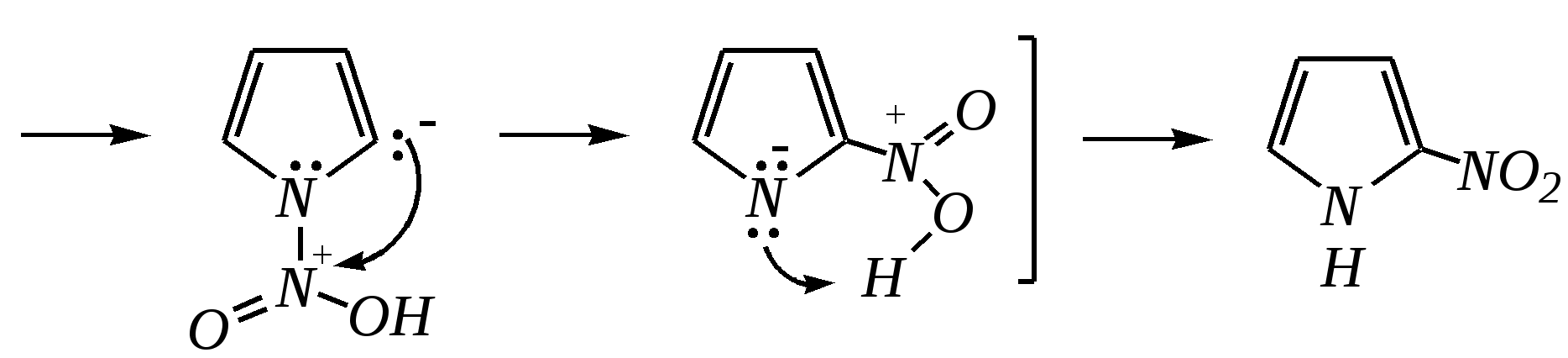 2-нитропиррол Сульфировать серной кислотой можно только тиофен: 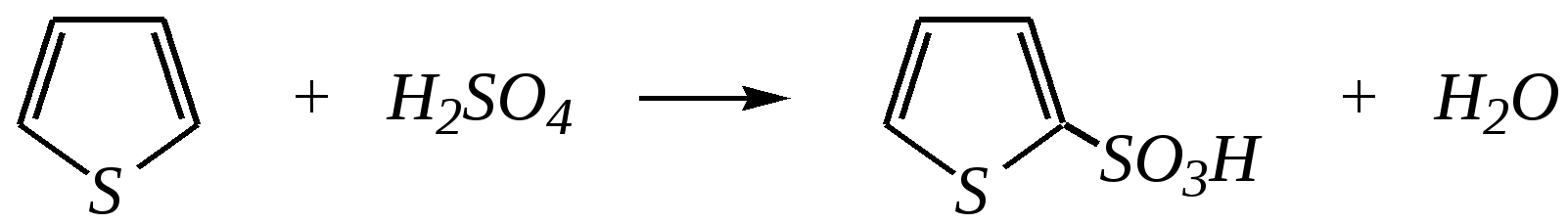 тиофен-2-сульфокислота (Механизм сульфирования здесь такой же, как и механизм взаимодействия с холодной концентрированной серной кислотой бензола и его производных.) Для сульфирования пиррола и фурана по причине их ацидофобности используют комплексы триоксида серы с электронодонорами, обычно пиридинсульфотриоксид или диоксансульфотриоксид: 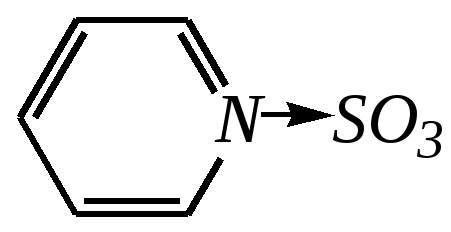  пиридинсульфотриоксид диоксансульфотриоксид Механизм сульфирования такими комплексами аналогичен механизму сульфирования триоксидом серы: 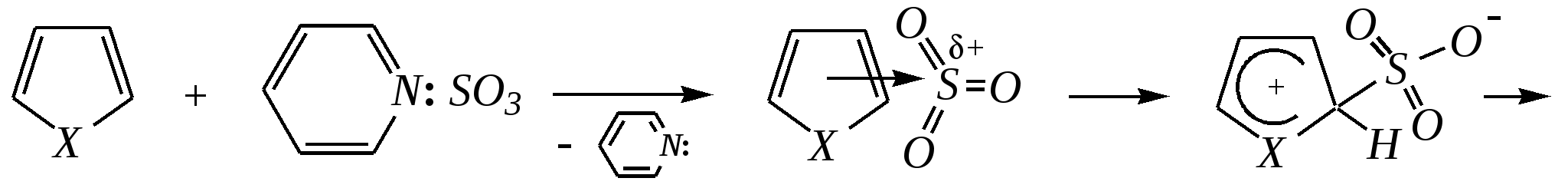 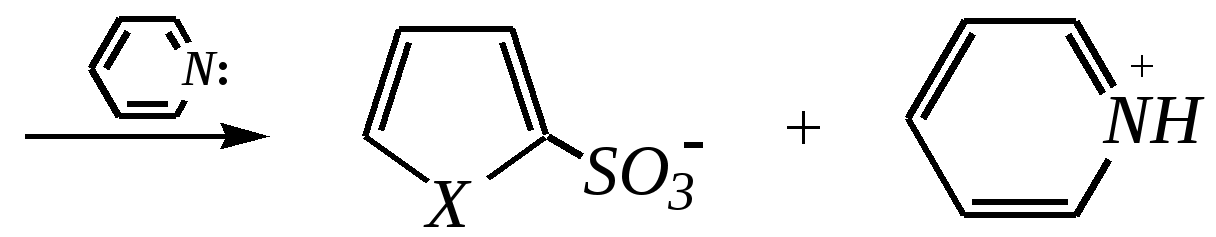 Пиридин (или диоксан) в качестве донора электронной пары необходим для связывания отщепляющегося протона. Галогенирование (хлорирование, бромирование, йодирование) пиррола и тиофена протекает настолько легко, что если специальным образом не контролировать течение реакции, образуются тетрагалогенопроизводные. Так, например, бромирование пиррола раствором брома в этаноле при 273 К даёт тетрабромпиррол: 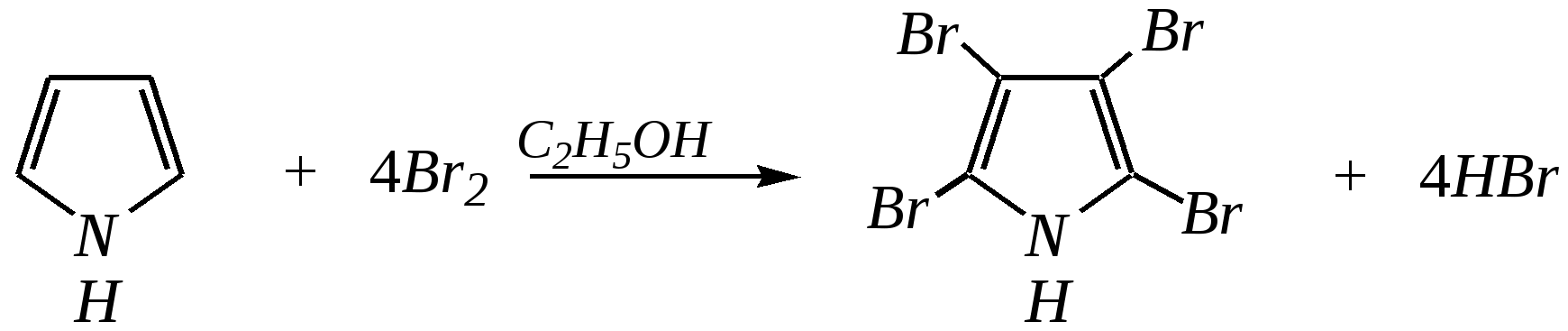 Получение монобромпиррола (-изомер) представляет определённую трудность, и необходимо специальным образом контролировать течение реакции или использовать специальные бромирующие агенты. Для получения монобромтиофена применяют достаточно низкие температуры (248—268 К). Для хлорирования используют сульфурилхлорид SO2Cl2или тетрахлорид олова SnCl4. Йодирование осуществляется молекулярным йодом (или KI + H2O2) в присутствии кислотного катализатора. Галогенирование фурана протекает через реакцию присоединения (с последующим отщеплением галогеноводорода) — в этом проявляется диеновый характер этого гетероцикла. Здесь возможно хлорирование (газообразным хлором) или бромирование с образованием полигалогенопроизводных, но не йодирование. Фуран не реагирует с йодом. Ацилирование пиррола, фурана и тиофена осуществляют ангидридами (реже галогенангидридами) карбоновых кислот. Алкилирование фурана и пиррола не проводят, так как вероятные продукты этой реакции ещё более ацидофобны и полимеризуются за счёт выделяющегося галогеноводорода. Высокая активность пиррола иллюстрируется его способностью реагировать со слабыми электрофилами, например с солями арендиазония, диоксидом углерода, альдегидами. Скорость азосочетания сильно зависит от рН среды. При значениях рН ниже 8 в реакцию сочетания с катионом бензолдиазония вступает нейтральная молекула пиррола, а при значениях рН раствора выше 10 в реакции участвует пиррил-анион, и она в этом случае протекает в 108 раз быстрее. В более щелочных условиях происходит образование 2,5-бис-диазопроизводных.   Взаимодействие пиррил-калия с диоксидом углерода протекает по механизму, аналогичному реакции Кольбе–Шмитта (гл. 10.5.3.3), с образованием пиррол-2-карбоновой кислоты. 12.2.3.3. Реакции присоединения В этих реакциях проявляется диеновый характер гетероциклов. Поэтому такие реакции наиболее характерны для фурана. Примерами могут быть присоединение водорода, галогенов и реакция диенового синтеза. Водород присоединяется в присутствии катализаторов (Ni,Pd,Pt) при нагревании и под давлением. Из пиррола, фурана и тиофена образуются соответствующие тетрагидропроизводные — пирролидин, тетрагидрофуран и тиофан:  (X = NR, O, S) Труднее всех гидрируется тиофен и его производные, а легче — фуран. Присоединение галогенов наиболее характерно для фурана, причём продукт присоединения может отщеплять молекулу галогеноводорода, давая продукт формального замещения, например:  2,5-дибром-2,5-дигидрофуран 2-бромфуран Реакции диенового синтеза характерны, главным образом, для фурана. Это, например, взаимодействие с малеиновым ангидридом: 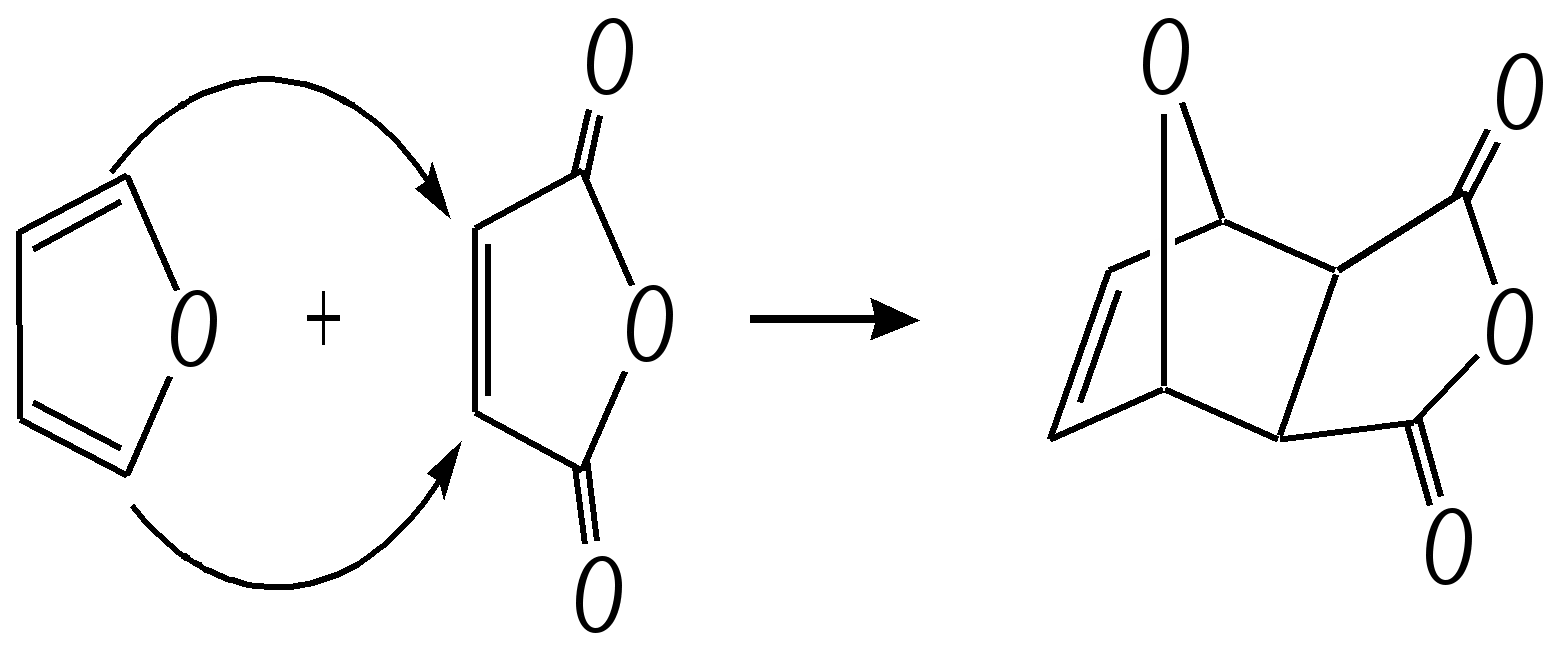 Тиофен с малеиновым ангидридом не реагирует, но он может быть введён в реакцию Дильса–Альдера при использовании очень реакционноспособных алкинов, например дицианоацетилена; но продукт присоединения легко теряет атом серы и превращается во фталодинитрил: 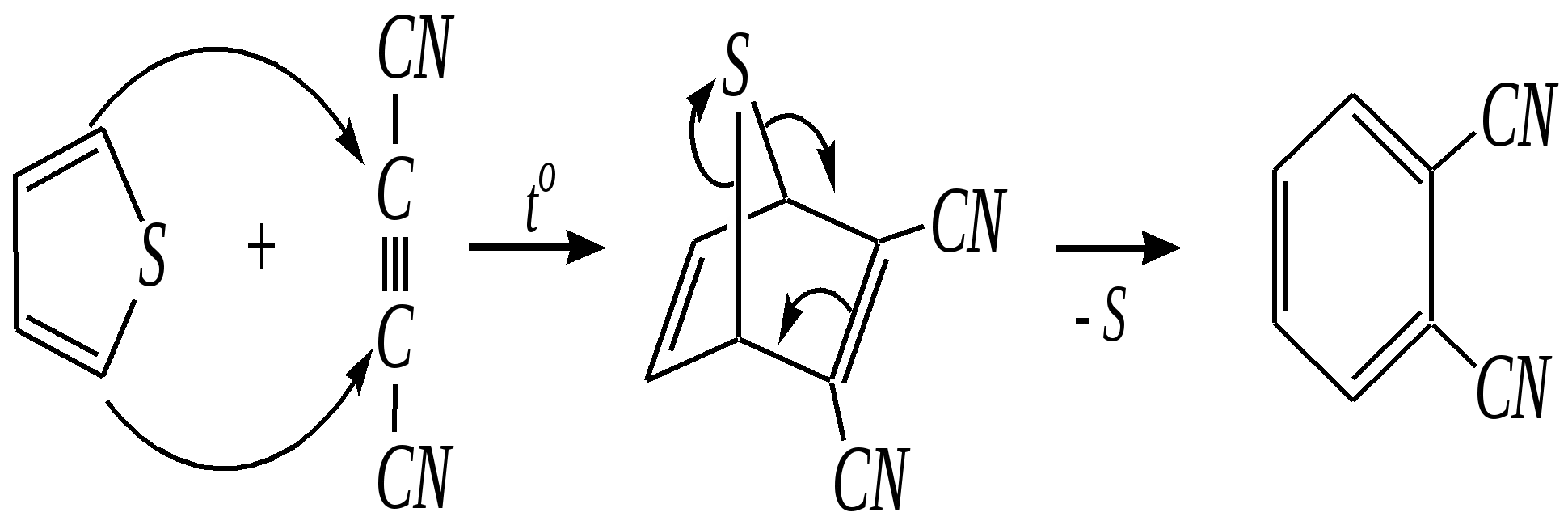 Пиррол взаимодействует с малеиновым ангидридом как с электрофилом: 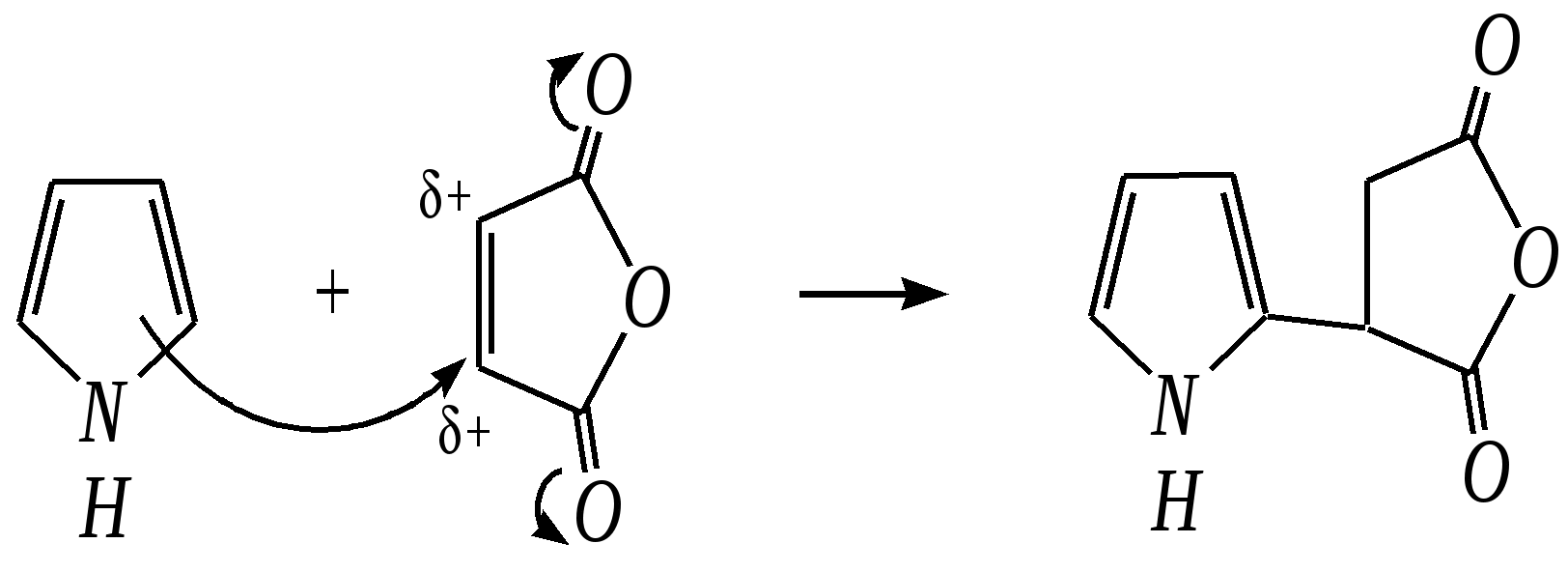 12.2.3.4. Реакции замены гетероатома Эти реакции представляют взаимное превращение пиррола, фурана и тиофена: 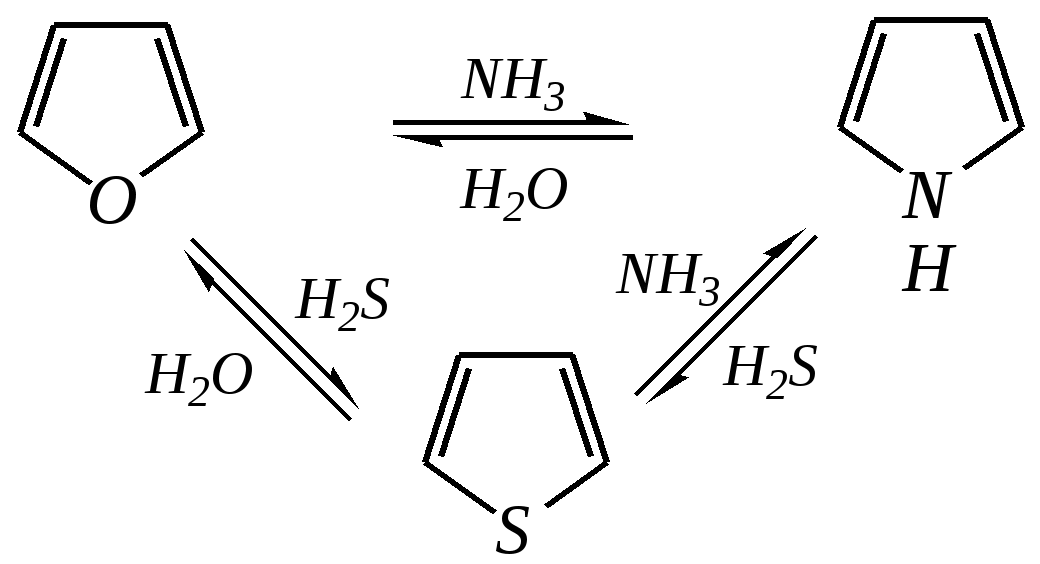 Они были открыты в 1936 году Ю.К. Юрьевым и называются также синтезом Юрьева или циклом Юрьева. Реакции осуществляются при температуре 670—770 К в присутствии катализатора Al2O3. Практическое значение имеют только превращения фурана в пиррол и тиофен: 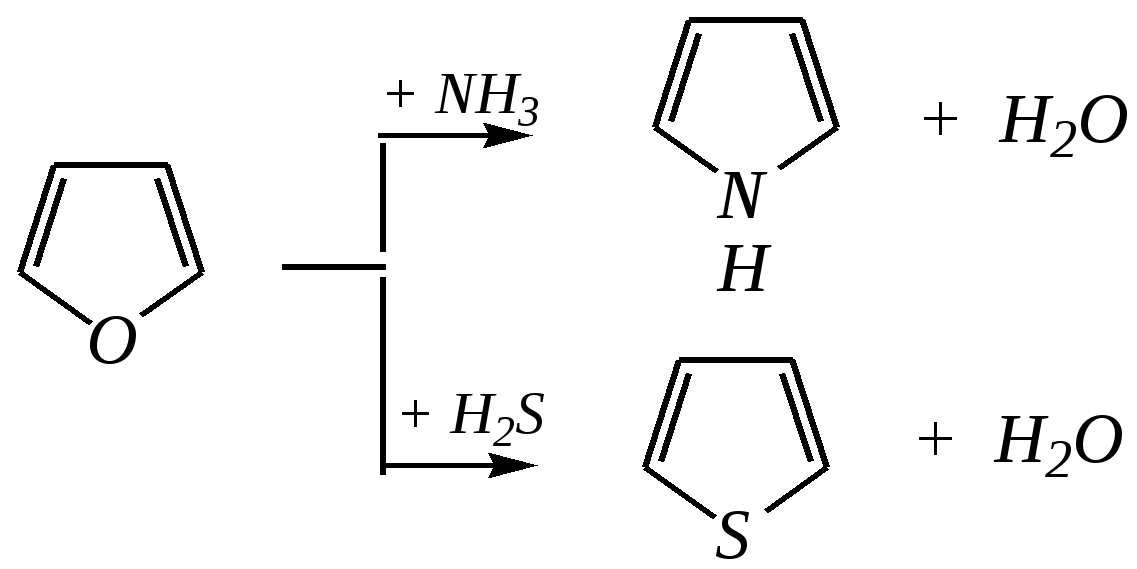 В остальных четырёх реакциях (с участием пиррола и тиофена) выход продуктов не превышает 2%. Причиной предпочтительного участия фурана во взаимопревращениях в другие гетероциклы можно считать его меньшую ароматичность, а также наибольшую жёсткость атома кислорода как оснόвного центра (по Р. Пирсону) в сравнении с азотом и серой в пирроле и тиофене. Тогда механизм превращения фурана, например в тиофен, можно представить в следующем виде: 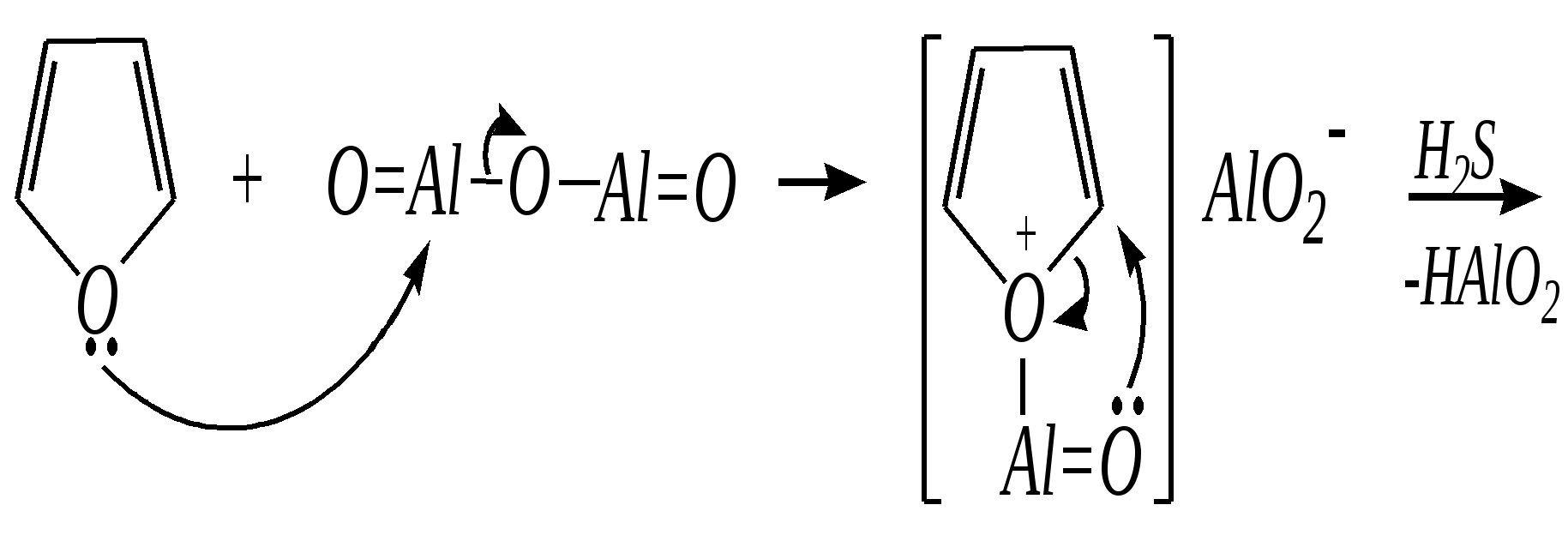  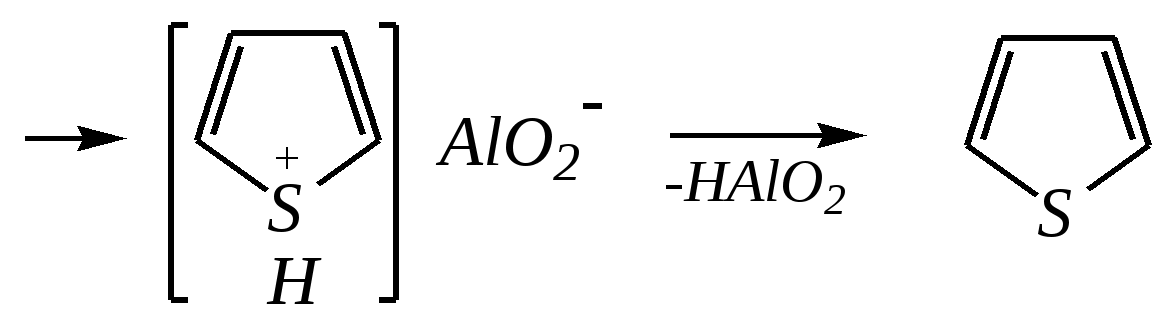 (2 HAlO2 Al2O3 + H2O) |
