глава 12. Гетероциклические соединения
 Скачать 2.57 Mb. Скачать 2.57 Mb.
|
Реакция аналогична получению бензола, протекает при высоких температурах, но представляет только теоретический интерес.
Первоначально из глицерина под действием серной кислоты образуется акролеин, который затем взаимодействует с ариламином: 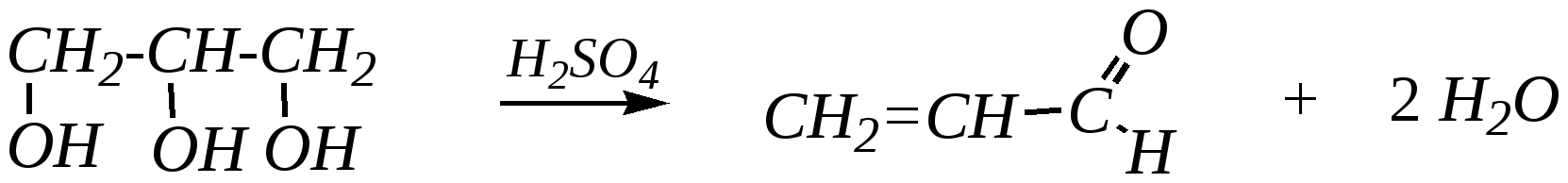 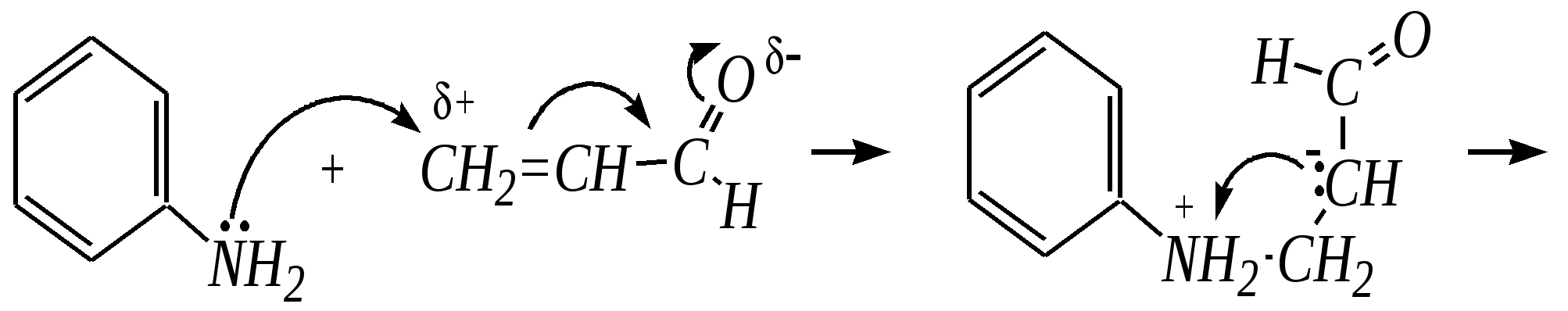 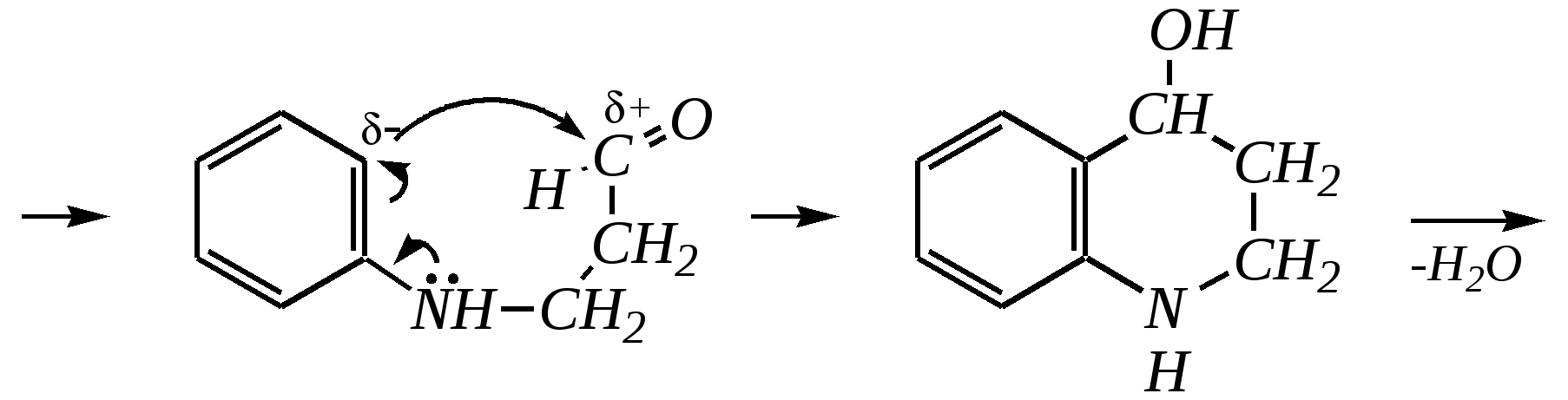 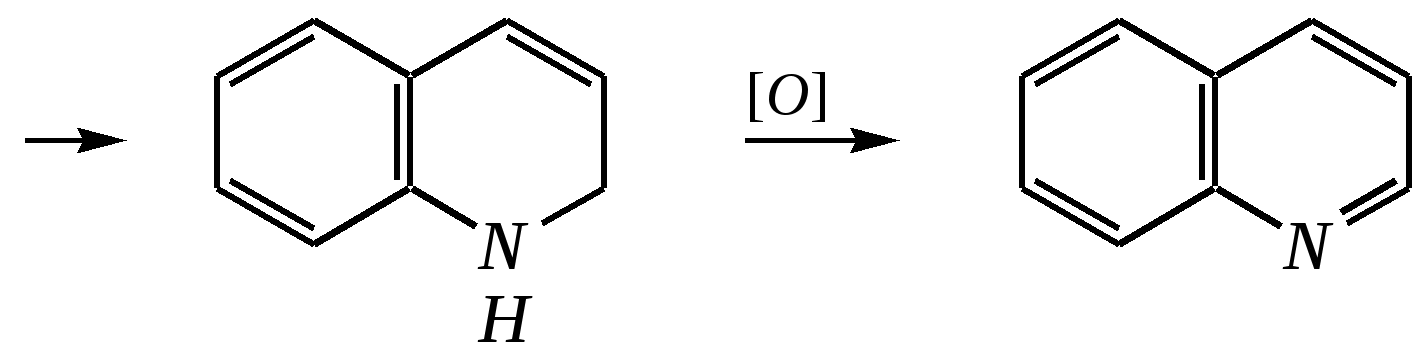
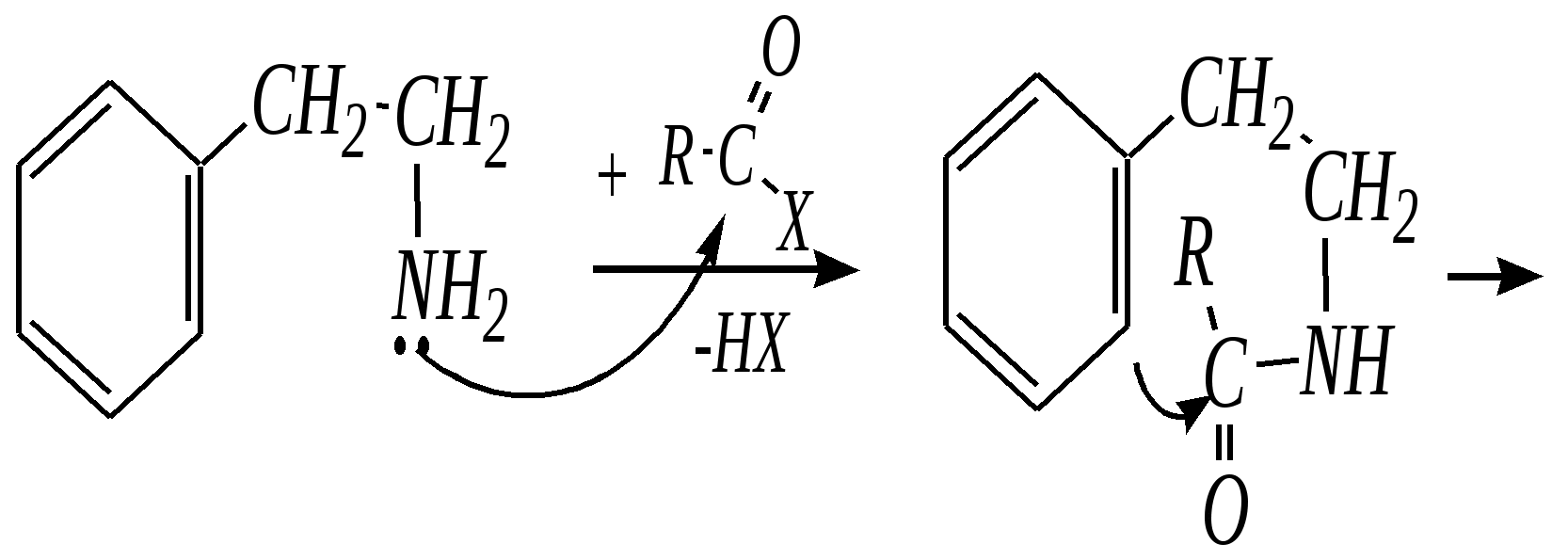 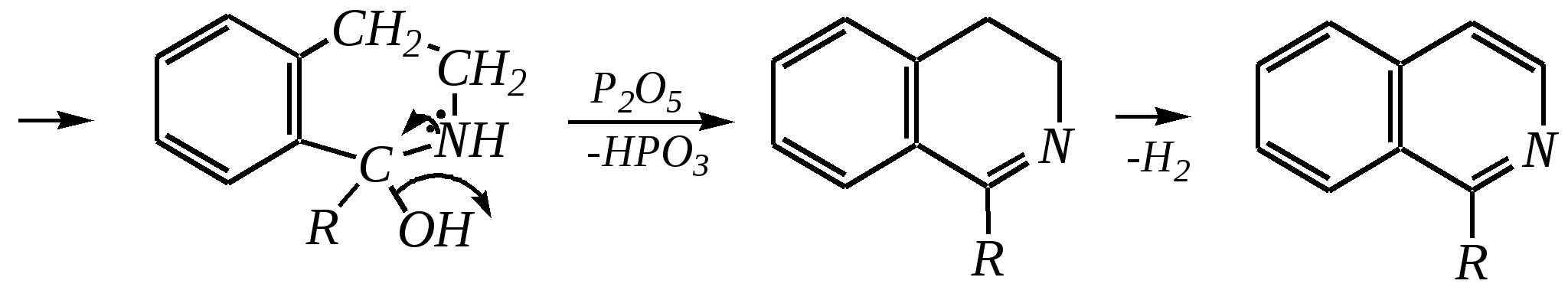
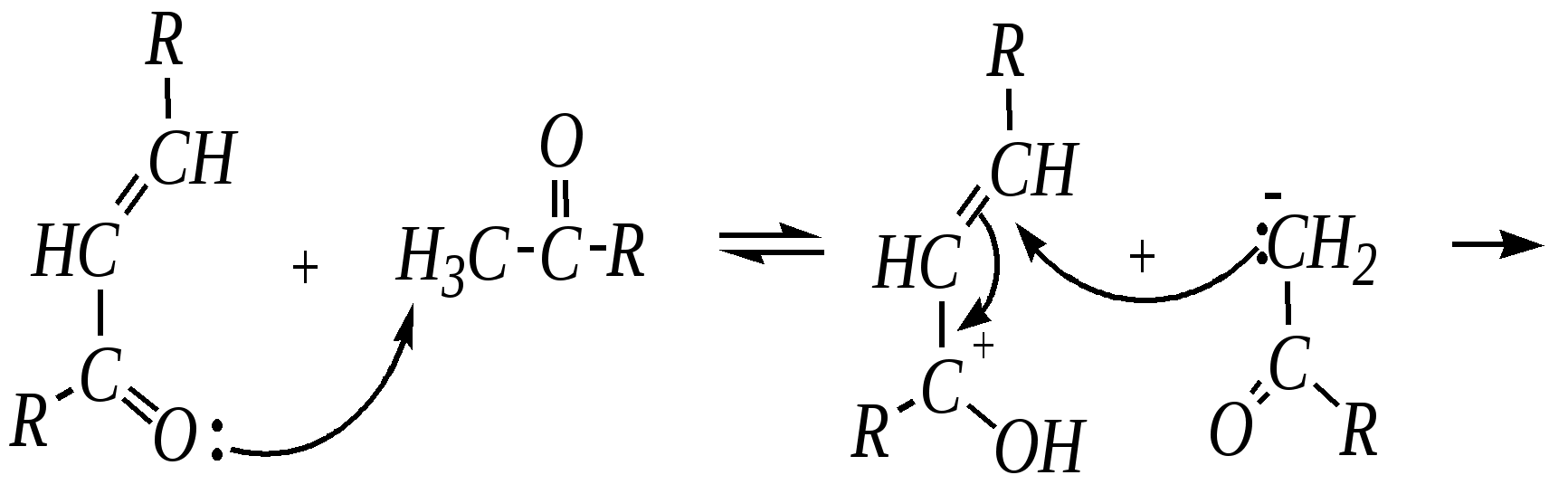 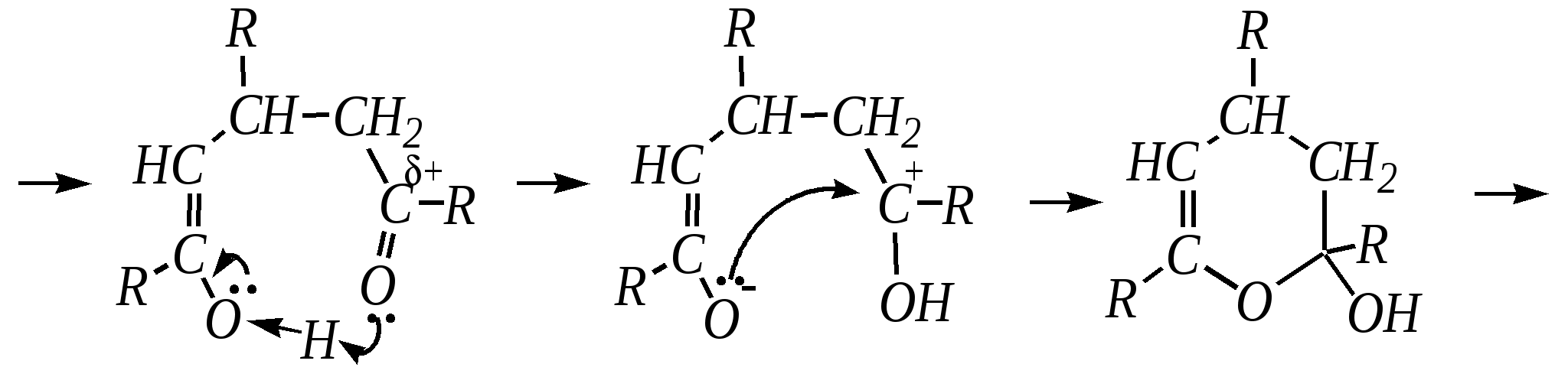 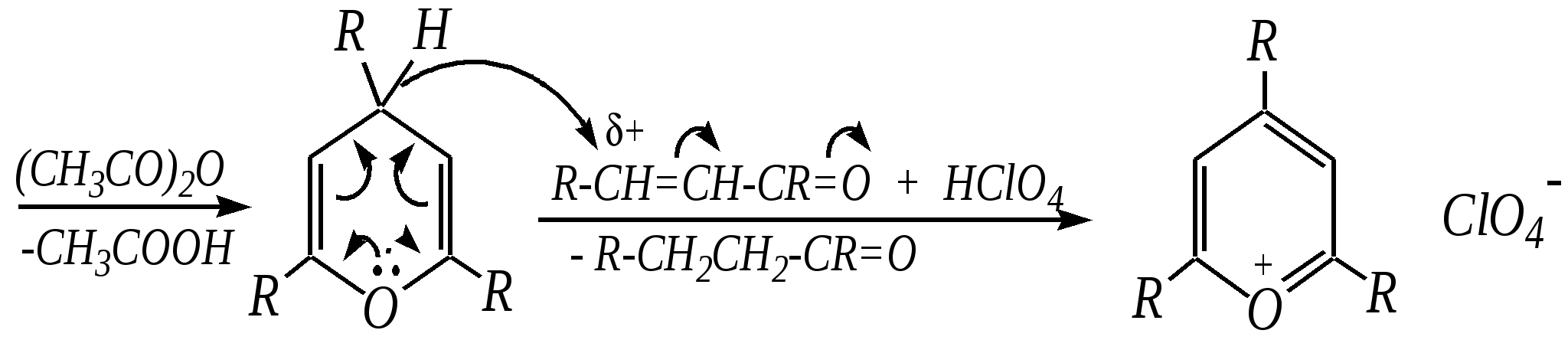 12.4.8. важнейшие представители и медико-биологическое значение Пиридин — бесцветная жидкость с неприятным запахом, температурой кипения 389 К. Растворим в воде, ядовит. Получают пиридин при коксовании каменного угля. Пиколины — бесцветные жидкости с неприятным запахом, температурами кипения 403 К, 417 К и 418 К (для -, - и -изомеров соответственно). Хорошо растворимы в воде. Пиколины получают из каменноугольной смолы. Пиридинкарбоновые кислоты представляют собой бесцветные кристаллические вещества, растворимые в воде. Их получают окислением производных пиридина (главным образом, пиколинов). Никотиновая (-пиридинкарбоновая) кислота является провитамином РР, а её амид — витамином РР. Недостаток этого витамина вызывает заболевание кожи, называемое пеллагрой. 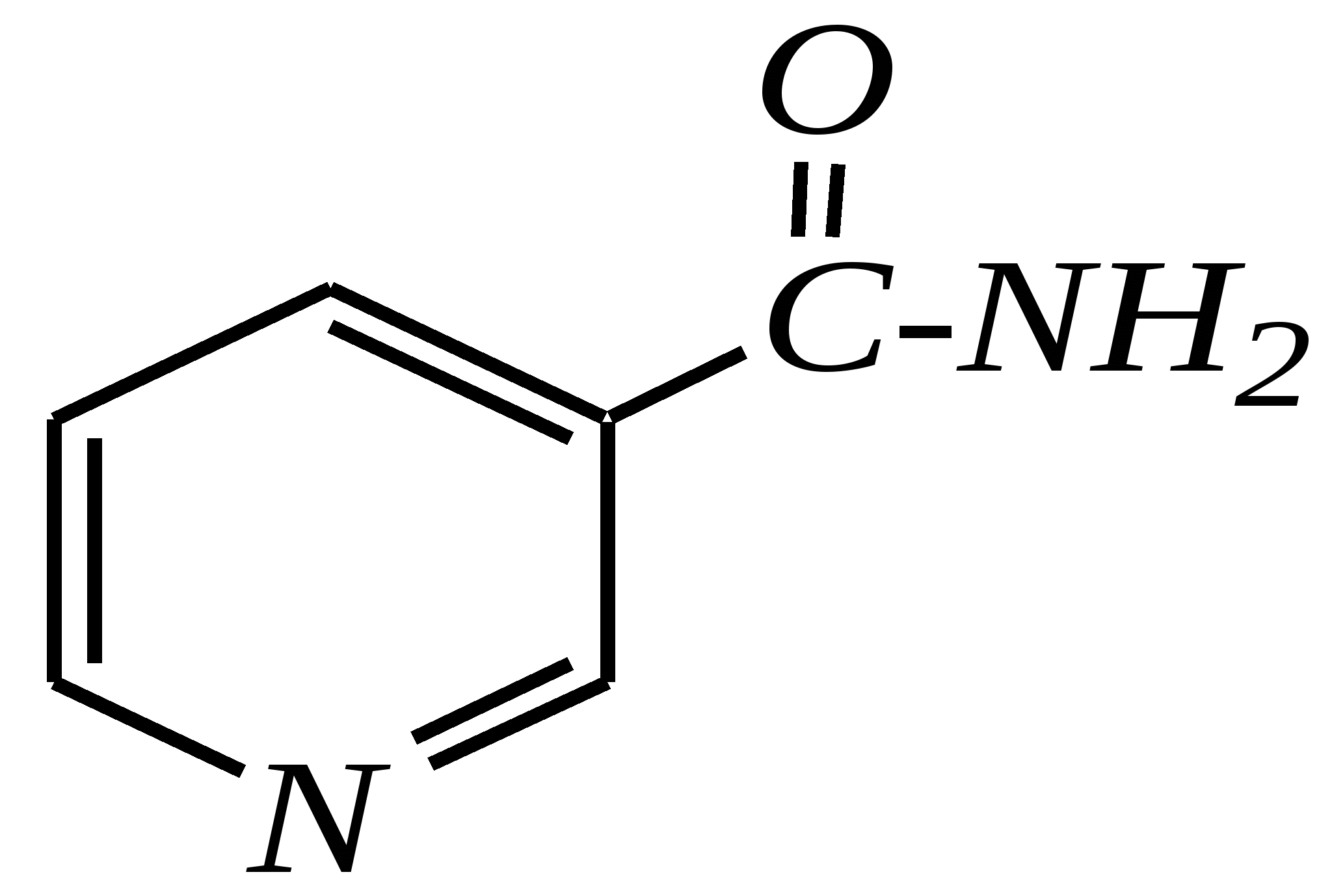 никотинамид (витамин РР) Гидразид изоникотиновой кислоты (изониазид) является структурной основой противотуберкулёзных препаратов. Его производные используются при лечении туберкулёза. 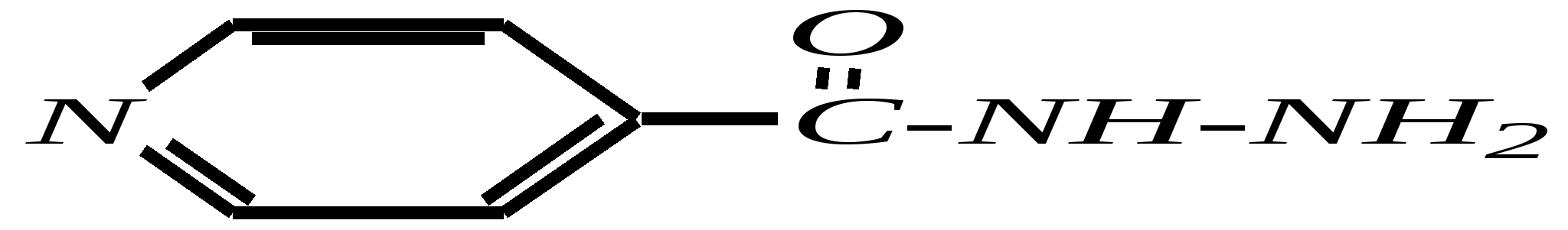 изониазид Пиридоксин (витамин В6) — бесцветное кристаллическое вещество, хорошо растворимое в воде. Содержится в различных природных продуктах (дрожжах, бобах, печени). В организме превращается в пиридоксаль-5-фосфат, участвующий в метаболизме аминокислот.
витамин В6 Хинолин — бесцветная жидкость с температурой кипения 510 К и неприятным запахом. Получают хинолин при переработке каменноугольной смолы. Используют в качестве растворителя и исходного вещества для получения аналитических реагентов и лекарственных веществ. Хинальдин (2-метилхинолин) — бесцветная жидкость с температурой кипения 520 К и запахом хинолина. Получают из каменноугольной смолы. Используют для синтеза красителей. Изохинолин — бесцветное вещество с температурой плавления 297.5 К, кипения 515 К. Получают из каменноугольной смолы. Антоцианидины— гидроксипроизводные солей замещённого бензо[b]пирилия.
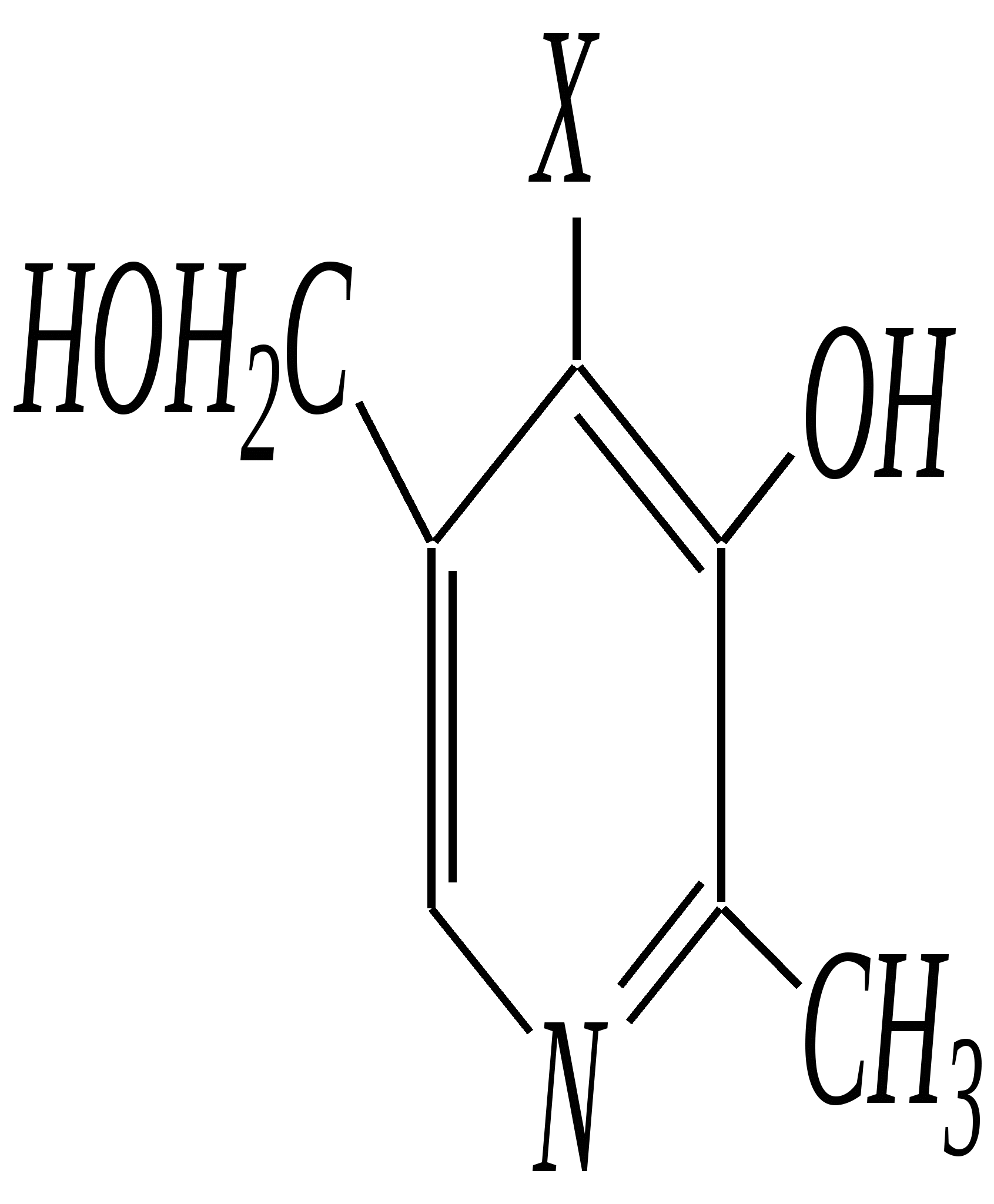
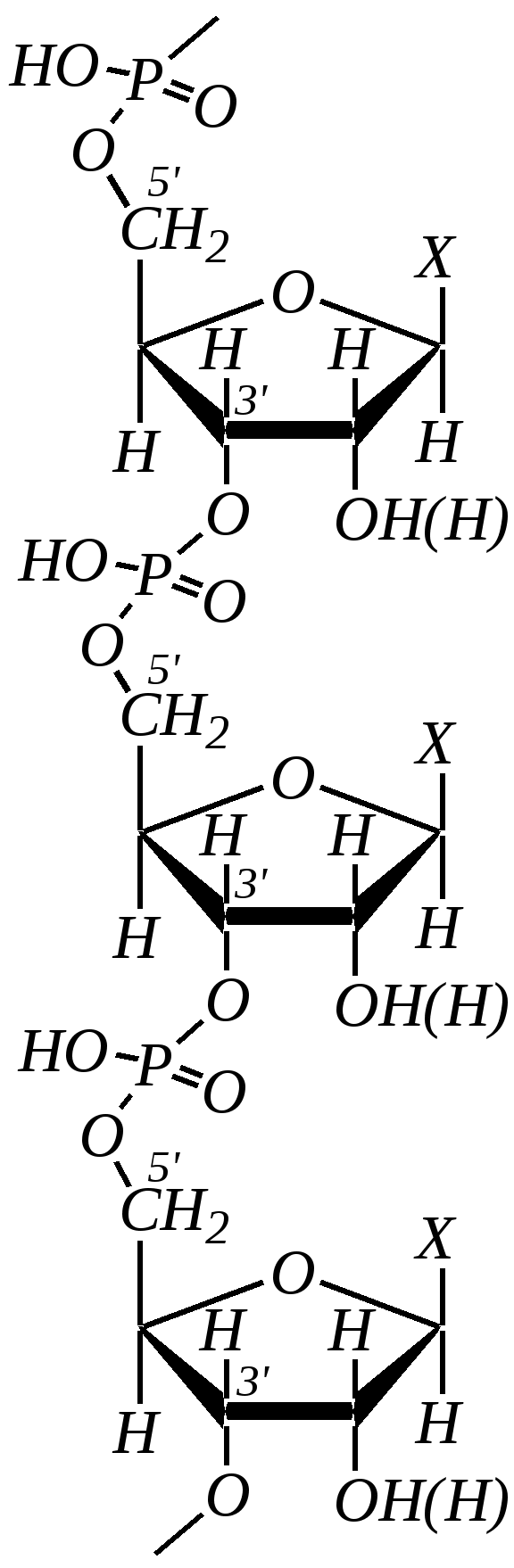
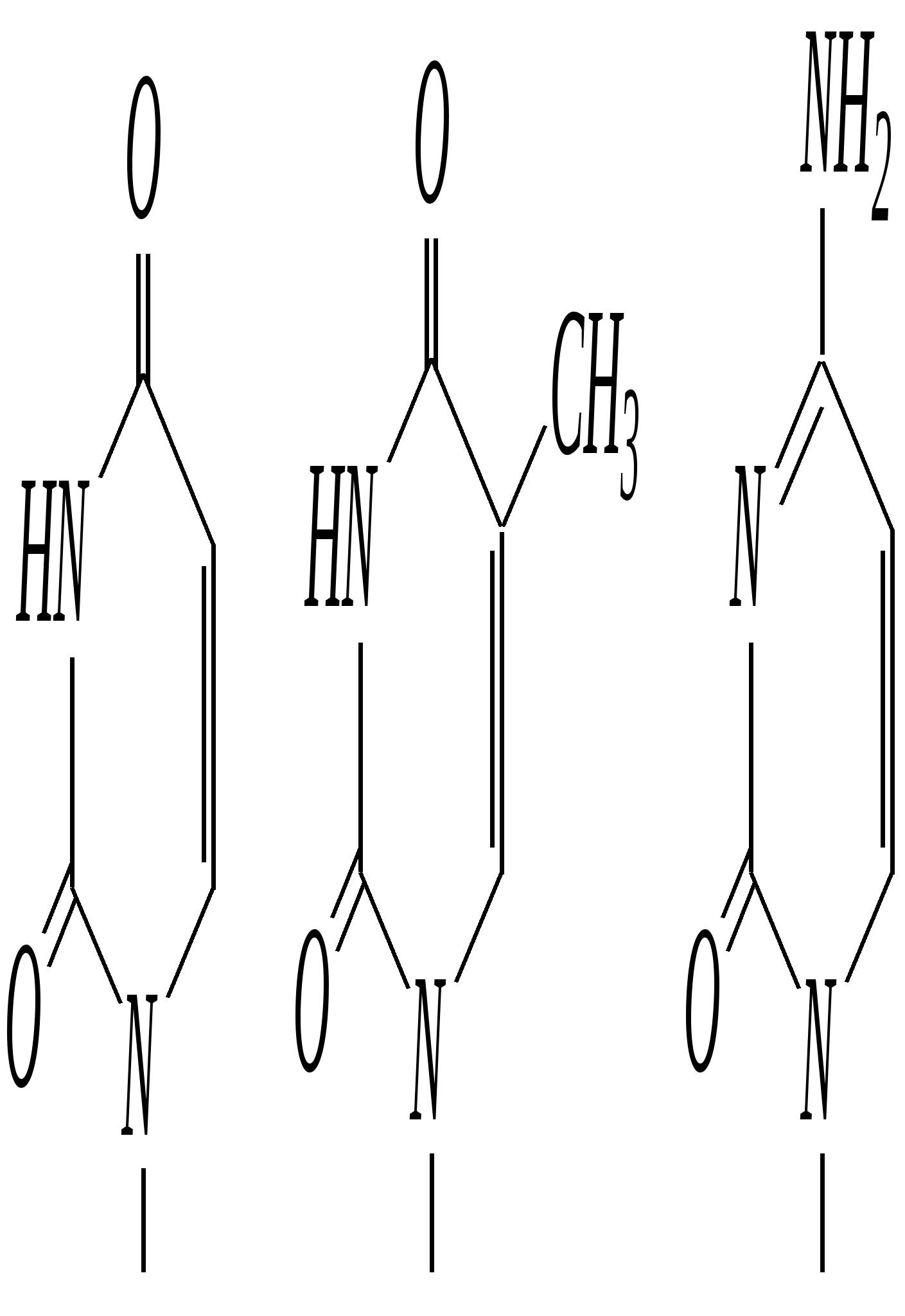
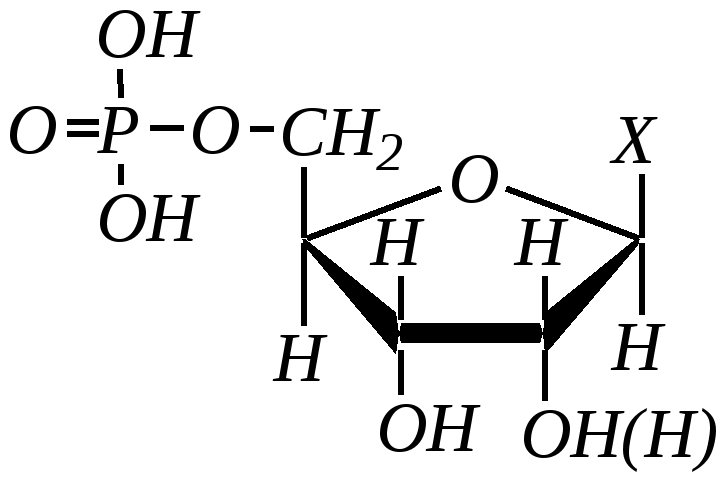
Антоцианидины являются основой пигментов цветов, ягод, овощей, в состав которых они входят в виде гликозидов моносахаридов, называемых антоцианами. 12.5. шестичленные гетероциклические соединения с двумя гетероатомами Из шестичленных гетероциклических соединений с двумя гетероатомами наиболее важны в практическом отношении производные пиримидина и конденсированные системы на его основе (в частности, пурин). Однако находят применение и встречаются в составе природных соединений и другие гетероциклы с двумя атомами азота, двумя атомами кислорода и пр. Примеры: 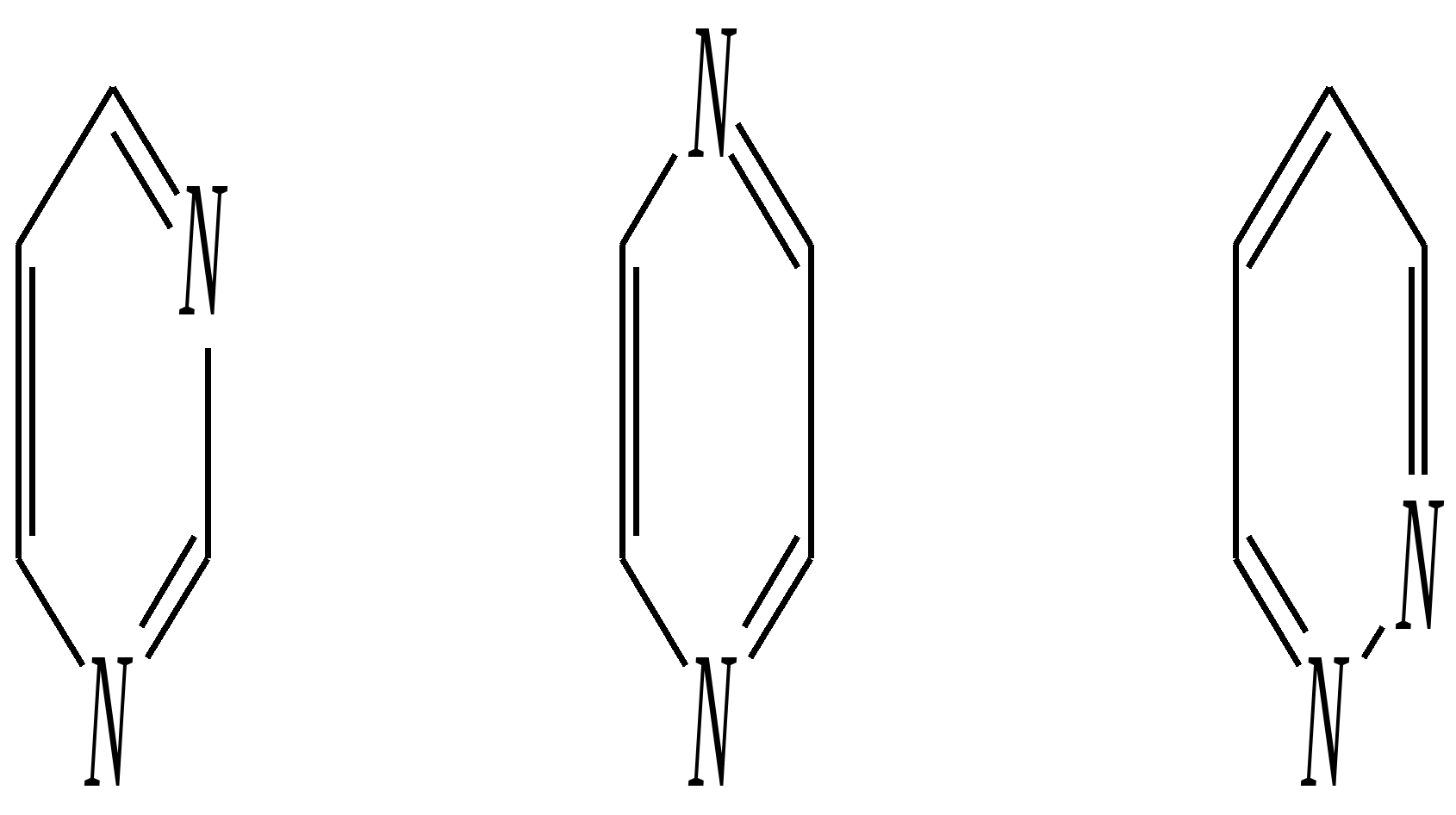 пиримидин пиразин пиридазин (1,3-диазин) (1,4-диазин) (1,2-диазин) 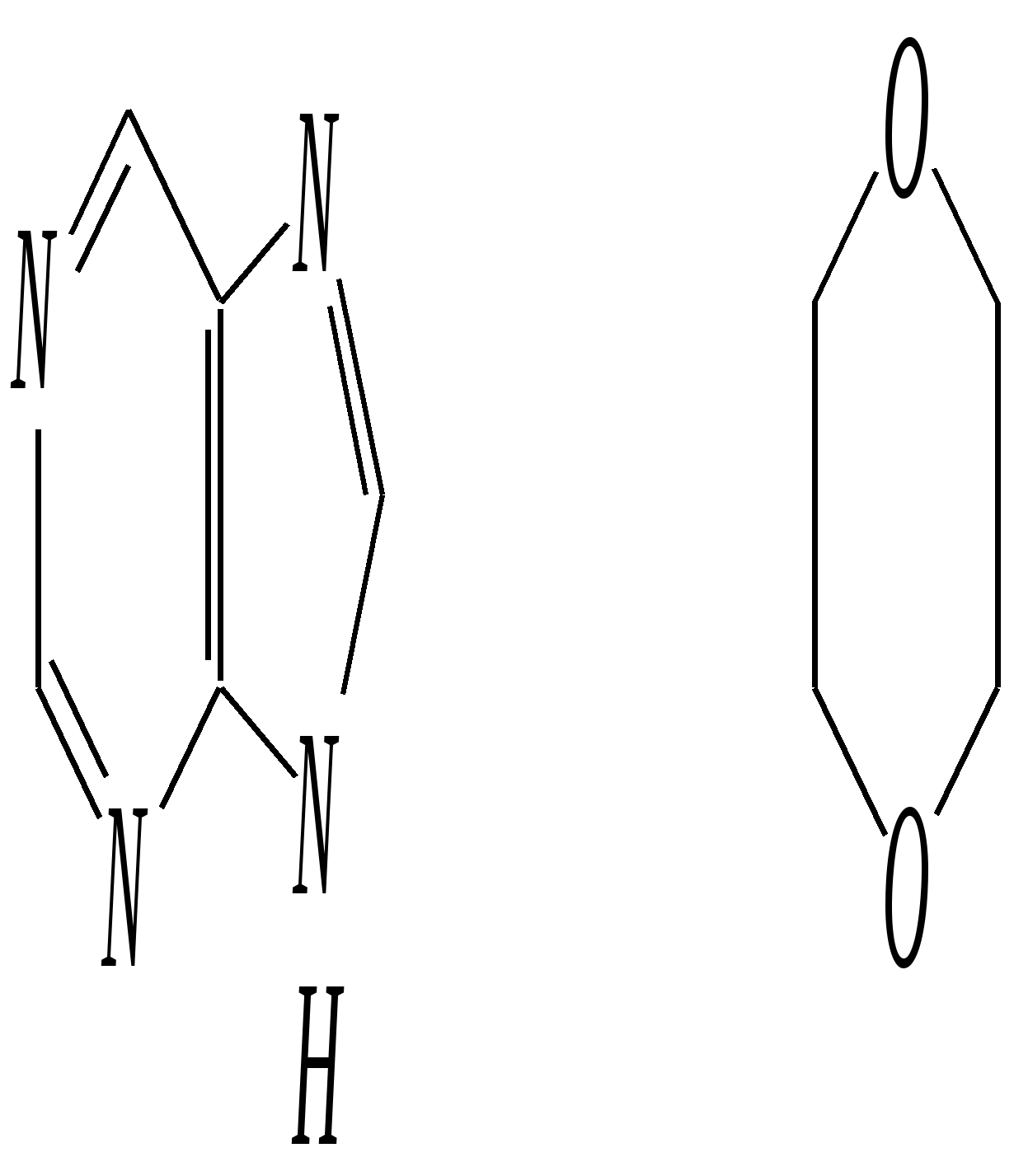 пурин диоксан (имидазо[4,5-d]пиримидин) (пергидро-1,4-диоксин) Диоксан по химической структуре является простым насыщенным циклическим диэфиром. Циклические простые эфиры изучались ранее (гл. 3.4) и поэтому здесь рассматриваться не будут. Пиримидин, пиразин и пиридазин в соответствии с номенклатурными правилами являются изомерными диазинами, и далее для них будет использоваться это собирательное название. Нумерация атомов в их циклах соответствует номенклатурным правилам: 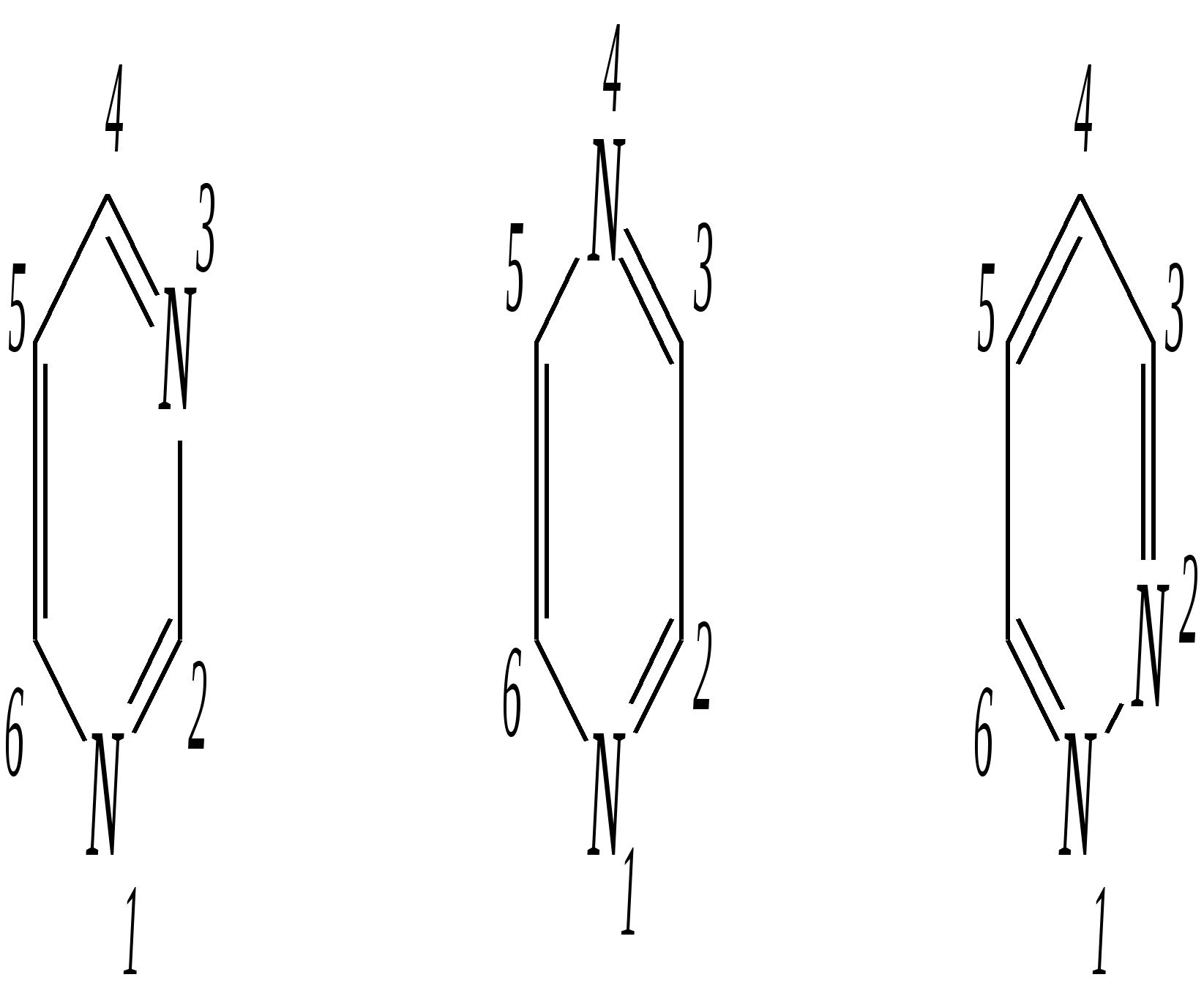 12.5.1. строение и свойства диазинов Пиримидин, пиразин и пиридазин представляют собой бесцветные вещества, растворимые в воде. Пиридазин отличается от других диазинов поразительно высокой температурой кипения (480 К), что на 80—90 К выше температур кипения пиримидина (396 К) и пиразина (391 К). Такая высокая температура кипения пиридазина является следствием близкого расположения двух атомов азота в молекуле, сильной поляризации молекул, приводящей к значительной ассоциации их в жидкости. Строение диазинов подобно строению пиридина. Каждая из молекул диазинов представляет собой плоский шестиугольник, содержащий сопряжённую -электронную систему, удовлетворяющую всем критериям ароматичности, в том числе и правилу Хюккеля (6 -электронов). Валентные углы и длины связей искажены по сравнению с бензолом. В целом диазины менее ароматичны, чем пиридин. Акцепторное влияние двух гетероатомов в диазинах значительно сильнее, чем одного атома азота в пиридине. При этом в пиримидине влияние атомов азота согласованное, и электронная плотность сильно понижена в положениях 2, 4 и 6. В молекулах 1,2- и 1,4-диазинах несогласованное влияние гетероатомов приводит к понижению электронной плотности на всех углеродных атомах. 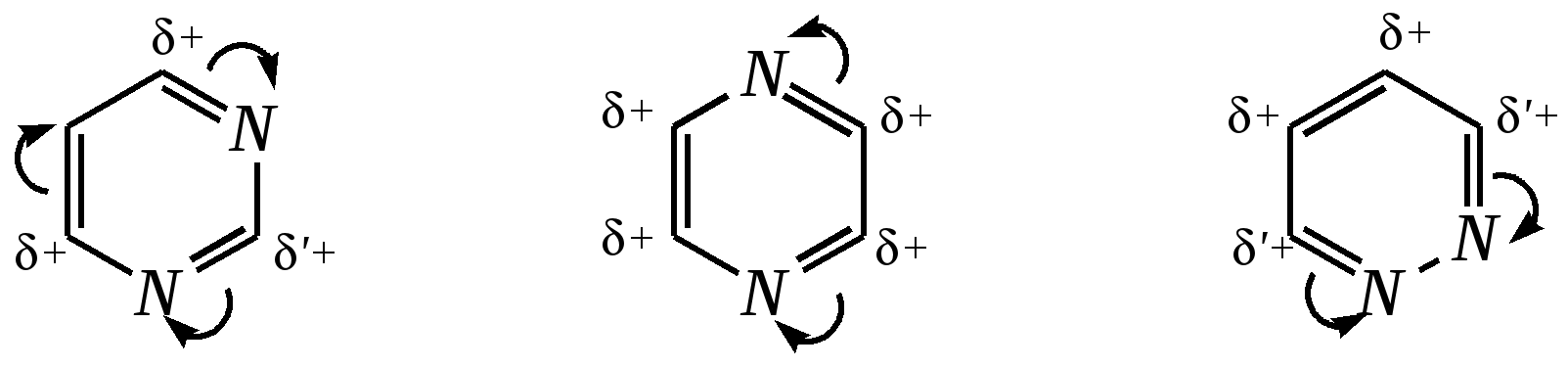 Вследствие этого диазины ещё менее склонны к реакциям электрофильного замещения, чем пиридин. Но понижение электронной плотности на атомах углерода приводит к облегчению атаки нуклеофильными реагентами по сравнению с пиридином. Химические свойства диазинов (как самих гетероциклов, так и их производных), по аналогии с пиридином, включают в себя и реакции непосредственно по атому азота (основные свойства, реакции алкилирования, окисления), и реакции с участием ароматического кольца (электрофильное и нуклеофильное замещение, гидрирование). Рассмотрим их на примере пиримидина. 12.5.1.1. Основность Пиримидин, как и другие диазины, — это преимущественно однокислотное основание. Его основность (рКb = 12.7) значительно слабее выражена, чем основность пиридина (рКb = 8.8). Это связано с электроноакцепторным влиянием другого атома азота. 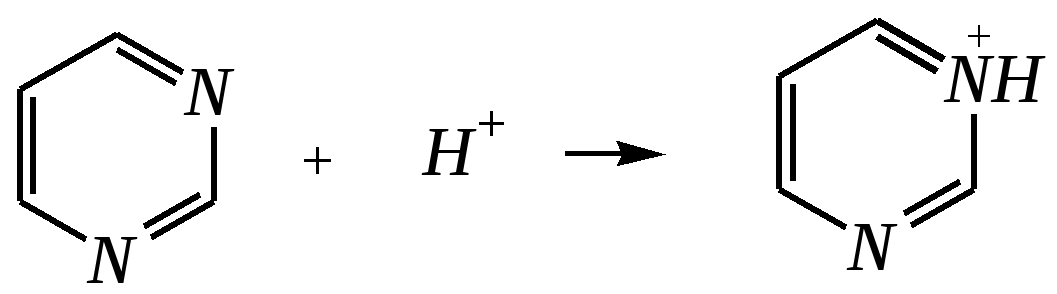 пиримидиний-катион Присоединение второго протона — чрезвычайно сложный процесс, и возможен лишь в концентрированных растворах очень сильных кислот. 12.5.1.2. Реакции алкилирования по атому азота Пиримидин реагирует с алкилгалогенидами труднее, чем пиридин, с образованием N-алкилониевых солей: 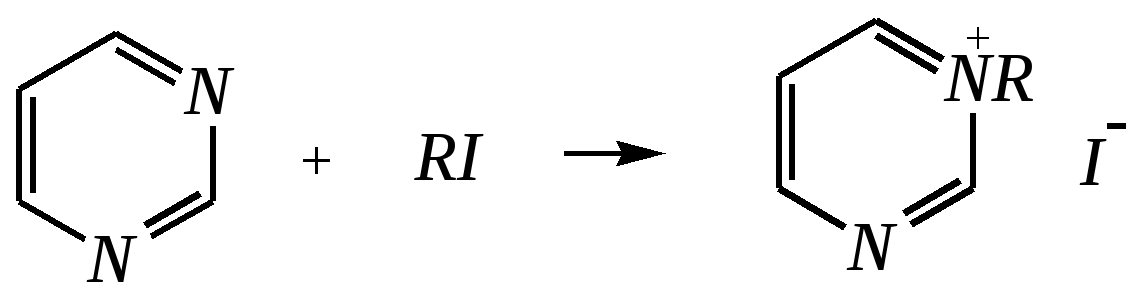 йодид N-алкилпиримидиния Диалкилпроизводные в этих условиях получить не удаётся. 12.5.1.3. Реакции электрофильного замещения В молекуле пиримидина положение 5 — это единственное положение во всех трёх диазинах, которое не является - или -положением по отношению к атому азота, и оно аналогично -положению пиридина. Величина -электронной плотности на этом атоме углерода остаётся самой высокой из всех углеродных атомов диазинов — см. выше строение диазинов. Тем не менее, осуществить реакции нитрования, сульфирования, ацилирования практически не удаётся. Незамещённый пиримидин в SE-реакции не вступает. Однако галогенирование в ряде случаев может протекать в достаточно мягких условиях и с хорошим выходом (80—90%) как для пиримидина, так и для других диазинов: 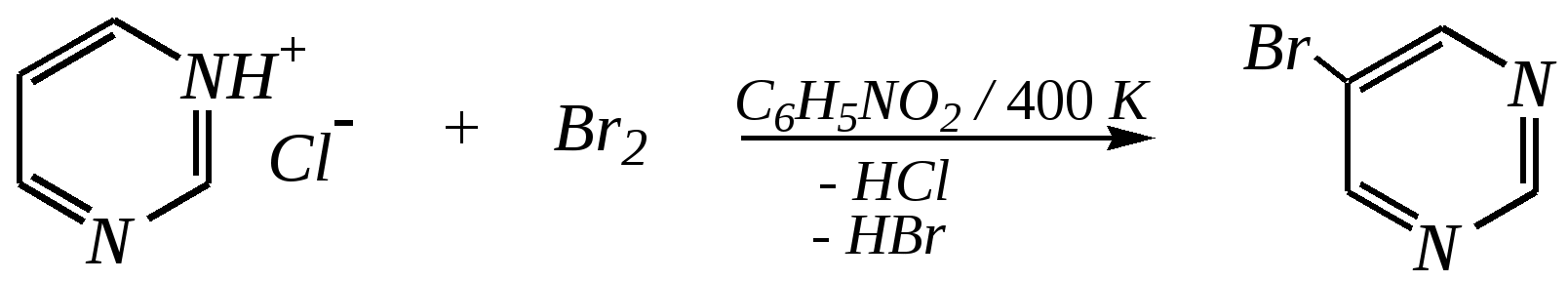 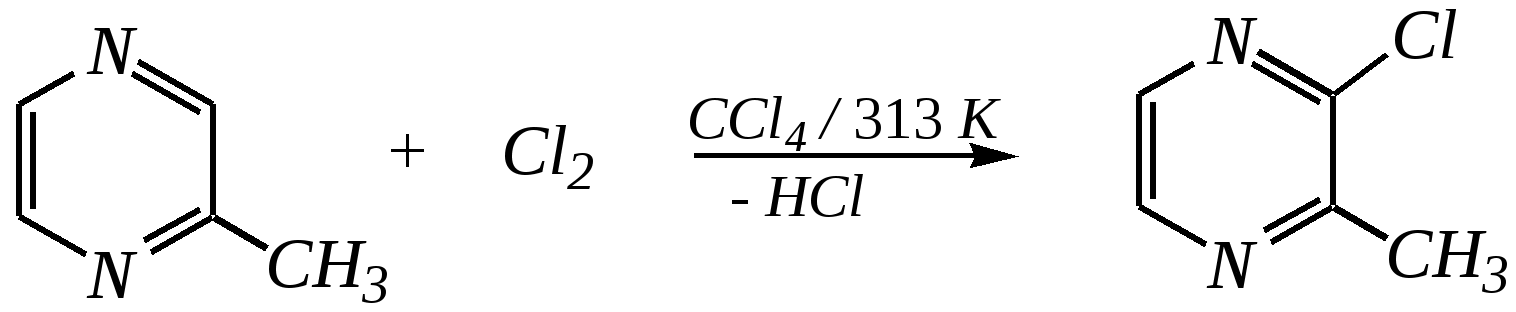 Объяснить это можно тем, что в данных случаях реализуется механизм присоединения–отщепления, а не классического электрофильного замещения. Например, бромирование хлорида пиримидиния может протекать так: 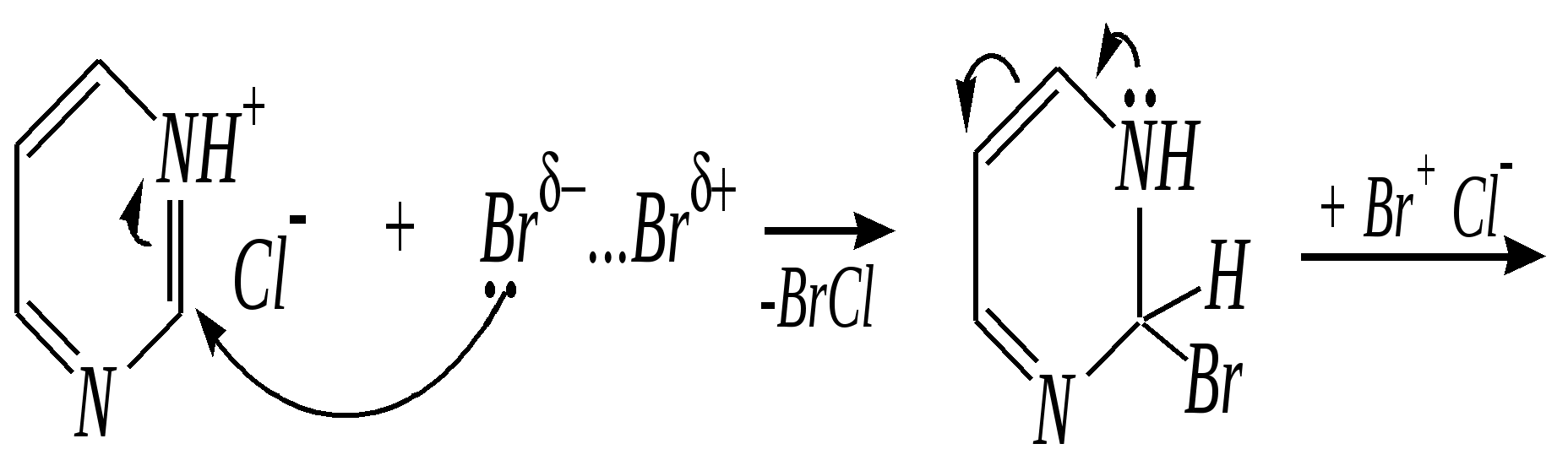 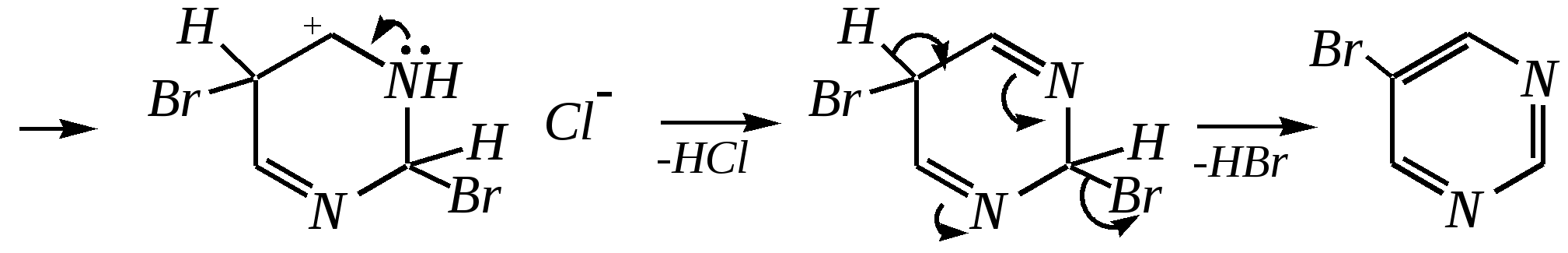 Наличие в кольце пиримидина хотя бы одной сильной электронодонорной группы во многих случаях достаточно для облегчения SE-реакций; две аминогруппы активируют молекулу настолько, что становятся возможными реакции даже со слабыми электрофилами, такими, как катионы диазония. Например: 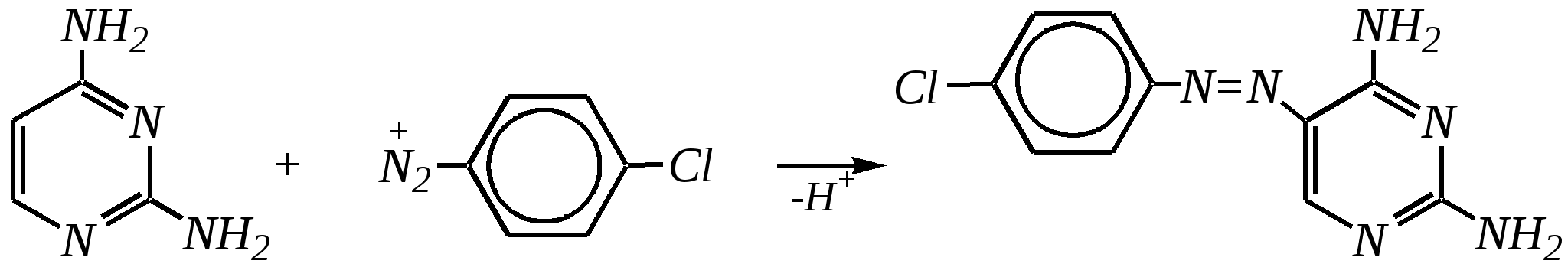 12.5.1.4. Реакции нуклеофильного замещения Для пиримидина, как и для всех диазинов, по причине сильного электроноакцепторного влияния двух атомов азота более характерными оказываются реакции нуклеофильного (а не электрофильного) замещения. Для диазинов эти реакции протекают легче, чем для пиридина. Например, легко осуществляется нуклеофильная атака амид-анионом в реакции Чичибабина: лимитирующей стадией является отрыв гидрид-иона, и необходимо использование (перманганата калия или другого окислителя) для отщепления нуклеофугной группы: 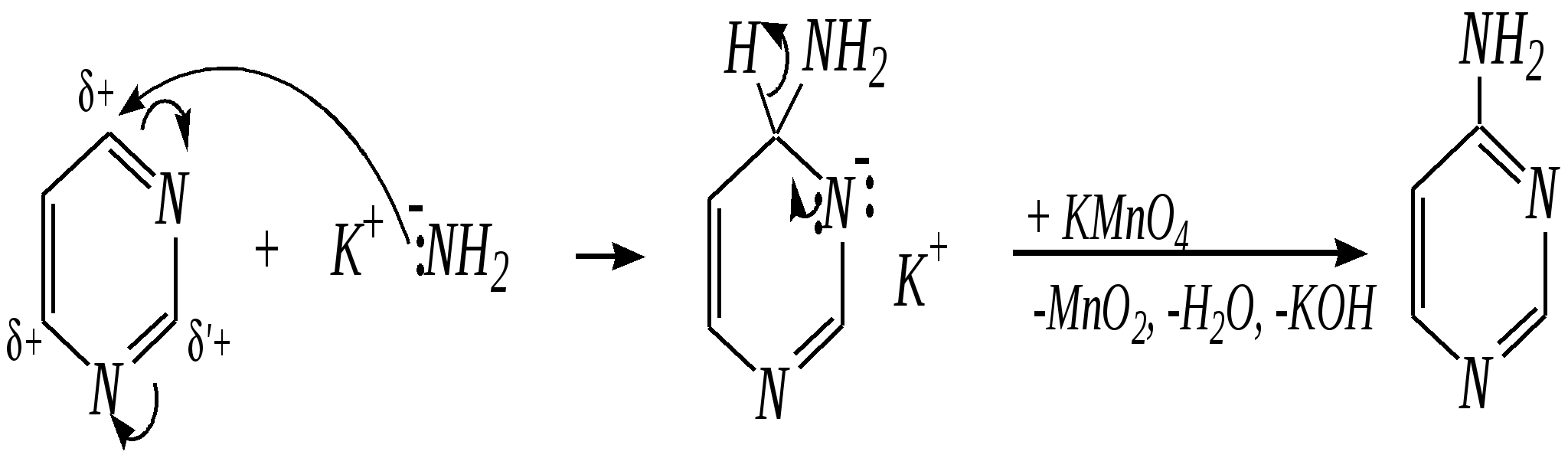 По этой же причине нуклеофильное замещение преимущественно наблюдается в положении 4, а не в положении 2 (гидрид-ион у атома С2 сильнее удерживается акцепторным влиянием двух атомов азота). Замещение других уходящих групп в молекулах производных пиримидина может происходить легко, в мягких условиях, если отщепляемый анион достаточно устойчив. Так, например, происходит с 2-, 4- или 6-галогенозамещёнными пиримидинами. (Положение 5 не активировано для нуклеофильной атаки, и галоген там может замещаться в жёстких условиях, подобно тому, как это происходит в галогенаренах.) Взаимодействие 2,4-дихлорпиримидинов с аммиаком в этаноле в обычных условиях (293 К) протекает не селективно: 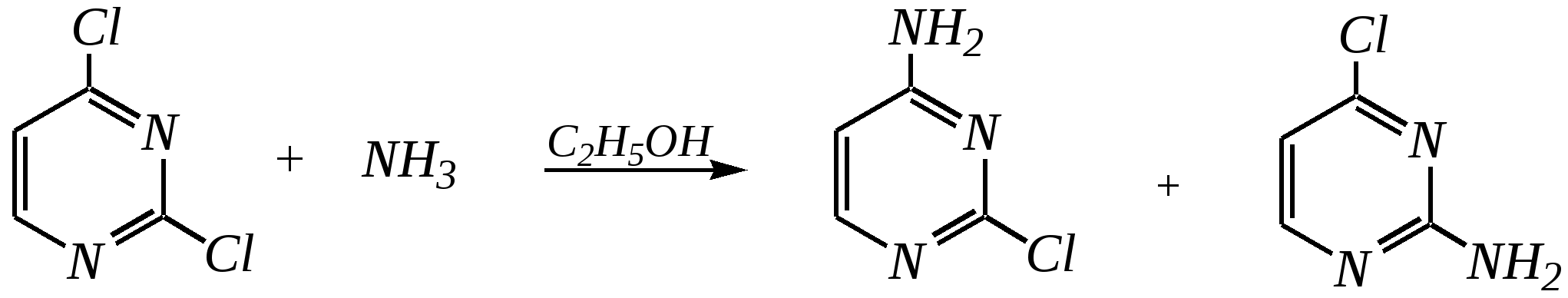 В общем случае селективность других реакций нуклеофильного замещения производных пиримидина зависит от природы нуклеофильного реагента и условий проведения процесса. 12.5.1.5. Реакции окисления и восстановления Пиримидиновый цикл, так же как и пиридиновый, устойчив к окислителям; образование N-оксидов пиримидина протекает значительно труднее, чем для пиридина. Алкилпроизводные при действии CrO3 или KMnO4 окисляются до карбоновых кислот: 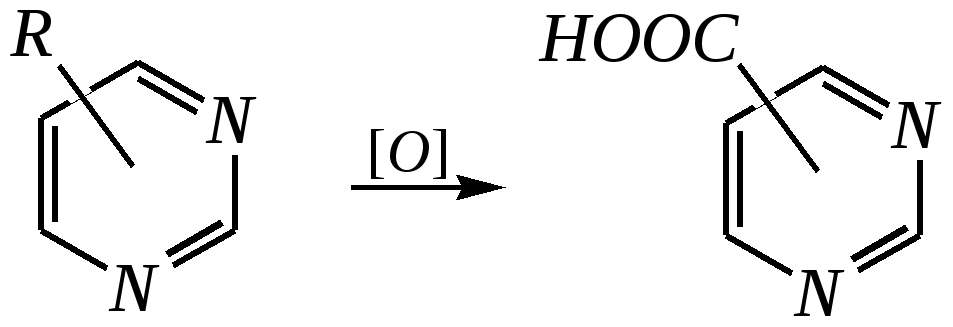 Поскольку ароматичность диазинов меньше, чем пиридина, их восстановление проходит легче, чем для цикла с одним атомом азота. Каталитическое восстановление водородом или натрием в кипящем спирте приводит к гексагидропроизводным в случае пиримидина и пиразина, а в пиридазине расщепляется цикл по связи N–N. 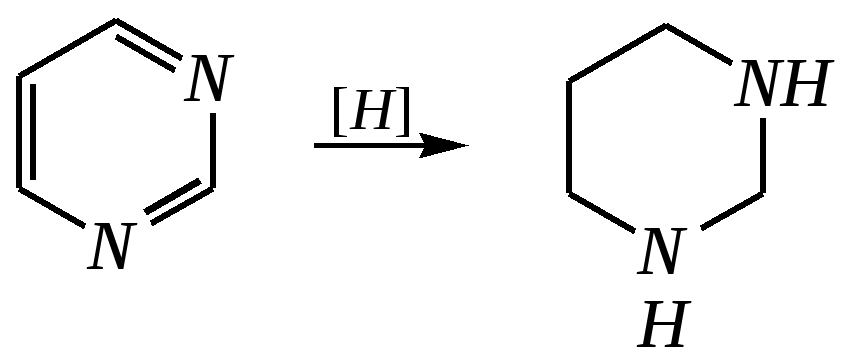 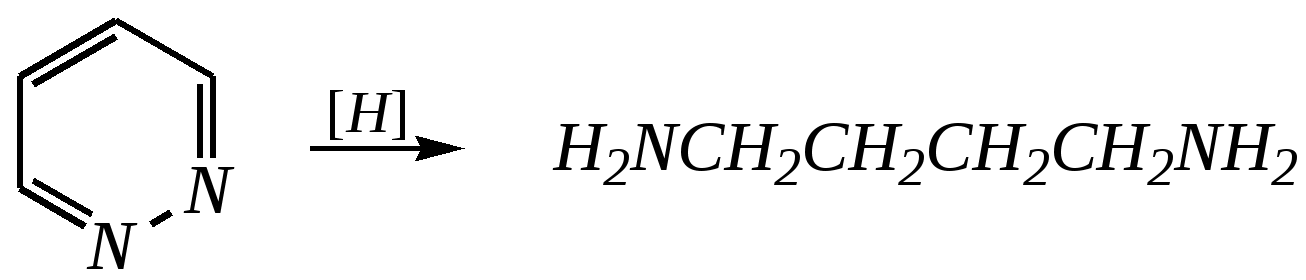 12.5.2. пурин Пурин (имидазо[4,5-d]пиримидин) представляет собой конденсированную бициклическую систему, построенную из пиримидинового и имидазольного циклов. Он имеет свою, оригинальную нумерацию атомов, которая отличается от правил нумерации конденсированных структур. Пурин существует в виде двух таутомеров — 9Н-пурина и 7Н-пурина. (Ещё две теоретически возможные таутомерные формы, 1Н-пурин и 3Н-пурин, не обнаружены.) 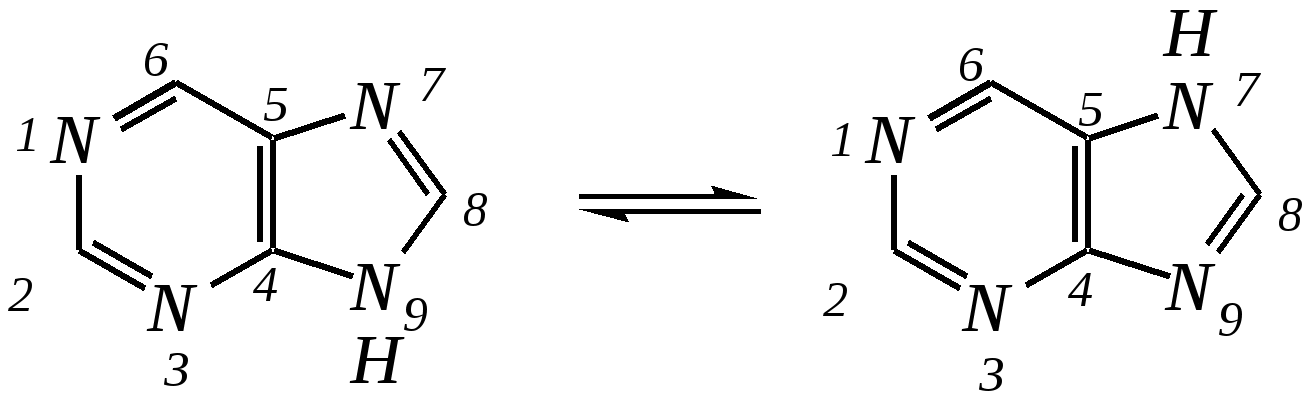 9Н-пурин 7Н-пурин В кристаллическом состоянии пурин существует в виде 7Н-таутомера, однако в растворе 7Н-пурин и 9Н-пурин представлены примерно в равных количествах. Система пурина, подобно бициклической системе индола, содержит 10--электронную систему. При этом в имидазольном кольце электронная плотность повышена, а в пиримидиновом, наоборот, понижена по сравнению с бензольным. По кислотным свойствам пурин (рКа = 8.9) — немного более сильная кислота, чем фенол (рКа = 9.9), и значительно более сильная кислота, чем имидазол (рКа = 14.2). Такая сравнительно высокая кислотность обусловлена значительной делокализацией отрицательного заряда аниона между четырьмя атомами азота: 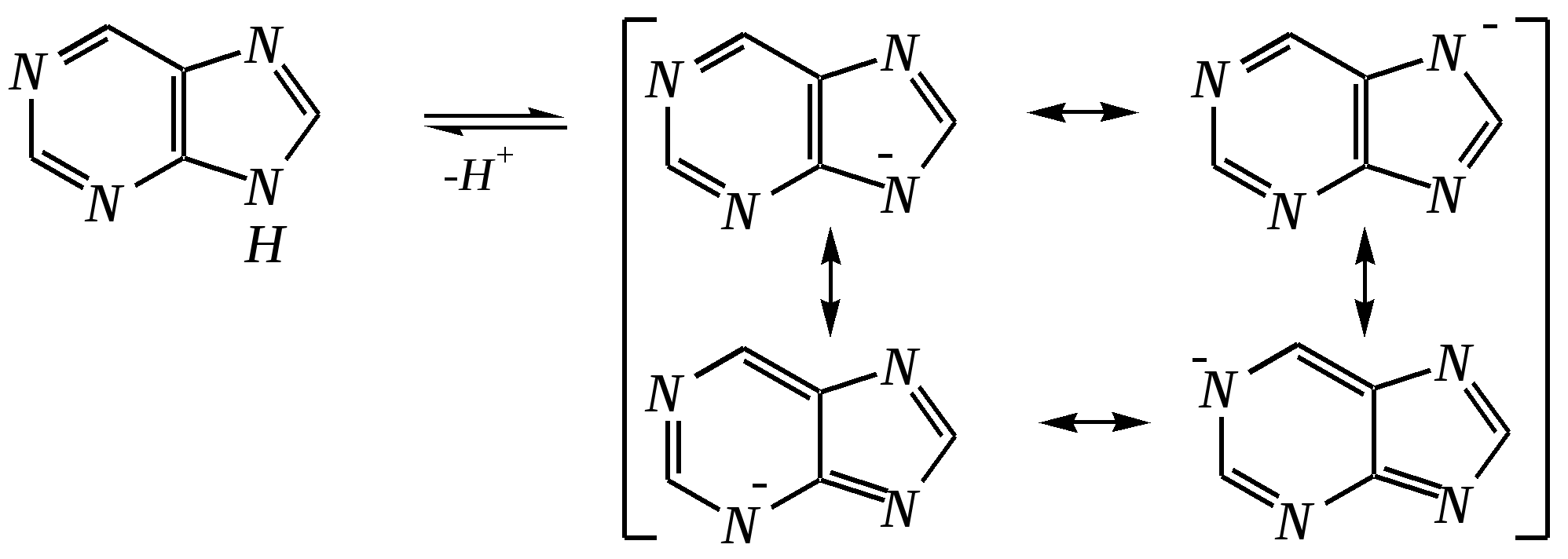 Основные свойства пурина выражены слабо (рКb = 11.5); в растворе существуют все три возможные протонированные формы пурина, но с преобладанием катиона, образующегося при N1-протонировании: 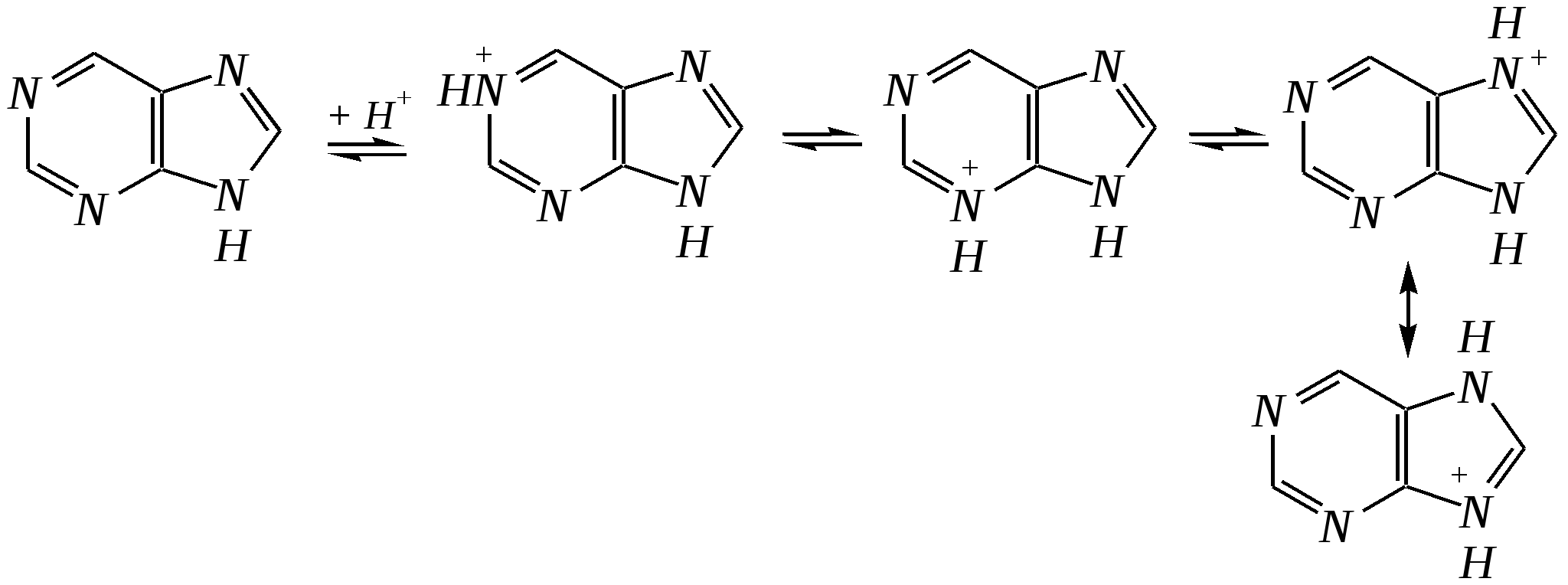 Алкилирование пурина протекает довольно сложно, и в нём могут участвовать нейтральная молекула или анион. С йодметаном в метаноле при 373 К образуется соль 7,9-диметилпуриния: 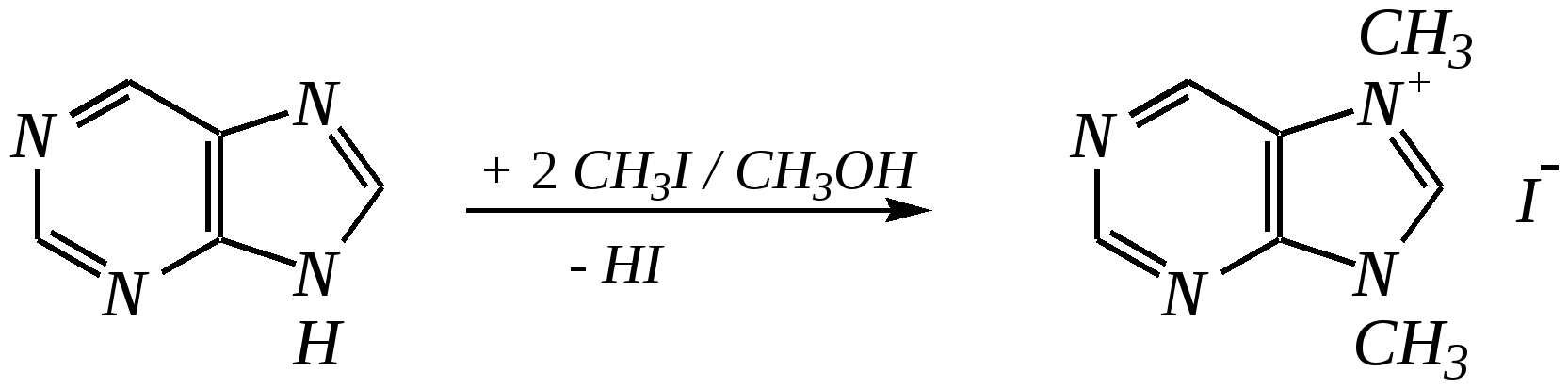 Возможные углеродные центры электрофильной атаки как в пиримидиновом, так и в имидазольном циклах пуриновой системы заняты, и вполне очевидно, что Se-реакции для самого пурина неизвестны. Однако замещённый пурин может галогенироваться, нитроваться и даже вступать в реакцию азосочетания, как это показано в следующих примерах. 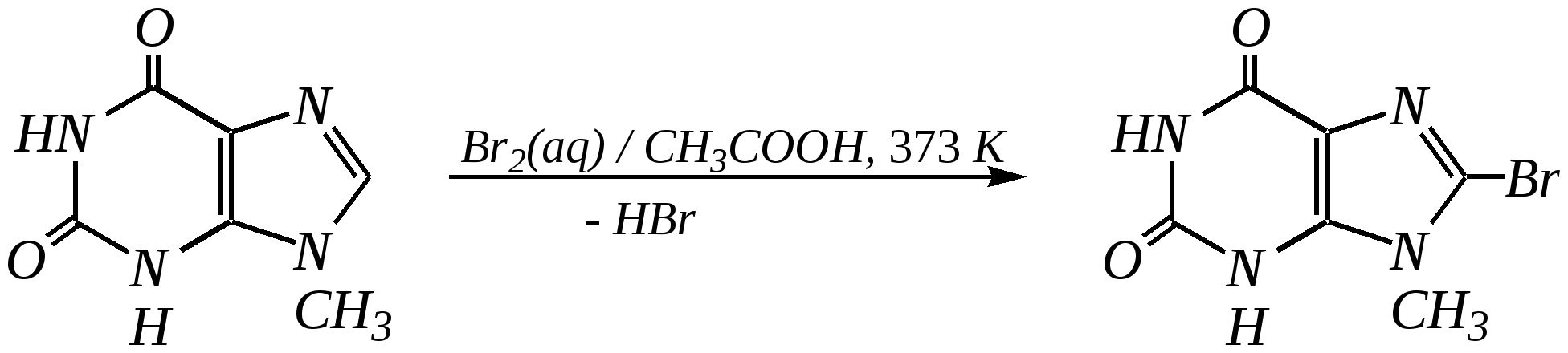 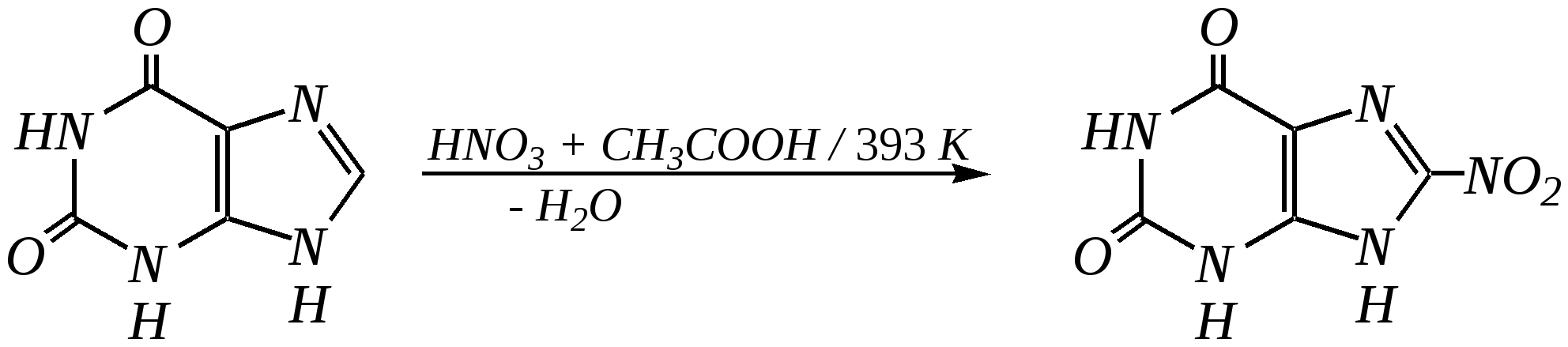 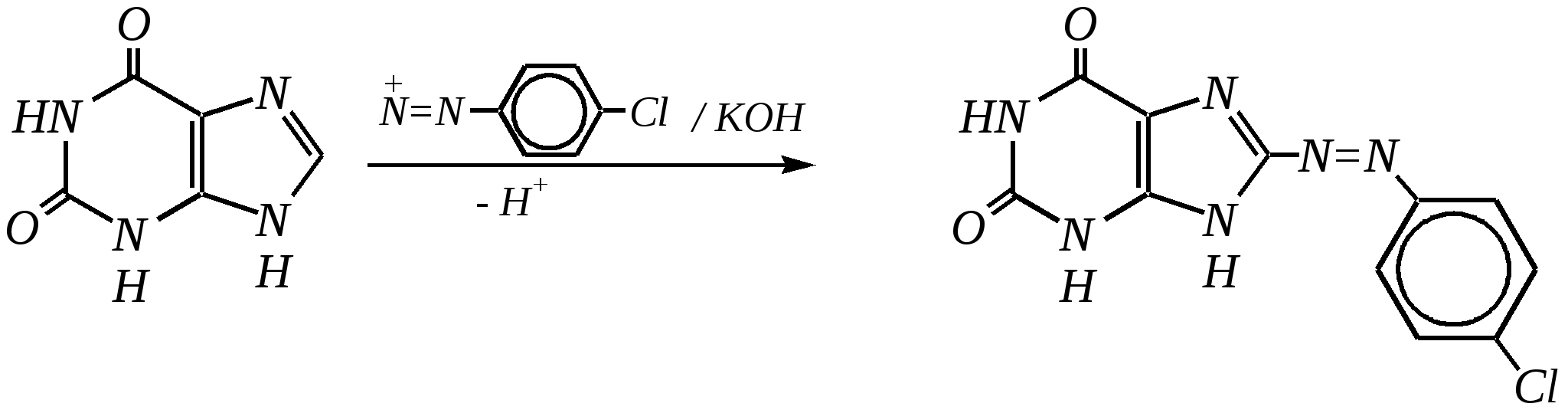 Нуклеофильное замещение наиболее характерно для галогенозамещённых пуринов. Реакции замещения для 2-, 6- или 8-галогенопуринов протекают относительно легко с такими нуклеофилами, как амины, цианиды, алкоксиды, сульфиды и др. Механизм реакции SN2аром. Например: 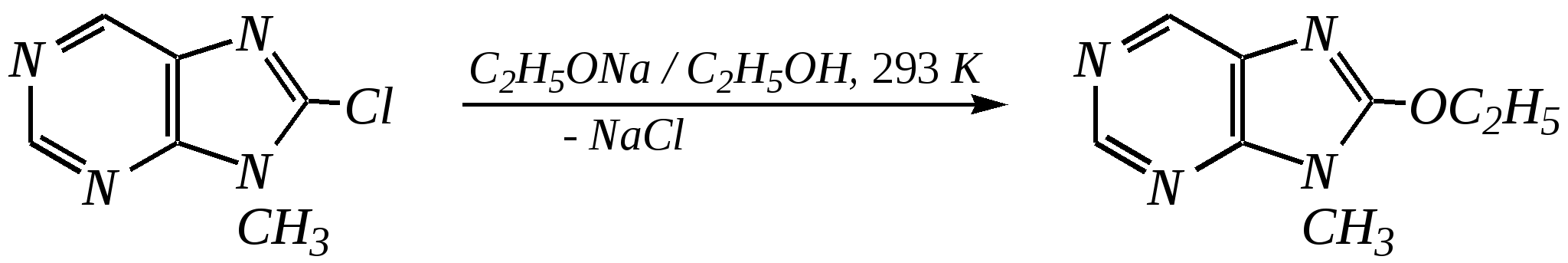 В 9-замещённых галогенопуринах наибольшей реакционной способностью обладает галоген в 8-м положении, в 9Н-галогенопуринах — галоген в 6-м положении. Изменение реакционной способности галогена в положении 8 связано с образованием аниона в пятичленном цикле 9Н-пурина, и нуклеофильная атака осуществляется по пиримидиновому кольцу. При наличии заместителя в 9-м положении пятичленный цикл протонируется растворителем, что облегчает нуклеофильную атаку по этому кольцу. 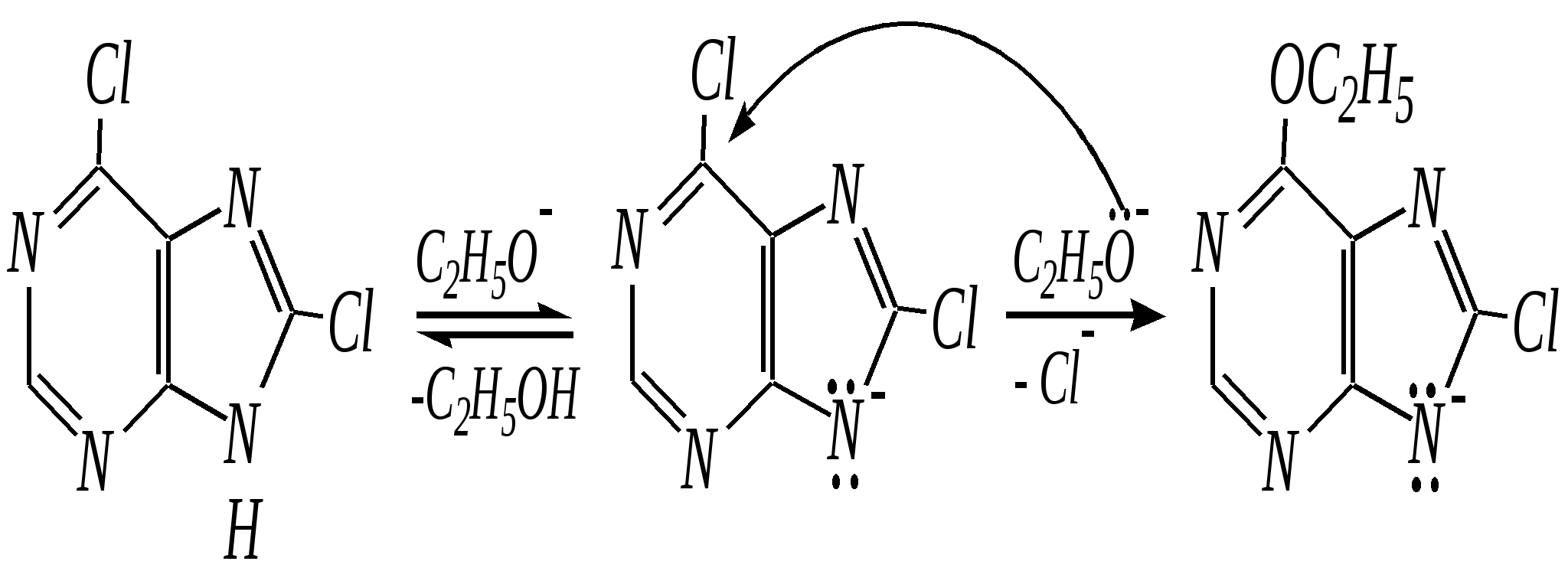 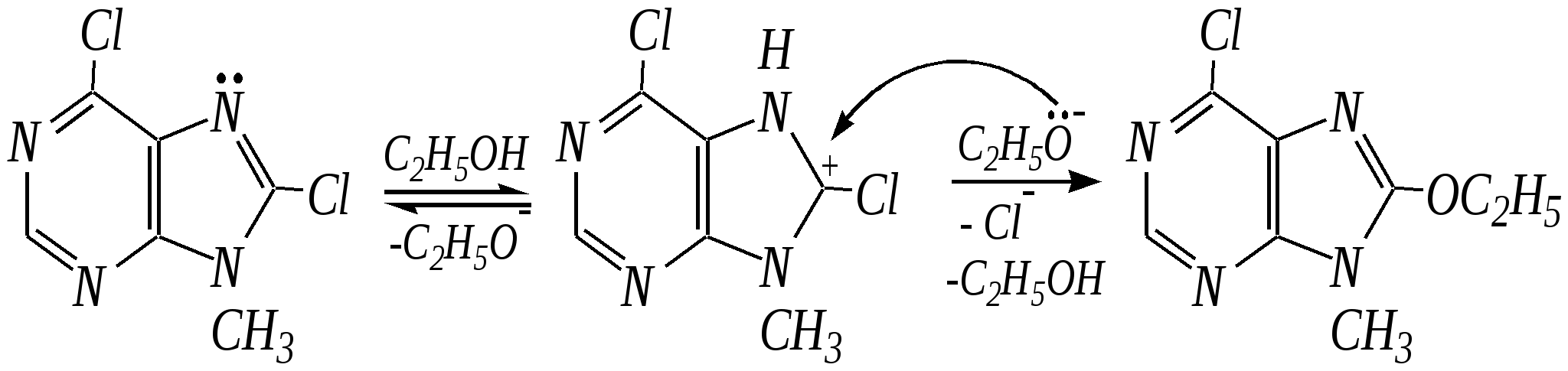 12.5.3. способы получения В синтетическом отношении производные диазинов оказываются более доступными, чем сами незамещённые гетероциклы. 1. Пиримидиновое кольцо получают конденсацией -дикарбонильных соединений с мочевиной или её производными. Например, барбитуровая кислота образуется из малонового эфира и мочевины: 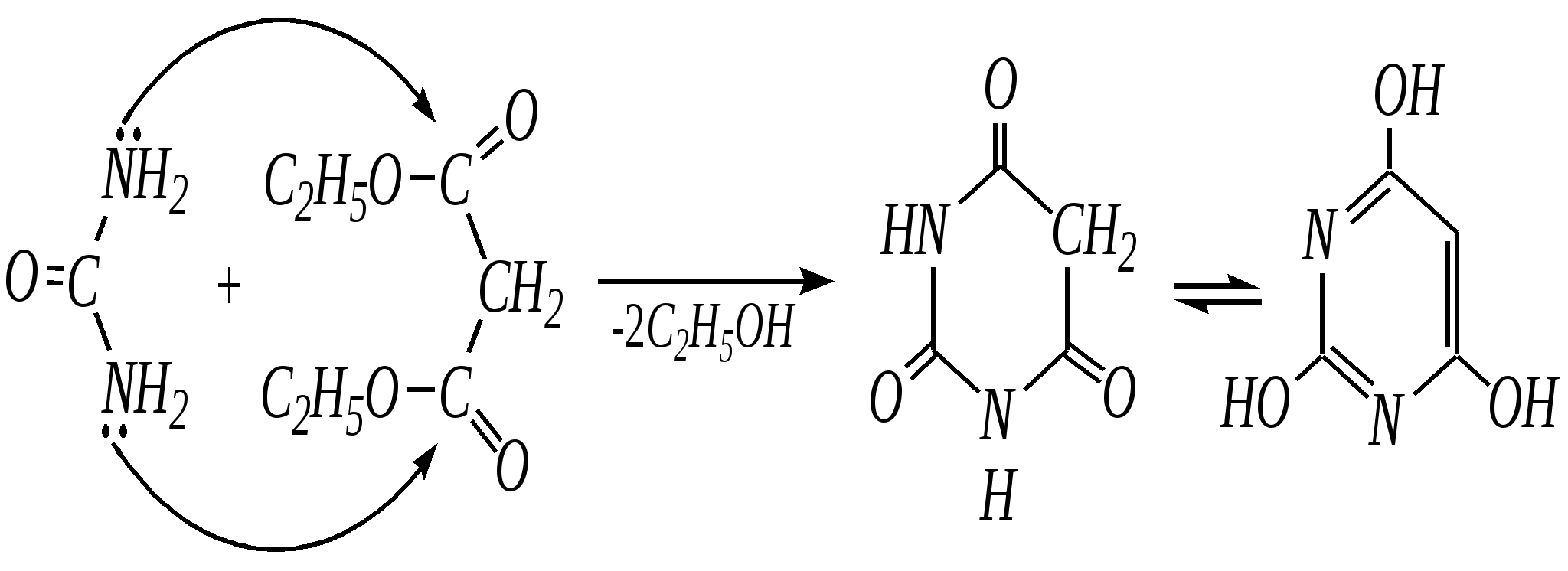 барбитуровая кислота Сам пиримидин может быть получен путём превращения барбитуровой кислоты в трихлорпиримидин, и последующим его восстановлением: 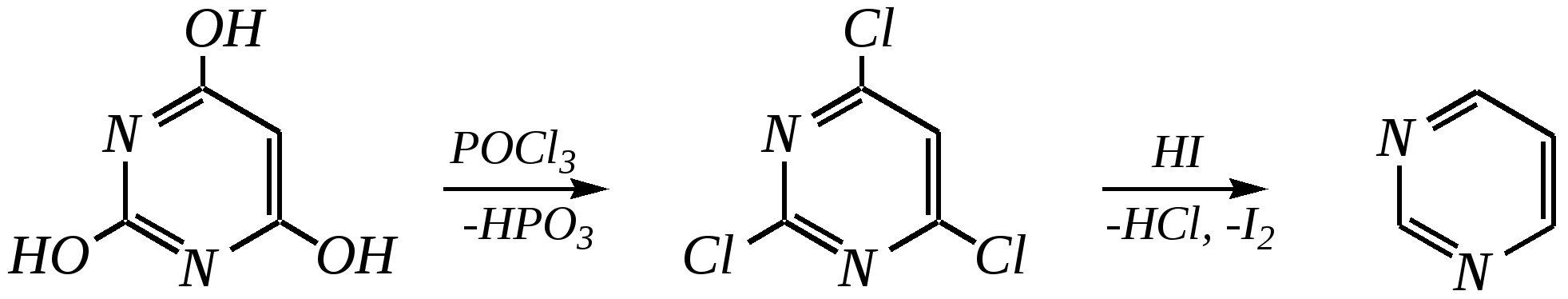 2. Пиразиновое кольцо легко образуется при самоконденсации -аминокарбонильных соединений (в том числе -аминокарбоновых кислот — гл. 6.9.2.3). 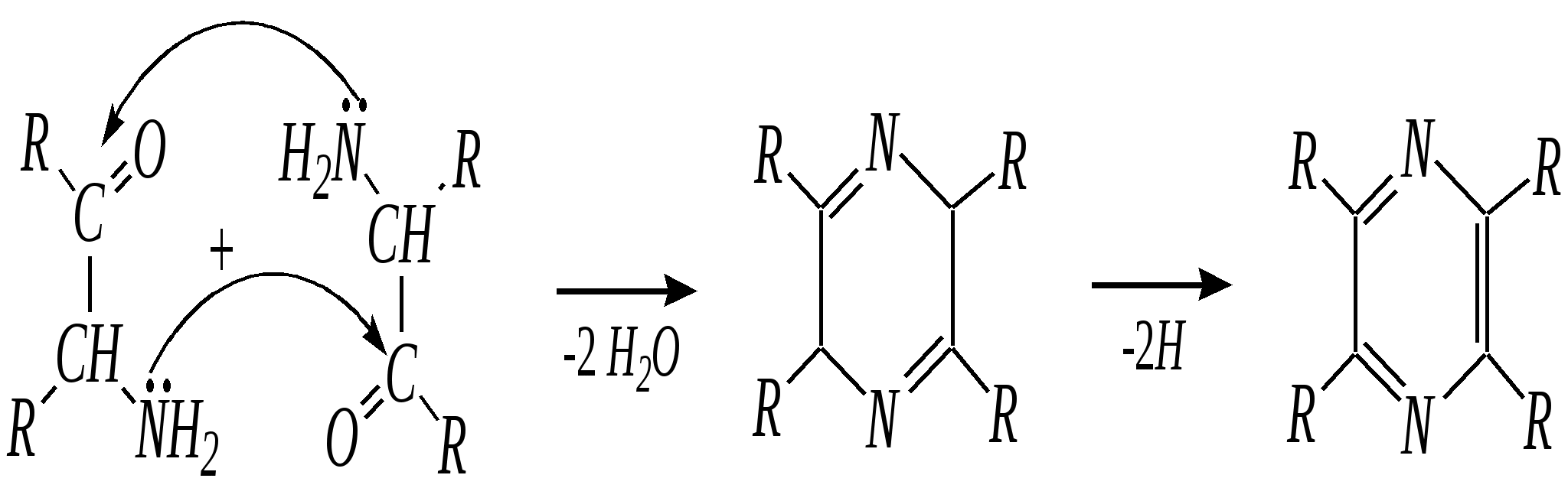 2,5-дигидротетраалкилпиразины 3. Пиридазин и его производные получают с использованием гидразина. 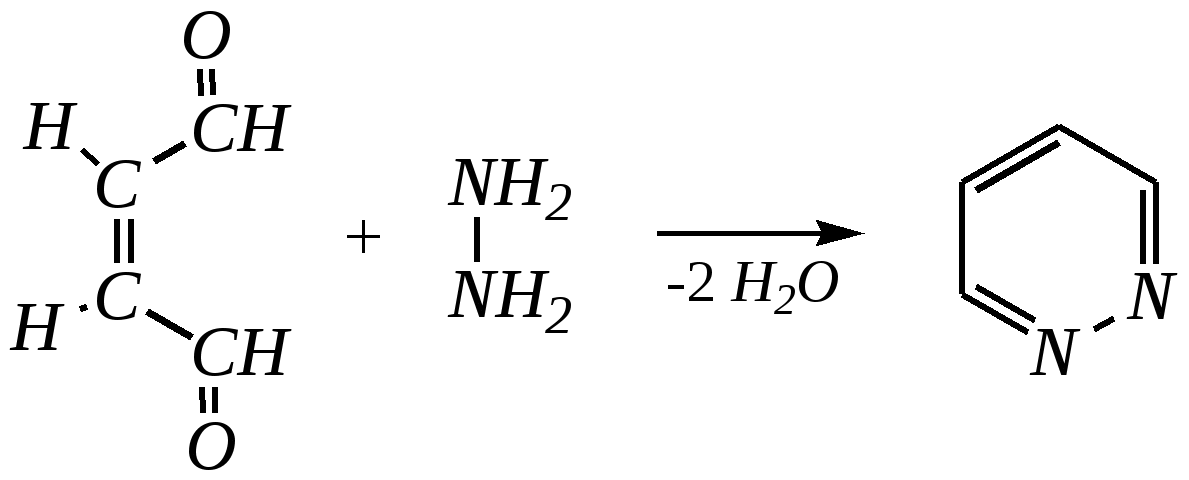 4. Для получения пурина и его производных могут использоваться 5,6-диаминопиримидины (или соответствующие гидроксильные производные). Например, аминобарбитуровая кислота при конденсации с цианатом (изоцианатом) калия образует мочевую кислоту, которая затем может быть превращена в пурин: 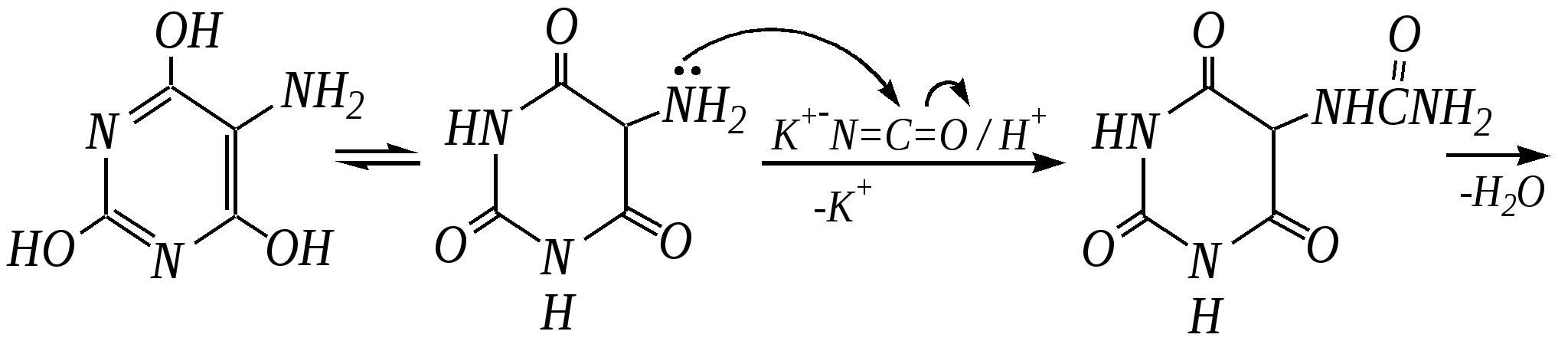 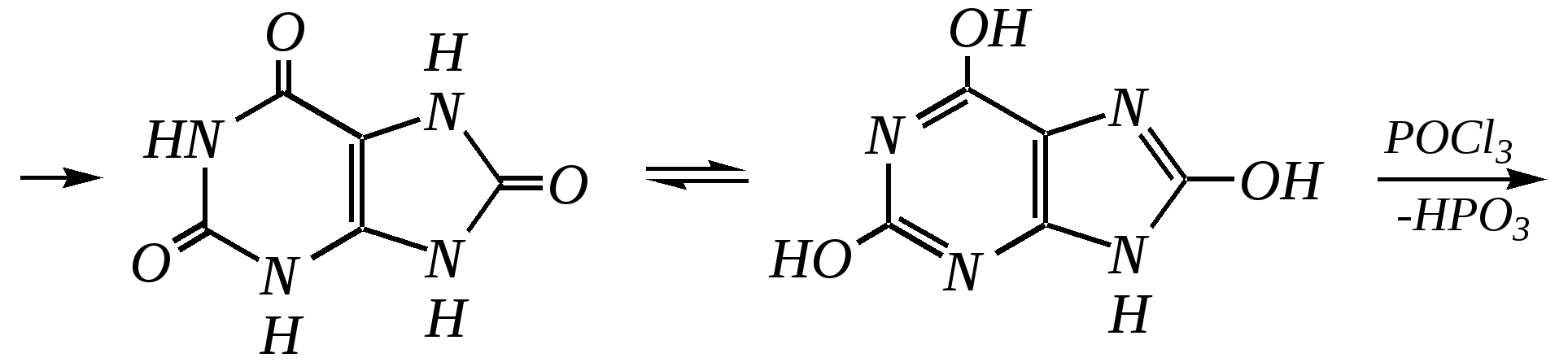 мочевая кислота 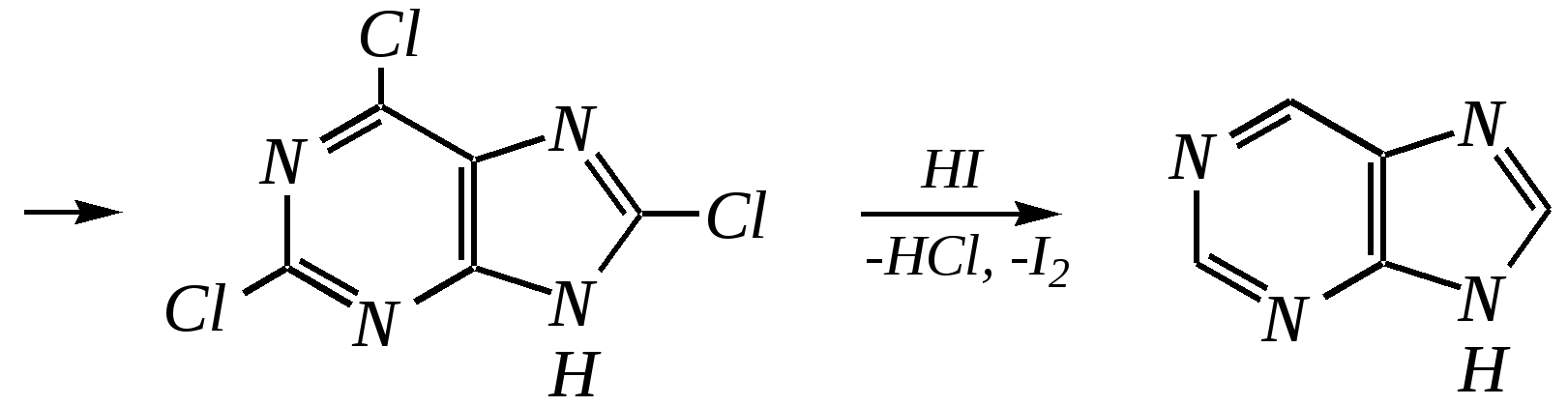 12.5.4. важнейшие представители и медико-биологическое значение Пиримидин — бесцветное вещество со слабым запахом; температура плавления 294 К, кипения — 397 К; растворяется в воде. Пиразин — бесцветное кристаллическое вещество со слабым запахом; температура плавления 330 К, кипения — 391 К; растворяется в воде. Получают каталитическим дегидрированием пиперазина. Пиридазин — бесцветная жидкость со слабым запахом; температура плавления 265 К, кипения — 481 К; растворяется в воде. Барбитуровая кислота — бесцветное кристаллическое вещество с температурой плавления 518 К; растворяется в воде. Получают из малонового эфира и мочевины. Стабильной таутомерной формой является триоксоформа. В медицине применяются 1,5,5-тризамещённые барбитуровые кислоты («барбитураты»). Они обладают снотворным (а некоторые и противоэпилептическим) действием. 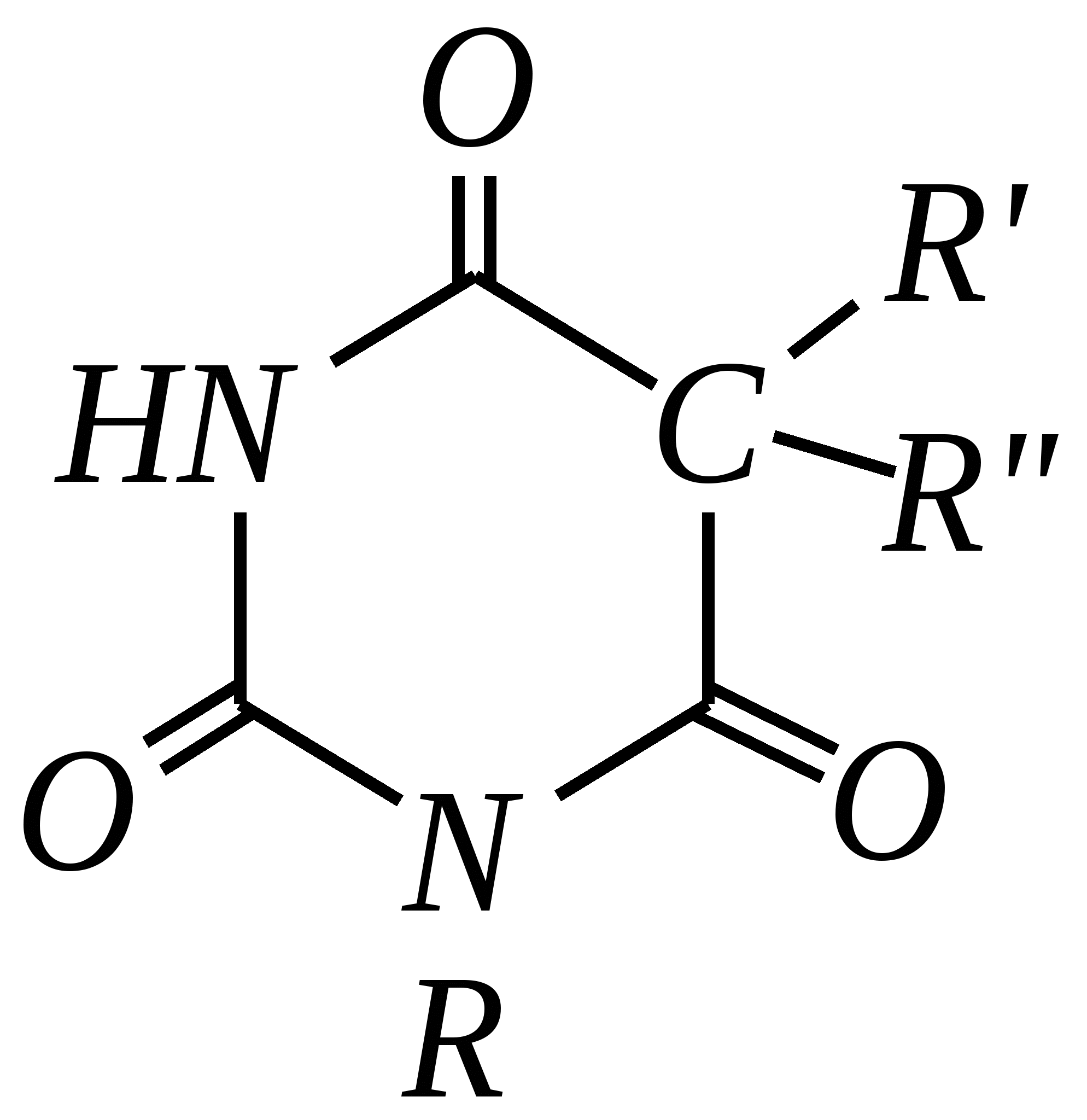 где R – чаще всего водород, а R, R – алкил или арил Наиболее известными препаратами этого ряда являются барбитал, барбитал-натрий, барбамил (амитал-натрий), этаминал-натрий (нембутал, пентобарбитал-натрий), циклобарбитал (фанодорм), гексенал (гексобарбитал-натрий), тиопентал-натрий и др. Пурин — бесцветное кристаллическое вещество с температурой плавления 489 К; растворяется в воде. Получают из 5,6-диаминопиримидина. Оротовая кислота (витамин В13) — промежуточное вещество в биосинтезе пиримидиновых оснований. В качестве лекарственного вещества используется калиевая соль оротовой кислоты (оротат калия) как стимулятор метаболичеких процессов. 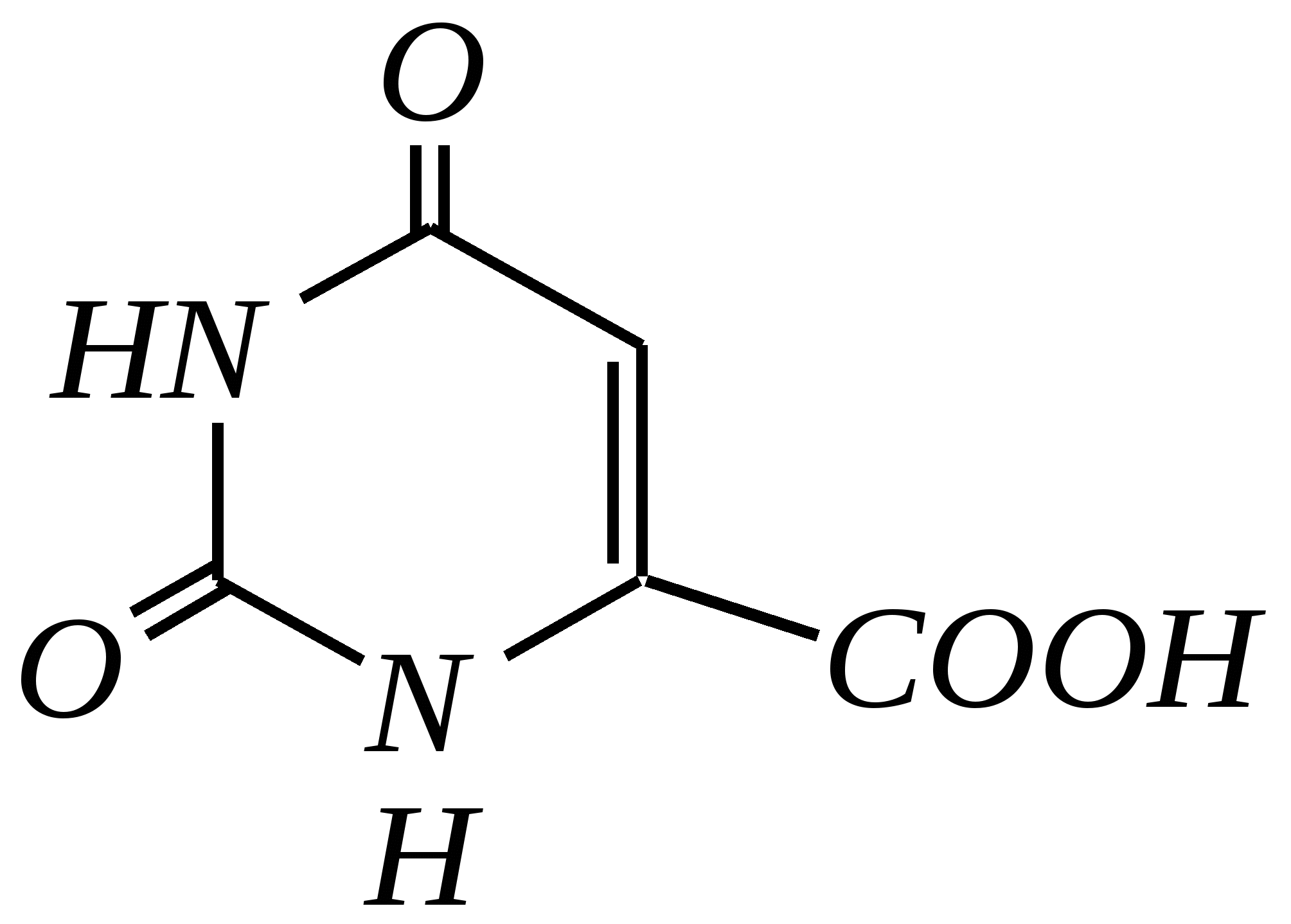 оротовая кислота Мочевая кислота — бесцветное кристаллическое вещество, малорастворимое в воде. Синтетически получают из барбитуровой кислоты. Стабильной таутомерной формой является триоксоформа. Является продуктом обмена веществ живых организмов. Урацил, тимин, цитозин, аденин и гуанин входят в состав важных природных соединений нуклеотидов и нуклеиновых кислот (см. далее) и поэтому известны под общим названием «нуклеиновые основания». Для урацила, тимина, цитозина и гуанина наиболее стабильными являются оксоформы:  урацил тимин цитозин  аденин гуанин 12.5.5. нуклеозиды, нуклеотиды и нуклеиновые кислоты Нуклеиновые кислоты являются составной частью каждой живой клетки. Они представляют собой высокомолекулярные водорастворимые соединения, в макромолекулы которых входят производные пиримидина и пурина (так называемые нуклеиновые основания), фосфорная кислота и моносахарид (пентоза) — D-рибоза или 2-дезокси-D-рибоза. Полинуклеотидная цепь, таким образом, состоит из фосфатных и моносахаридных звеньев за счёт образования фосфодиэфирных связей между положением 5 одной пентозы и положением 3 другой. К рибозе (или дезоксирибозе) присоединены пиримидиновые и пуриновые основания.
Такая полинуклеотидная цепь представляет первичную структуру нуклеиновых кислот, которая определяется последовательностью расположения нуклеиновых оснований в ней. Известны два различных типа нуклеиновых кислот — рибонуклеиновые кислоты (РНК), содержащие моносахарид D-рибозу, и дезоксирибонуклеиновые кислоты (ДНК), в которых углеводный остаток представляет собой 2-дезокси-D-рибозу. ДНК содержат два пиримидиновых основания — тимин и цитозин и два пуриновых — аденин и гуанин. В РНК вместо тимина присутствует урацил. Структурными звеньями нуклеиновых кислот являются мононуклеотиды. Они представляют собой фосфорнокислые эфиры нуклеозидов:
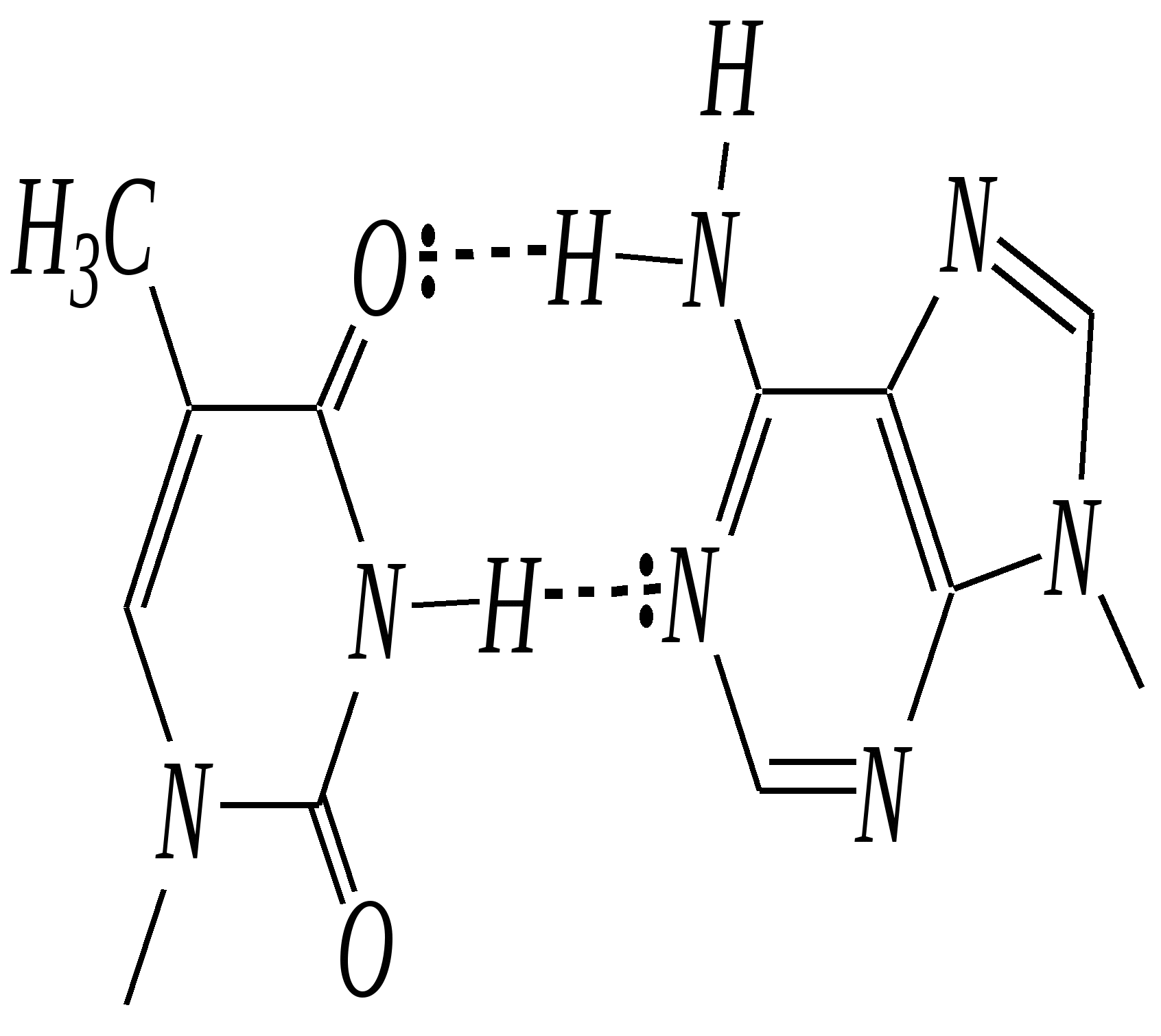
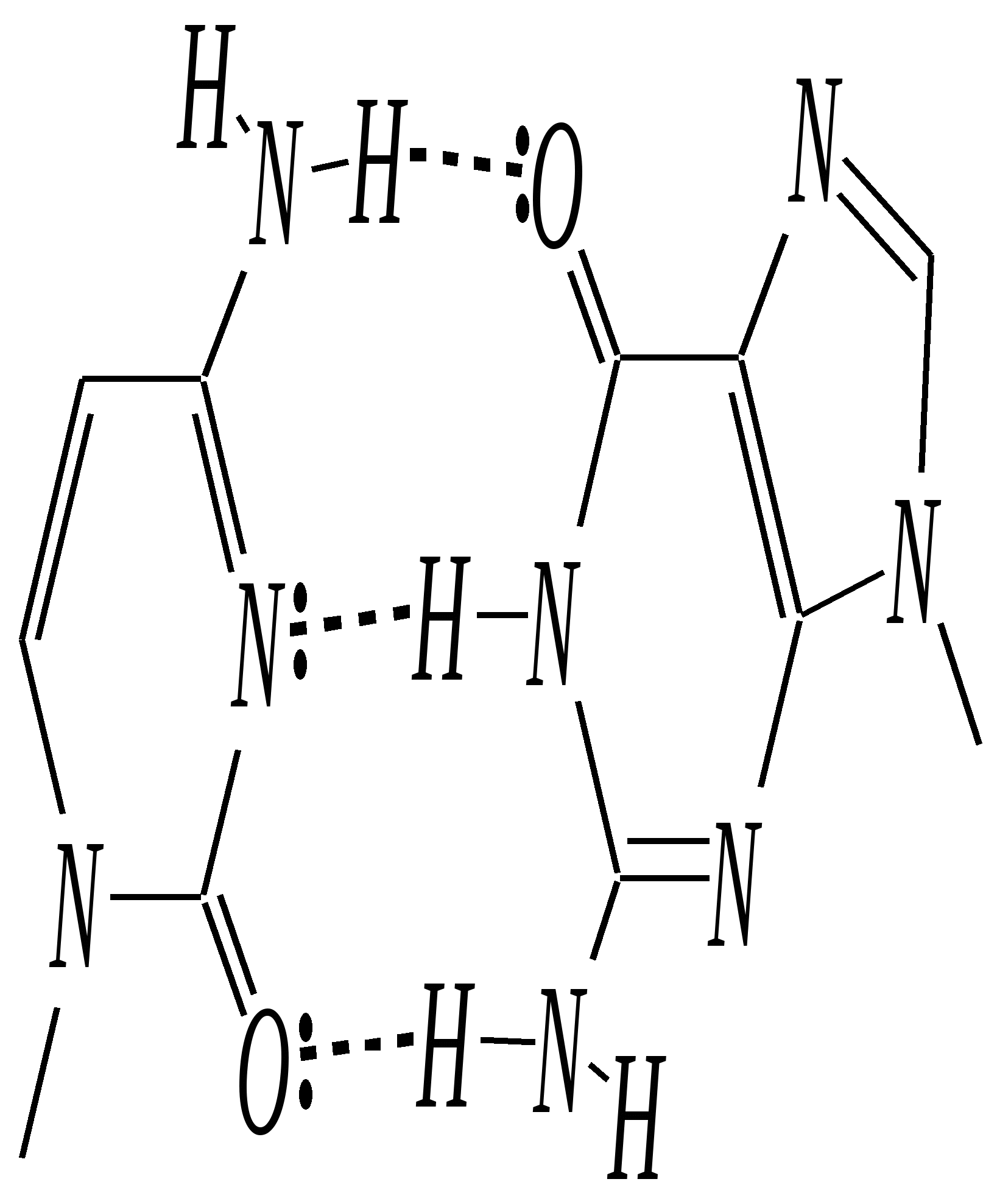
нуклеозид-5-фосфат В свободном состоянии существуют также дифосфаты и трифосфаты. Так, аденозин-5-трифосфорная кислота (АТФ) играет важную роль в процессах обмена веществ в живых организмах. 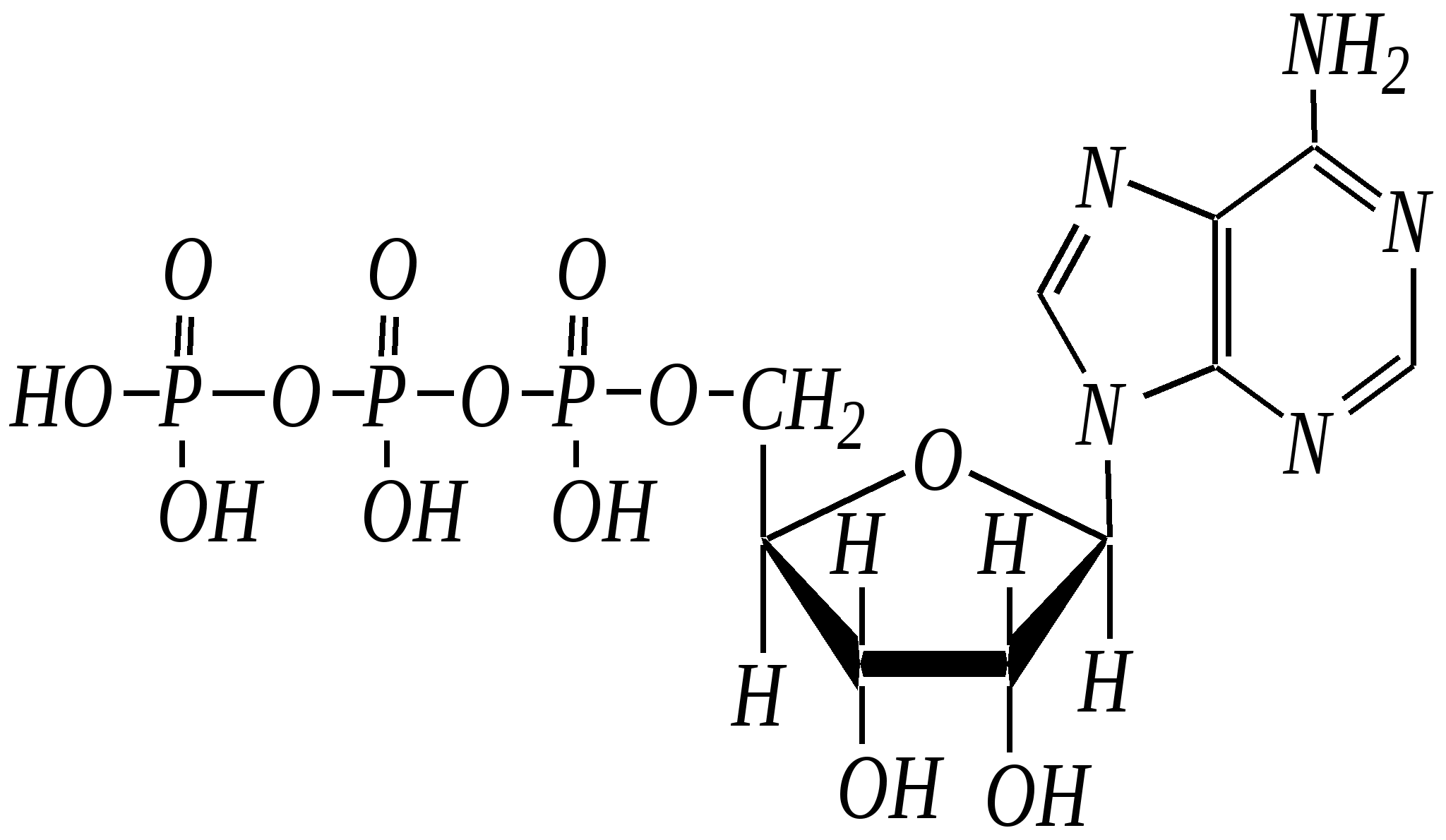 АТФ При гидролизе связей Р–О–Р выделяется значительное количество энергии (33—46 кДж/моль). Она является своеобразным аккумулятором энергии, поставщиком энергии в различных процессах биосинтеза. Сложноэфирная связь в нуклеотидах необратимо гидролизуется в щелочной среде, при этом образуются нуклеозиды, являющиеся N-гликозидами рибозы или дезоксирибозы — уридин, тимидин (2-дезокситимидин), цитидин, 2-дезоксицитидин, аденозин, 2-дезоксиаденозин, гуанозин, 2-дезоксигуанозин: 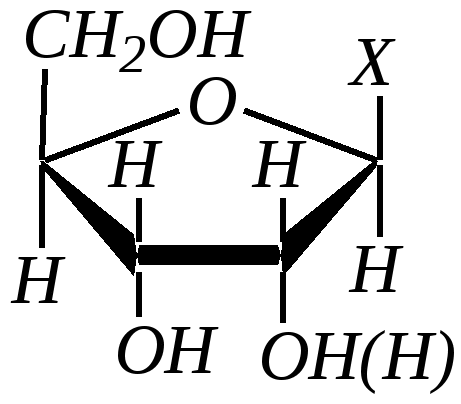 где Х — остаток пиримидинового или пуринового основания Гликозиды сахаров, как известно, подвергаются кислотному гидролизу (гл. 7.1.2.2). При гидролизе нуклеозидов образуются D-рибоза (или 2-дезокси-D-рибоза) и соответствующее гетероциклическое соединение (урацил, тимин, цитозин, аденин, гуанин). Если первичная структура нуклеиновых кислот — это полинуклеотидная цепь, то вторичная структура представляет пространственное расположение макромолекул. Это определяется внутримолекулярным и межмолекулярным взаимодействием и стабилизируется главным образом посредством водородных связей. Известны одноцепочечные нуклеиновые кислоты, цепь которых может принимать различные пространственные формы, в том числе спиралеобразные; в них плоские фрагменты пиримидина и пурина, как правило, расположены одна над другой в виде стопки. Для многих ДНК вторичная структура представляет собой комплекс из двух полинуклеотидных цепей. Такие нуклеиновые кислоты называются двухцепочечными. Как показали в 1953 году Д. Уотсон и Ф. Крик, двухцепочечные нуклеиновые кислоты в пространстве образуют структуру двойной спирали. Каждая цепь макромолекулы закручена в спираль, при этом спирали связаны между собой посредством водородных связей, которые образуются между пиримидиновыми и пуриновыми остатками. Образование таких водородных связей очень специфично и возможно только между адениновым остатком одной цепи и тиминовым остатком другой, который расположен строго напротив первого, а также между цитозиновым остатком первой цепи и гуаниновым остатком другой. И, напротив, аденин не может образовывать мультивалентные водородные связи с цитозином, а цитозин не может образовывать связи с аденином. Образование таких специфических пар — это пример комплементарности, то есть полного пространственного и зарядового соответствия взаимодействующих молекул. Комплементарные пары: Т—А
Ц—Г
В особых условиях двойная спираль может раскручиваться с образованием одноцепочечных фрагментов нуклеиновых кислот. В состав клеточного ядра бактерий входят ДНК с молекулярной массой 2,8106. В ядрах клеток высших животных и растений находятся ДНК большой длины ( до 2 мм) и молекулярной массой > 5109. Рибонуклеиновые кислоты, подобно ДНК, являются необходимыми компонентами живых клеток. Разные типы РНК имеют различные биологические функции. В клетке встречаются в основном три типа РНК: рибосомальные, транспортные и информационные. Рибосомальные РНК имеют молекулярную массу 104 106. Транспортные РНК способны связываться с аминокислотами, причём каждый вид только с определённой аминокислотой; их молекулярная масса 3104. Информационные РНК, участвуя в передаче генетической информации, определяют аминокислотную последовательность синтезируемого белка. Все вместе они образуют белоксинтезирующий аппарат клетки. Генетическая информация — это набор данных, определяющих структурные и функциональные свойства клеток. Носителями генетической информации служат ДНК (в отдельных случаях РНК); генетическая информация (генетический код) об аминокислотной последовательности белка зашифрована в нуклеотидной последовательности нуклеиновых кислот. Каждая аминокислота синтезируемого белка кодируется последовательностью трёх нуклеотидов (триплетом, кодоном), однако большинство аминокислот кодируется более чем одним триплетом, часто — двумя различными триплетами, в некоторых случаях даже четырьмя. В процессе митоза генетическая информация передаётся при расплетении двух цепей спирали ДНК. Затем происходит репликация (дубликация, копирование) за счёт того, что на каждой старой цепи синтезируется новая дочерняя цепь, при этом происходит строго специфическое связывание пар нуклеиновых оснований А–Т и Г–Ц водородными связями, благодаря чему получается точная копия молекул ДНК. 12.6. алкалоиды Алкалоиды — азотосодержащие органические основания природного (преимущественно растительного) происхождения. Обычно алкалоидам присваивают тривиальные названия, используя видовые или родовые названия растений–алкалоидоносов с прибавлением суффикса -ин, например, атропин (выделен из растения Atropabelladonna), стрихнин (выделен из StrychnosnuxVomica). Большинство алкалоидов — гетероциклические соединения. В растениях они существуют обычно в виде солей органических кислот — лимонной, яблочной, щавелевой, янтарной и др. В настоящее время выделено несколько тысяч алкалоидов. Содержание их в растениях невелико (0.001—2%), однако известны уникальные растения, в которых оно достигает 10—18% (например, хинное дерево, листья табака). Часто алкалоиды локализуются лишь в определённых органах растения, например, в листьях, семенах, клубнях, корнях, коре. Некоторые алкалоиды — сильные яды (например, стрихнин). Многие алкалоиды обладают специфическим, зачастую уникальным физиологическим действием и используются в медицине (например, атропин, кофеин, кодеин, папаверин, эфедрин). Это обычно бесцветные кристаллические вещества горького вкуса, практически не растворимые в воде, но растворимые в органических растворителях. Их соли, напротив, хорошо растворимы в воде и не растворимы в органических растворителях. Алкалоиды экстрагируют (обычно с помощью хлороформа или 1,2-дихлорэтана) из предварительно обработанного щелочными агентами (водным раствором аммиака, карбоната натрия и др.) растительного сырья либо непосредственно из этого сырья водным раствором кислоты или спиртом (обычно этанолом). Химическая классификация алкалоидов основана на строении углеродно-азотного скелета молекулы (например, изохинолиновые алкалоиды, пуриновые алкалоиды и др.). Рассмотрим некоторые представители разных групп алкалоидов. Пирролидиновые и пиридиновые алкалоиды 1) Гигрин — алкалоид, выделенный из растения Erythroxyloncoca. 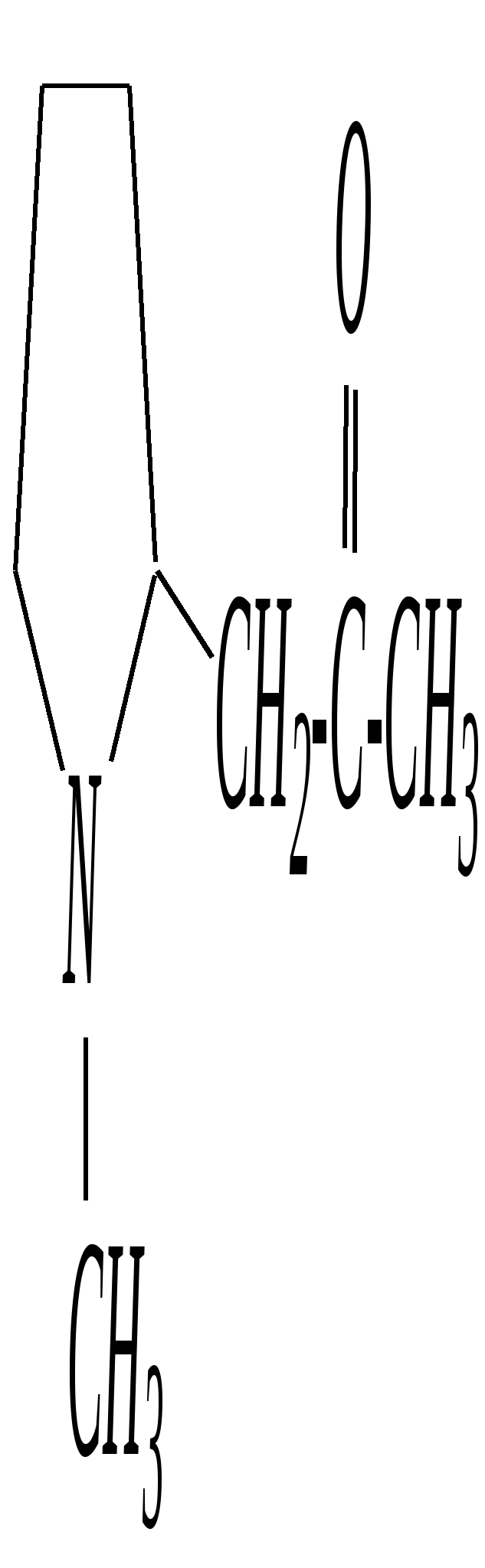 Был открыт в 1862 году Вёлером и Лоссеном. Гигрин — бесцветная маслянистая жидкость; температура кипения 365— 367 К / 20 мм рт.ст. Оказывает общее стимулирующее действие. 2) Никотин содержится в листьях табака (до 8%). 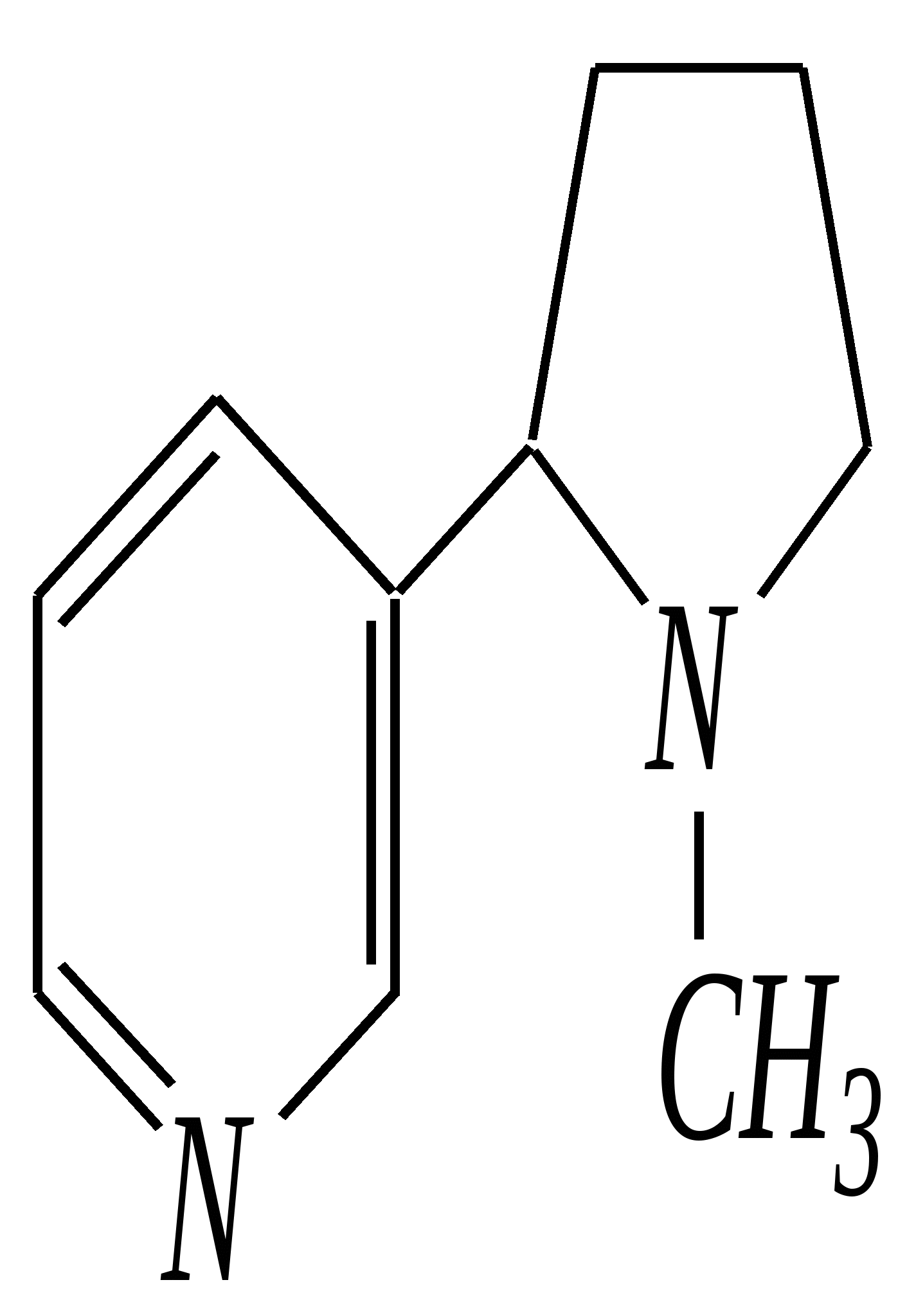 Его получают из отходов табачной промышленности. Впервые в чистом виде получен в 1828 году, синтез проведён в 1904 году Пикте. Никотин — бесцветная маслянистая жидкость, растворимая в воде; температура кипения 519 К. Токсичный алкалоид. Летальная доза для человека 40 мг. Воздействует на центральную и вегетативную нервные системы, сужает кровеносные сосуды. При окислении триоксидом хрома CrO3 образуется никотиновая кислота (гл. 12.4.1, 12.4.8). 3) Кониин — чрезвычайно токсичный алкалоид. 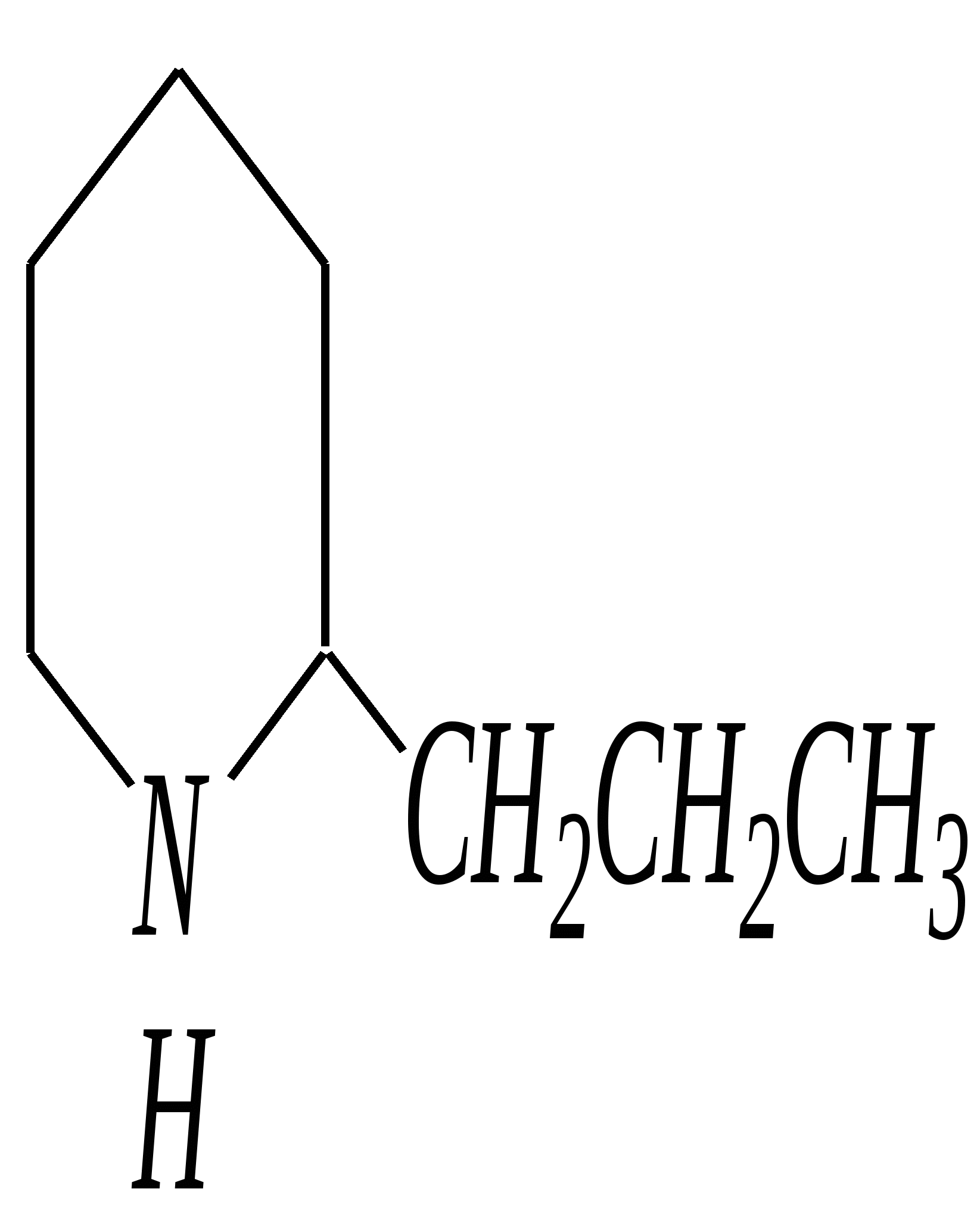 Синтез кониина, осуществлённый Ладенбургом в 1886 году, был первым синтезом алкалоида: 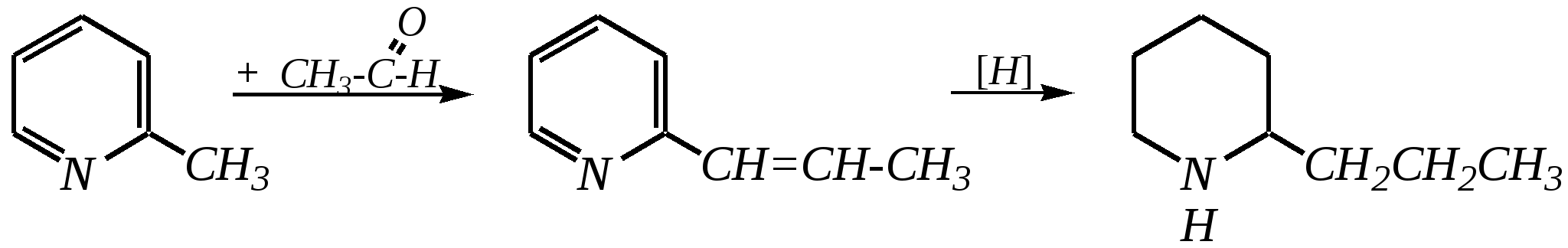 Кониин — маслянистая жидкость, мало растворимая в воде; температура кипения 439 К. Это очень токсичное вещество, парализует окончания двигательных и чувствительных нервов, участвующих в иннервации кожи; при больших дозах смерть наступает вследствие прекращения дыхания. 4) Анабазин обнаружен в ежовнике безлистном, в небольших количествах содержится также в табачных листьях.  Анабазин — бесцветная маслянистая жидкость; температура кипения 549 К. Это чрезвычайно токсичный алкалоид. Его используют в качестве сильнодействующего инсектицида. 5) Лобелин обнаружен в растениях Lobeliainflata. 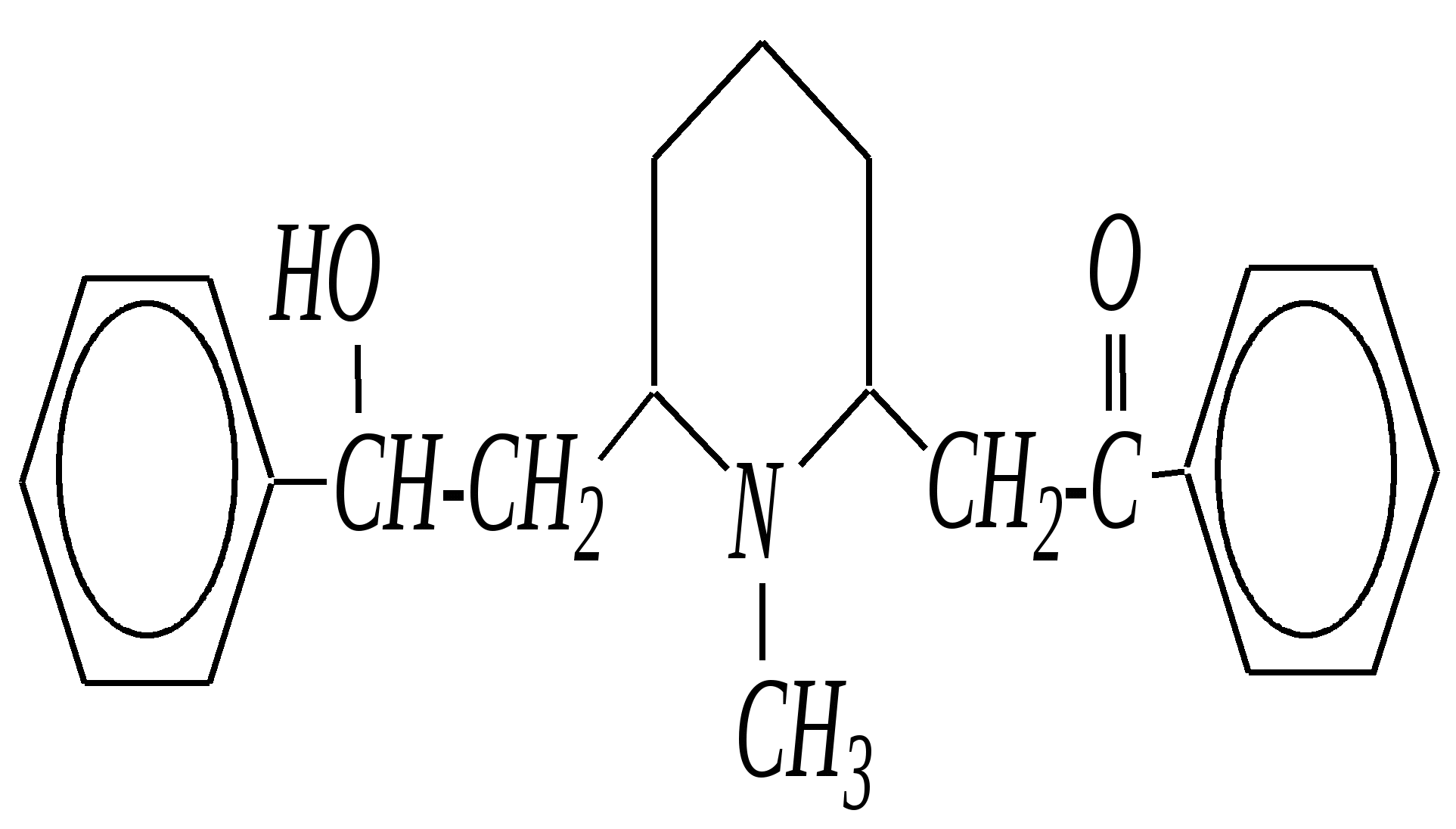 Обладает свойством возбуждать дыхательные центры и применяется в медицине для облегчения и усиления дыхания. Тропановые алкалоиды Тропан — бициклическое азотосодержащее соединение: 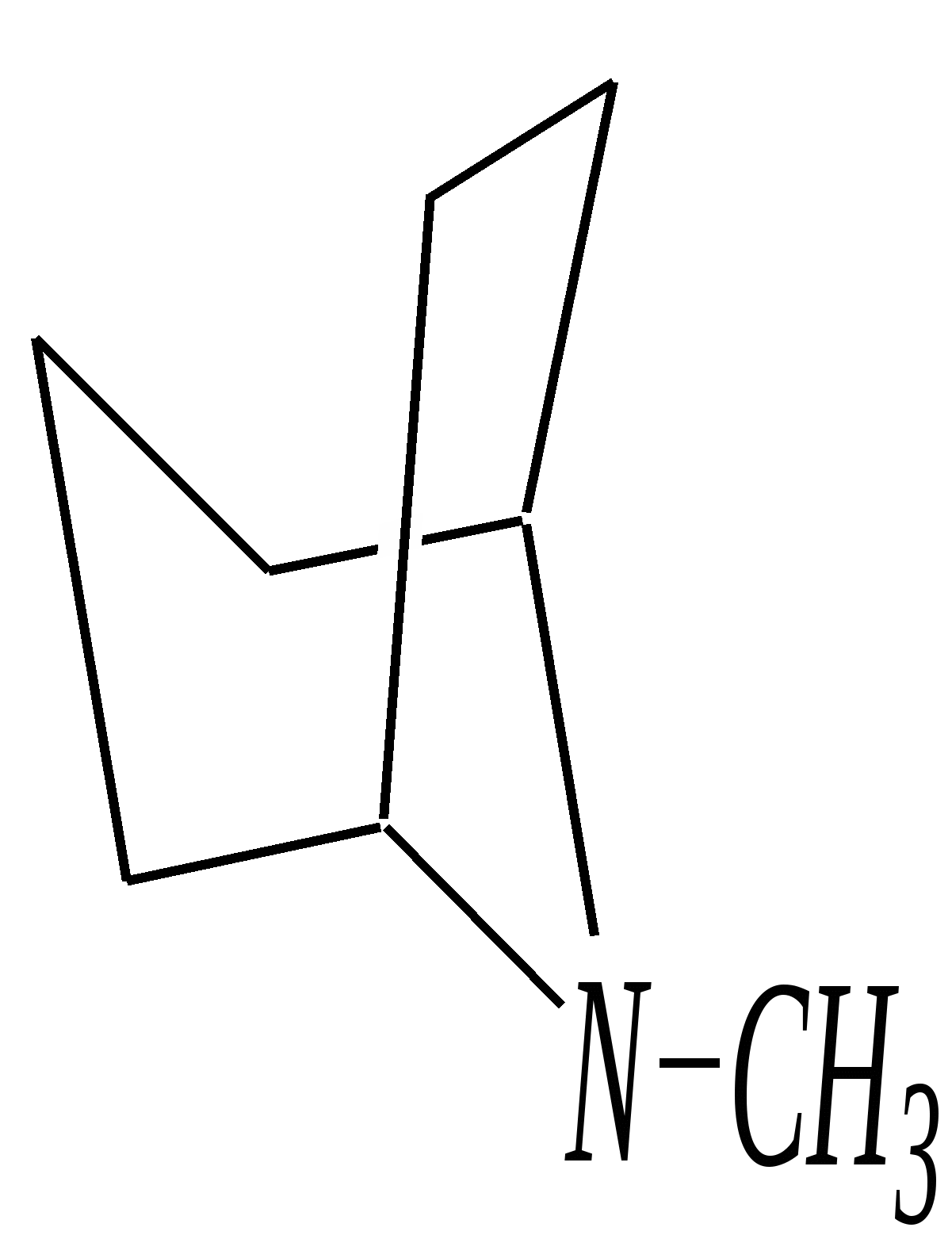 Однако сам тропан алкалоидом не является. 6) Атропин содержится в растениях семейства паслёновых — беладонне, дурмане, белене. 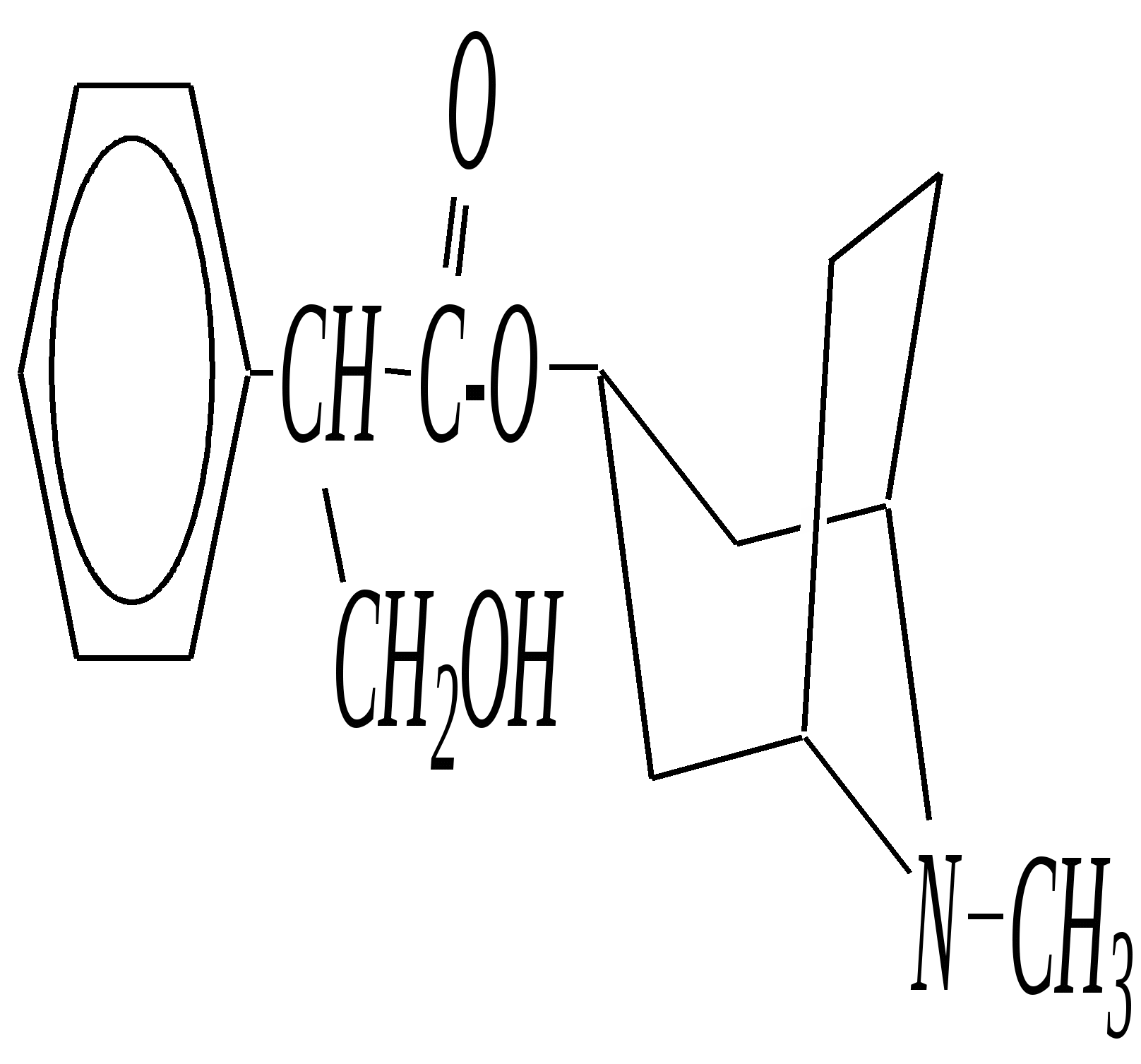 Атропин — бесцветное кристаллическое вещество; температура плавления 389 К. Действует на парасимпатическую нервную систему, вызывает расширение зрачка. Применяется в офтальмологии. Кроме того, служит противоядием при отравлении мухомором. Особенностью атропина является его способность уже в малых дозах подавлять деятельность желёз; так, он сокращает или совсем приостанавливает выделение слюны, пота, мочи, и это его свойство используют в медицине. 7) Кокаин — основной алкалоид растения Erythroxyloncoca. В южноамериканских листьях его содержится до 1.3%. 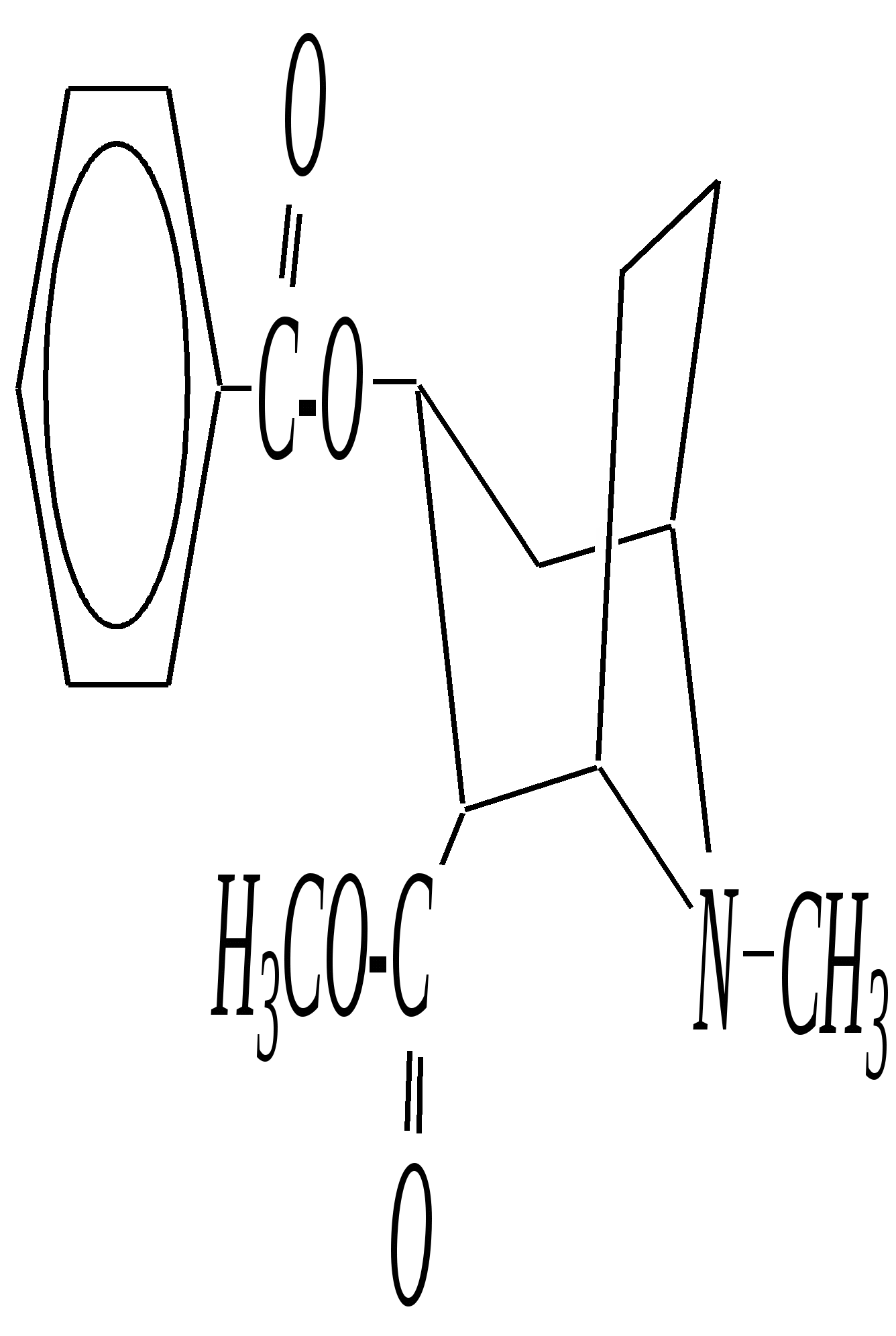 Кокаин — бесцветное кристаллическое вещество; температура плавления 371 К. Стимулирует и возбуждает нервную систему, вызывает эйфорию, а затем торможение нервной системы. Вызывает сильную местную анестезию. Это одно из первых местноанестезирующих и наркотических средств. При частом применении может развиться болезненное пристрастие к нему. Большие дозы кокаина вызывают смерть вследствие паралича дыхательного центра. Синтезирован в 1923 году Вильштеттером. Алкалоиды индола и имидазола 8) Резерпин выделен из корней растений рода раувольфия. 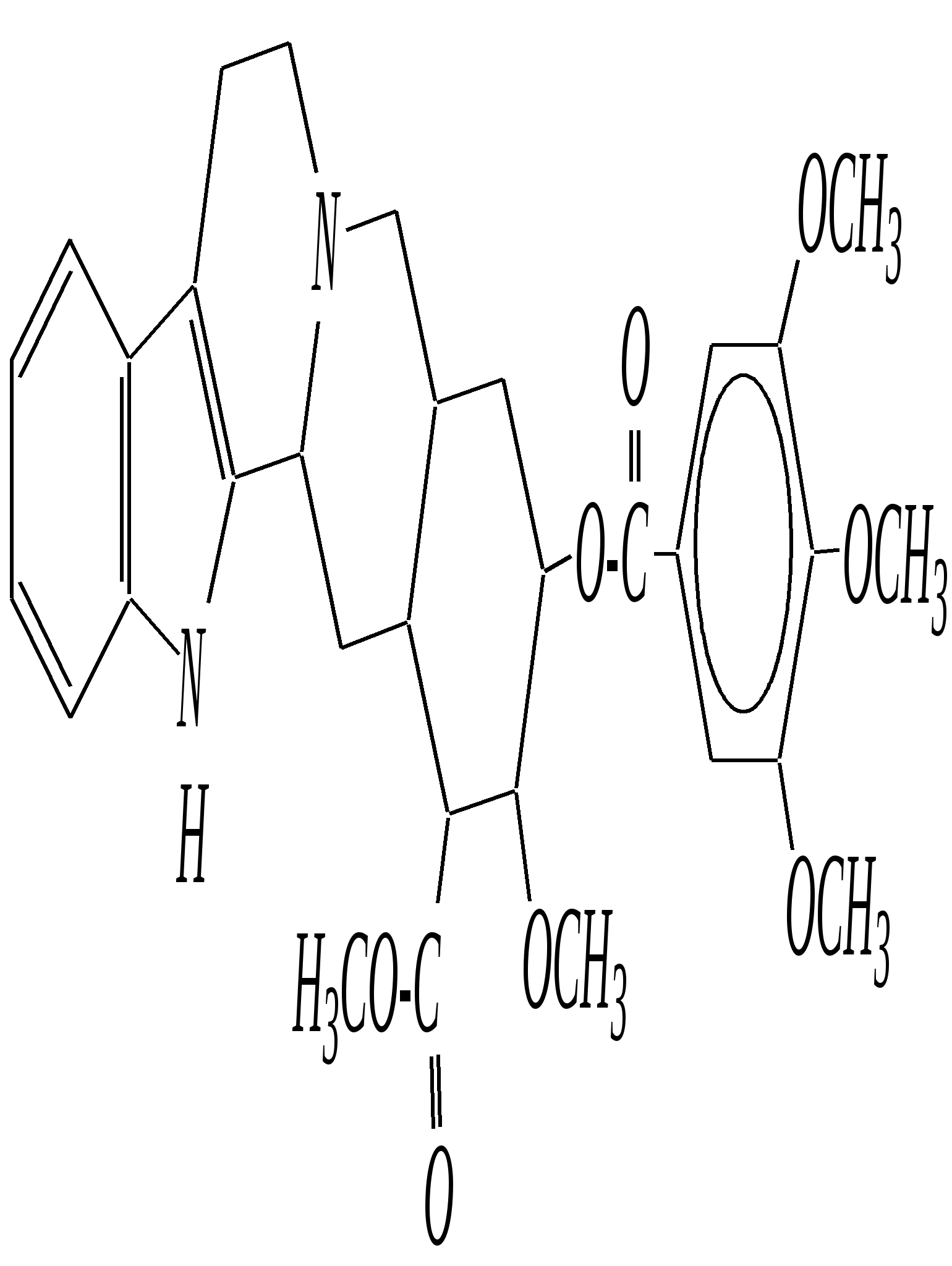 Его строение установил и провёл полный синтез Р. Вудворд в 1956 году. Резерпин — бесцветное кристаллическое вещество, нерастворимое в воде; температура плавления 558 К. Применяется в медицине как гипотензивное средство (понижающее артериальное давление). 9) Стрихнин — одно из наиболее ядовитых веществ; его выделяют из семян многих видов чилибухи (Strychnos), особенно много — в рвотном орехе (Nuxvomica).  В малых дозах применяется как тонизирующее средство. 10) Лизергиновая кислота входит в состав алкалоидов спорыньи. 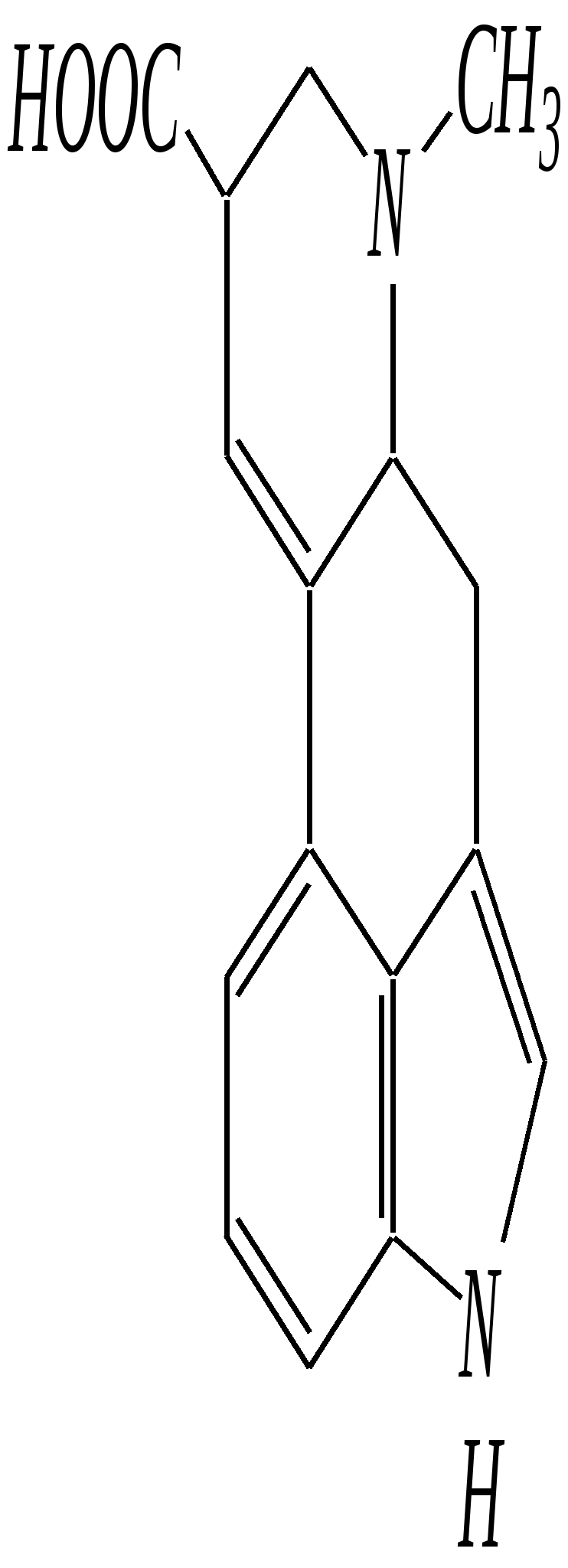 Полный синтез провёл Р. Вудворд в 1954 году. Лизергиновая кислота — бесцветное кристаллическое вещество, нерастворимое в воде; температура плавления 511 К. Амид лизергиновой кислоты — эргин — проявляет высокую физиологическую активность: сужает кровеносные сосуды, действует на гладкую мускулатуру матки, облегчает роды. Диэтиламид лизергиновой кислоты — препарат ЛСД-25 — является сильным галлюциногенным средством. 11) Пилокарпин содержится в листьях растения Pilocarpuspennatifolius. 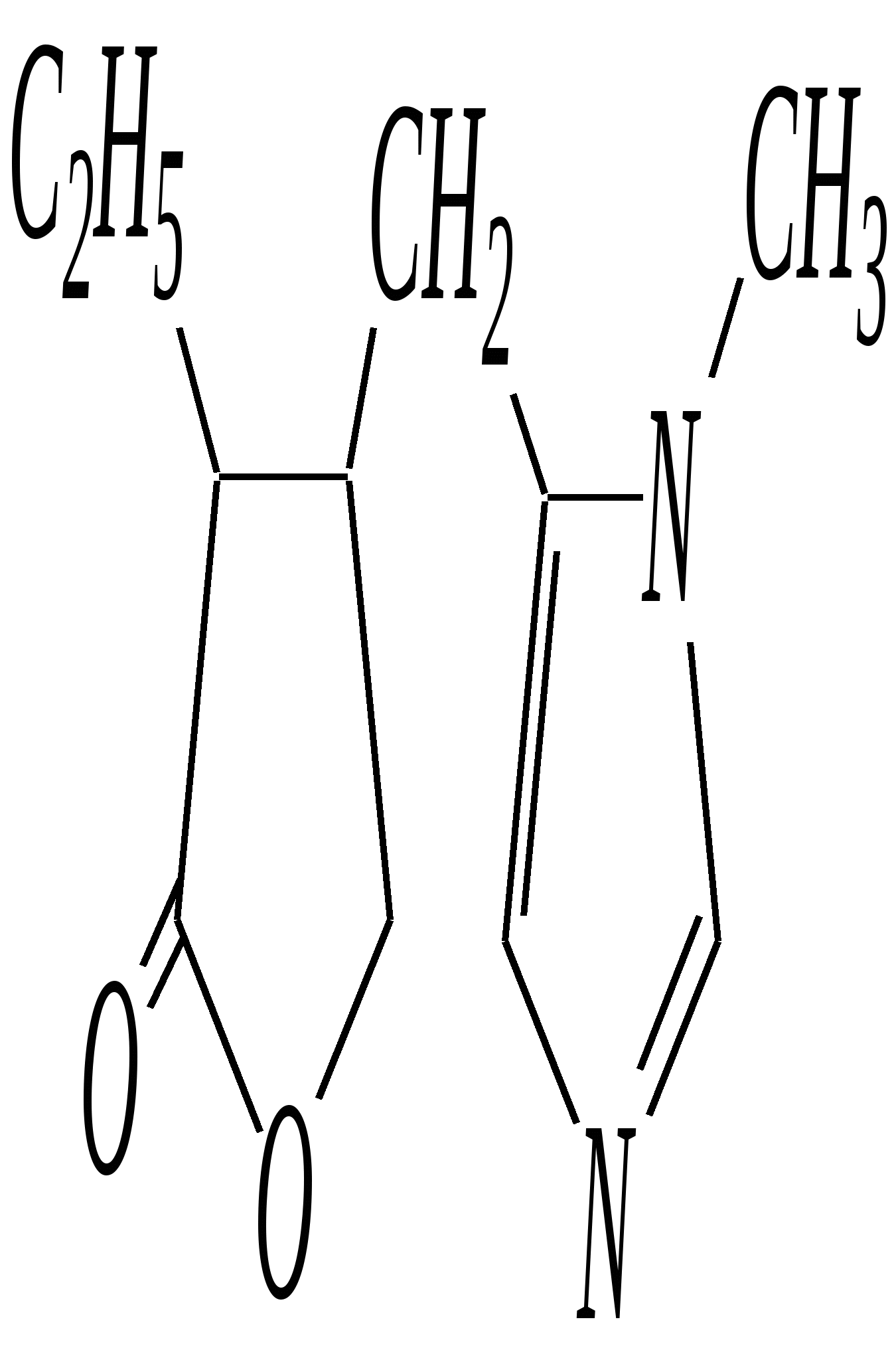 Физиологически очень активен, повышает деятельность желёз, увеличивает отделение пота и слюны и усиливает перистальтику кишечника. Являясь антагонистом атропина, он при введении в глаз вызывает сужение зрачка. Используется при лечении глазных заболеваний и, кроме того, в качестве потогонного средства. Хининовые алкалоиды 12) Хинин — алкалоид коры хинных деревьев, принадлежащих к семействам Cinchonaи Remijia. 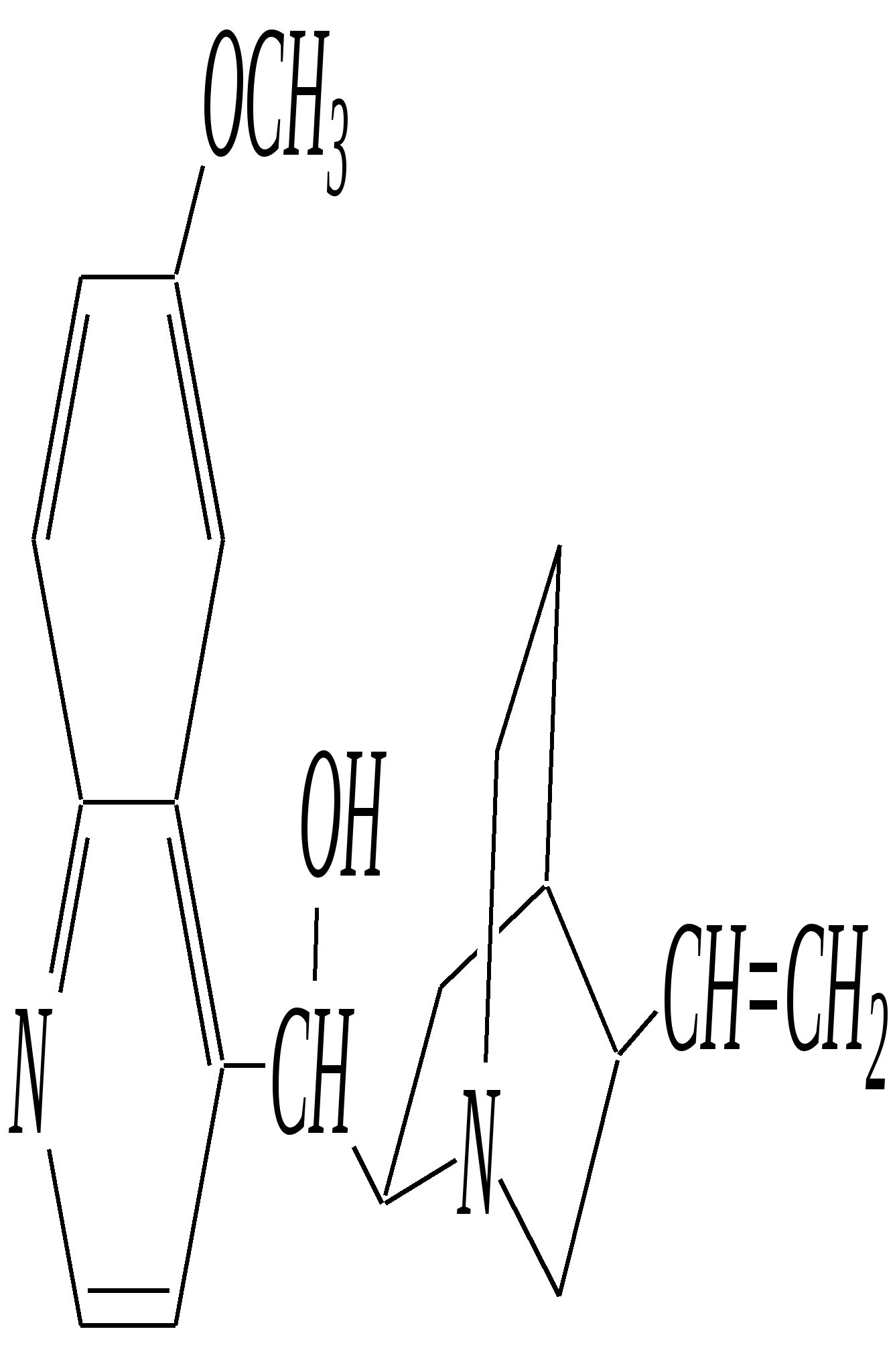 Полный синтез проведён Р. Вудвордом и В. Дёрингом в 1944 году. Хинин — бесцветный порошок, малорастворимый в воде; температура плавления 450 К. Является одним из первых противомалярийных средств. 13) Цинхонин — так же, как и хинин, это алкалоид коры хинных деревьев, принадлежащих к семействам Cinchonaи Remijia. 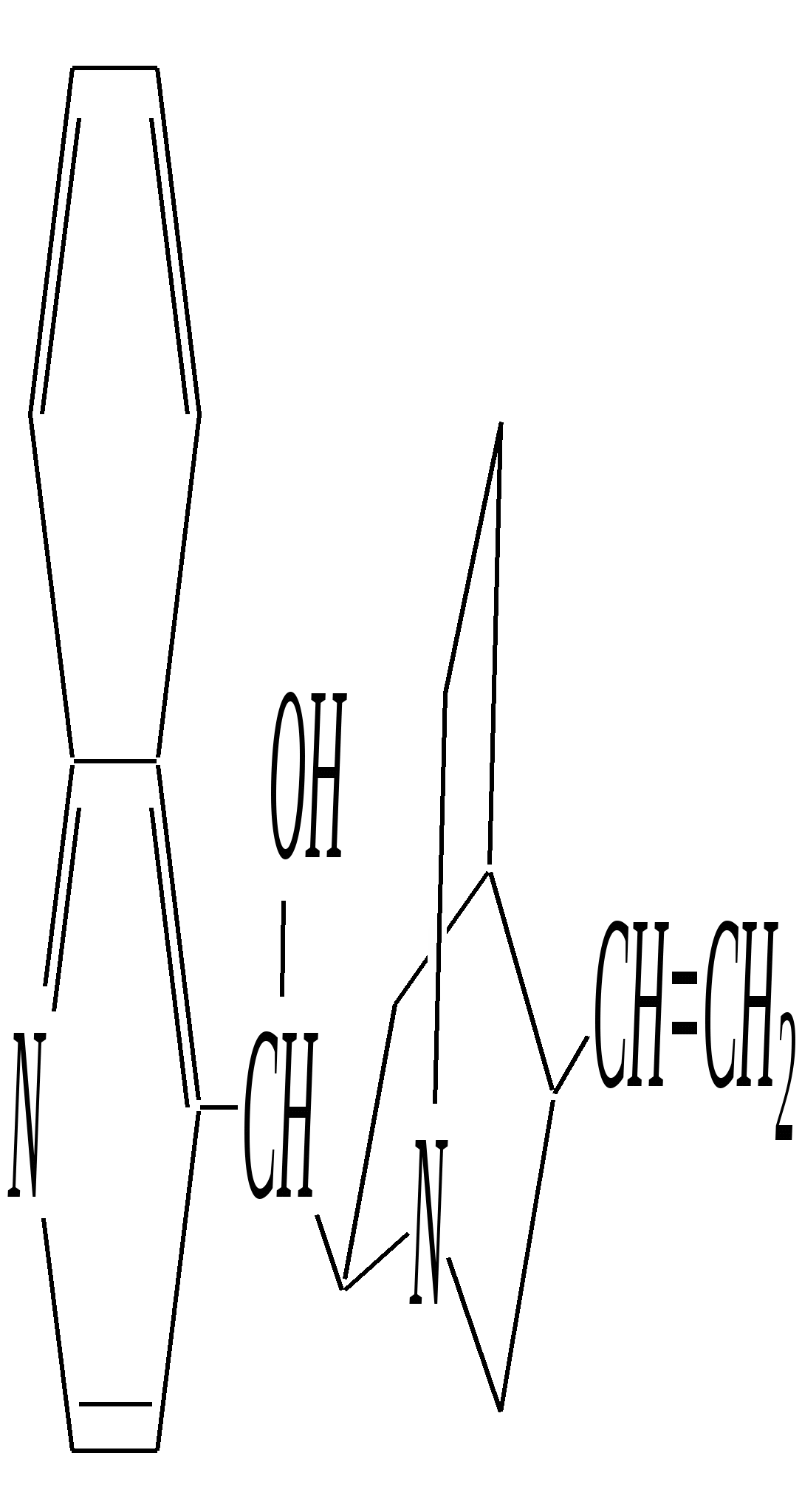 Цинхонин — бесцветный порошок, трудно растворимый в воде; температура плавления 478 К. Наряду с хинином применялся в качестве «противолихорадочного» средства в составе хинной коры. Изохинолиновые алкалоиды 14) Папаверин — алкалоид опия. 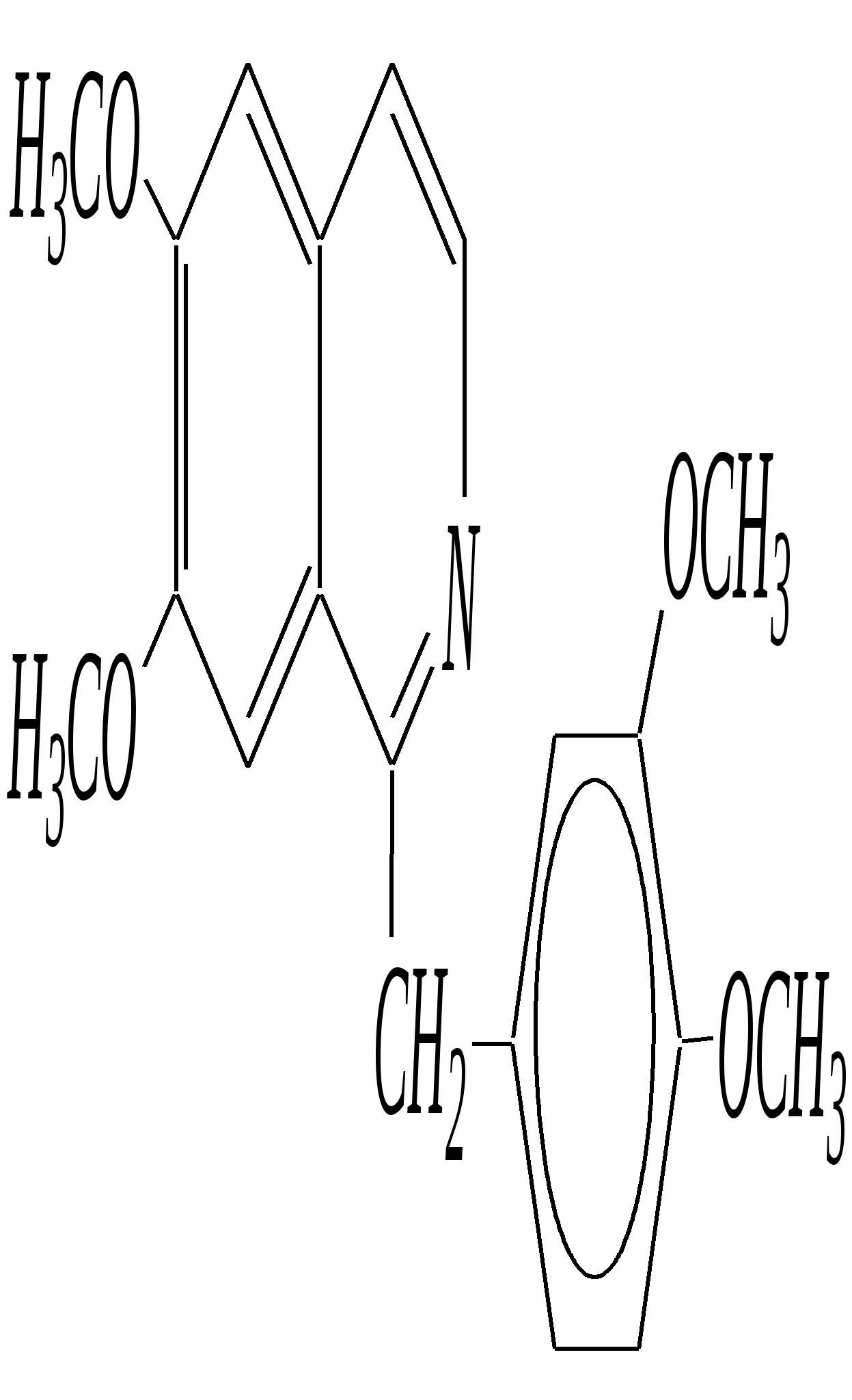 Папаверин — бесцветное кристаллическое вещество, практически нерастворим в воде; температура плавления 420 К. Применяется в качестве спазмолитического и сосудорасширяющего средства. 15) Морфин — так же, как и папаверин, является алкалоидом опия. 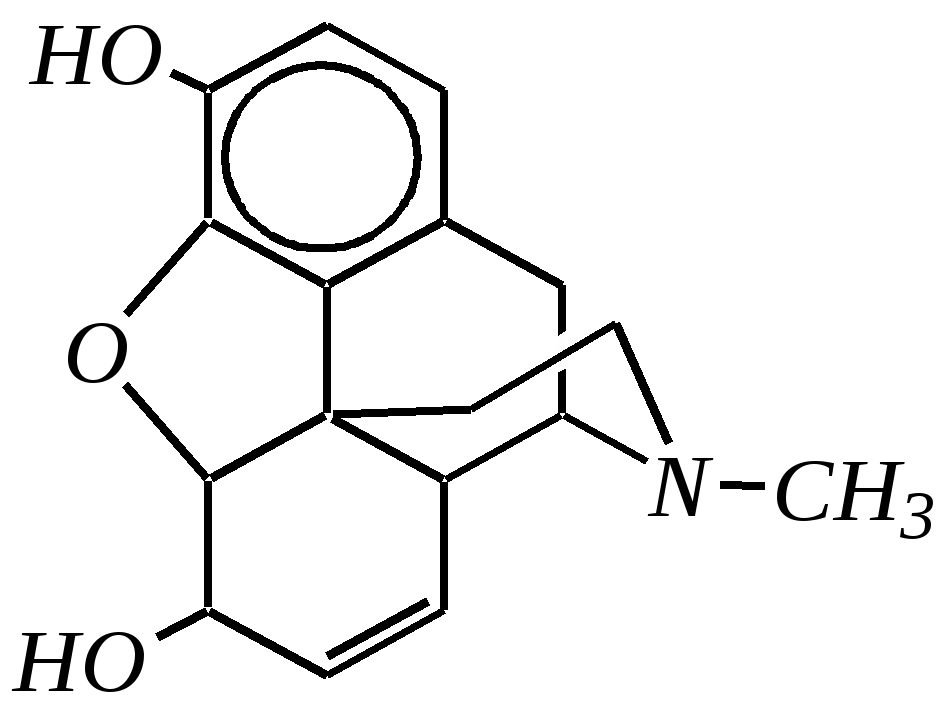 Полный синтез был осуществлён в 1951—1956 гг. Морфин — бесцветное кристаллическое вещество, растворимое в кислотах и щелочах; температура плавления 527 К. Является сильным обезболивающим средством, наркотик, вызывает эйфорию. Регулярное применение вызывает привыкание. Ослабляет и парализует действие центральной нервной системы. 16) Кодеин также является алкалоидом опия. 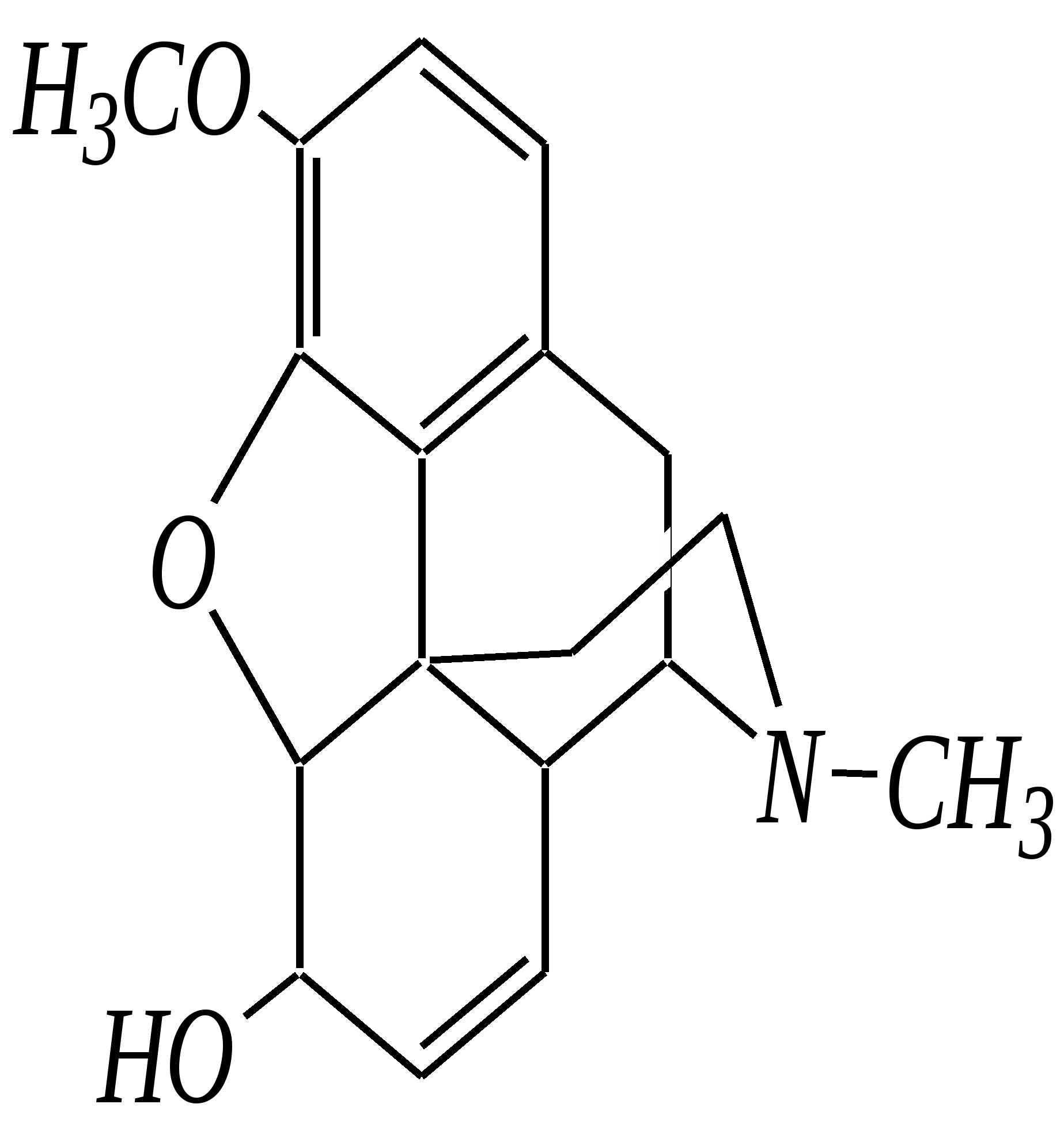 Растворим в кислотах, но нерастворим в щелочах. В виде солей его используют в медицине в качестве болеутоляющего и противокашлевого средства. Пуриновые алкалоиды 17) Кофеин содержится в зёрнах кофе, листьях чая. 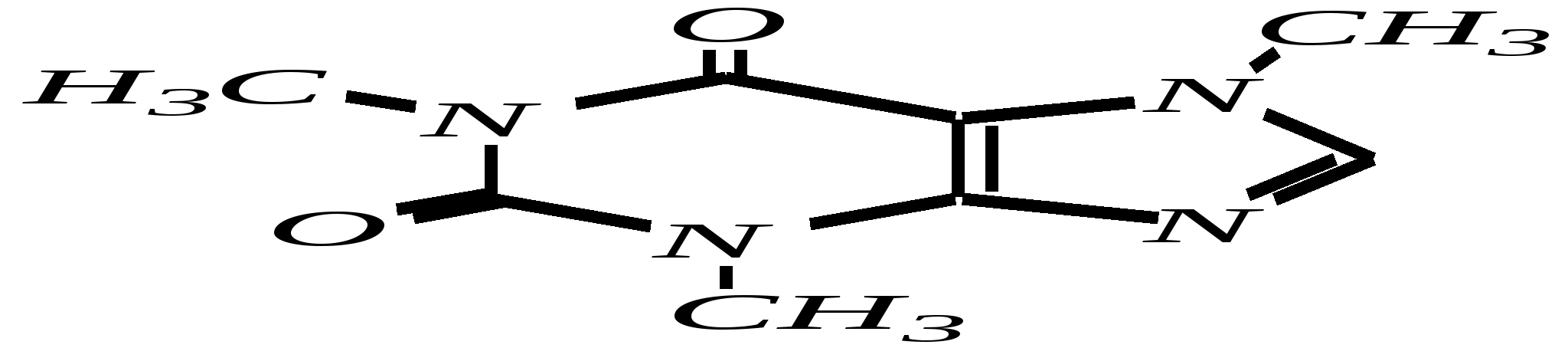 Кофеин — бесцветное кристаллическое вещество, растворимое в воде; температура плавления 508 К. Это эффективное средство, возбуждающее центральную нервную систему и стимулирующее работу сердца. 18) Теофиллин — алкалоид чая. 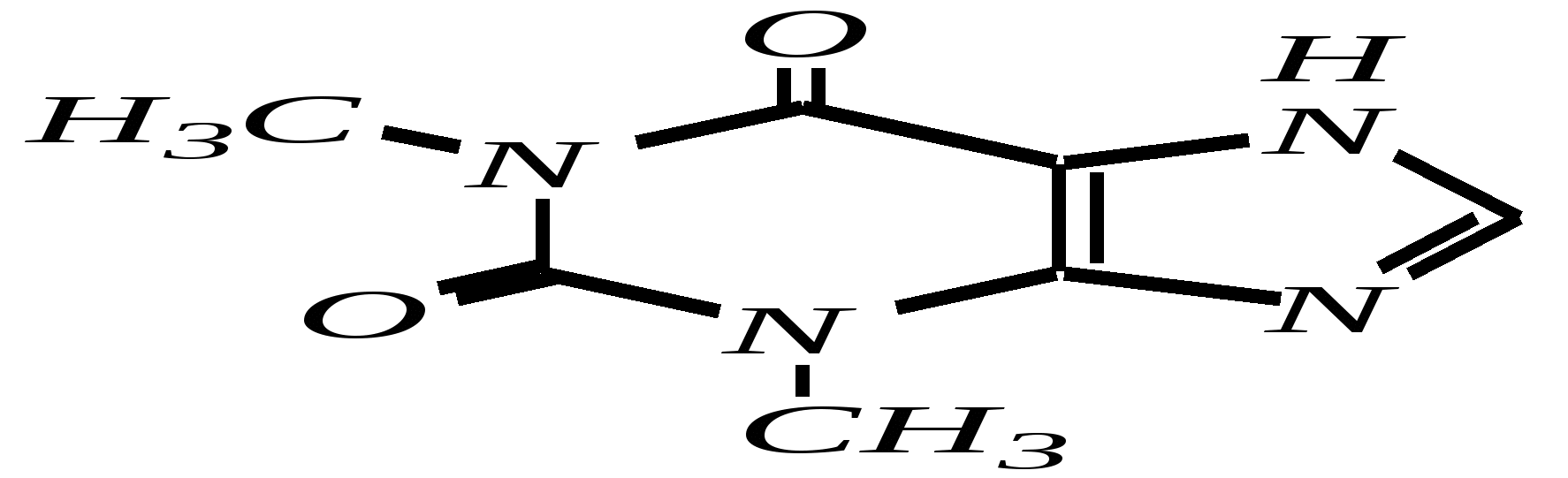 Обладает сильными мочегонными свойствами (является диуретиком). 19) Теобромин — алкалоид какао. 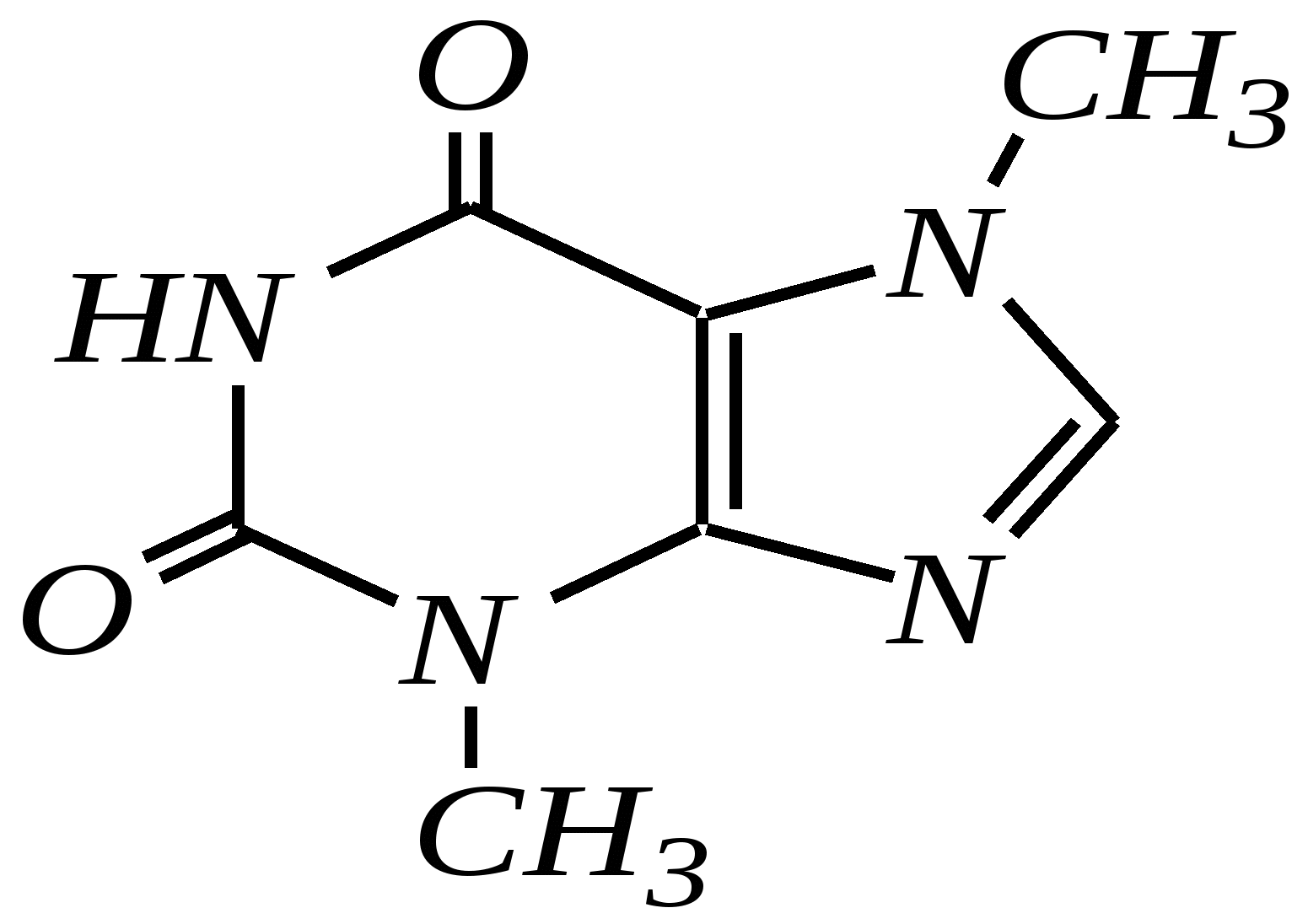 Так же, как и теофиллин, обладает мочегонным действием. вопросы и упражнения
|