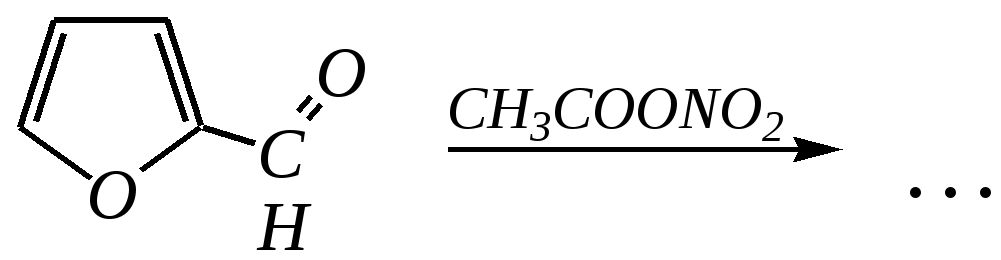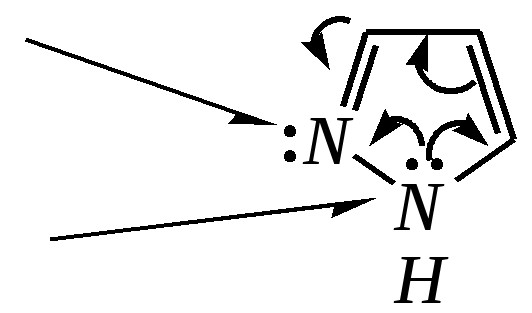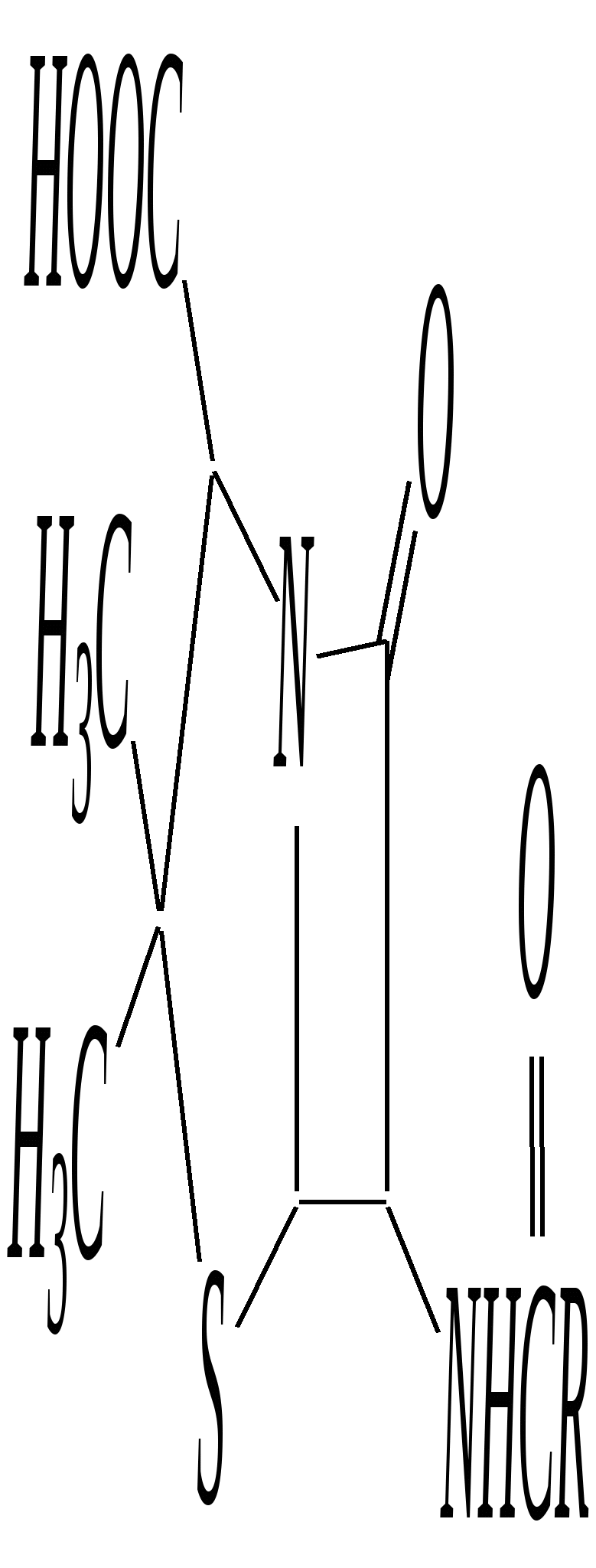глава 12. Гетероциклические соединения
 Скачать 2.57 Mb. Скачать 2.57 Mb.
|
|
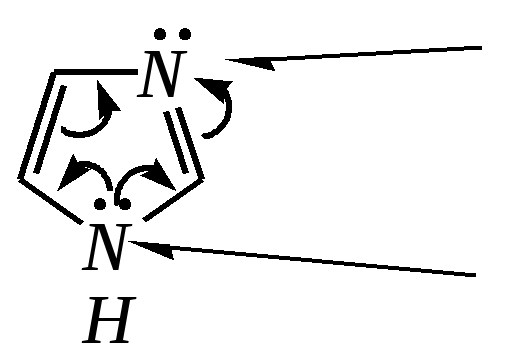
12.2.4. особенности индола Название индола как конденсированной системы, содержащей гетероциклическое кольцо пиррола, — бензо[b]пиррол. 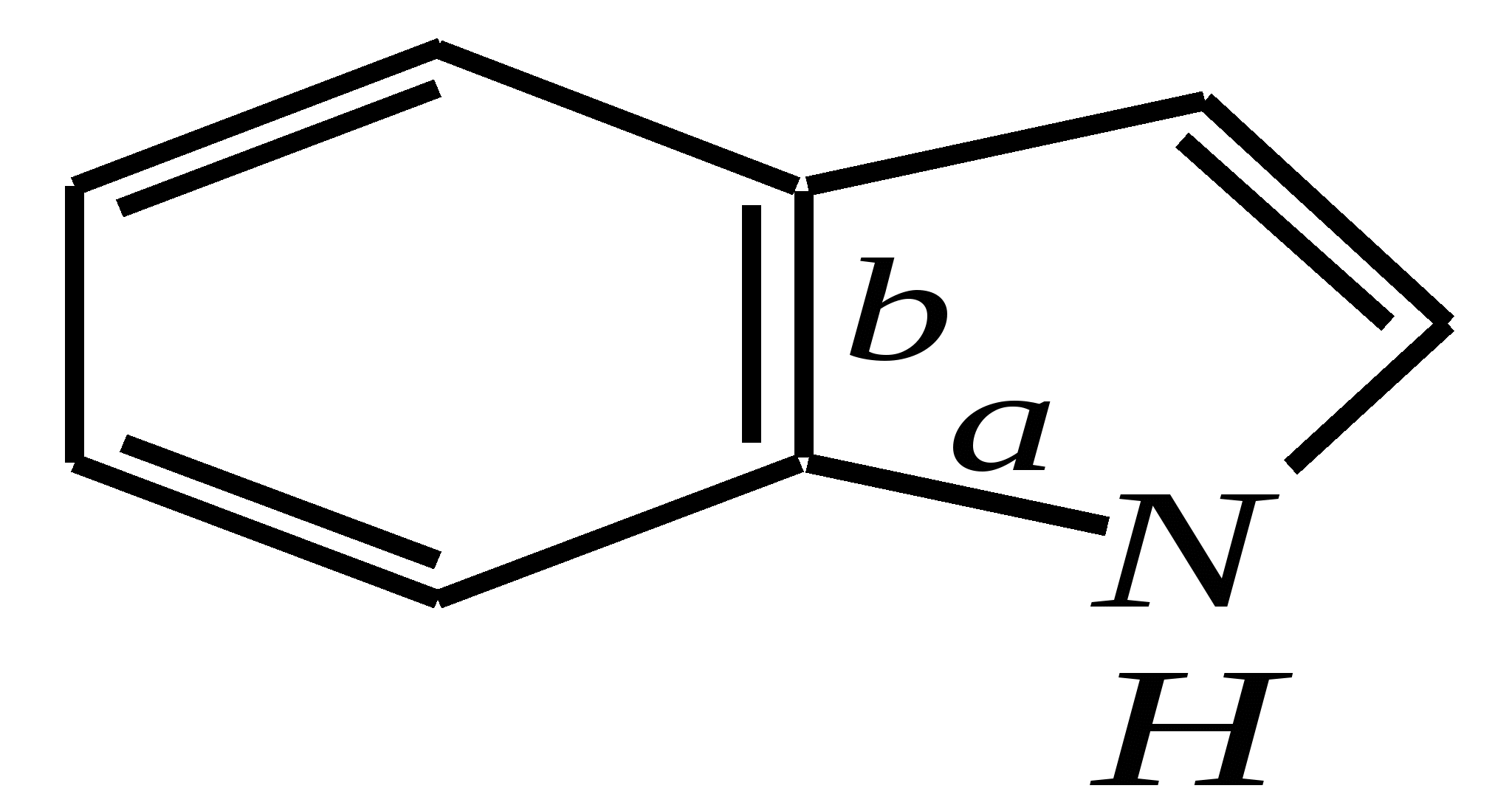 Нумерацию атомов в индоле начинают с гетероатома, атомы углерода в пиррольном цикле могут быть обозначены также греческими буквами: 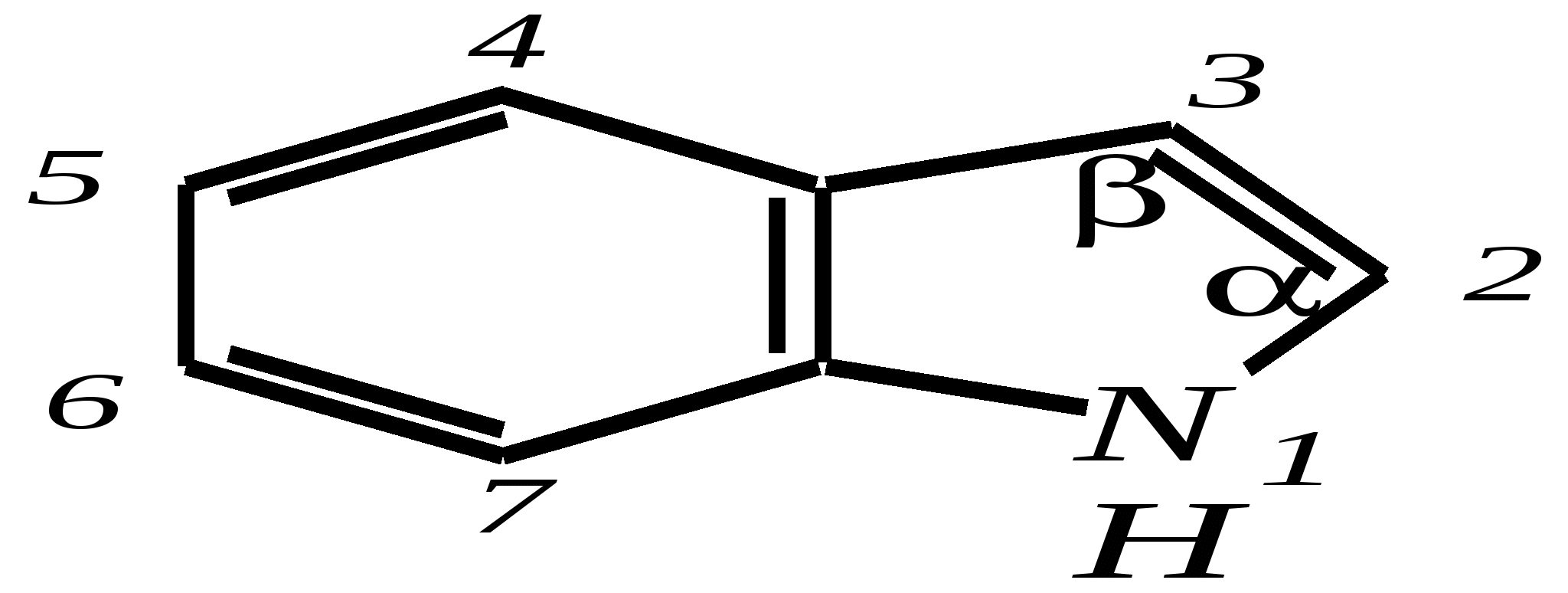 Индол и его производные — это бесцветные кристаллические вещества, не растворяющиеся в воде и имеющие своеобразный неприятный запах. 12.2.4.1. Строение Молекула индола представляет 10--электронную бициклическую сопряжённую систему, в которой участвует гетероатом со своей неподелённой электронной парой. В результате электронодонорного мезомерного эффекта атома азота повышается электронная плотность в положениях 3, 5 и 7: 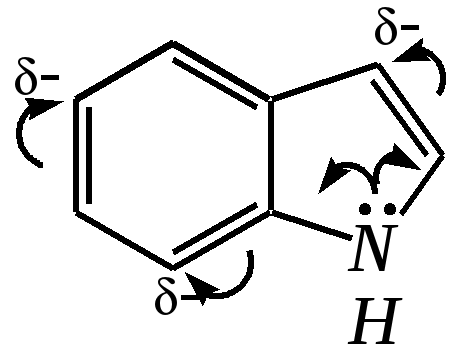 12.2.4.2. Кислотно-осόвные свойства Сильные кислоты протонируют индол в положение 3, тем самым нарушается сопряжённая система пиррольного цикла, что приводит к его раскрытию и дальнейшим превращениям (димеризация, олигомеризация): 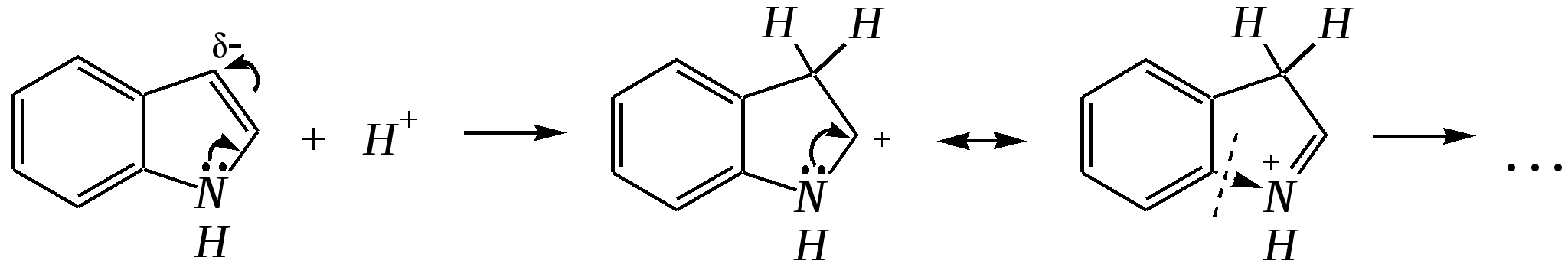 Индол является слабой NH-кислотой (по кислотности сравним с пирролом). Он образует соли при действии щелочей, алкоголятов и металлорганических соединений (аналогично пирролу). 12.2.4.3. Реакции с электрофилами Ввиду выраженных ацидофобных свойств индола его реакции с сильными электрофилами в кислой среде приводят к продуктам олигомеризации. С более мягкими электрофилами осуществляется замещение в -положение. Если оно занято, то реакция протекает в -положение. Объяснить такое направление электрофильного замещения можно сравнением устойчивости образующихся -комплексов: 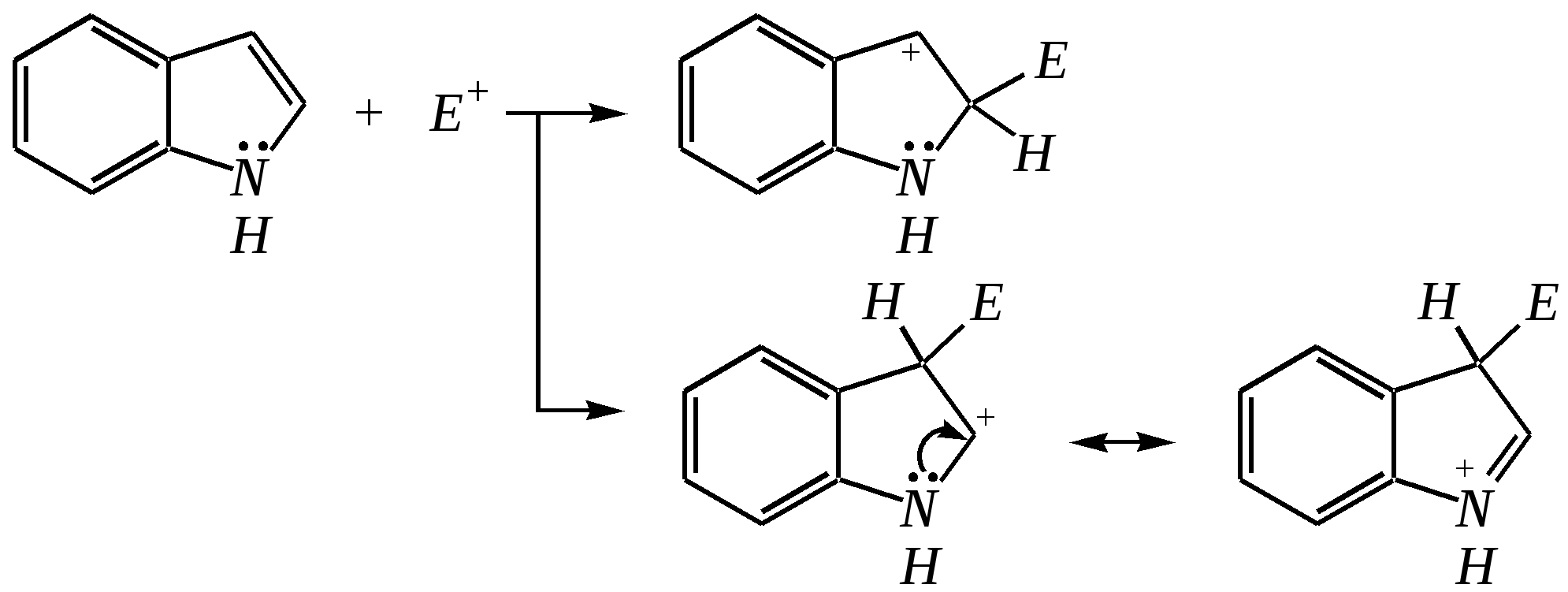 (Здесь не приведены граничные структуры с участием -электронной плотности бензольного кольца по причине их значительно меньшего вклада, но таких структур было бы в каждом случае на три больше.) Как видно из приведённых направлений взаимодействия индола с электрофильной частицей, делокализация положительного заряда в случае атаки по -атому (второе направление) полнее и такой -комплекс устойчивее. Нитрование индола осуществляется так же, как и пиррола, через образование солей, сульфирование — пиридинсульфотриоксидом, а для бромирования используется комплекс брома с диоксаном: 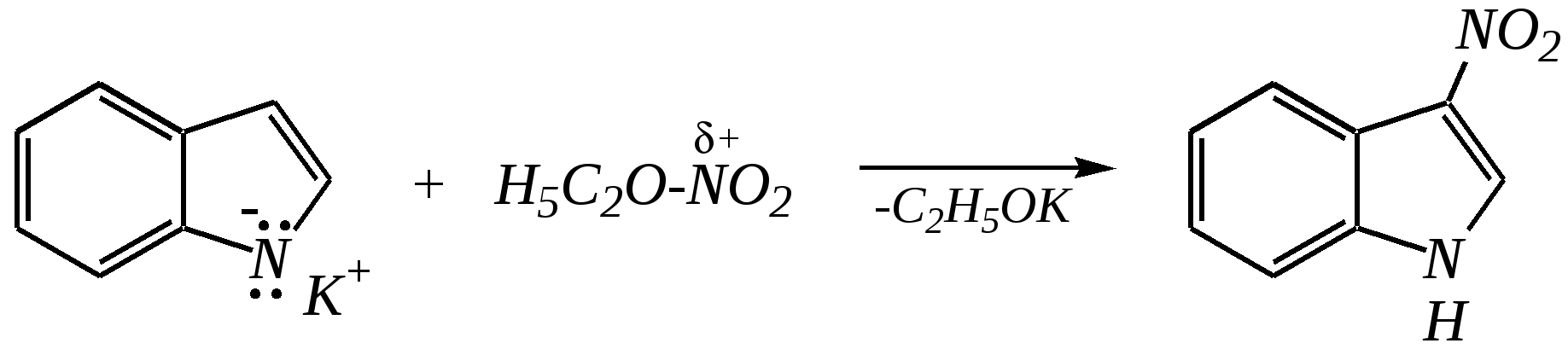 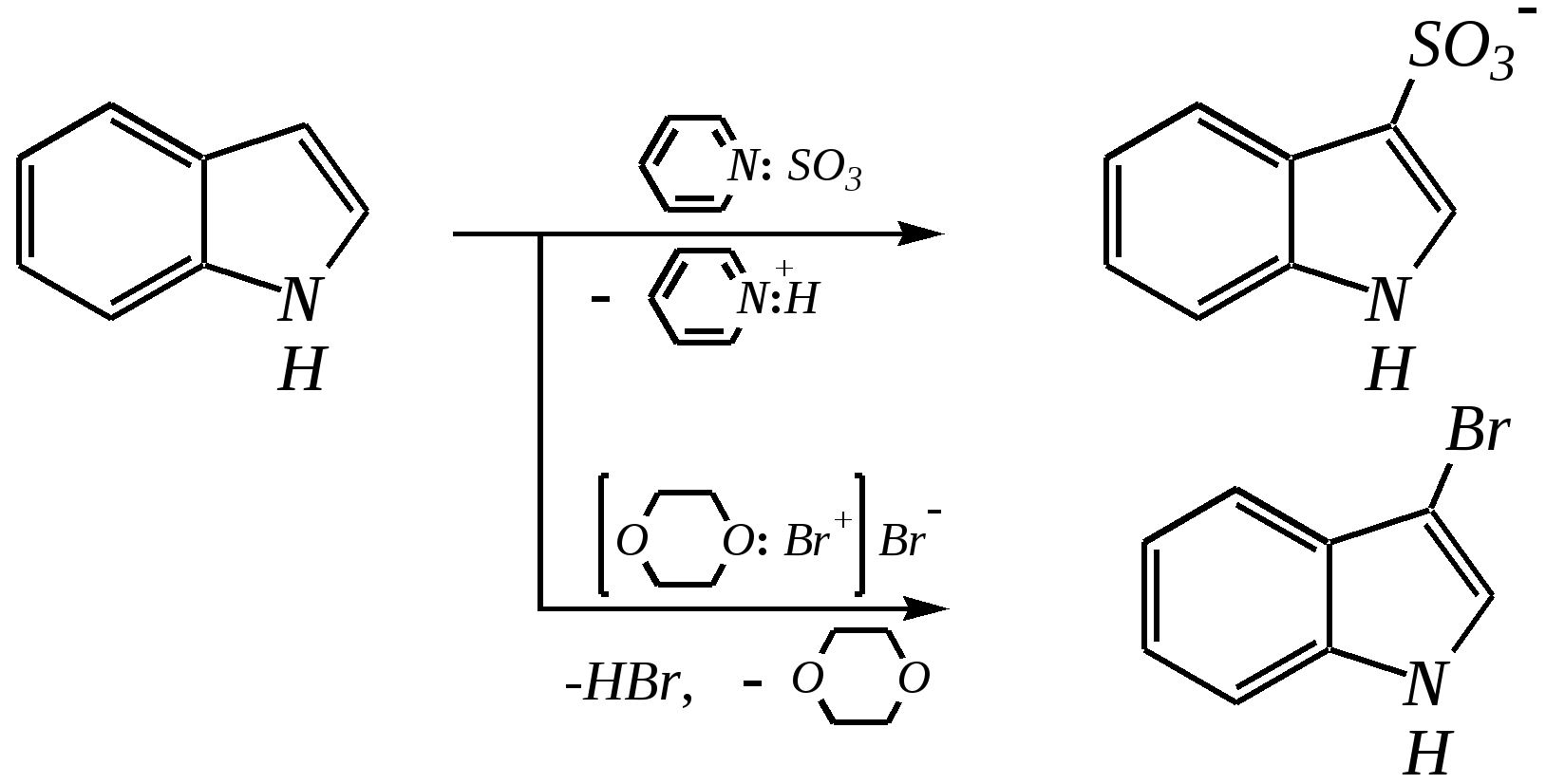 Алкилирование может осуществляться как по атому азота, так и по атому углерода. Направление реакции определяется главным образом температурой, а также природой металла и растворителем. Это можно изобразить схемой: 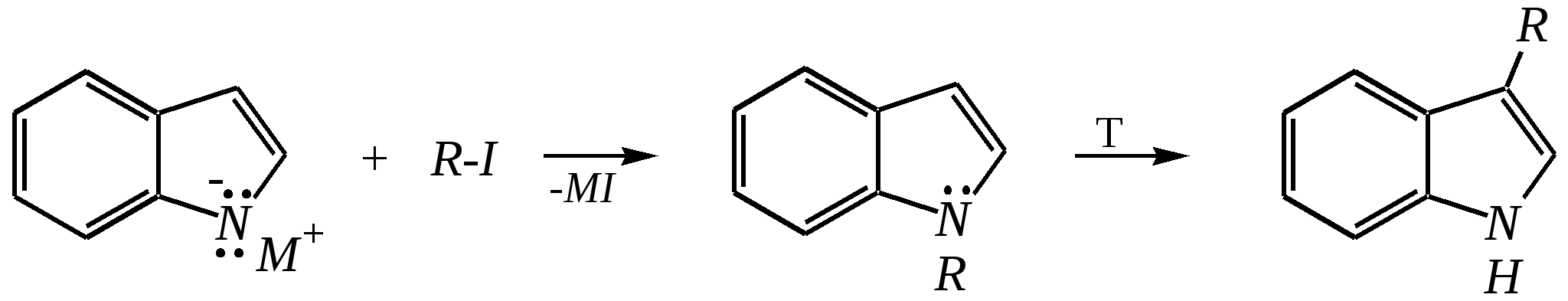 12.2.4.4. Реакции окисления Мягкое окисление индола даёт синий краситель индиго: 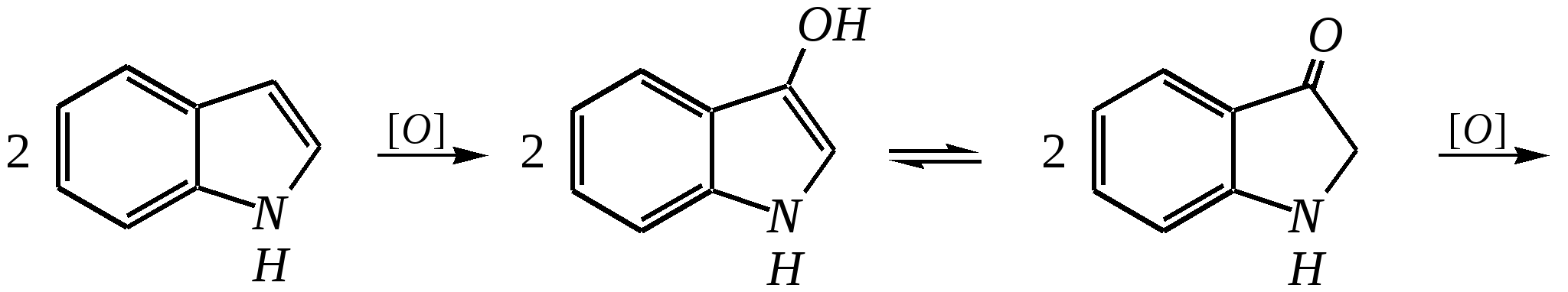 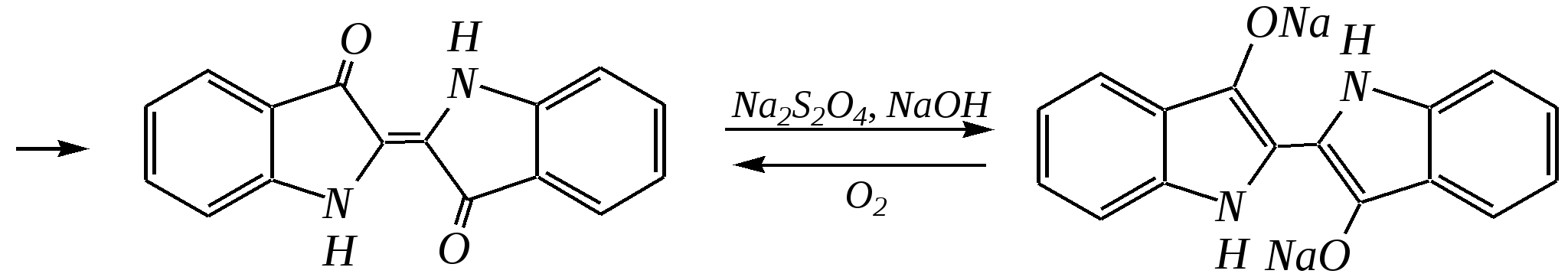 индиго (синего цвета) соль белого индиго Сильными окислителями (KMnO4) индиго окисляется до изатина: 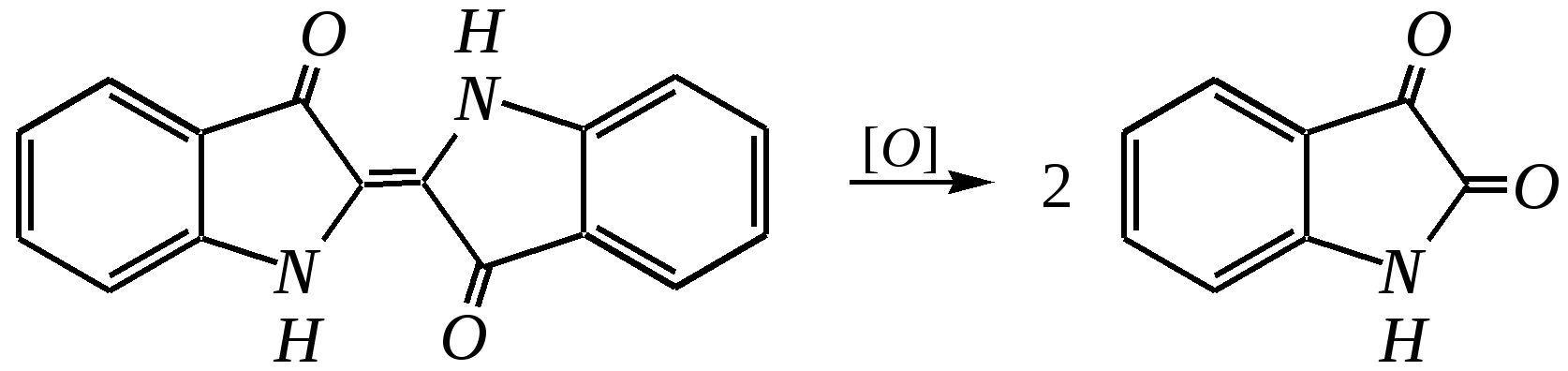 изатин 12.2.5. способы получения пиррола, фурана, тиофена, индола В небольших количествах пиррол и тиофен содержатся в каменноугольной смоле. При этом тиофен выгоняется из неё вместе с бензолом. К синтетическим способам получения можно отнести следующие.
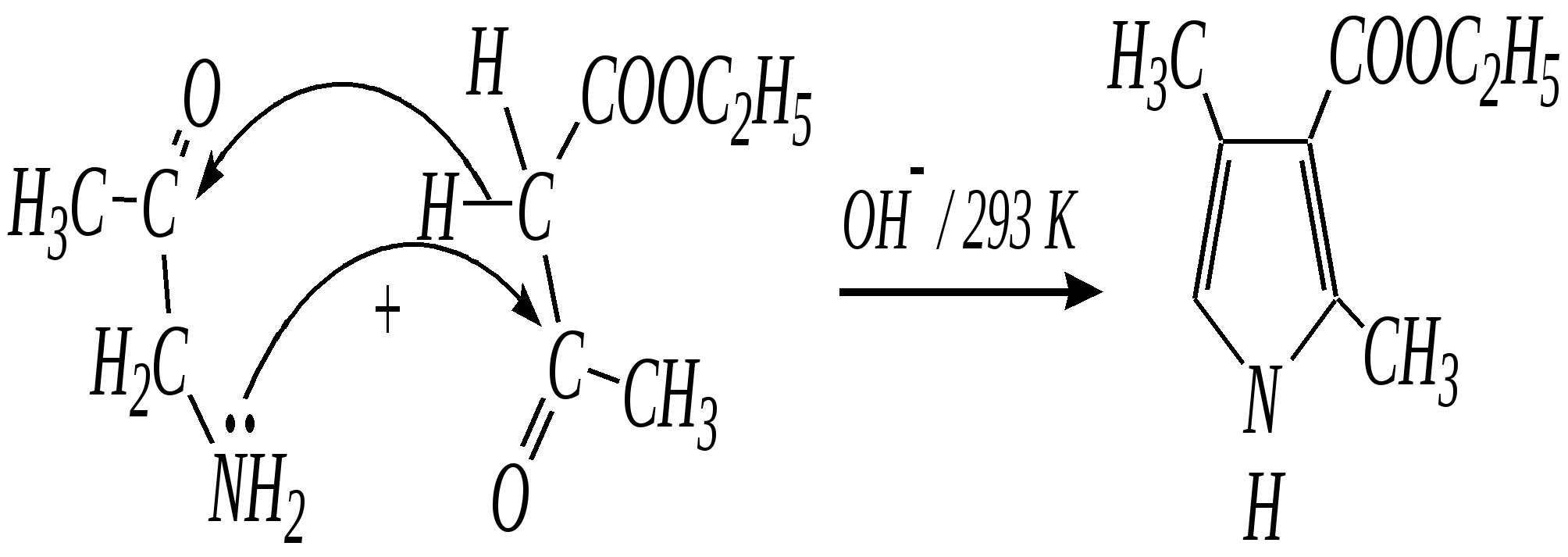
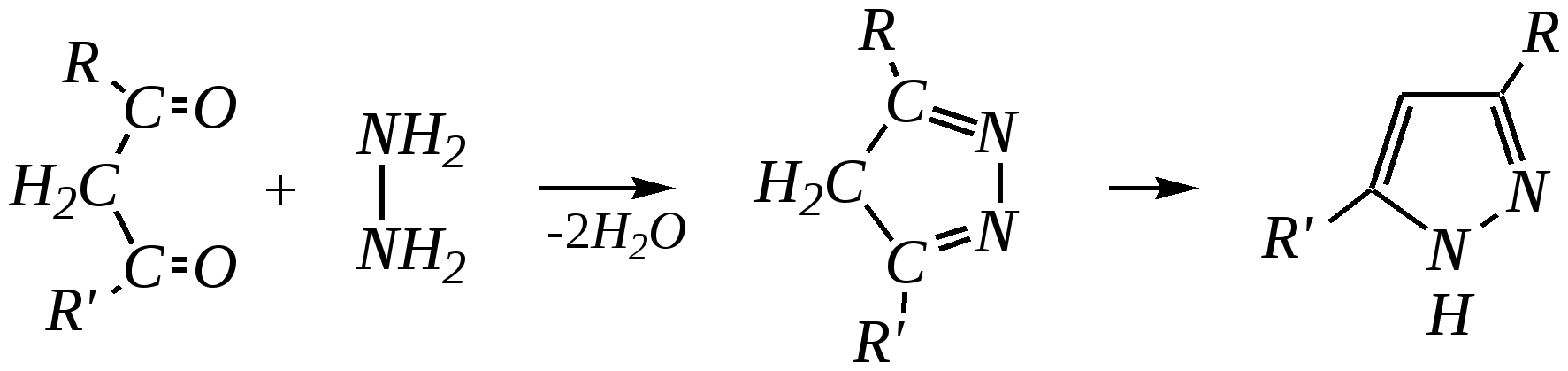
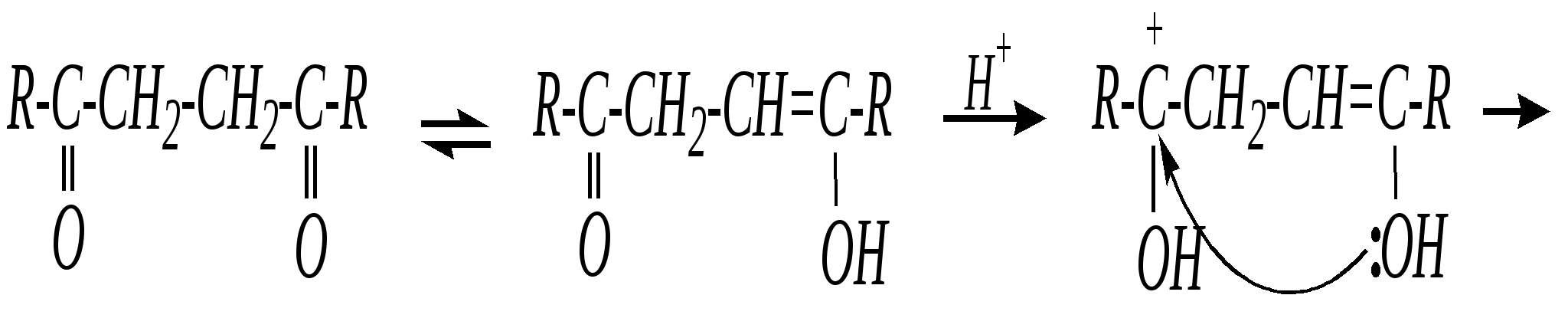 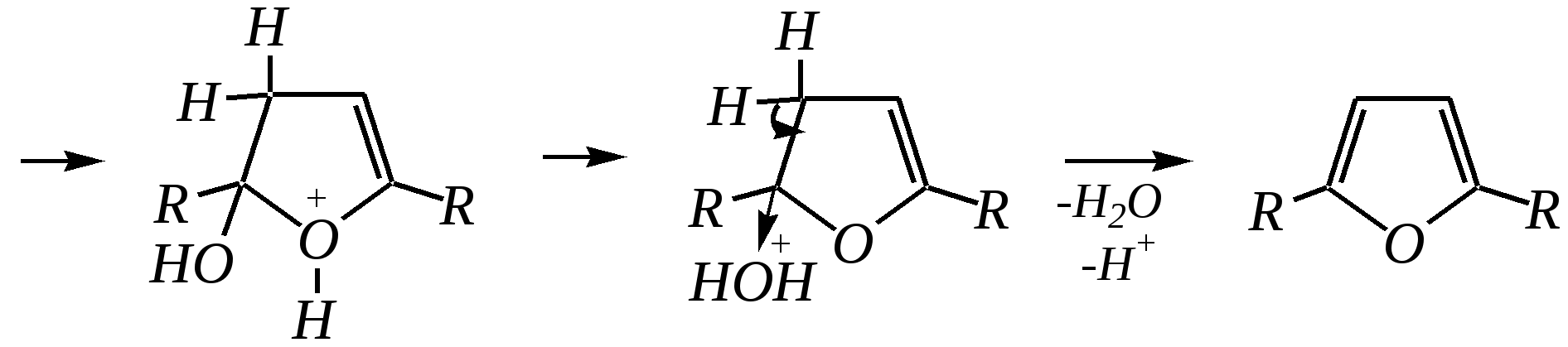 В синтезе пирролов необходима нуклеофильная атака аммиаком, а для получения тиофенов используются сульфиды фосфора. Например, механизм образования пирролов: 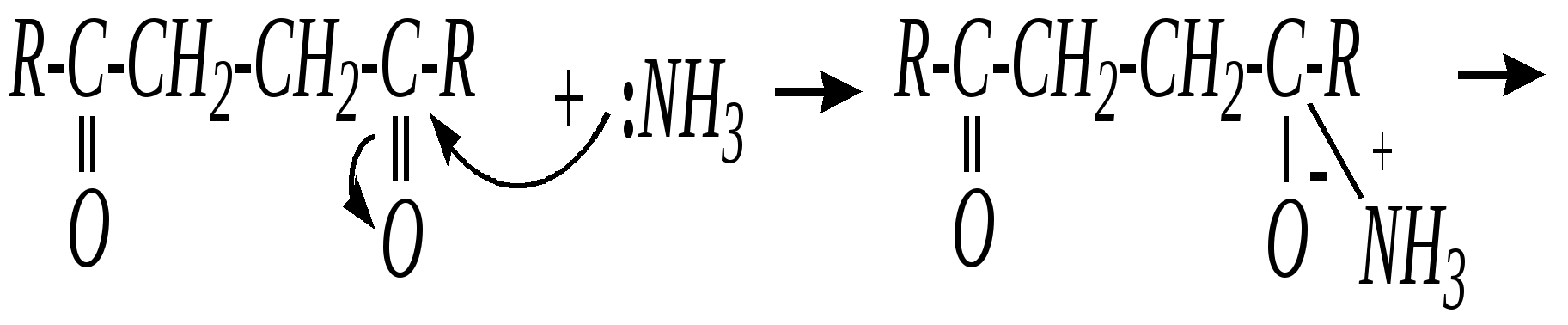 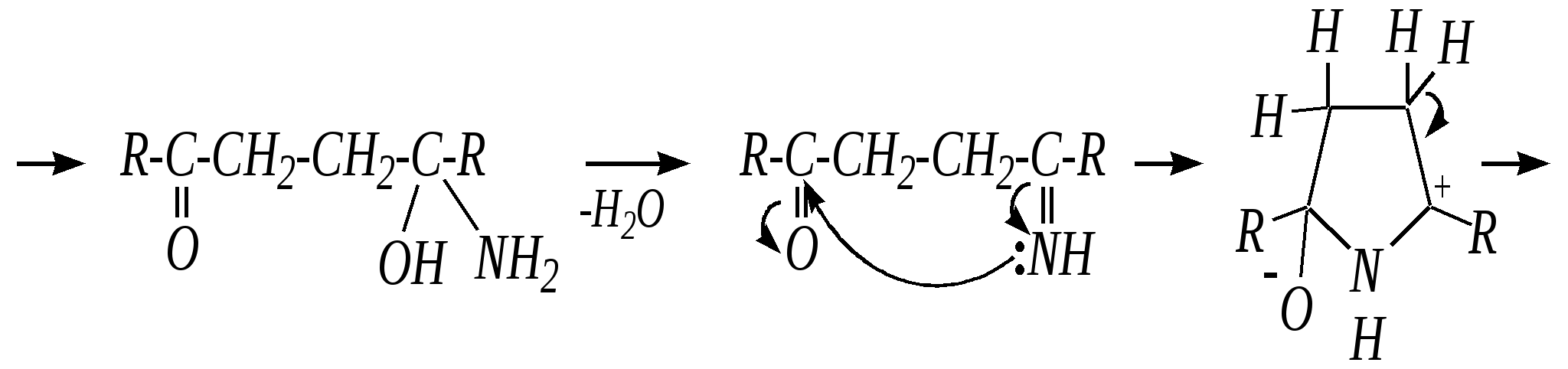 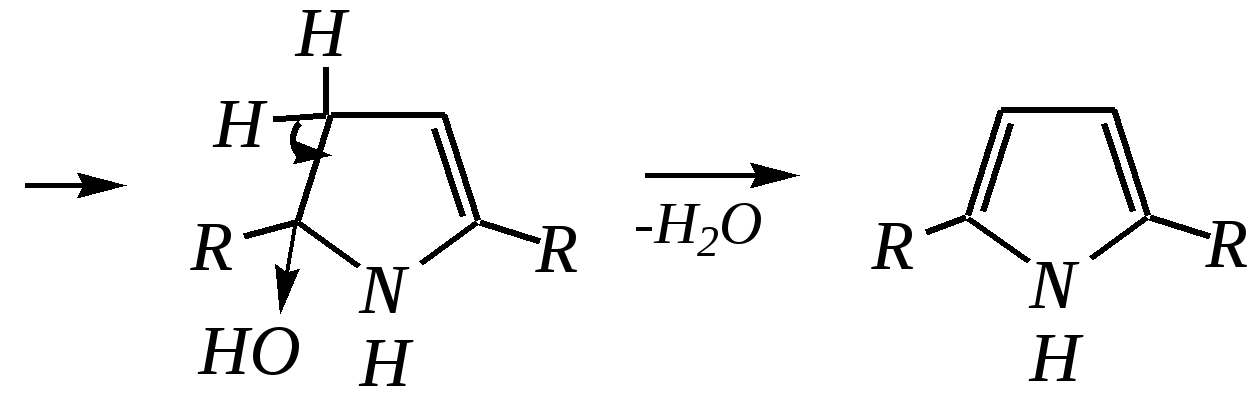
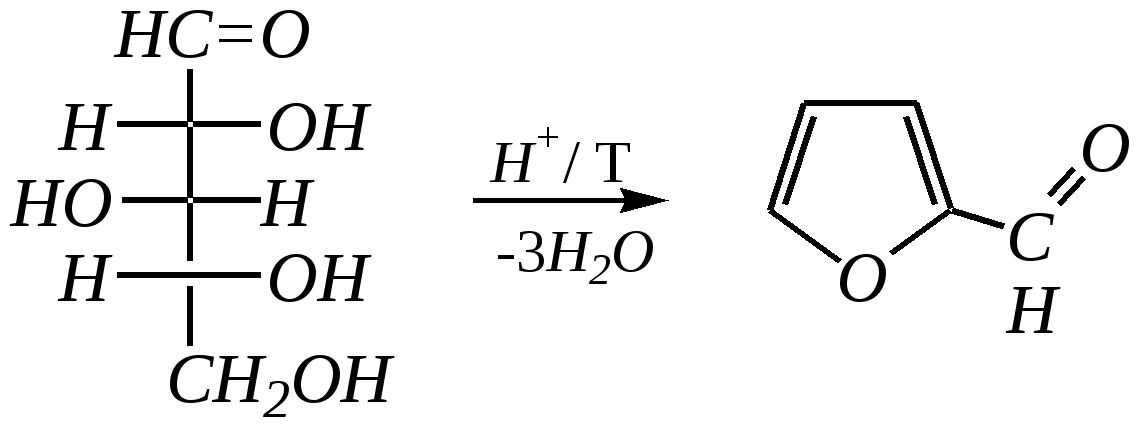 D-ксилоза фурфурол или другие производные фурана в зависимости от природы исходного моносахарида (гл. 7.1.2.3).
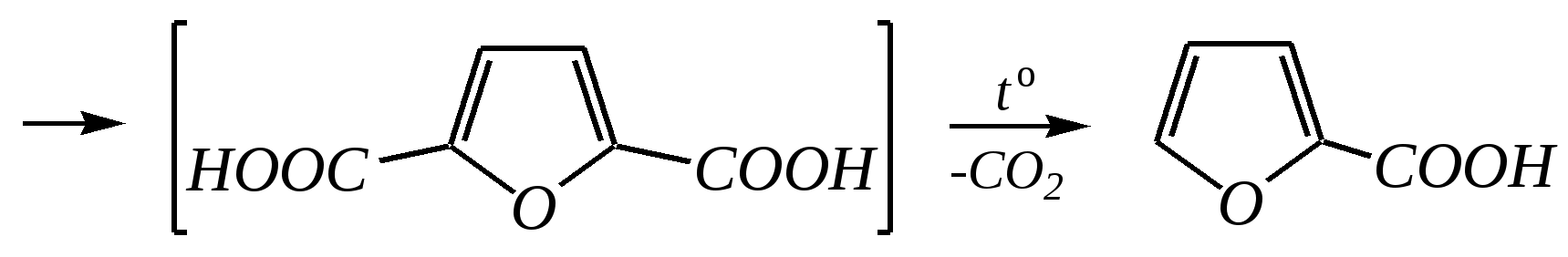 пирослизевая кислота
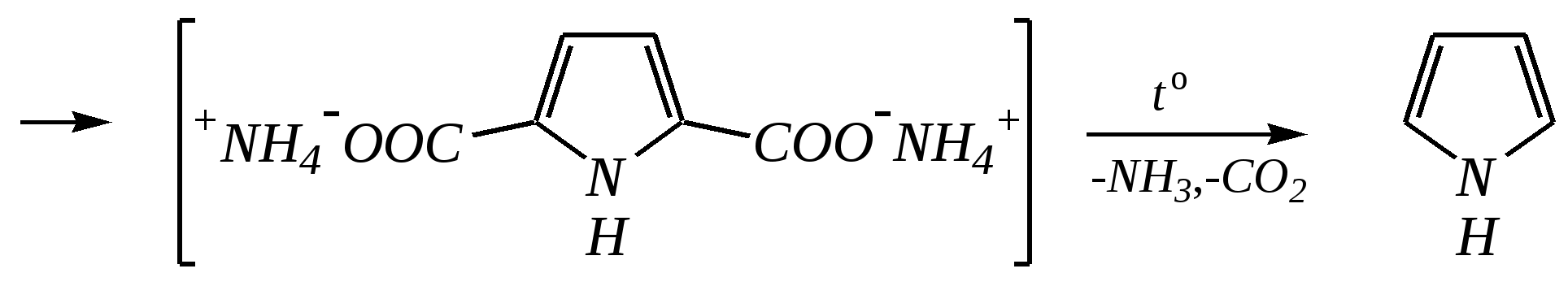
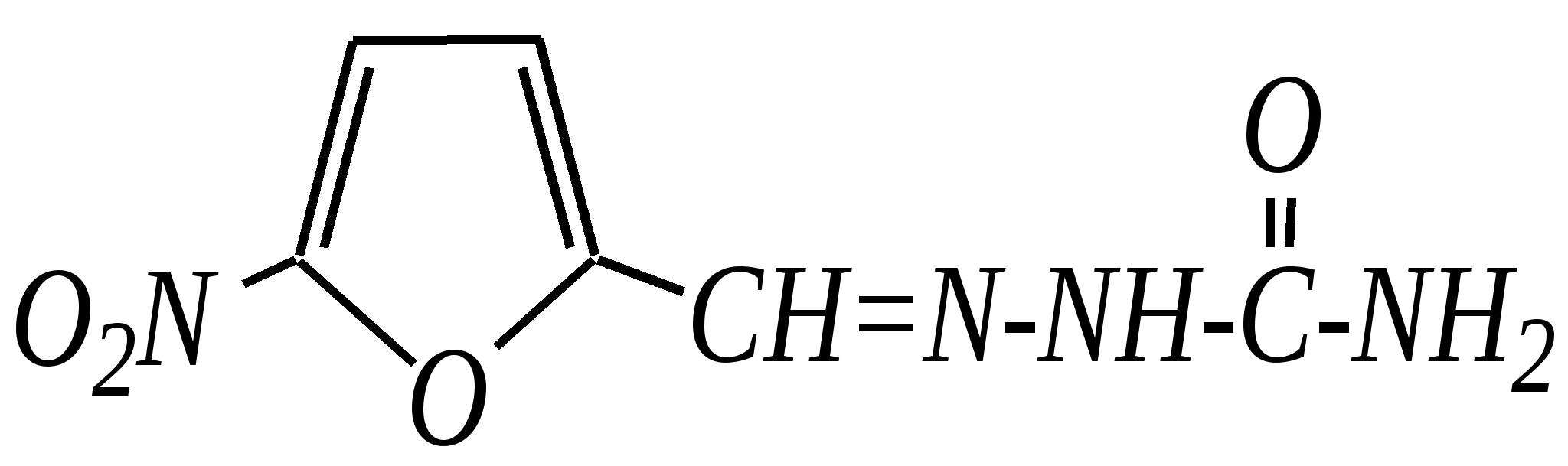
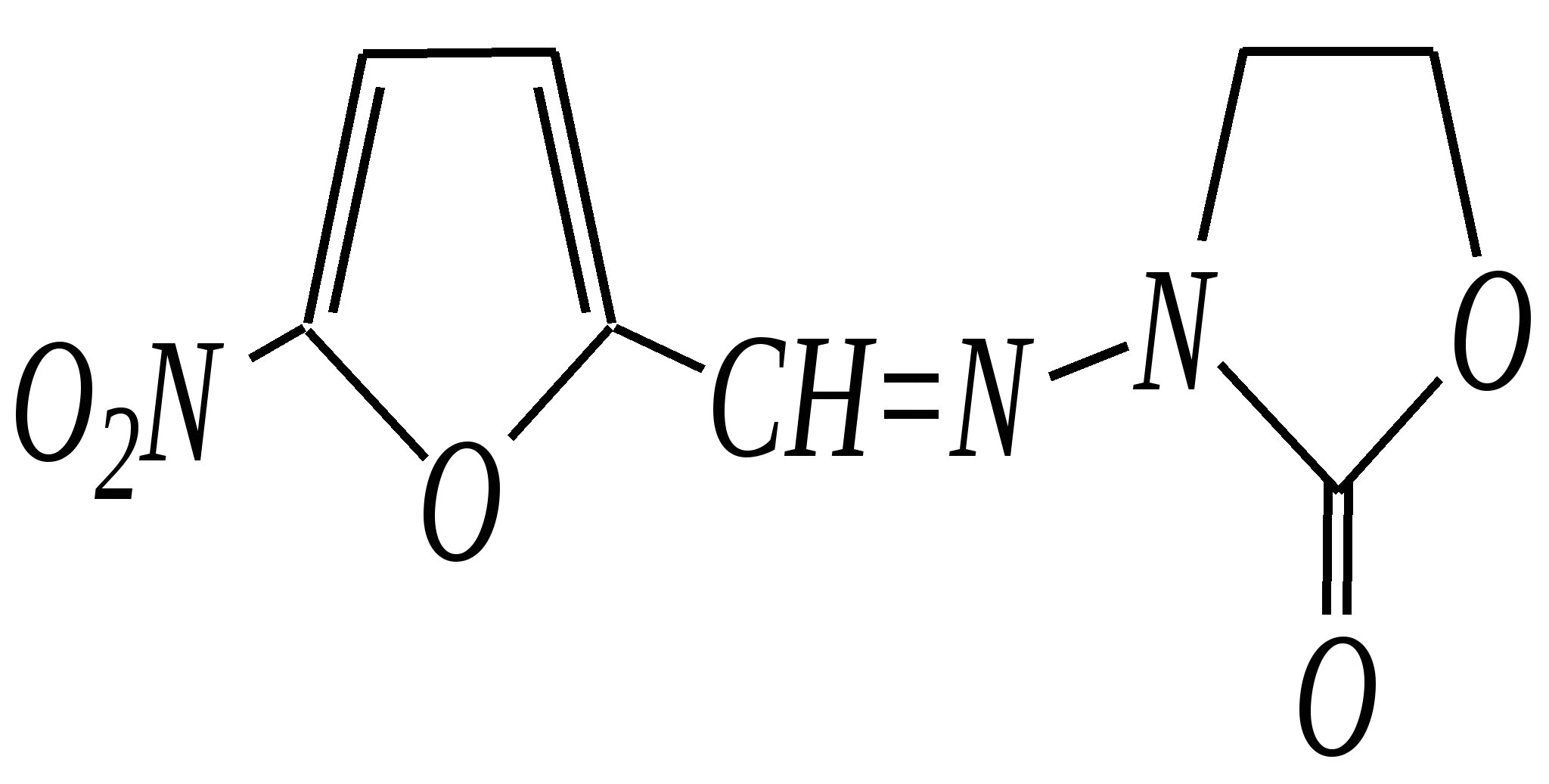
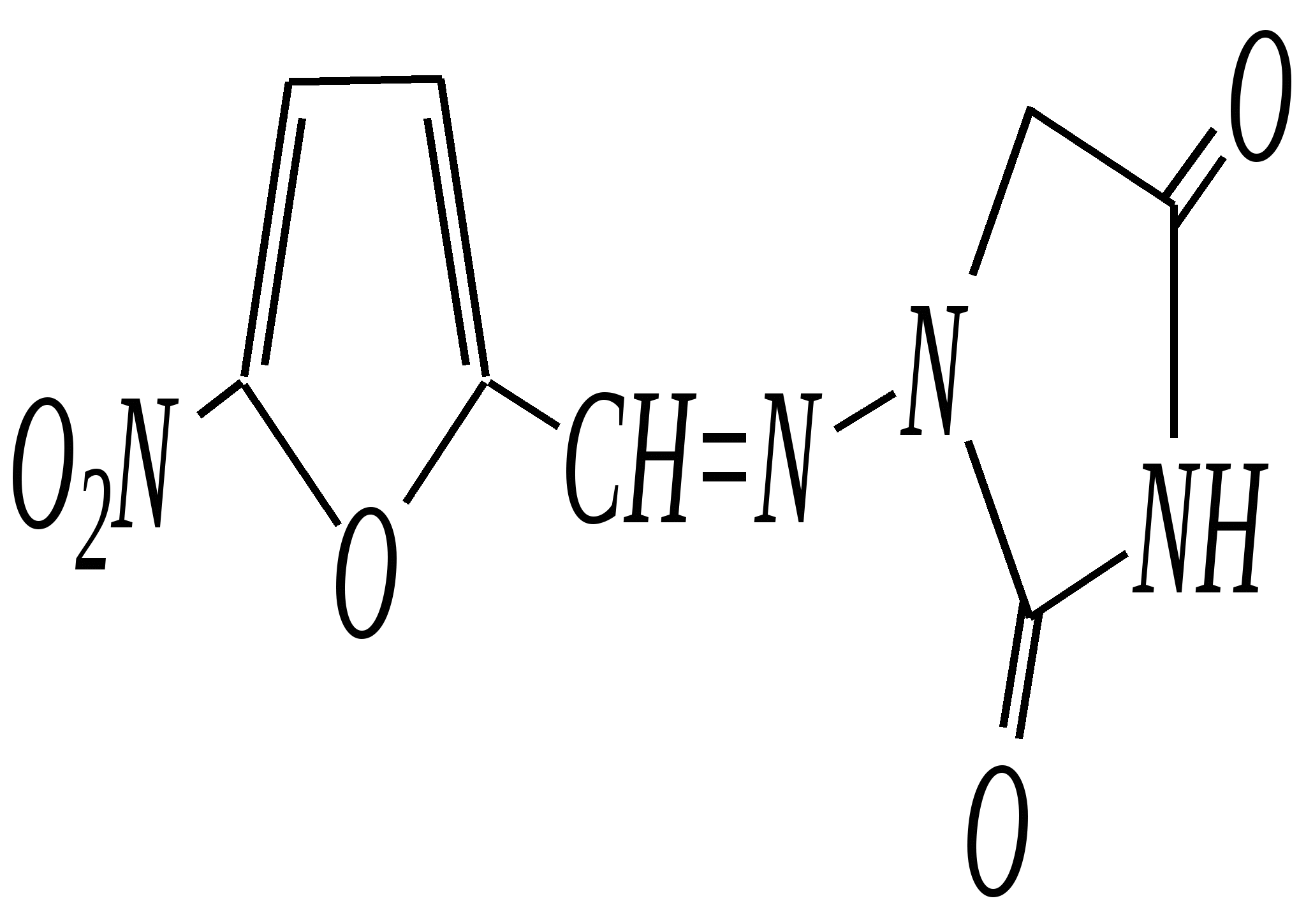
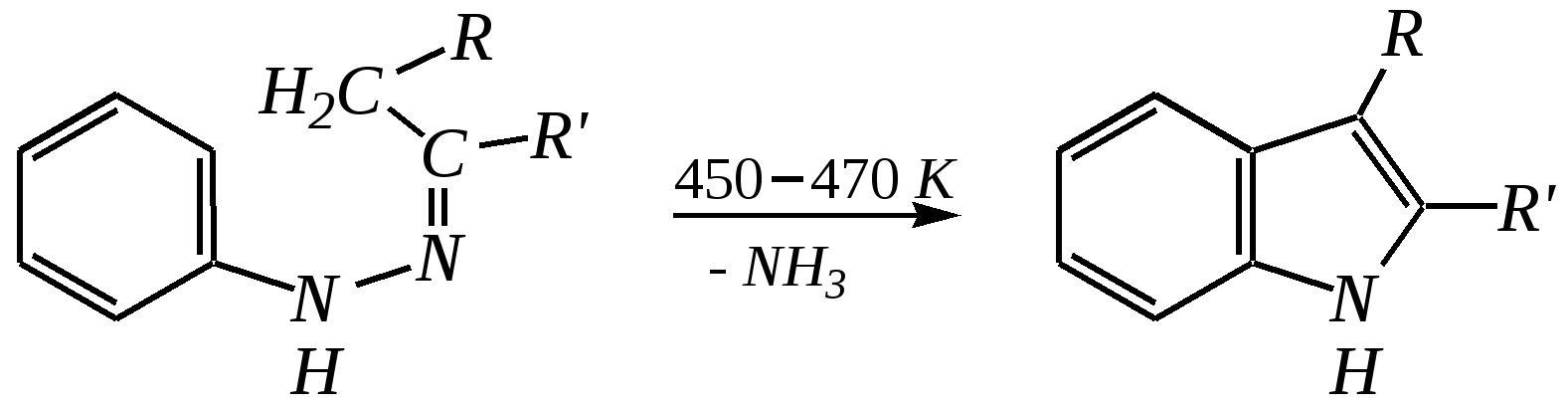 Общепринятый в настоящее время механизм этой реакции можно представить в следующем виде: 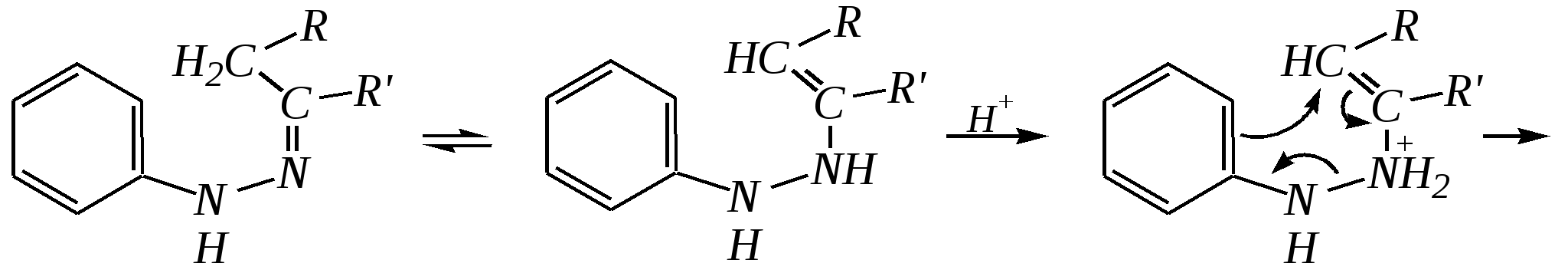 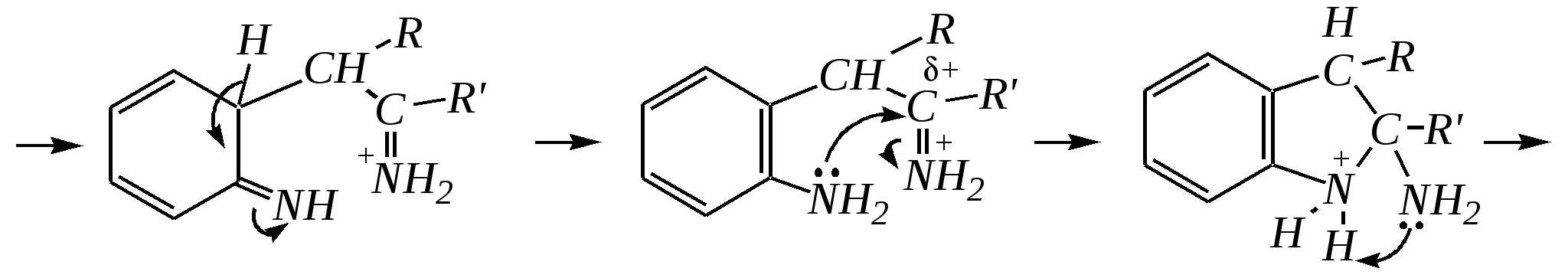 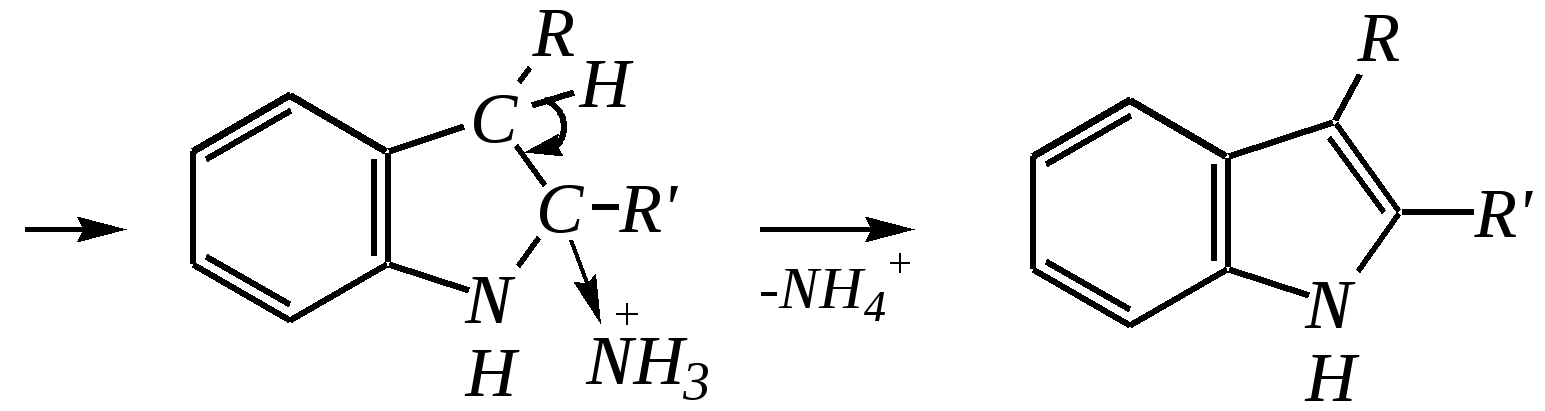 12.2.6. важнейшие представители и медико-биологическое значение Пиррол — бесцветная жидкость с запахом хлороформа с температурой кипения 403 К, малорастворим в воде. Пирролидинкарбоновые кислоты (пролин и гидроксипролин) являются важными протеиногенными аминокислотами гл. 6.9. Порфин — тёмно-красное кристаллическое вещество. Его молекула содержит четыре пиррольных кольца: 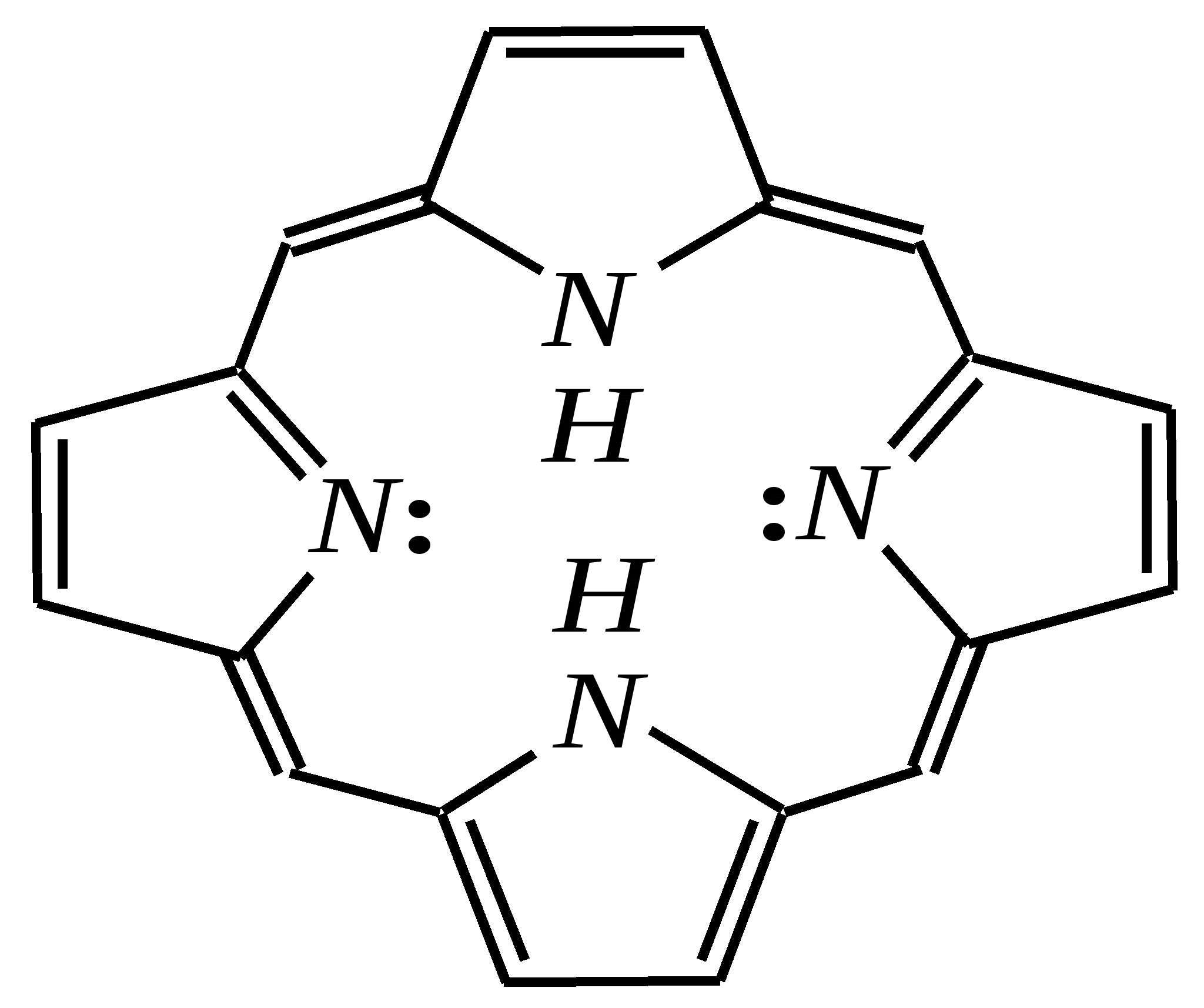 За счёт двух водородных атомов (у атомов азота), которые могут быть замещены металлом, образуются устойчивые комплексы, в которых ион металла образует связи одновременно с четырьмя атомами азота. Замещённые порфины называются порфиринами. Они лежат в основе очень важных природных соединений. Например, гем — небелковая часть красного вещества крови гемоглобина. По химическому составу гем является порфирином, содержащим катион Fe2+. 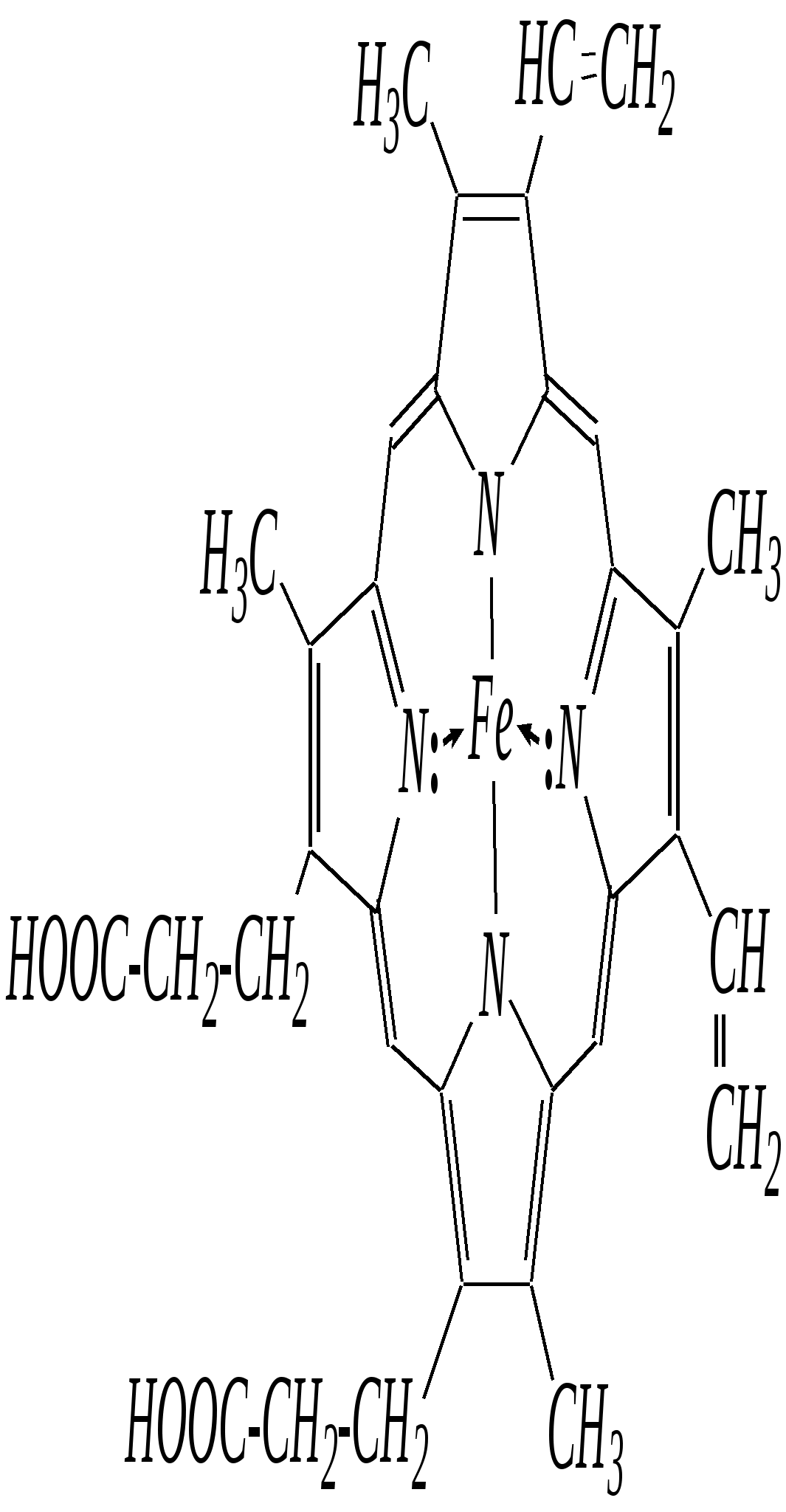 гем Другой пример — зелёный пигмент растений хлорофилл, содержащий катион Mg2+. Из растений выделены хлорофилл а (сине-чёрные кристаллы) и хлорофилл b(тёмно-зелёные кристаллы). Хлорофиллы были выделены Р.М. Вильштеттером*, им же была установлена формула хлорофилла а и структура его отдельных фрагментов. За эти работы Р.М. Вильштеттер был удостоен в 1915 году Нобелевской премии. 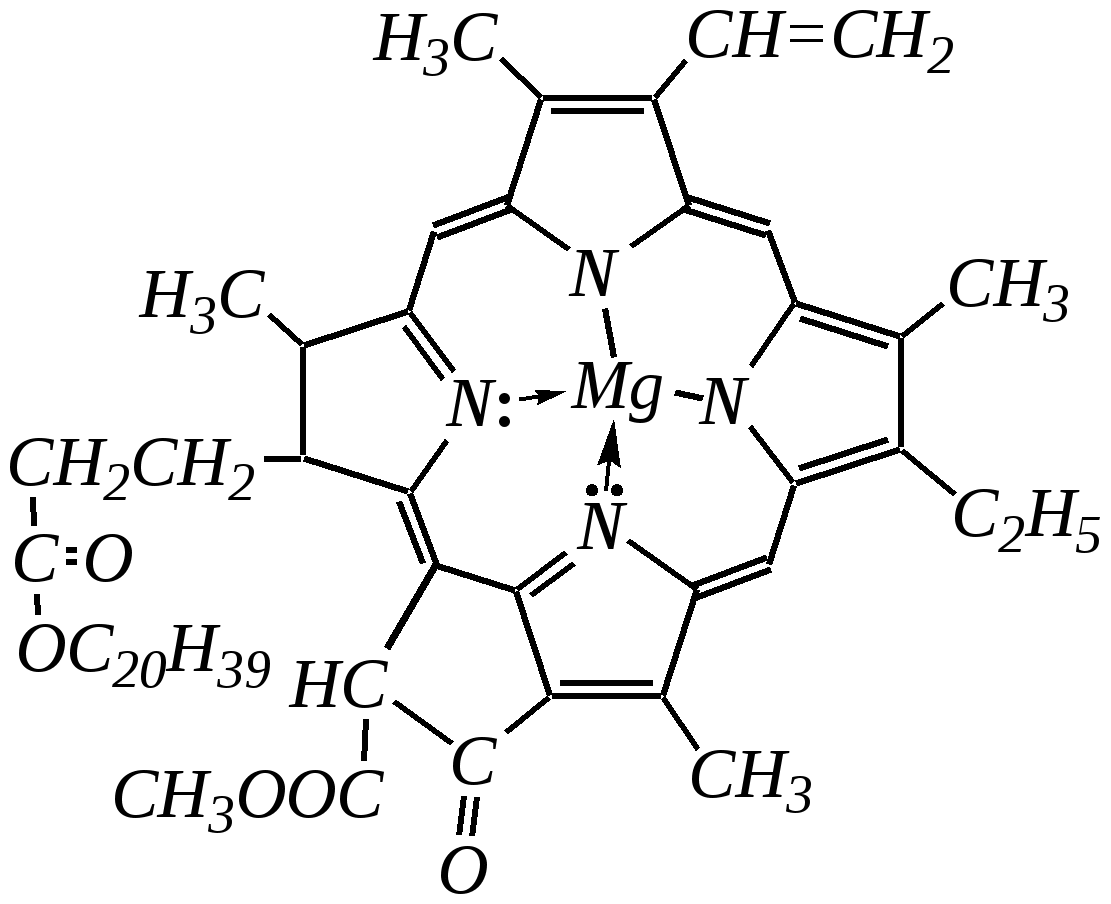 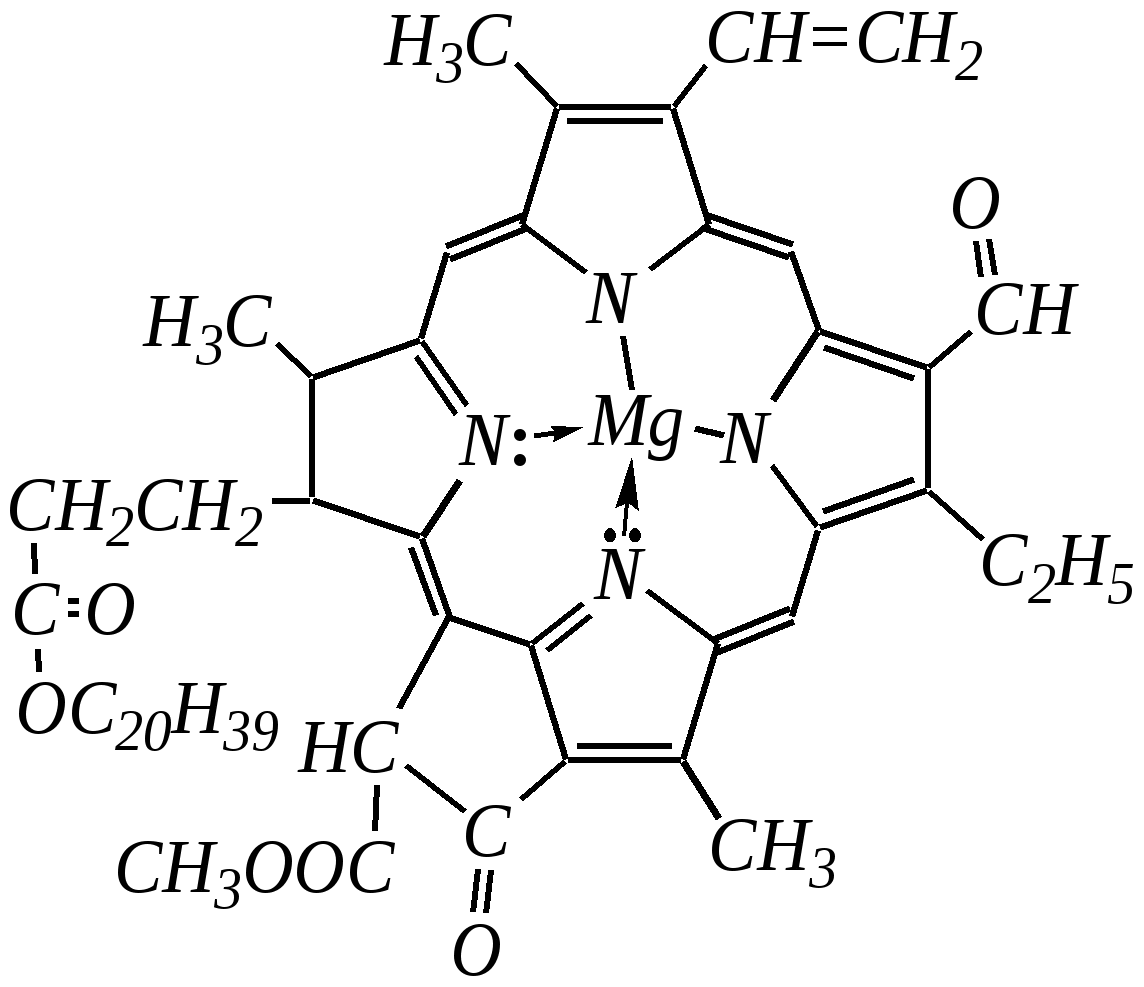 хлорофилл а хлорофилл b Витамин В12(кобаламины: природные — оксикобаламин и метилкобаламин, лекарственная форма — цианкобаламин)— тёмно-красные кристаллические вещества, растворимые в воде. В основе молекул лежит фрагмент, структурно похожий на порфириновый, содержащий четыре пиррольных кольца и катион Co2+. Витамин В12 является активным средством против анемии, его применяют для лечения злокачественного малокровия, заболеваний нервной системы и печени. Билирубиноиды — окрашенные вещества, которые содержат четыре бензольных кольца и встречаются в организмах позвоночных, а также некоторых беспозвоночных и даже в водорослях. Они образуются при биологическом окислении гемоглобина и родственных соединений. Важнейшим их представителем является окрашенный в оранжевый цвет билирубин. Он встречается в желчи, а также в желчных камнях и выделяется с калом и мочой. 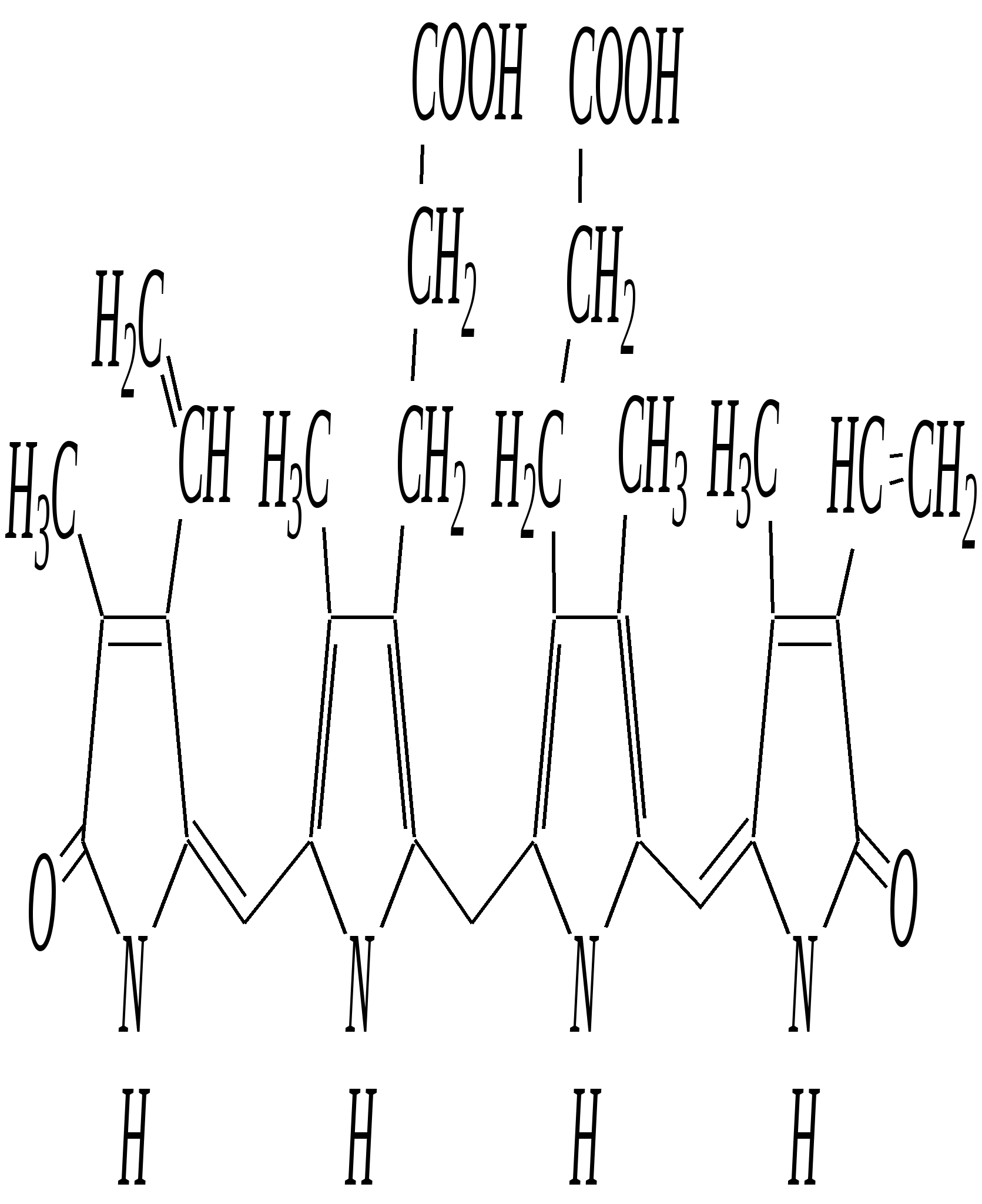 билирубин Фуран — бесцветная жидкость с запахом хлороформа; температура кипения 304 К, малорастворим в воде. Получают фуран из фурфурола (в промышленности) или пирослизевой кислоты (в лаборатории). Фурфурол — бесцветная или слегка желтоватая жидкость с запахом корочки свежеиспечённого ржаного хлеба; температура кипения 435 К, умеренно растворим в воде (10 г на 100 г воды). Фурфурол образуется при нагревании некоторых моносахаридов (в частности, ксилозы) с минеральными кислотами (гл. 7.1.2.3). Поэтому фурфурол получают из растительного сырья. Фурфурол является очень важным исходным веществом для органического синтеза. Каталитическим окислением из него получают малеиновый ангидрид: 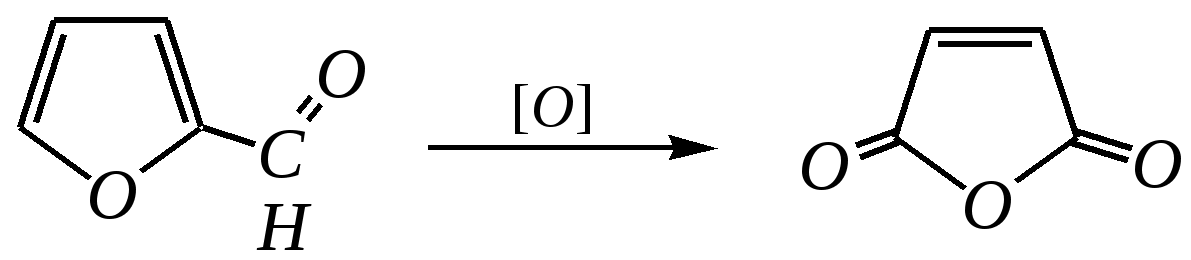 Нитрование фурфурола лежит в основе производства таких бактерицидных препаратов, как фурацилин, фуразолидон, фурадонин:
Тиофен — бесцветная жидкость с запахом, похожим на бензол; температура кипения 357 К, нерастворим в воде. Получают из каменноугольной смолы. Индол — бесцветное кристаллическое вещество с неприятным запахом; температура плавления 325 К, температура кипения 526 К, нерастворим в воде. Используют в органическом синтезе и в парфюмерии. Триптофан — одна из незаменимых протеиногенных -аминокислот (гл. 6.9). Триптамин — «биогенный амин», образующийся в организме человека и животных при декарбоксилировании аминокислоты триптофана под действием ферментов — декарбоксилаз. 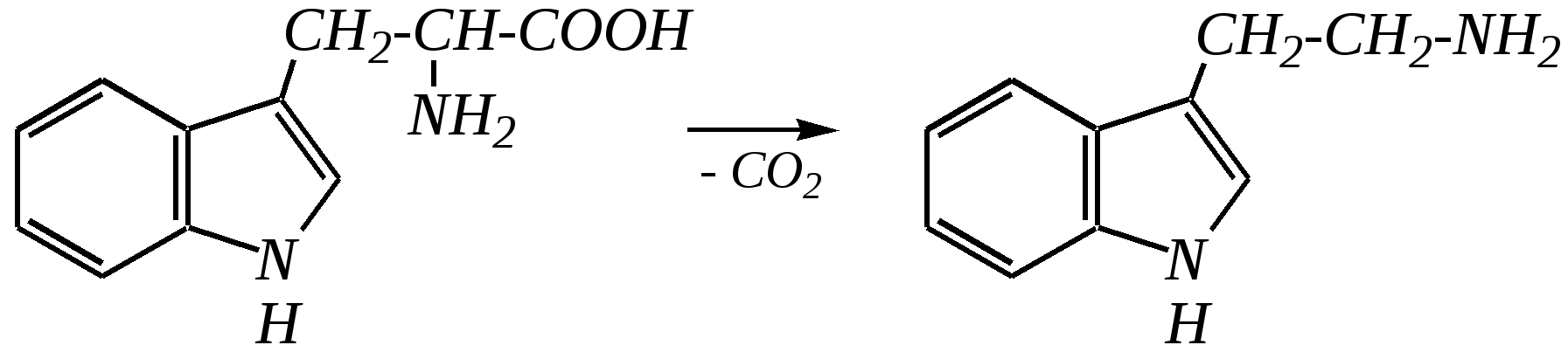 триптофан триптамин Скатол (3-метилиндол) является конечным продуктом биологических превращений триптофана. Он обладает пронзительным запахом фекалий, однако в очень больших разбавлениях имеет цветочный запах и поэтому добавляется к цветочным композициям. Серотонин (3-аминоэтил-5-гидроксииндол) является «биогенным амином». Он обладает высокой биологической активностью, содержится в сыворотке теплокровных, участвует в поддержании тонуса сосудов и процессе передачи нервных импульсов в центральной нервной системе. В организме образуется из триптофана. Буфотенин был впервые выделен из кожи жаб. Кроме того, он содержится в некоторых растениях. Вызывает повышение кровяного давления и парализует дыхательные центры головного и спинного мозга. Псилоцин является психоактивным веществом, выделенным из мексиканского священного гриба Teonanacatl. Он повышает психическую возбудимость и вызывает галлюцинации. 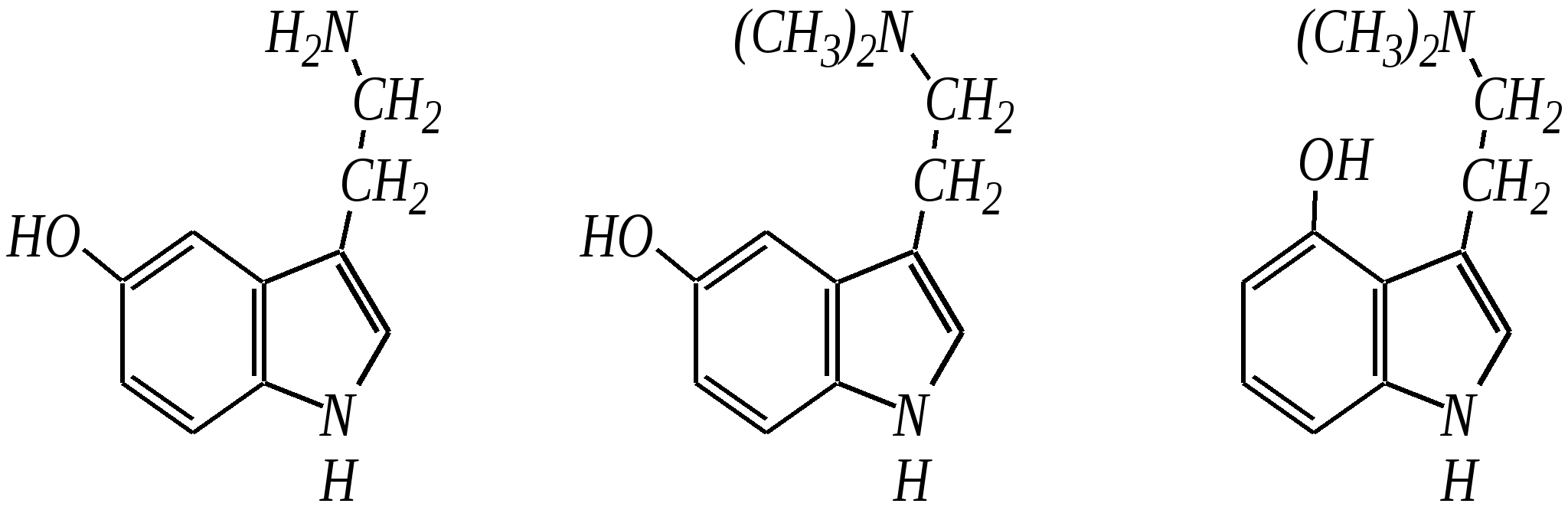 серотонин буфотенин псилоцин 12.3. пятичленные гетероциклические соединения с двумя гетероатомами Среди этих гетероциклических соединений наиболее важны в практическом отношении имидазол, пиразол, оксазол, тиазол, изоксазол, изотиазол и конденсированные системы на их основе бензимидазол и бензотиазол.  имидазол пиразол оксазол тиазол изоксазол  изотиазол бензимидазол бензотиазол 12.3.1. номенклатура имидазола и пиразола Систематические названия имидазола и пиразола — 1,3-диазол и 1,2-диазол. Атомы цикла нумеруются начиная с гидрированного (или замещённого) азота (N–Hили N–R) в направлении второго атома азота по кратчайшему пути.  Названия радикалов, образованных от этих гетероциклов, — имидазолил и пиразолил, с указанием атома, имеющего свободную валентность, цифровым локантом. 12.3.2. строение имидазола и пиразола Молекулы имидазола и пиразола, так же как и пиррола, являются сопряжёнными системами. Природа атомов азота, входящих в гетероцикл, различна. Один из них образует двойную связь с атомом углерода и в целом участвует в образовании двух -связей и -связи за счёт своих валентных электронов. Неподелённая электронная пара этого атома азота находится на sp2-гибридной орбитали, ось которой лежит в плоскости гетероцикла, и потому эти электроны не могут участвовать в сопряжении с -электронной системой кольца. Такой атом азота называется пиридиновым, так как по природе идентичен атому азота в шестичленном гетероцикле пиридине (см. далее). Другой атом азота по природе является таким же, как и в пирроле и называется пиррольным. Его неподелённая электронная пара, так же как и в пирроле, участвует в сопряжении с двумя -связями кольца. В результате здесь тоже образуется циклическая сопряжённая система с шестью -электронами (четыре -электрона от двух двойных связей и два — от пиррольного атома азота). По сравнению с пирролом имидазол и пиразол имеют более ароматический характер, так как пиридиновый атом азота, являясь акцептором, способствует более полной делокализации неподелённой электронной пары пиррольного азота по кольцу, а значит, и более равномерному распределению электронной плотности в кольце.
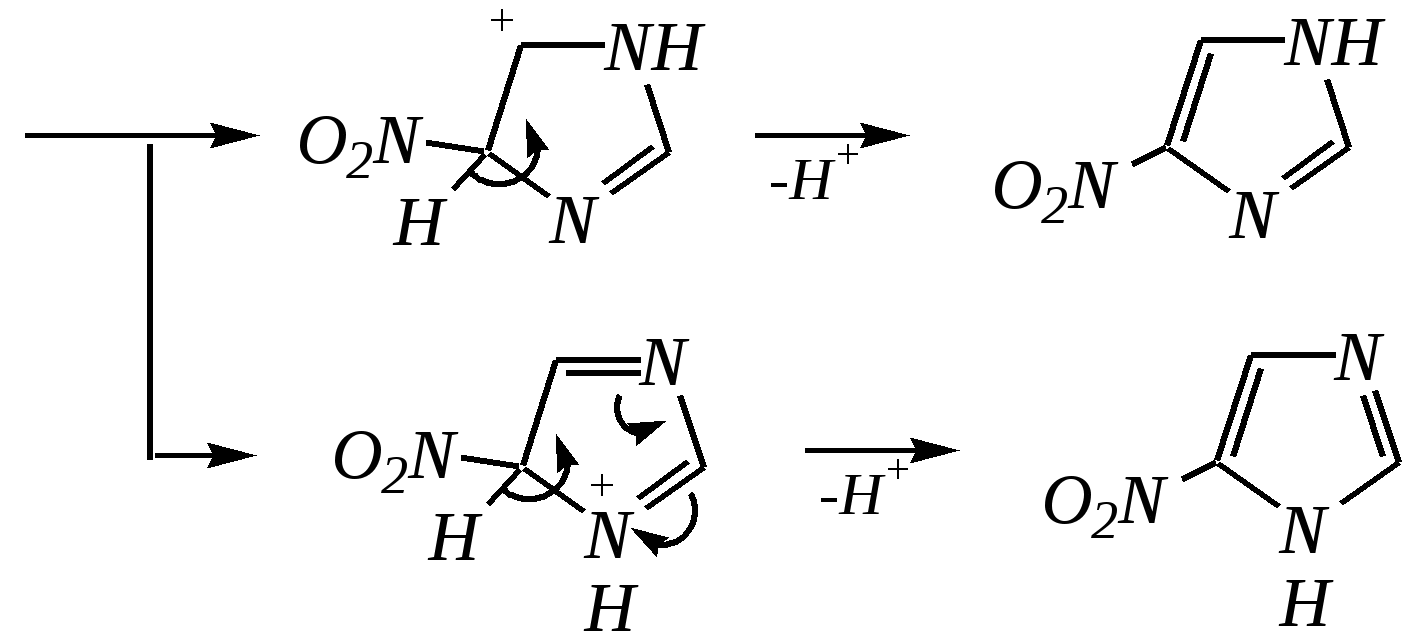
12.3.3. физические и химические свойства имидазола и пиразола Имидазол и пиразол являются бесцветными кристаллическими веществами, но их N1-производные (не содержащие связи N–H) могут быть жидкостями. Кристаллическое состояние вещества самих диазолов обусловлено наличием прочных межмолекулярных водородных связей. Например, для имидазола: 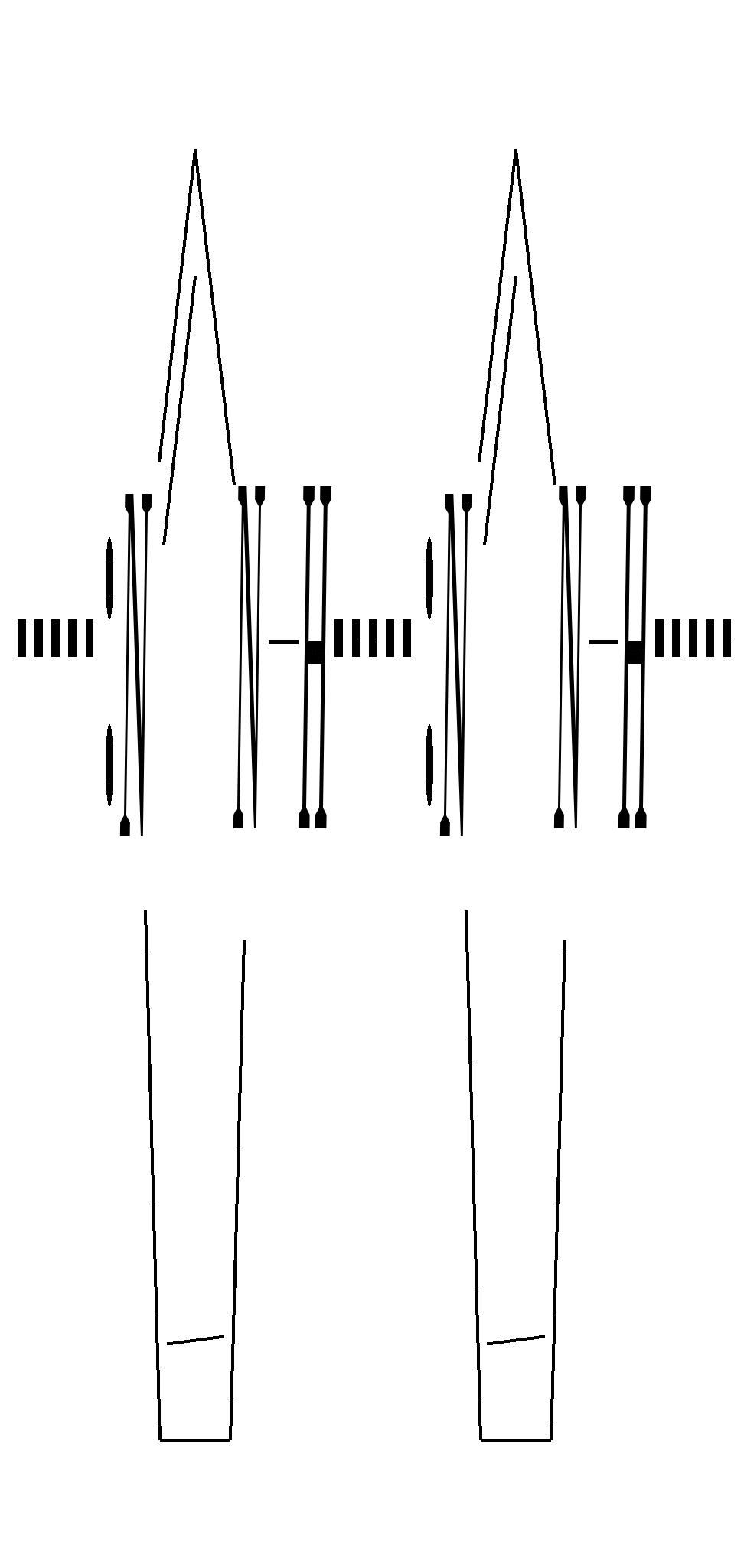 для пиразола: 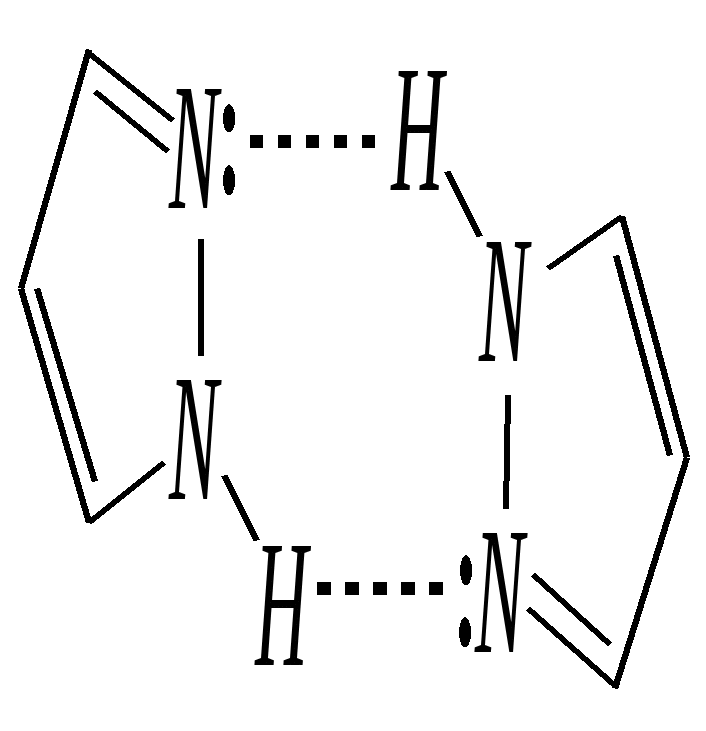 Следствием этого являются как их высокие температуры кипения (например, в сравнении с пирролом), так и существенная разница этих температур для имидазола и пиразола между собой (для имидазола температура кипения составляет 529 К, для пиразола — 460 К, для пиррола — 404 К). На химические свойства диазолов, в отличие от пиррола оказывает влияние наличие пиридинового атома азота. 12.3.3.1. Кислотно-оснόвные свойства Имидазол и пиразол обладают амфотерными свойствами. Они являются слабыми NH-кислотами аналогично пирролу. 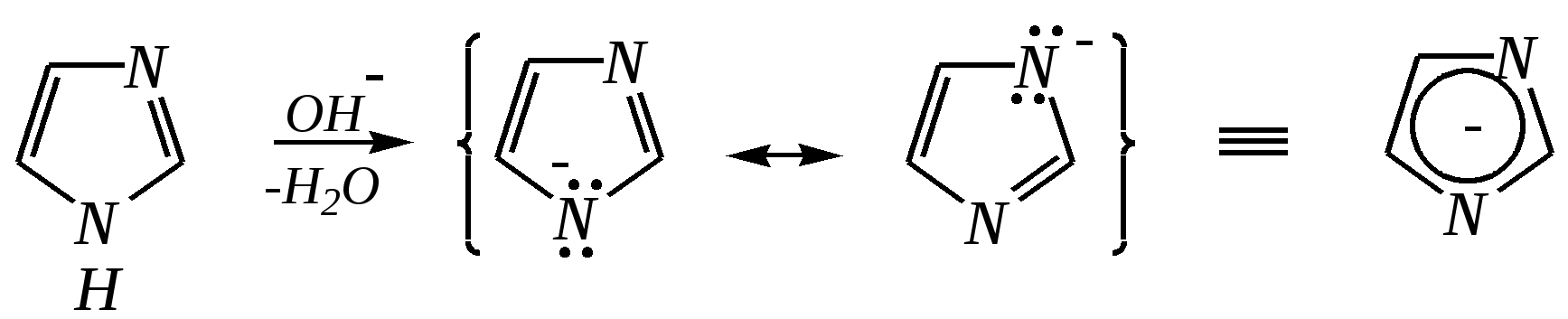 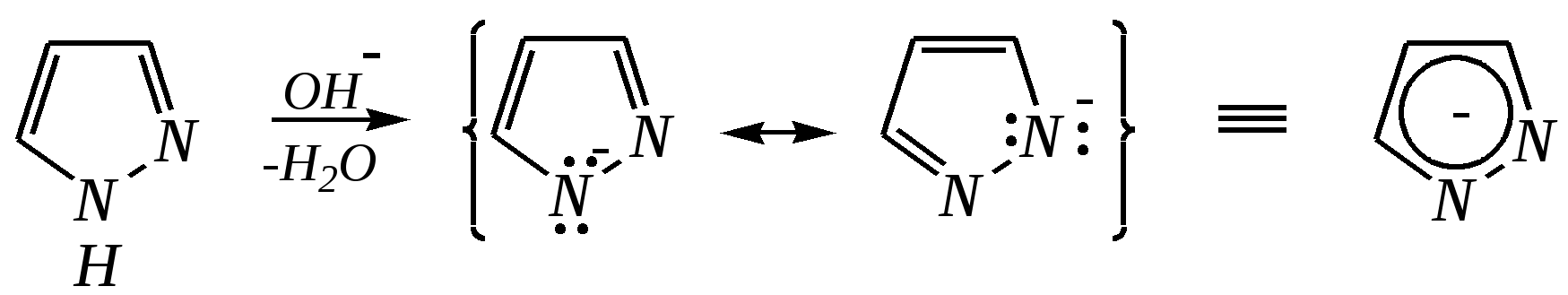 В результате при проявлении ими кислотных свойств в анионе атомы азота становятся идентичными друг другу. Но в сравнении с пирролом кислотные свойства диазолов выражены несколько сильнее, что является результатом акцепторного влияния пиридинового атома азота. Поэтому ряд уменьшения кислотных свойств можно показать следующим образом (в скобках приведено значение рКа): пиразол (14.2) имидазол (14.2) > пиррол (17.5). Имидазол и пиразол обладают оснόвными свойствами средней силы за счёт пиридинового атома азота (рКb имидазола 6.9, а рКb пиразола 11.5). Более низкое значение основности для пиразола связано с наличием N–N-связи в его молекуле и проявлением, таким образом, сильного –I-эффекта пиррольного атома азота, понижающего основность пиридинового азота. В результате присоединения протона образуются стабильные катионы, циклическая сопряжённая система не нарушается, а положительный заряд в равной степени делокализуется по обоим атомам азота: 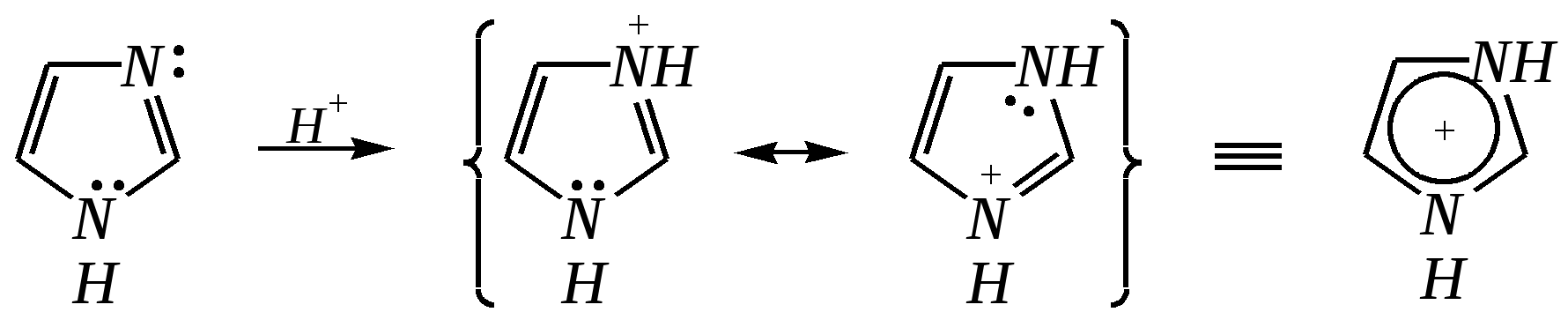 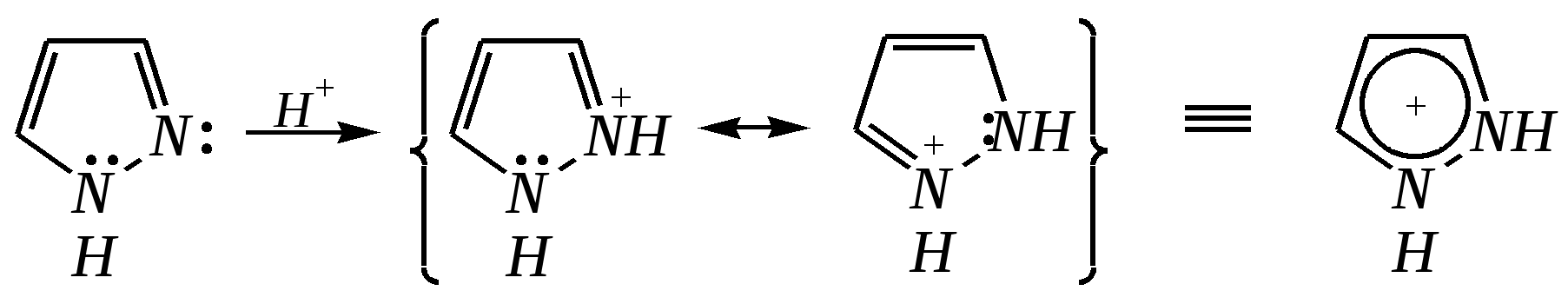 В катионе атомы азота становятся идентичными друг другу. Диазолы не обладают ацидофобностью, как и все гетероциклы с двумя гетероатомами. Ароматичность этих соединений сохраняется и в протонированной форме. Для замещённых диазолов характерны таутомерные превращения. В результате протонного переноса меняется положение заместителей в кольце. Так, таутомерия монозамещённых диазолов легко объясняется равнозначностью атомов азота в катионной и анионной формах. Например, превращение 3-метилпиразола в 5-метилпиразол  можно представить так: 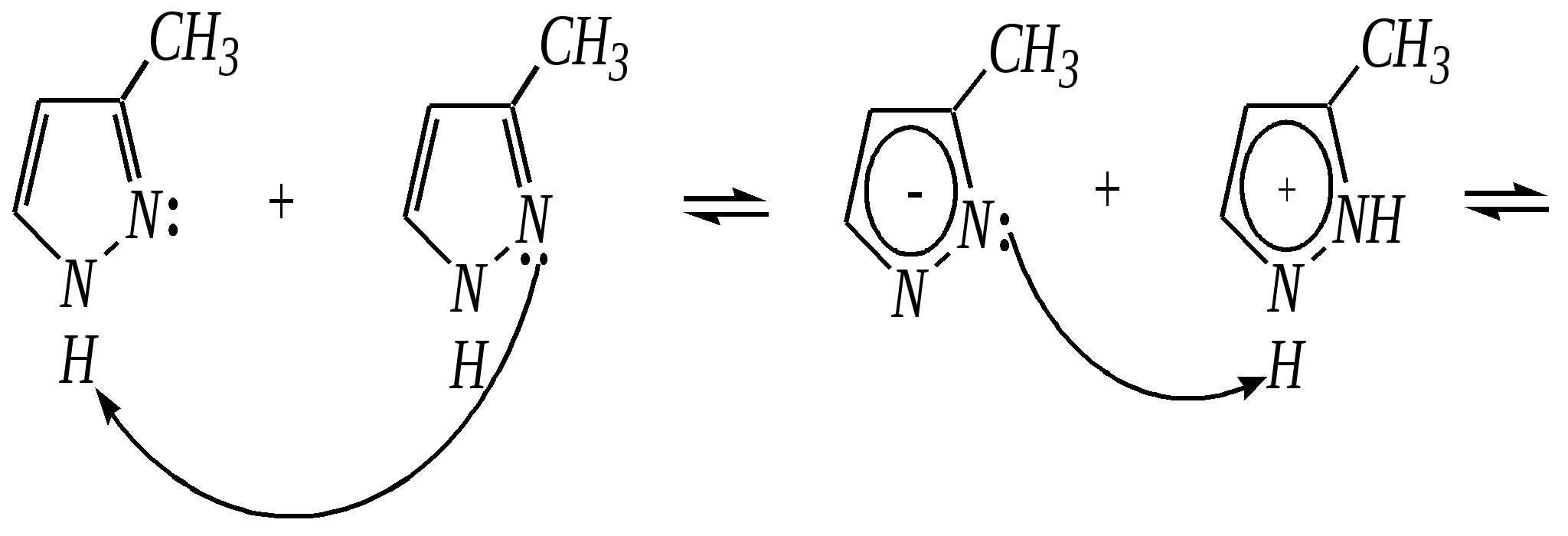 3-метилпиразол 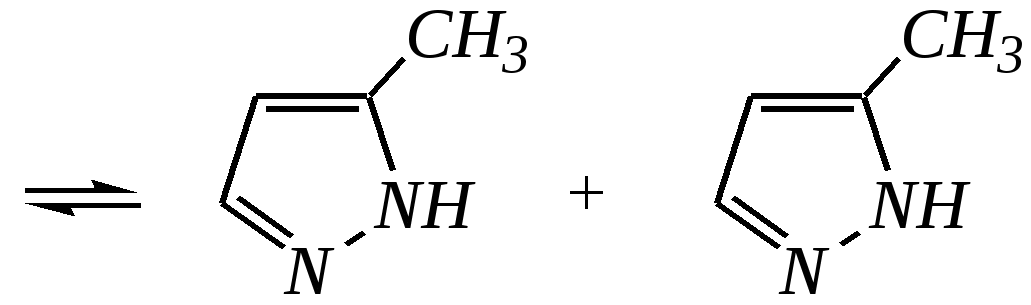 5-метилпиразол 12.3.3.2. Реакции алкилирования и ацилирования по атому азота Диазолы легко вступают во взаимодействие с алкилирующими и ацилирующими агентами с участием пиридинового атома азота. По механизму эти реакции — типичные реакции нуклеофильного замещения, в которых имидазол и пиразол являются нуклеофилами. При этом алкилирование избытком галогеналкана приводит к диалкильному производному, а при ацилировании образуется только моноацилированный гетероцикл. Например, взаимодействия имидазола с йодалканом и с ацилхлоридом протекают так: 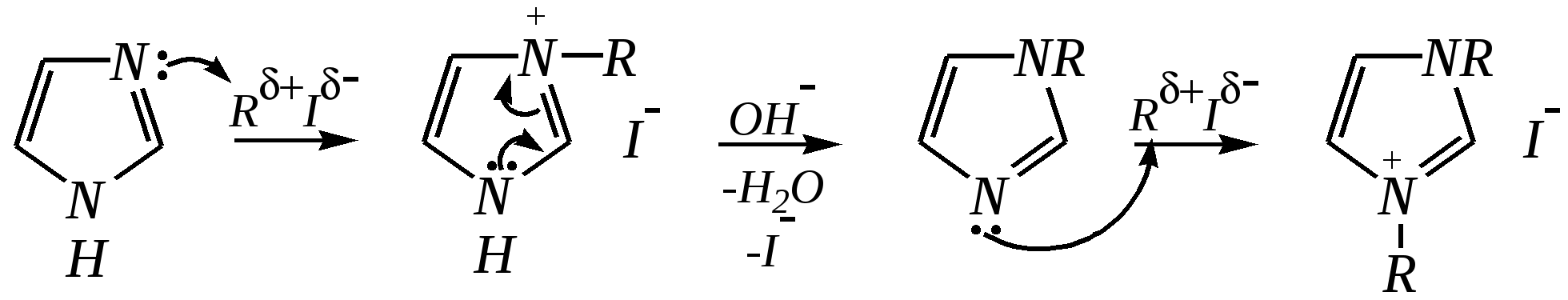 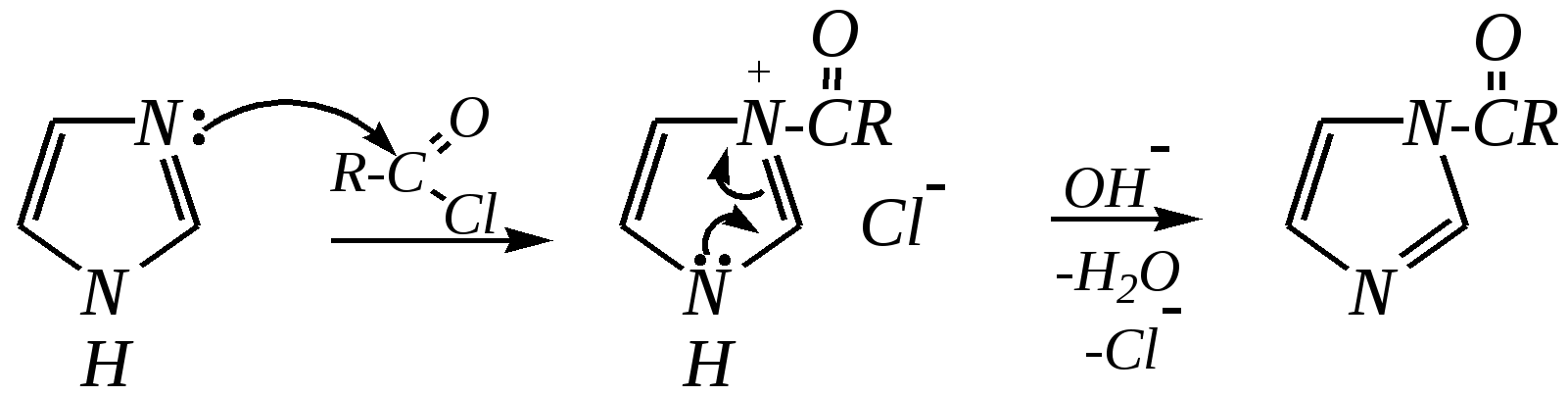 12.3.3.3. Реакции электрофильного замещения Атака электрофильного реагента может осуществляться как по атому азота, так и по атому углерода кольца. На атомах азота электронная плотность выше, однако образующиеся с азотом связи недостаточно прочны, и продукты такого взаимодействия значительно менее стабильны, чем продукты электрофильных реакций по углероду. Многие типичные SE-реакции протекают в кислой среде. Но имидазол и пиразол протонируются кислотами, при этом молекулы гетероциклов превращаются в мало-реакционноспособные катионы. Это снижает активность диазолов в таких реакциях, как нитрование, сульфирование, но, тем не менее, имидазол и пиразол нитруются нитрующей смесью и сульфируются в обычных условиях с удовлетворительными выходами. Имидазол образует продукты замещения по 4-му или 5-му атому кольца, пиразол — 4-замещённые продукты. Например, нитрование можно представить так: 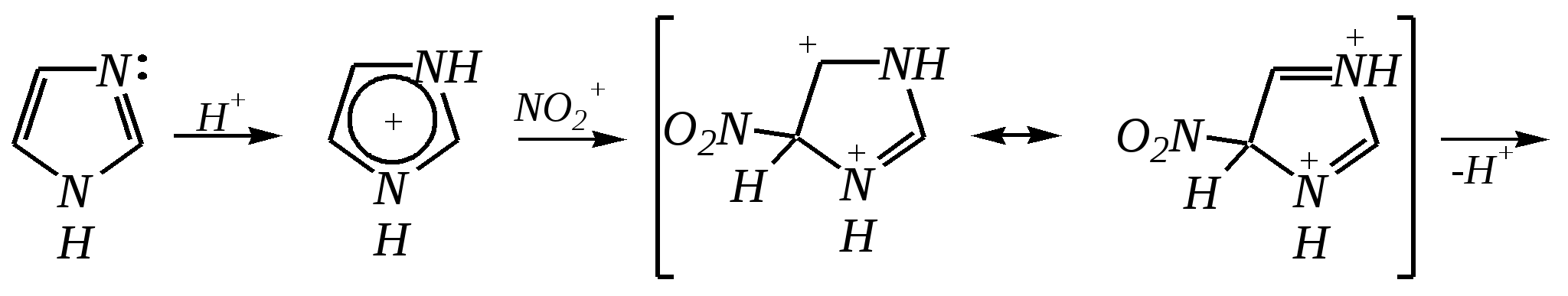
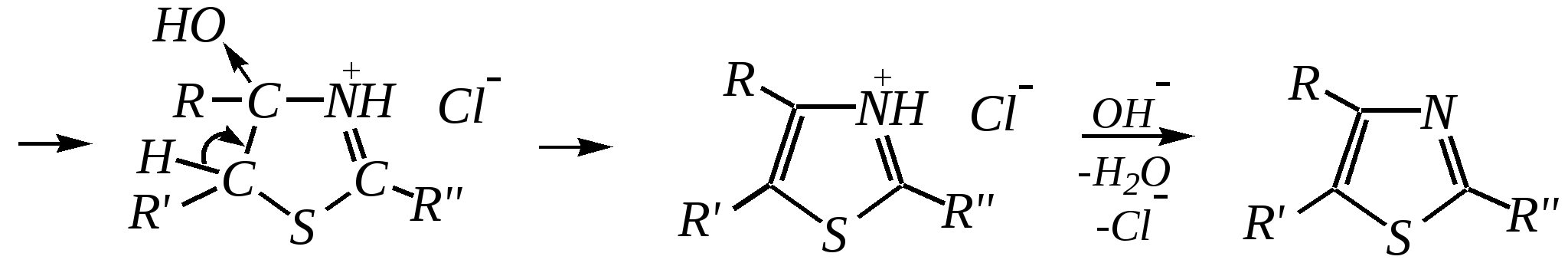
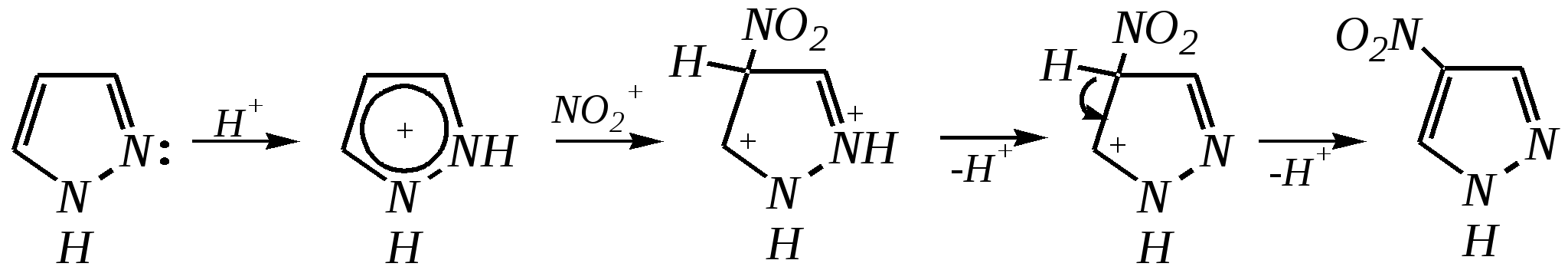 4-нитропиразол Однако если SE-реакцию удаётся провести в щелочной среде, то она протекает легко. Примерами могут служить реакция бромирования и взаимодействие с некоторыми слабыми электрофилами, например, с катионом арендиазония, как показано для имидазола в следующих схемах: 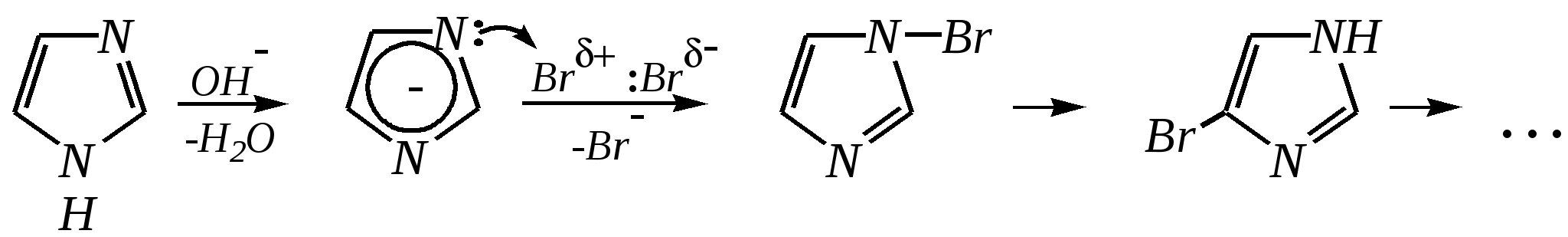 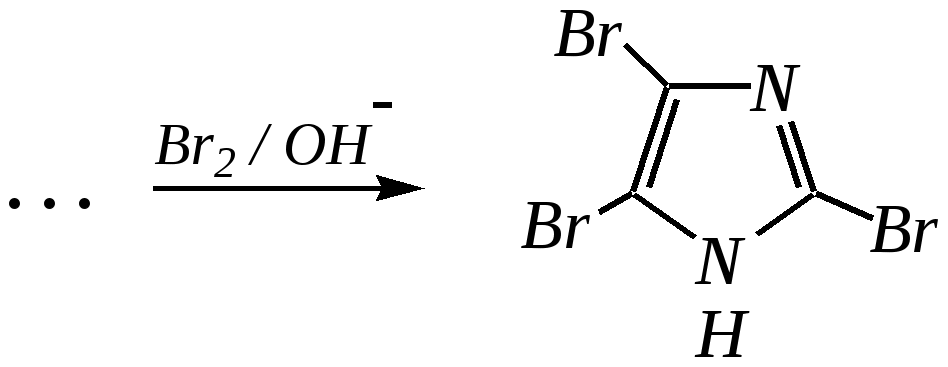 2,4,5-трибромимидазол 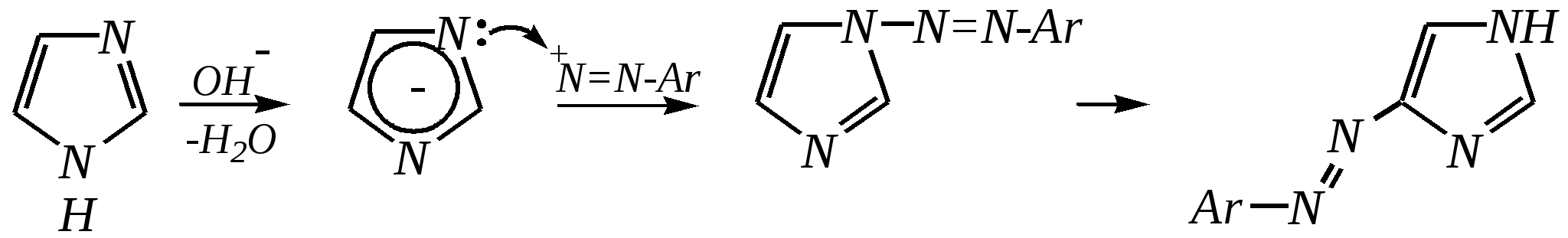 4-арилазоимидазол 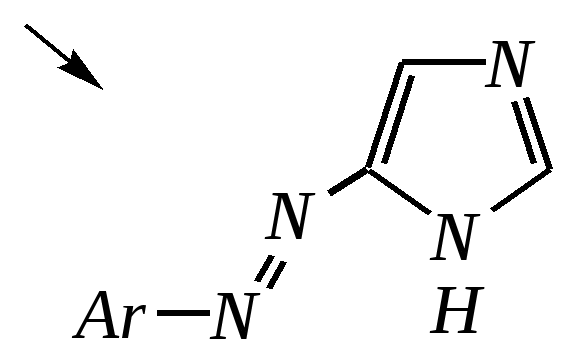 5-арилазоимидазол Существенно отличается от имидазола и пиразола поведение тиазола и оксазола по отношению к электрофильным агентам. Тиазол не вступает в реакцию нитрования даже при использовании азотной кислоты в олеуме при 433 К, но метилтиазолы успешно нитруются, причём преимущественно образуются 5-нитро- и в меньшем количестве 4-нитропроизводные. Гораздо менее реакционноспособные оксазолы не подвергаются нитрованию вовсе. Сульфирование тиазола протекает в жёстких условиях. Для этого требуются высокие температуры (523 К) и присутствие сульфата ртути (II) в качестве катализатора. Оксазол не сульфируется. 12.3.4. способы получения Для синтетического получения имидазола, пиразола, оксазола, тиазола, а также других пятичленных гетероциклических соединений с двумя гетероатомами используют исходные вещества, содержащие структурные фрагменты необходимого гетероцикла. Приведём некоторые примеры таких синтезов.
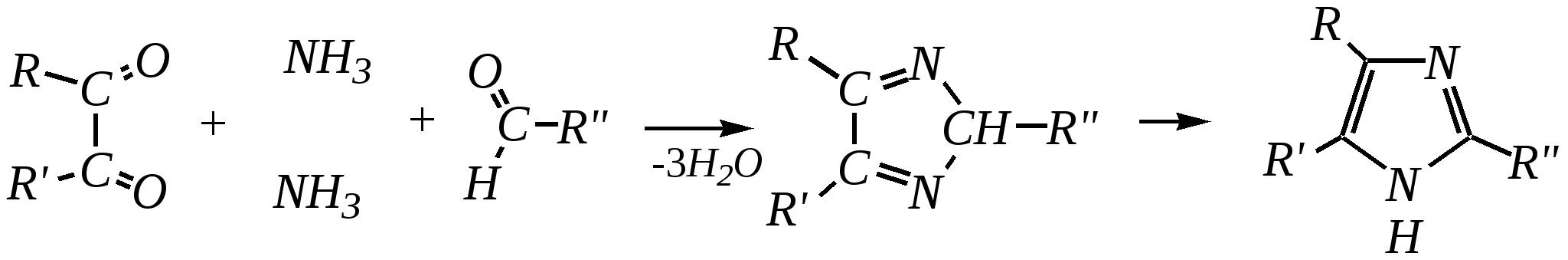
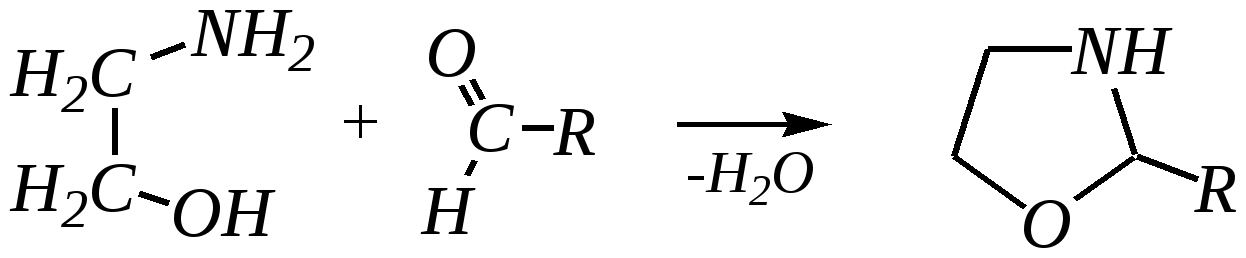 При дальнейшем дегидрировании можно получить 2-замещённые оксазолы.
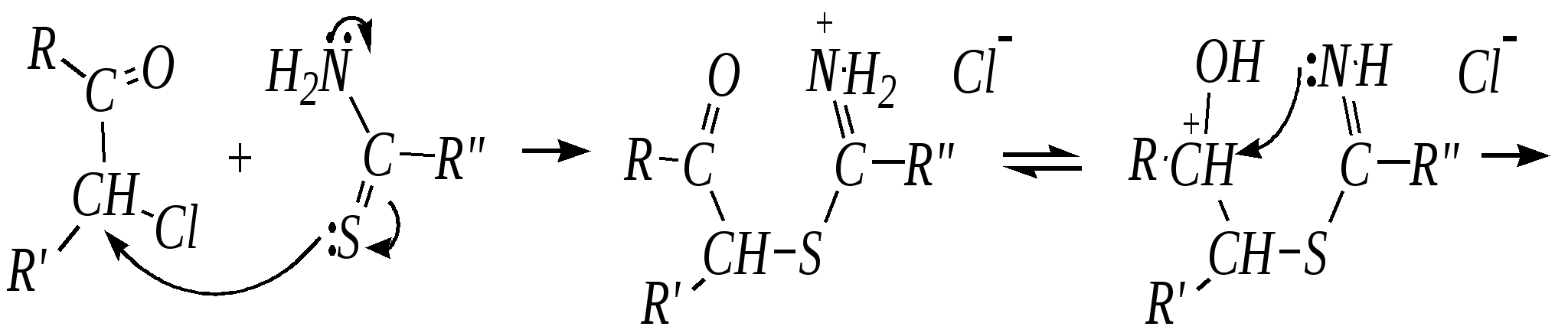  12.3.5. важнейшие представители и медико-биологическое значение Имидазол — бесцветное кристаллическое вещество с температурой плавления 363 К, кипения — 529 К, растворимое в воде. Получают из глиоксаля, аммиака и формальдегида (см. выше). Гистидин — одна из незаменимых протеиногенных -аминокислот (гл. 6.9). Гистамин — «биогенный амин», образуется в очаге воспаления, расширяя сосуды и ускоряя приток лейкоцитов. В организме образуется при декарбоксилировании аминокислоты гистидина под действием ферментов — декарбоксилаз. 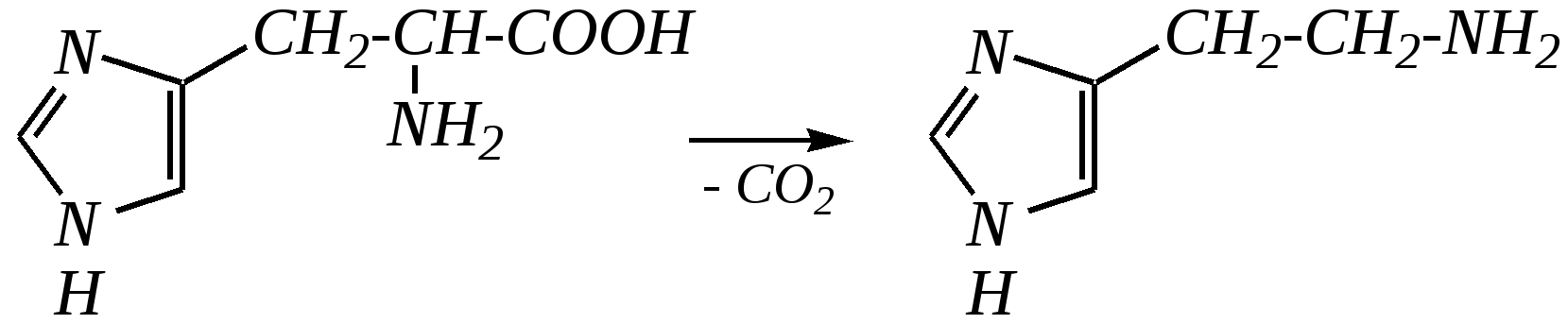 гистидин гистамин Витамин Н (биотин) — вещество, встречающееся в яичном белке и в печени, необходимо для роста микроорганизмов. 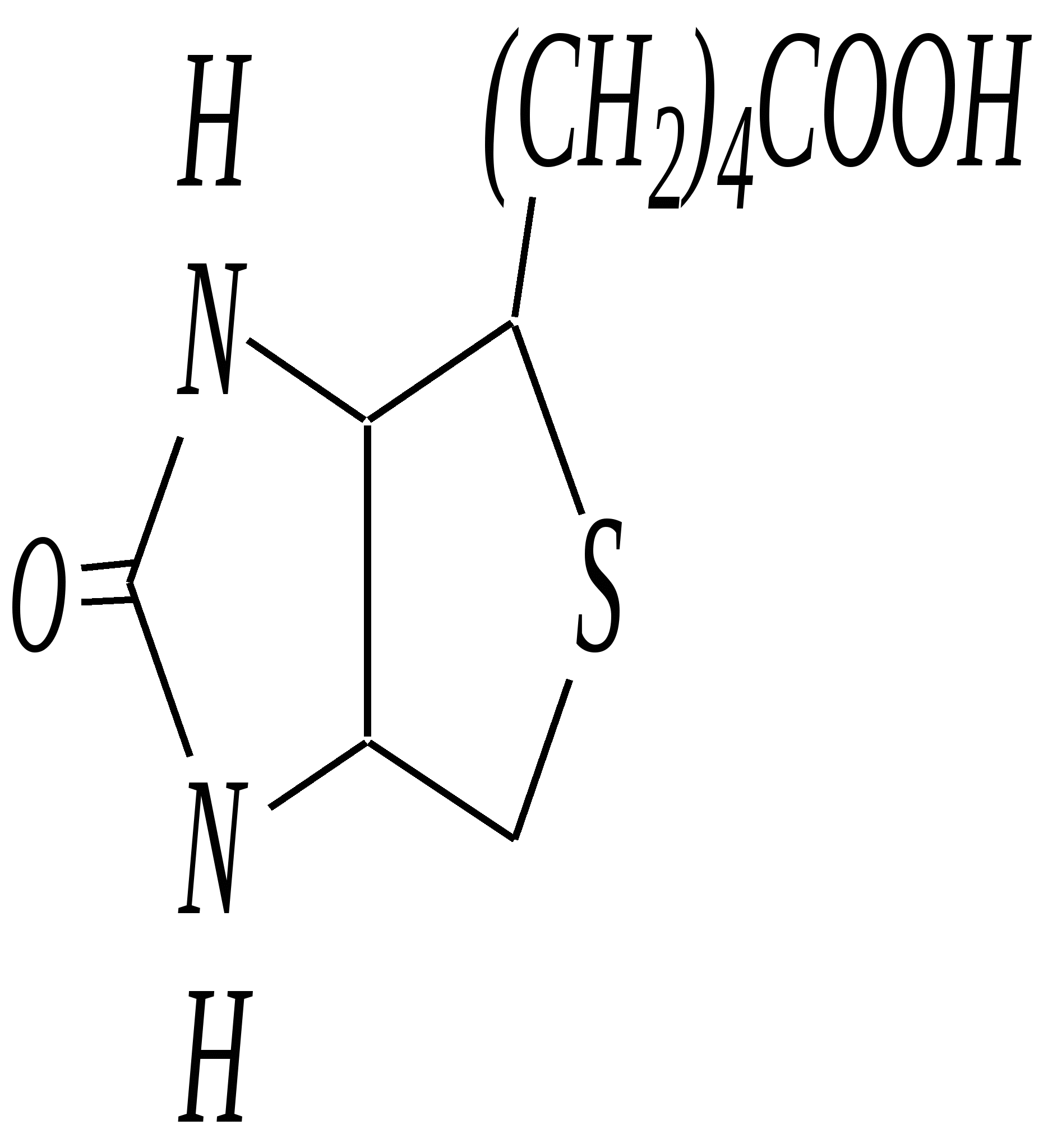 витамин Н (биотин) Пиразол — бесцветное кристаллическое вещество со слабым неприятным запахом, с температурой плавления 343 К, кипения — 460 К, растворимое в воде. Антипирин — бесцветное кристаллическое вещество с температурой плавления 387 К. Является важным исходным веществом для получения лекарственных веществ (анальгина и др.). Используется для анализа лекарственных препаратов, так как образует нерастворимые комплексы с металлами. 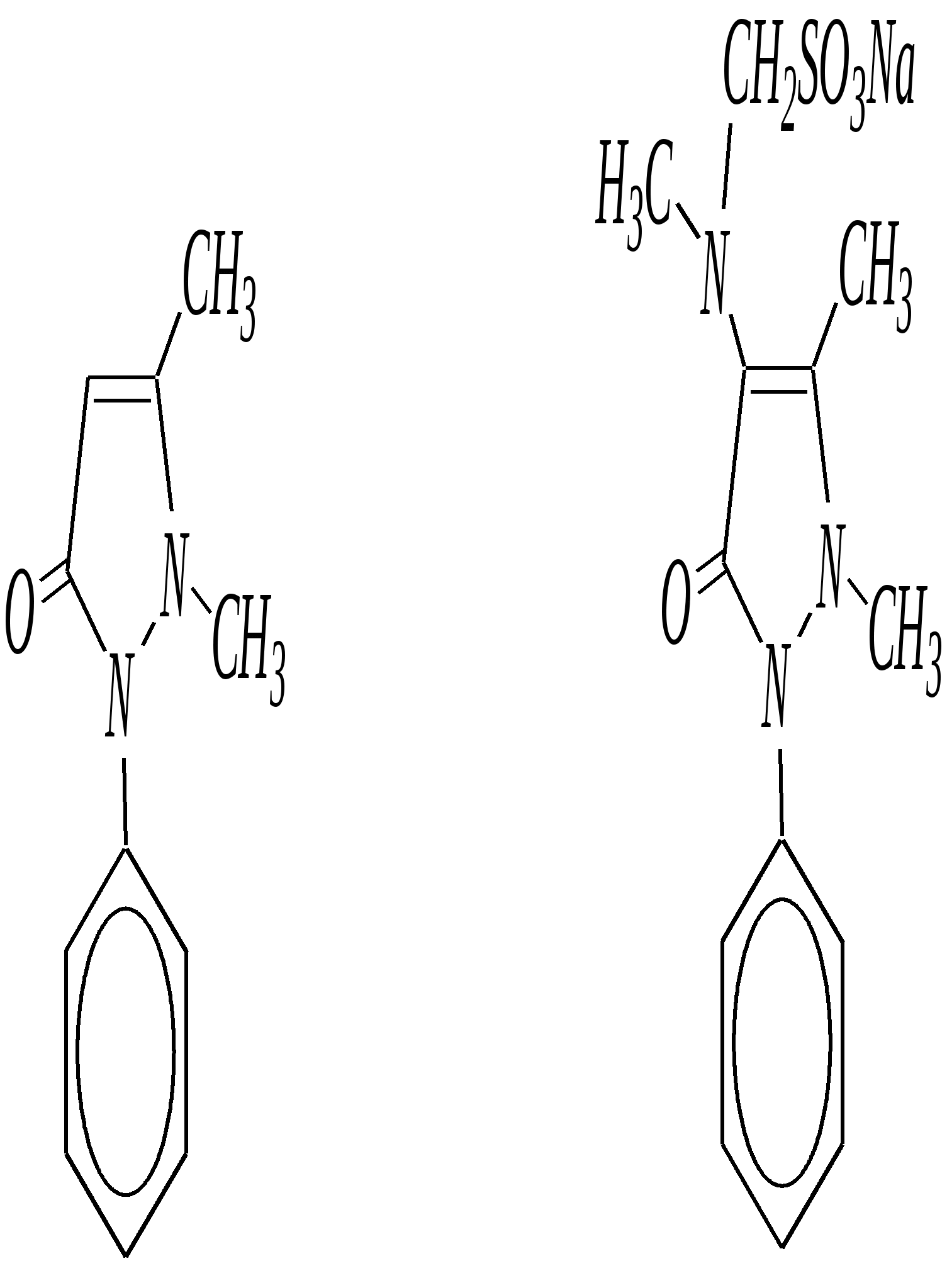
Анальгин — бесцветное кристаллическое вещество, хорошо растворимое в воде. Применяют в фармацевтической практике в качестве болеутоляющего, жаропонижающего и противовоспалительного средства. Тиазол — бесцветная жидкость с неприятным запахом, температурой кипения 390 К. Получают из хлорацетальдегида и тиоформамида. Применяют в органическом синтезе. Широко используются некоторые производные тиазола (лекарственные вещества, витамины, антибиотики). Норсульфазол — бесцветное кристаллическое вещество с температурой плавления 470 К. Является эффективным сульфаниламидным препаратом (гл. 10.6.5). 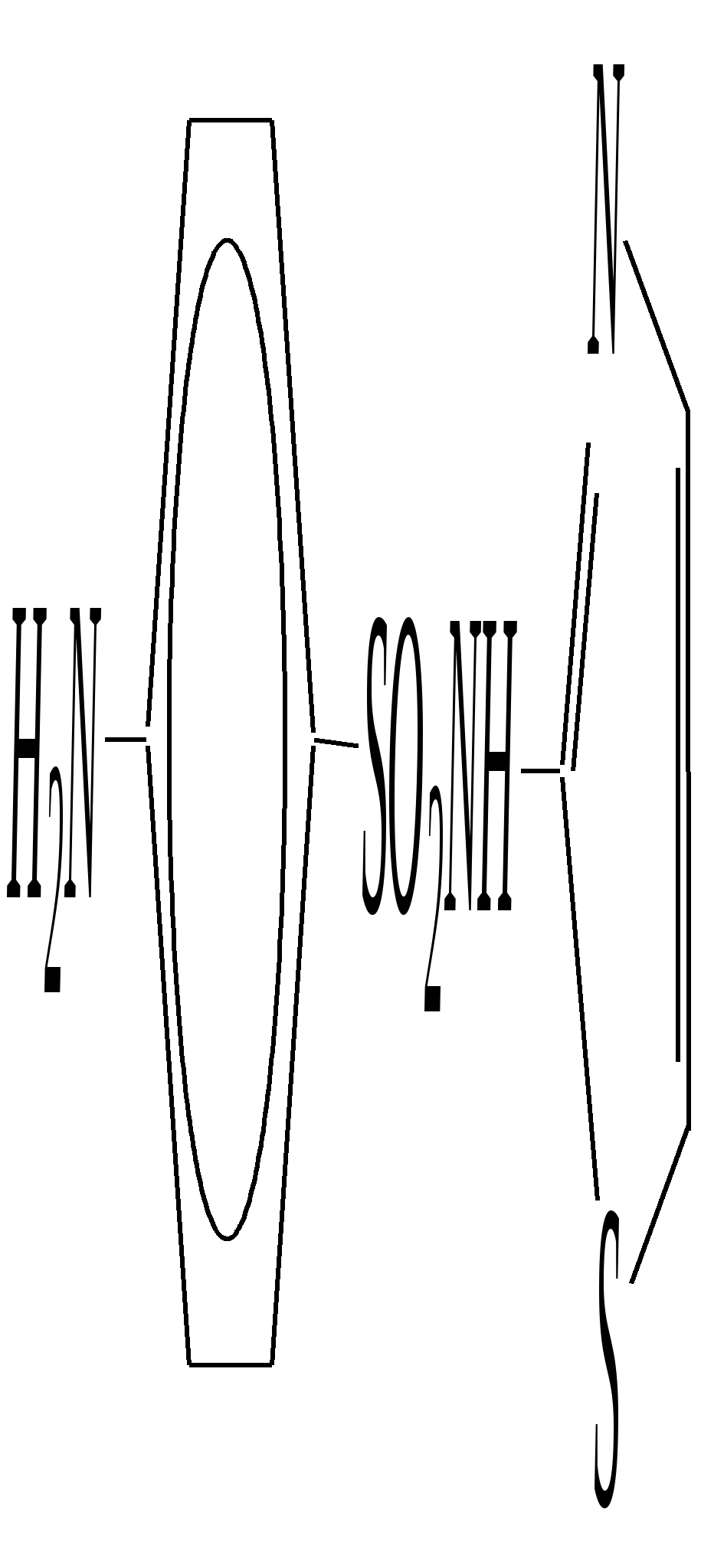 Получают из 2-аминотиазола. Применяют как антимикробное средство при инфекционных заболеваниях. Витамин В1 (тиамин) — бесцветное кристаллическое вещество, хорошо растворимое в воде. Входит в состав некоторых ферментов, способствующих процессам декарбоксилирования. Синтезируется в растениях и некоторых микроорганизмах. 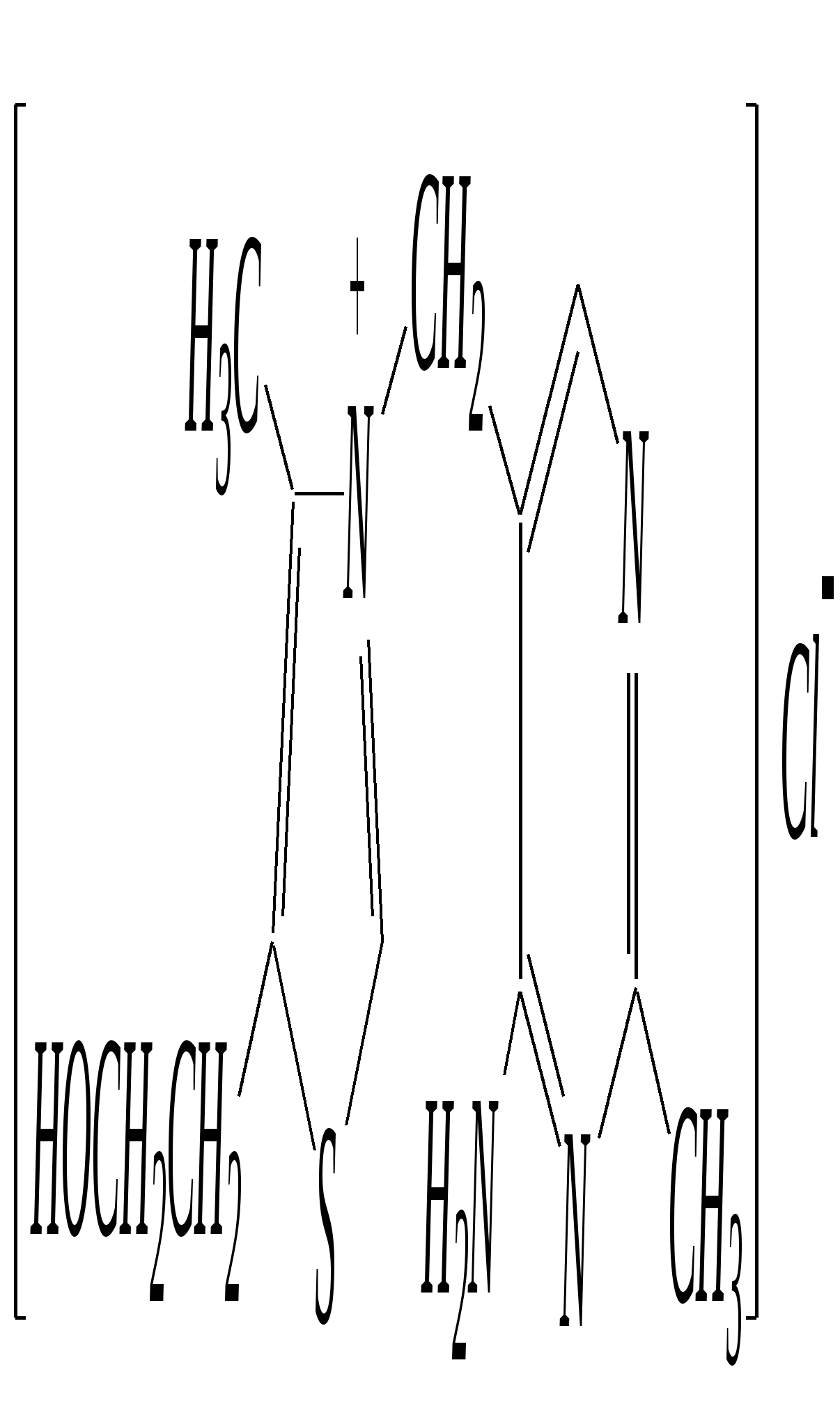 Пенициллины — антибиотики, эффективно действующие на различные микроорганизмы. Образуются в результате жизнедеятельности некоторых микроорганизмов (плесневых грибков).
Получают пенициллины биосинтетически или полусинтетическим путем из 6-аминопенициллановой кислоты. 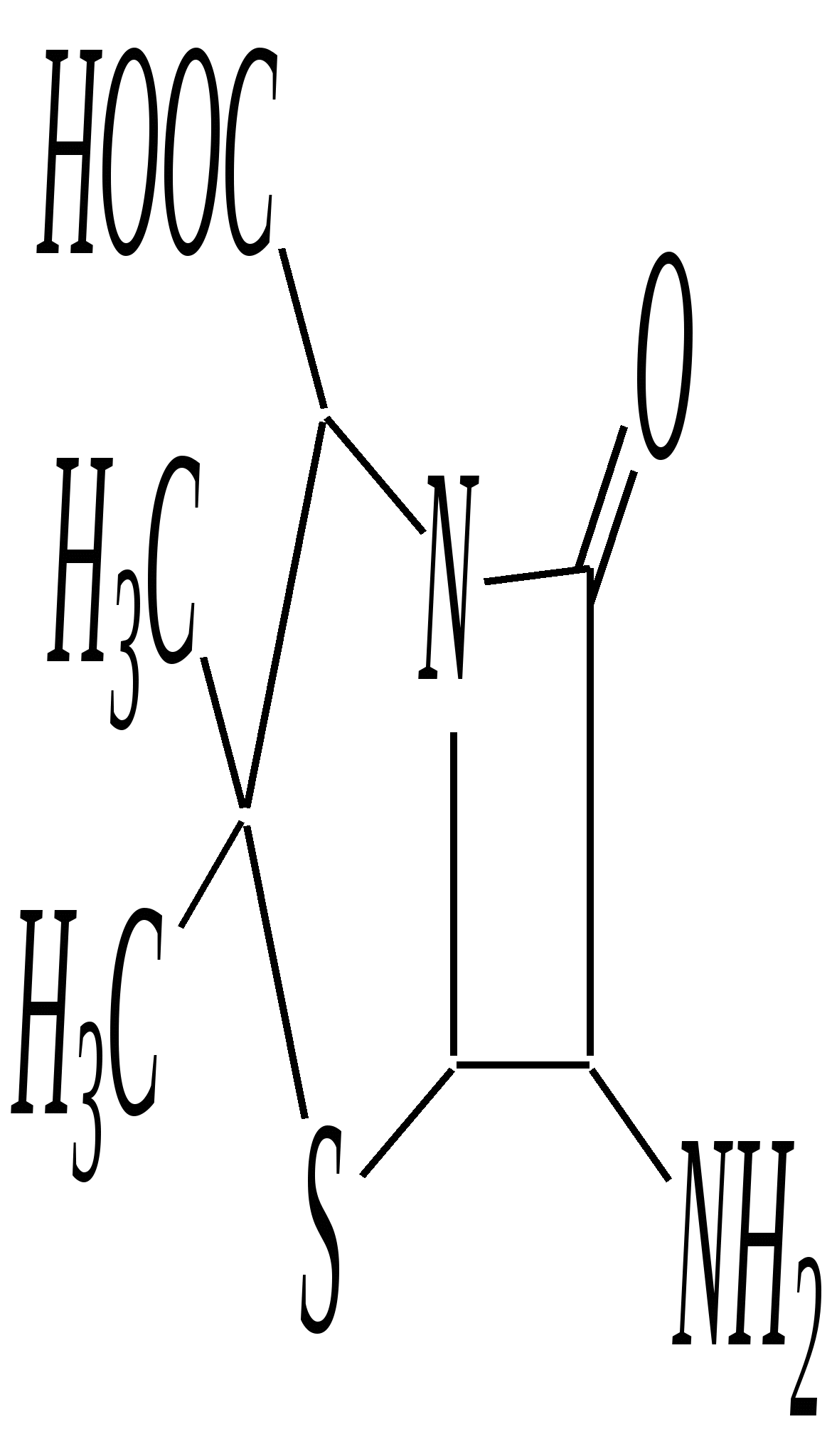 6-аминопенициллановая кислота 12.4. шестичленные гетероциклические соединения с одним гетероатомом Шестичленные гетероциклические соединения также могут содержать атомы азота, кислорода и серы. Но наиболее важны в практическом отношении азотосодержащие гетероциклы — пиридин, его производные и конденсированные соединения на их основе. Широко распространены также гетероциклические соединения на основе пиранов — циклов, содержащих атом кислорода. 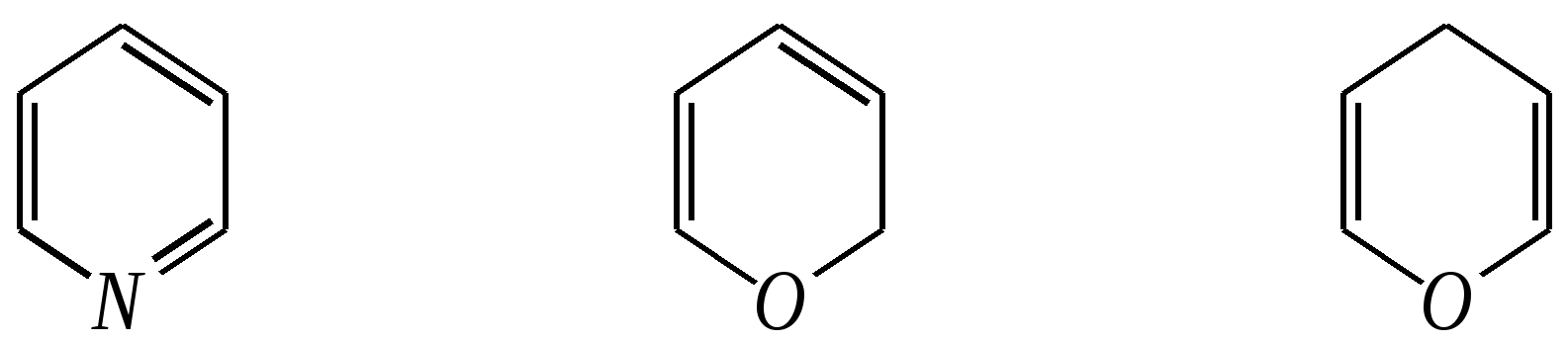 пиридин -пиран -пиран 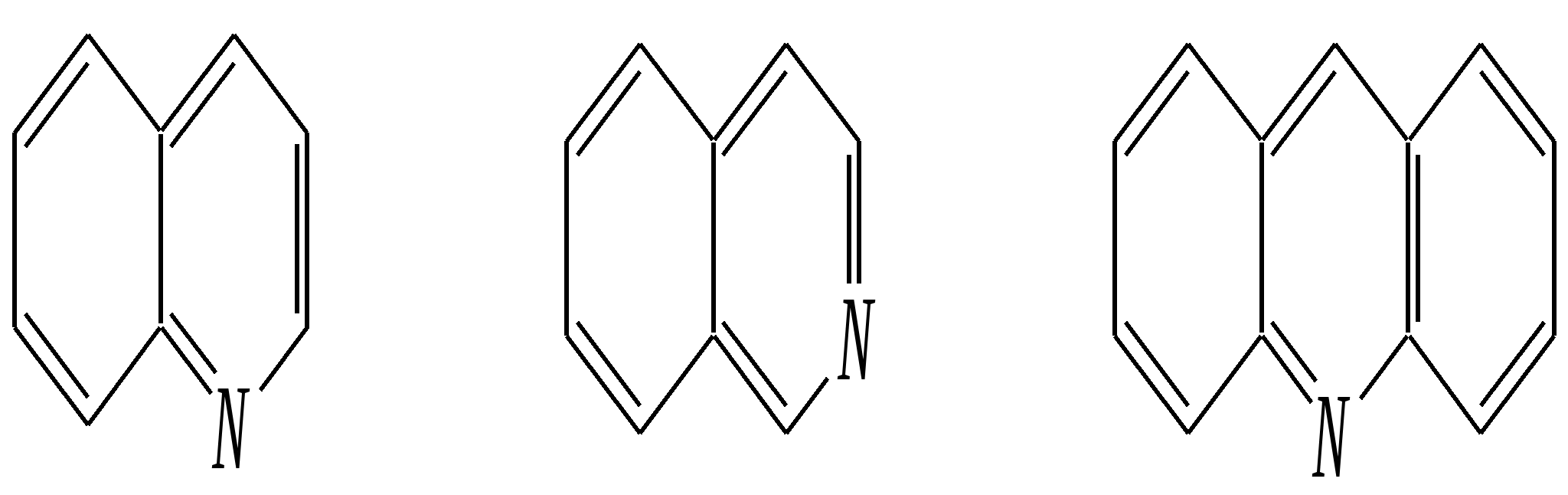 хинолин изохинолин акридин 12.4.1. номенклатура пиридина и его производных Систематическое название пиридина — азин (гл. 12.1). Однако как для самого гетероцикла, так и для его производных почти всегда используется тривиальное название «пиридин». Атомы цикла могут быть обозначены цифровыми локантами или же греческими буквами. Соответственно, возможны три радикала пиридина: 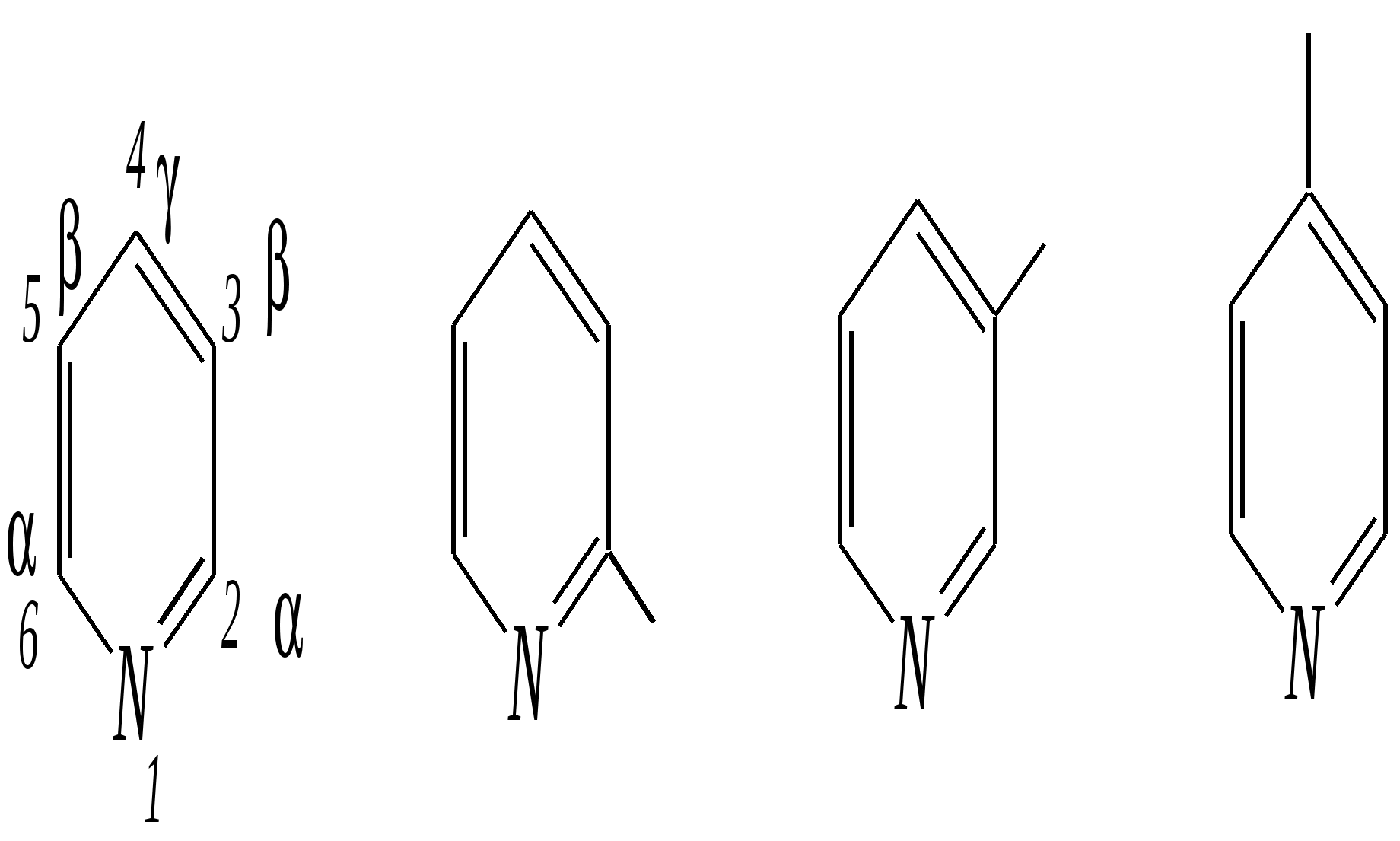 -пиридил -пиридил -пиридил (пиридил-2) (пиридил-3) (пиридил-4) Метилпроизводные пиридина имеют тривиальное название «пиколины», диметилпроизводные — «лутидины», например: 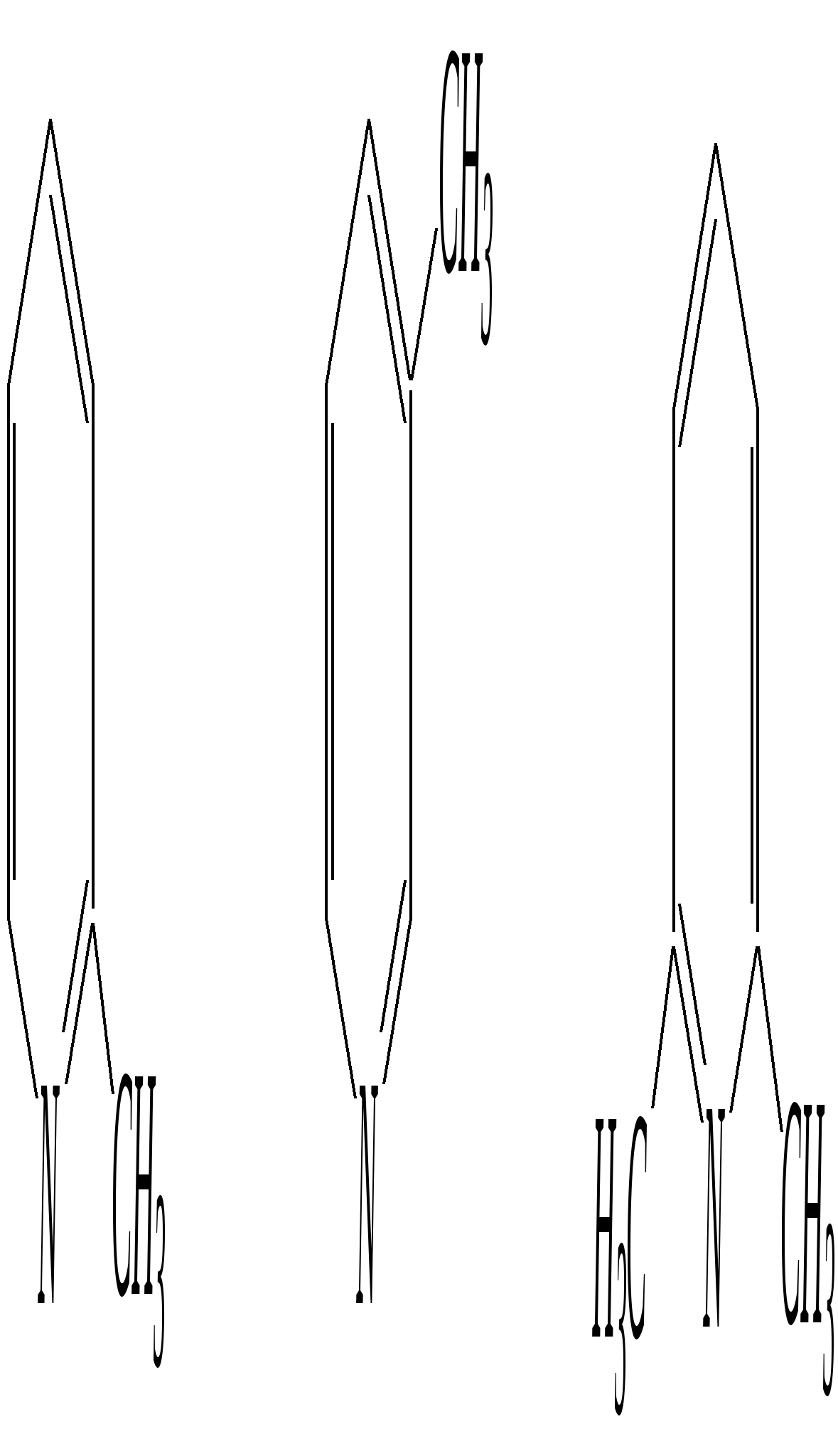 -пиколин -пиколин 2,6-лутидин (2-метилпиридин) (3-метилпиридин) (2,6-диметилпиридин) -, - и -пиридинкарбоновые кислоты имеют каждая своё тривиальное название:  пиколиновая кислота никотиновая кислота изоникотиновая кислота (пиридин-2-карбоновая (пиридин-3-карбоновая (пиридин-4-карбоновая кислота) кислота) кислота) 12.4.2. строение пиридина Молекула пиридина, как и молекула бензола, представляет собой плоский шестиугольник, содержащий сопряжённую -электронную систему, удовлетворяющую всем критериям ароматичности, в том числе и правилу Хюккеля (6 -электронов). Однако пиридиновый цикл содержит атом азота вместо одного из атомов углерода бензольного кольца. Ввиду большей электроотрицательности азота по сравнению с углеродом валентные углы и длины связей в молекуле пиридина несколько искажены по сравнению с бензолом. Энергия делокализации ароматической системы пиридинового кольца составляет 117 кДж/моль (против 151 кДж/моль для бензола). Атом азота находится в состоянии sp2-гибридизации; его 3 валентных электрона участвуют в образовании двух -связей и -электронной сопряжённой системы ароматического кольца. А его неподелённая электронная пара находится на sp2-гибридной орбитали, ось которой лежит в плоскости гетероцикла, и потому эти электроны не могут участвовать в сопряжении с -электронной системой кольца. 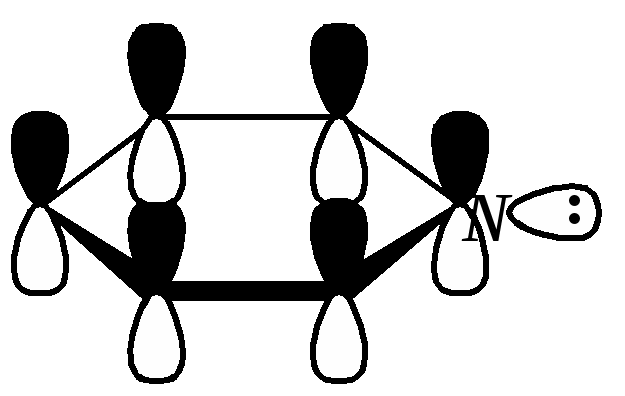 Атом азота в целом является электроноакцептором, понижая электронную плотность на атомах углерода кольца. Он проявляет –I-эффект и, участвуя в сопряжении, –М-эффект. В связи с этим распределение -электронной плотности в ароматическом кольце можно показать с помощью граничных структур: 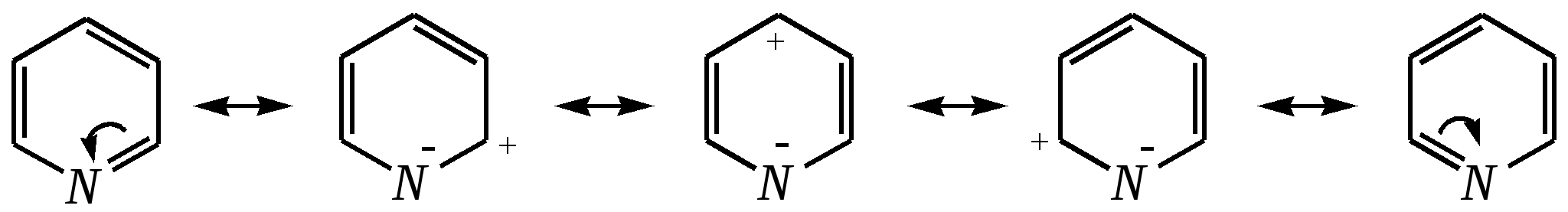 , ,из которых следует, что наибольшие эффективные положительные заряды, вызванные акцепторным влиянием атома азота, создаются в - и -положениях, причём акцепторное влияние азота на -атомы сильнее по причине индуктивного эффекта. 12.4.3. химические свойства пиридина Химические свойства пиридина, как следует из его строения, должны быть достаточно многообразны. Это и реакции непосредственно по атому азота (основные свойства, реакции алкилирования, окисления), и реакции с участием ароматического кольца (электрофильное и нуклеофильное замещение, гидрирование). 12.4.3.1. Основность Пиридин является типичным основанием с рКb = 8.8. Его основность ниже основности аммиака и алифатических аминов, так как неподелённая электронная пара пиридинового азота, за счёт которой происходит взаимодействие с протоном, находится наsp2-гибридной орбитали. Электронная же пара аминного атома азота находится на sp3-гибридной орбитали, поэтому более удалена от ядра и легче взаимодействует с протоном (рКbаммиака равна 4.8, метиламина — 2.3). С другой стороны, основность пиридина выше основности анилина и ароматических аминов (рКb анилина = 9.4). В молекуле анилина, как и других ароматических аминов, неподелённая электронная пара азота участвует в сопряжении с ароматическим кольцом и делокализована, а в молекуле пиридина пара электронов принадлежит только атому азота. Основные свойства пиридина проявляются как при взаимодействии с кислотами, так и при взаимодействии с водой: 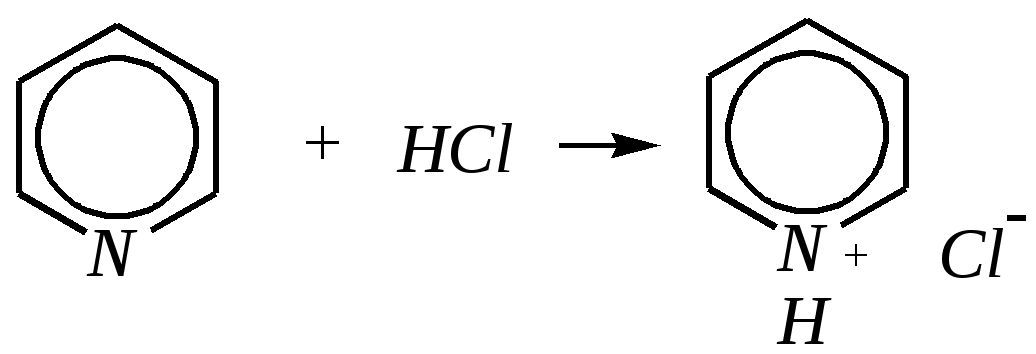 хлорид пиридиния 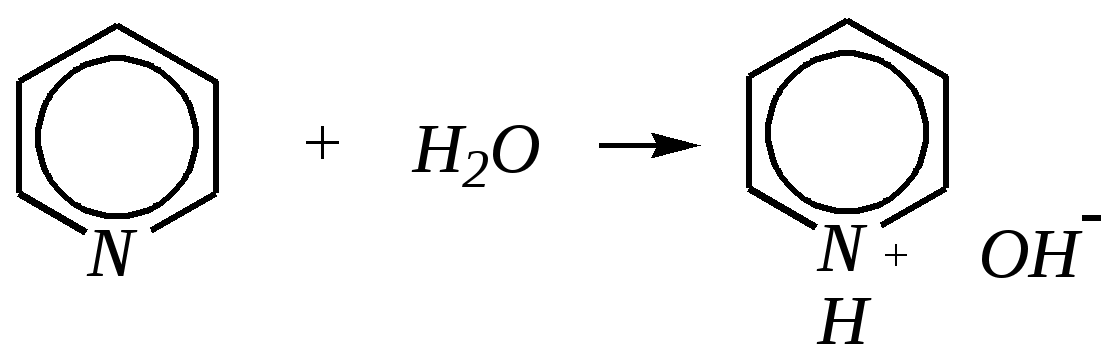 гидроксид пиридиния 12.4.3.2. Реакции алкилирования по атому азота Неподелённая электронная пара азота энергетически более доступна для атаки электрофильными агентами, чем сопряжённая система ароматического кольца. Однако только с алкилирующими агентами атом азота образует устойчивые продукты взаимодействия. Реакции между пиридином и галогеналканами протекают легко: 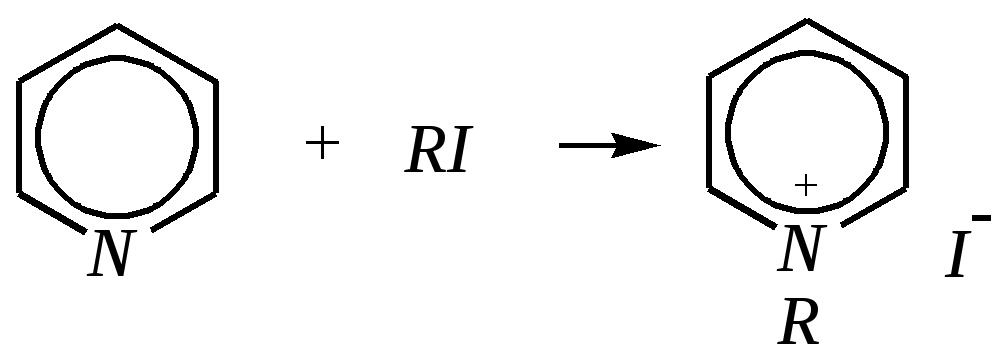 йодид N-алкилпиридиния По механизму эти реакции — типичные примеры нуклеофильного замещения, в которых пиридин является нуклеофилом. Но при нагревании продукт алкилирования по азоту претерпевает перегруппировку, протекающую по радикальному механизму, с выбросом галогеноводорода. Результатом этого является образование - и -алкилпиридинов: 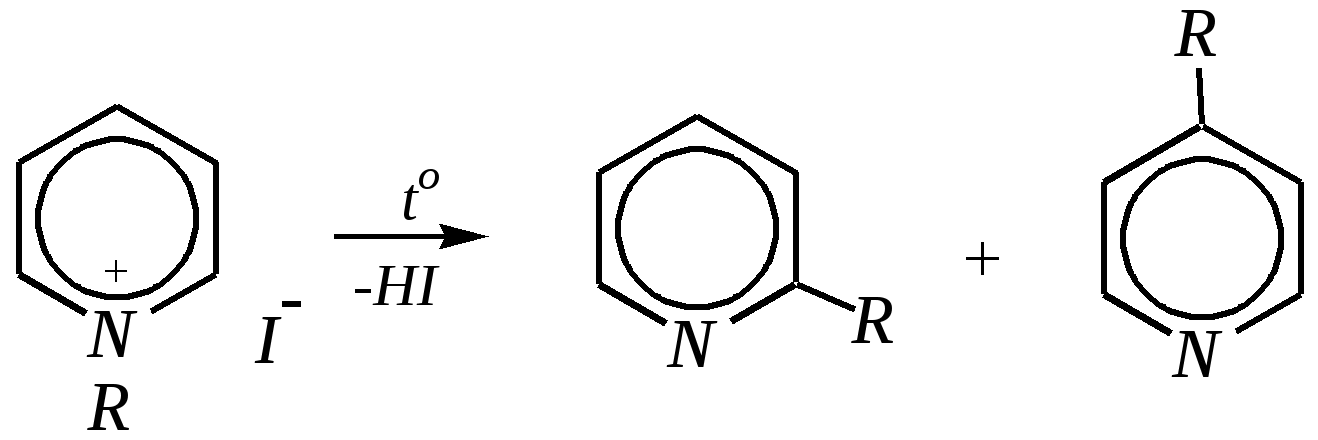 12.4.3.3. Реакции электрофильного замещения В молекуле пиридина имеются два реакционных центра для электрофильной атаки, и, как было сказано выше, легче она должна осуществляться по атому азота. Действительно, большинство электрофилов на первой стадии атакует атом азота, а затем происходит перегруппировка с образованием более прочных связей электрофильных частиц с атомами углерода кольца. При этом электрофильное замещение всегда протекает по -углеродному атому в отсутствие других ориентирующих групп, так как - и -атомы дезактивированы электроноакцепторным влиянием атома азота (см. выше). В целом электрофильное замещение в цикле пиридина протекает в жёстких условиях (при температурах около 500—570 К). Одним из примеров является реакция хлорирования, которая без катализатора протекает при 470 К, а в присутствии хлорида алюминия — при 370 К. Образование связи C–Clздесь происходит при действии избытка хлорирующего агента: 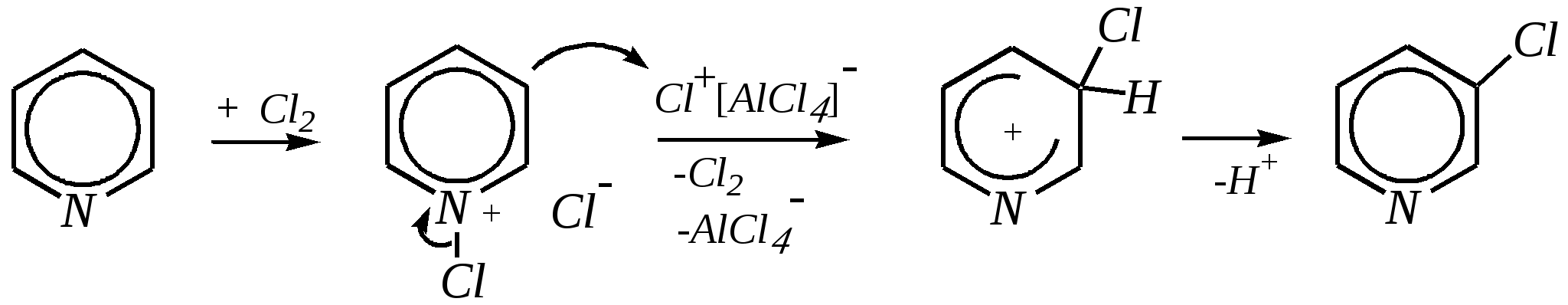 -хлорпиридин Проведение хлорирования при более высокой температуре (500 К) приводит к смене механизма, в результате чего вместо SE-реакции протекает радикальное замещение (SR) и образуются продукты -замещения: 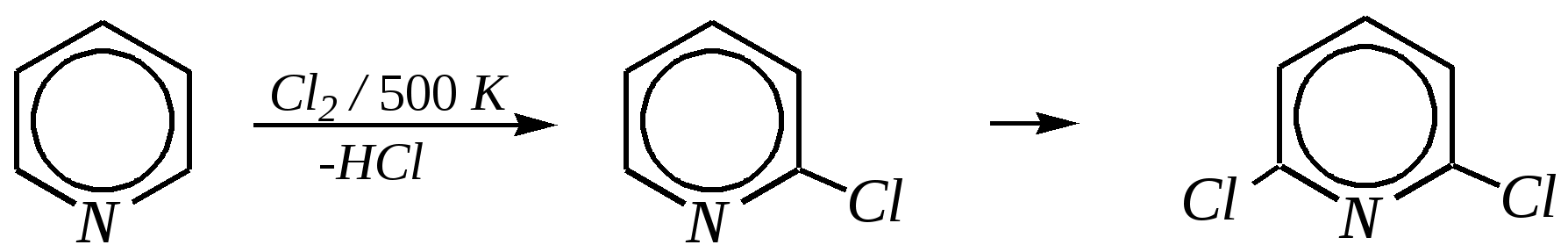 -хлорпиридин 2,6-дихлорпиридин Для проведения электрофильного бромирования требуется использование раствора брома в олеуме при 400 К: 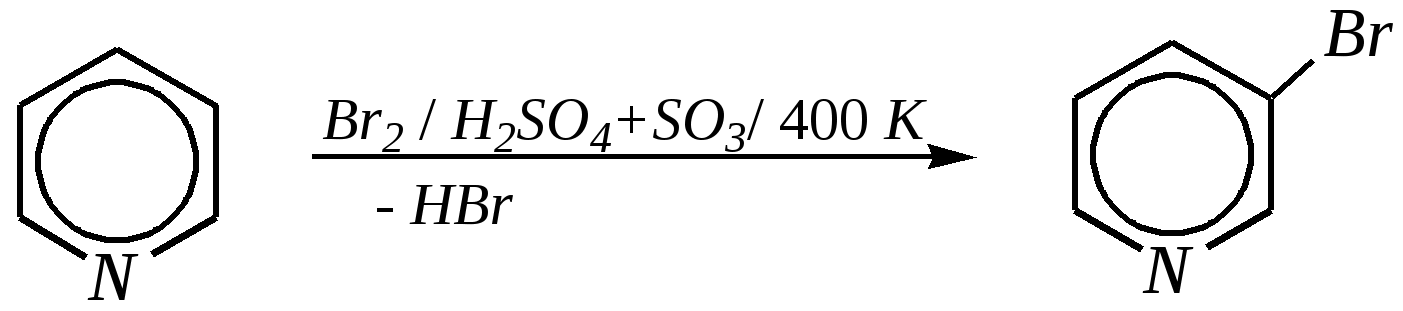 -бромпиридин Проведение бромирования без растворителя при более высокой температуре (770 К) также приводит к смене механизма реакции, в результате протекает радикальное замещение: 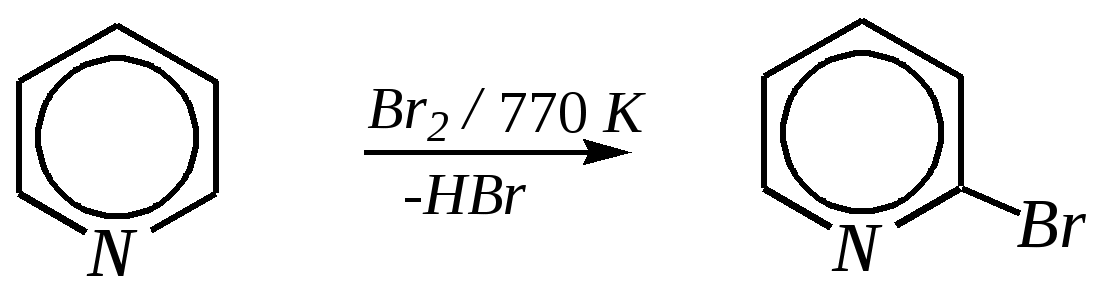 -бромпиридин Реакции нитрования и сульфирования протекают в сильнокислой среде, поэтому первой стадией этих процессов является протонирование с образованием катиона пиридиния, что в свою очередь ещё в большей степени замедляет электрофильное замещение. При нитровании повышение температуры выше 570 К (640 К) приводит к смене механизма с SEна SR. При этом вместо -нитропиридина образуется преимущественно -производное: 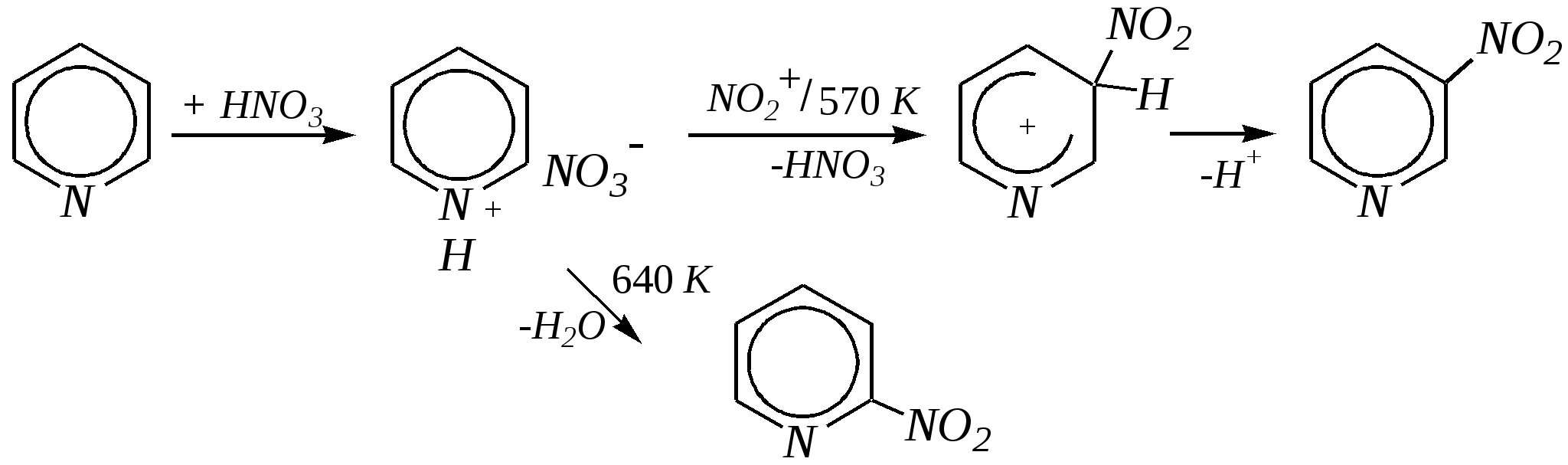 Сульфирование пиридина при 630 К даёт -пиридинсульфокислоту, существующую преимущественно в виде внутренней соли: 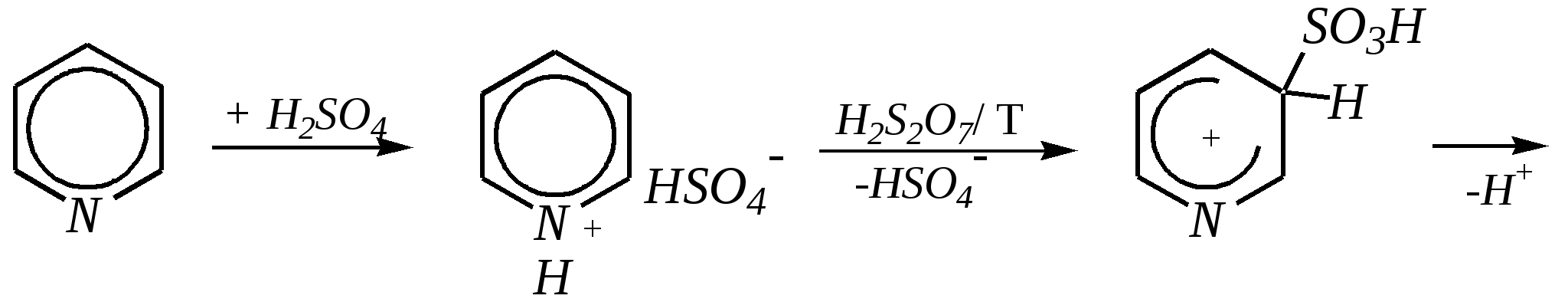  Некоторые другие типичные реакции электрофильного замещения, например, реакции алкилирования и ацилирования по Фриделю–Крафтсу, вовсе не характерны для пиридина, но такие реакции невозможны и для производных бензола с сильными электроноакцепторными группами (например, для нитробензола). 12.4.3.4. Реакции нуклеофильного замещения Наличие атома азота в ароматическом кольце пиридина существенно понижает -электронную плотность, и становится возможной нуклеофильная атака по атому углерода в -положении (и в меньшей степени в -положении). Тем не менее пиридин и его гомологи реагируют только с сильными нуклеофильными агентами. Щёлочи реагируют с пиридином только при температуре около 670 К с образованием -гидроксипиридина, который таутомеризуется в -пиридон. Механизм реакции — SN2аром.: 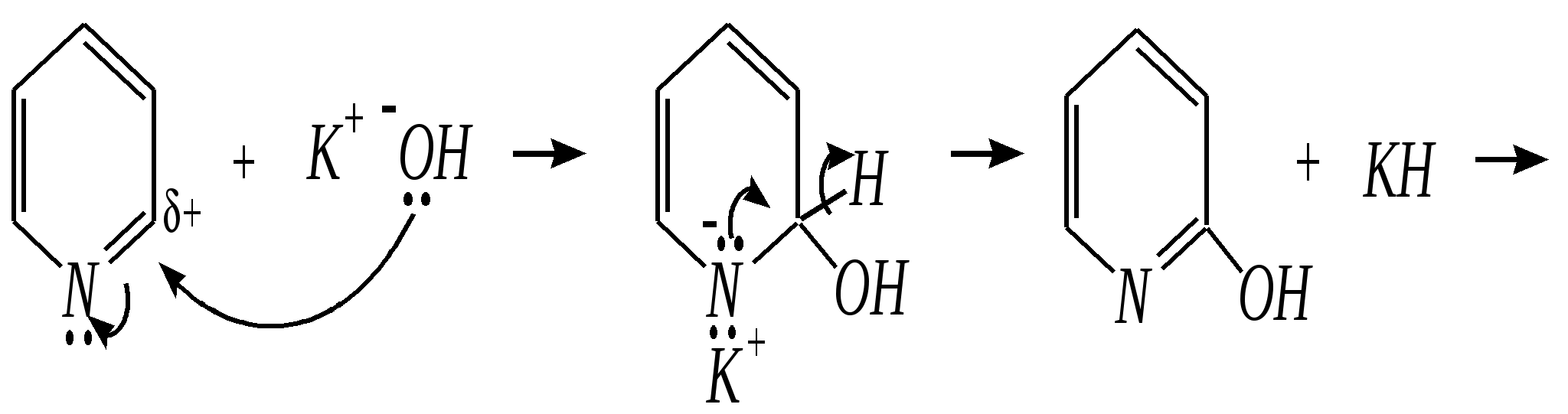 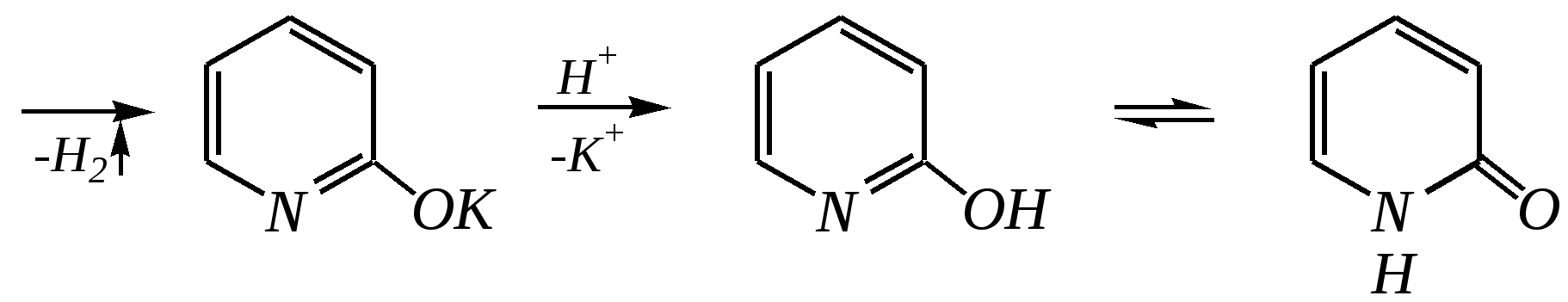 -гидроксипиридин -пиридон Алкилирование и арилирование проводятся литийорганическими соединениями R-Li или Ar-Li при температуре 370 К. Эти реакции также селективно приводят к образованию -замещённых пиридинов. Например, взаимодействие с бутиллитием осуществляется по следующей схеме: 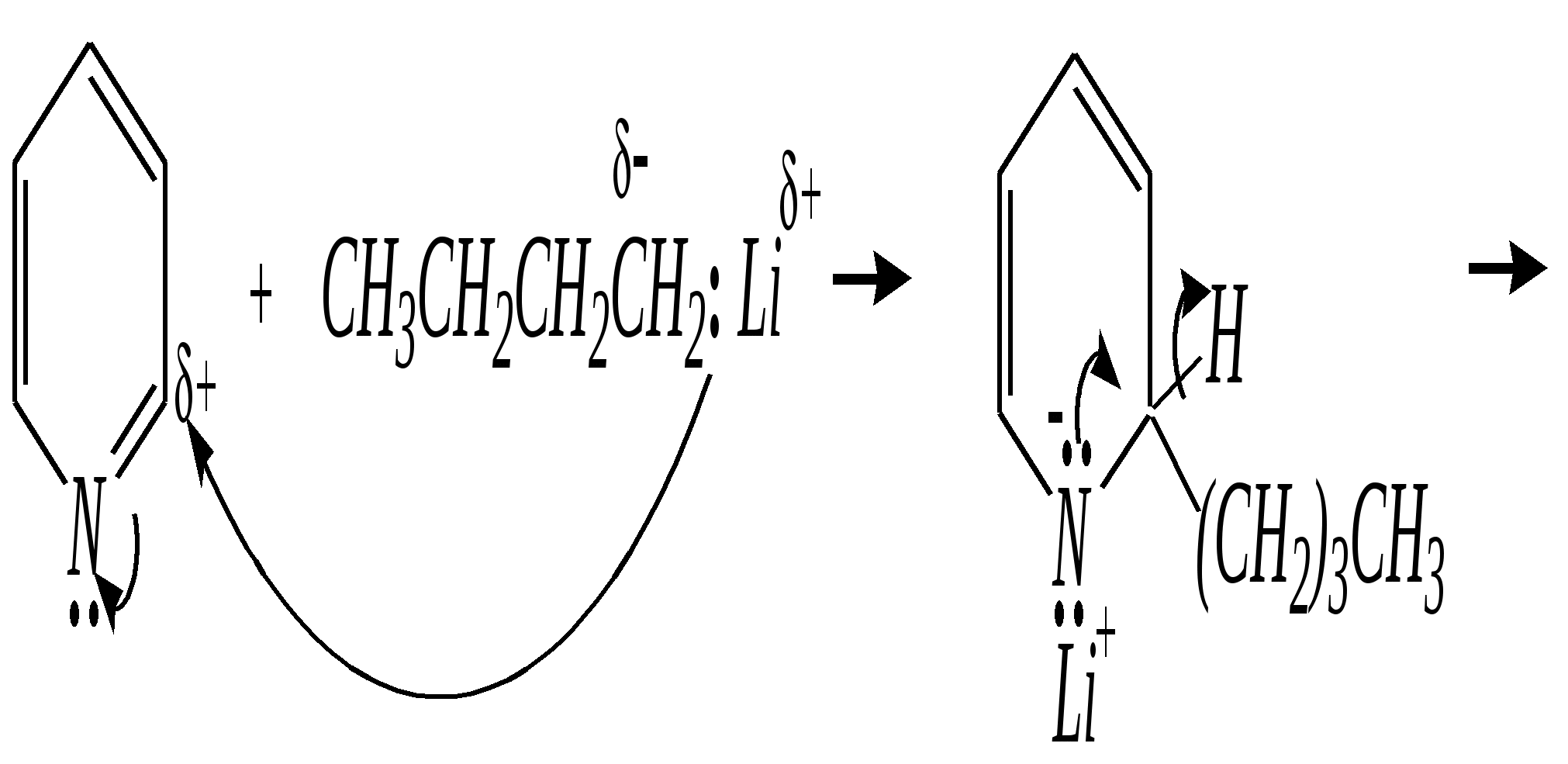 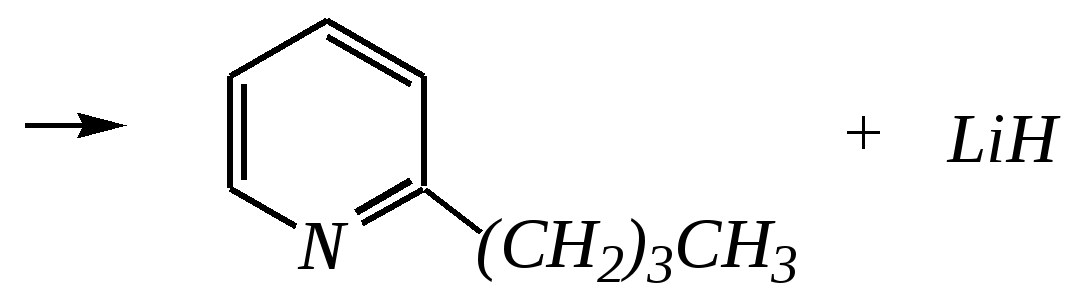 -бутилпиридин Для отщепления гидрид-иона на стадии превращения -комплекса в продукты реакции может быть использовано окисление кислородом воздуха; тогда вместо гидрида лития образуется LiOH. Аминирование пиридина и родственных гетероциклических соединений (реакция А.Е. Чичибабина*) осуществляется амидом натрия в апротонных растворителях при 370 К (или в жидком аммиаке при 240 К). Замещение осуществляется селективно в -положение. 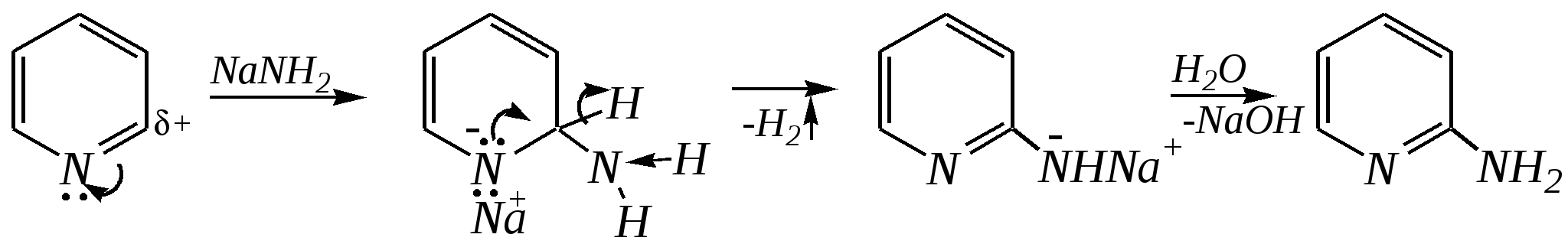 |