глава 12. Гетероциклические соединения
 Скачать 2.57 Mb. Скачать 2.57 Mb.
|
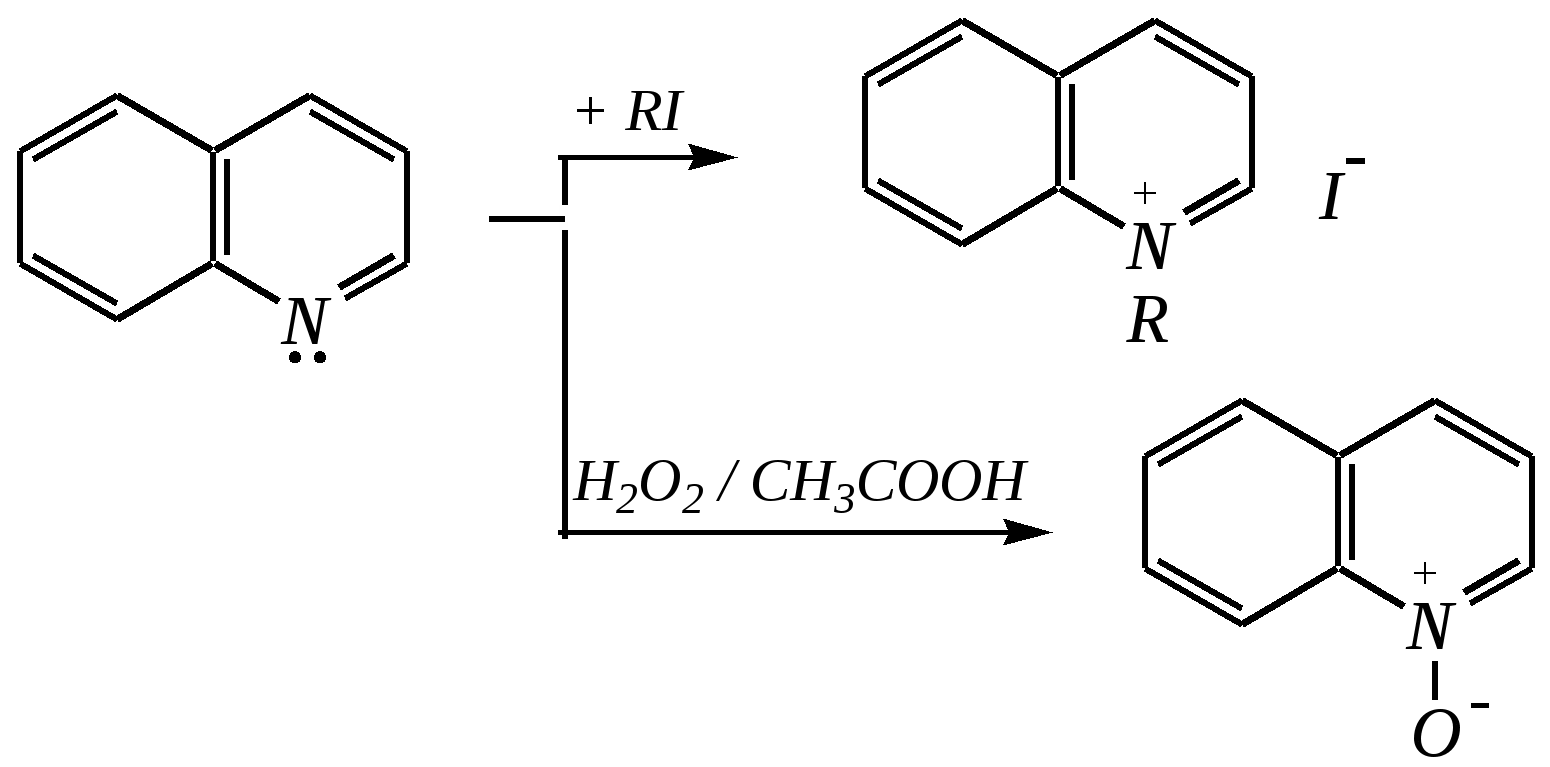
Но если оба -положения заняты, то замещается водород в -положении. При нагревании с избытком амида натрия можно получить 2,6-диаминопиридин.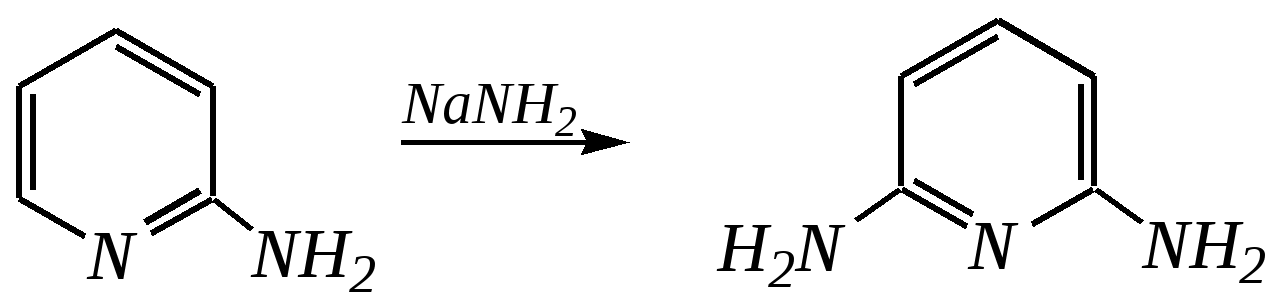 12.4.3.5. Реакции окисления и восстановления Пиридиновый цикл устойчив к окислителям. Окисление может протекать по атому азота, например, действием пероксида водорода или пероксикислот (H2SO5): 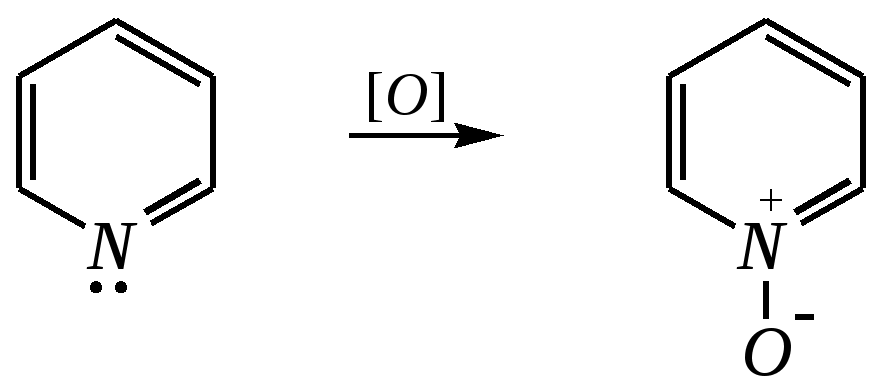 пиридин-N-оксид Восстановление пиридина водородом на никелевом катализаторе приводит к полному гидрированию цикла. Реакция гидрирования пиридина протекает трудно, в условиях, аналогичных гидрированию бензола (гл. 9.5.1.2). 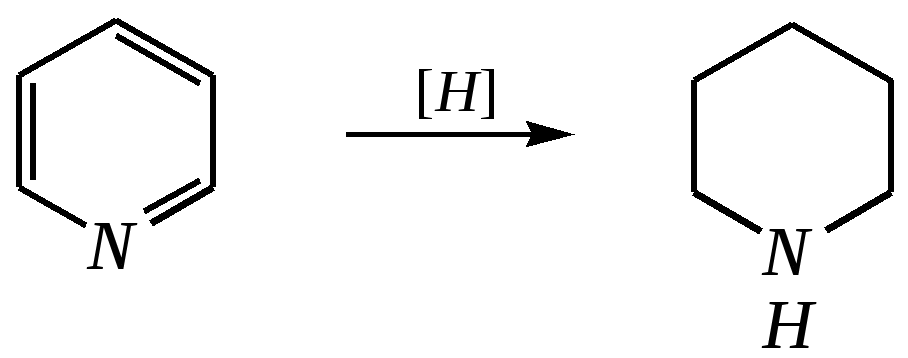 пиперидин 12.4.4. особенности химического поведения пиколинов и функциональных производных пиридина Пиколины с метильной группой в - и -положениях обладают повышенной СН-кислотностью за счёт акцепторного влияния атома азота: 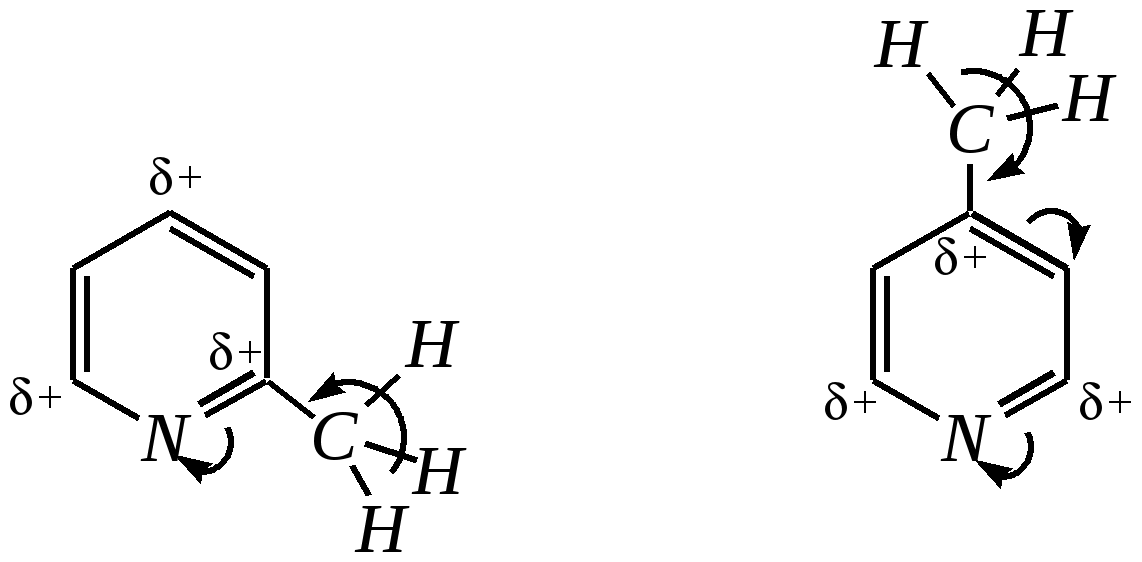 -пиколин -пиколин Это проявляется при образовании ими металлорганических соединений, например, при взаимодействии с бутиллитием, которые затем могут быть использованы в качестве реагентов в нуклеофильных реакциях: 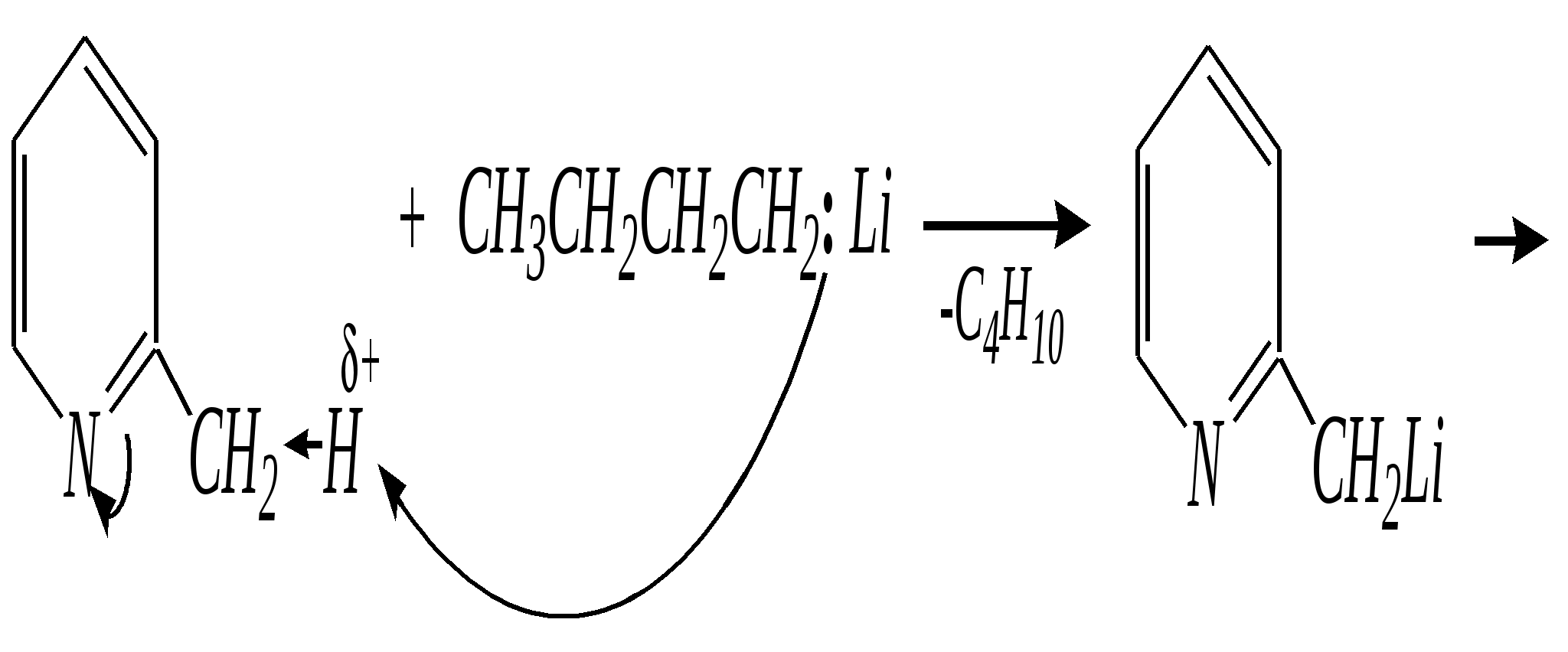 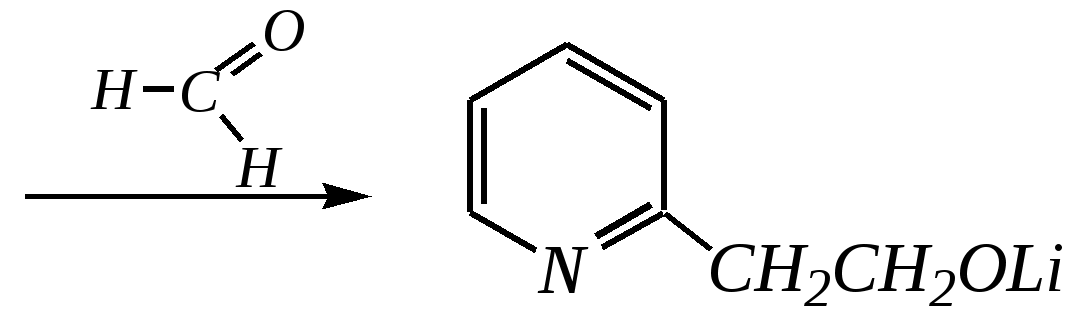 или же сами - и -метилпиридины могут вступать в реакции нуклеофильного присоединения с альдегидами в присутствии оснóвного (реже кислотного) катализатора: 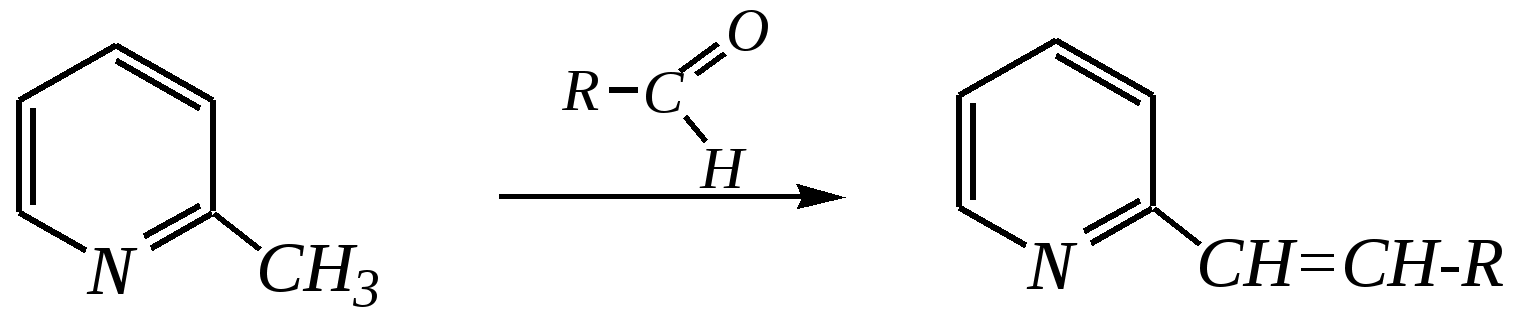 Кислотные свойства -пиколина близки к таковым для толуола, и в целом химические свойства -изомера с участием метильной группы аналогичны свойствам толуола. Из гидроксипиридинов - и -изомеры в обычных условиях существуют в виде - и -пиридонов, образующихся в результате таутомерных превращений: 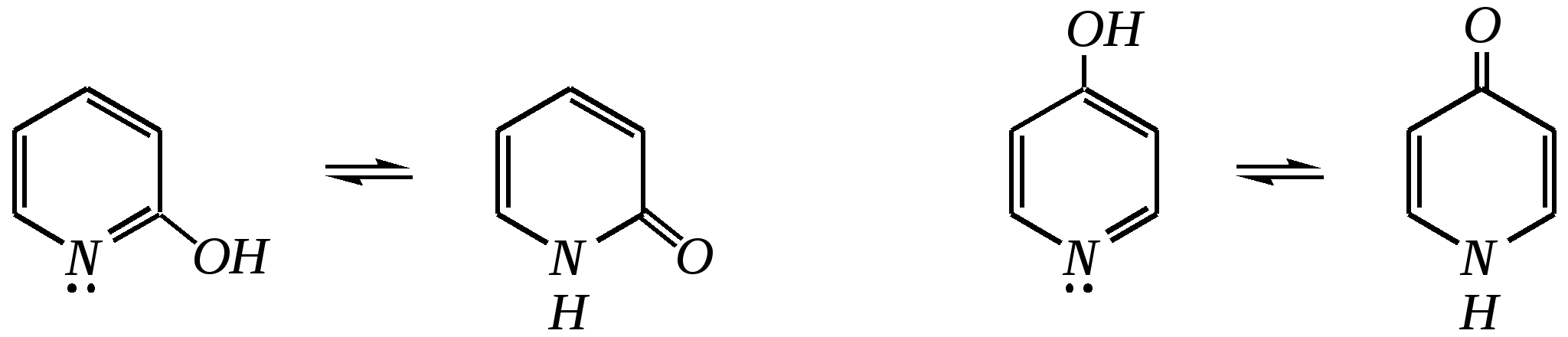 -гидроксипиридин -пиридон -гидроксипиридин -пиридон а -изомер существует в равновесии с биполярной формой (в водном растворе обе формы находятся примерно в равных количествах): 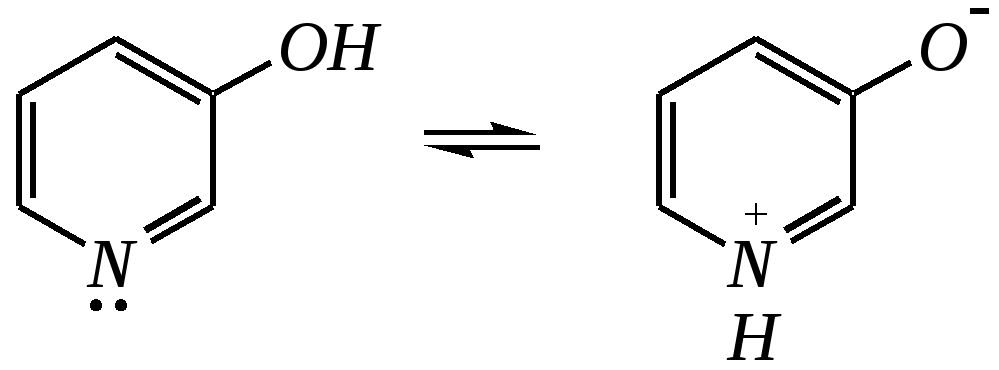 -гидроксипиридин Все гидроксипиридины являются слабыми основаниями и слабыми кислотами. В наибольшей степени кислотные свойства проявляются у -изомера (рКа = 8.7), для него характерны типичные свойства фенолов (нитруется и бромируется легко, реагирует с метаналем, с солями диазония — SE-реакции идут преимущественно в положение 2). Кислотные свойства - и -изомеров выражены значительно слабее (рКа11), для них становятся возможны реакции спиртов, не характерные для фенолов, в частности, замещение гидроксогруппы в 2-гидроксипиридине (или, что то же самое, атома кислорода в пиридоне-2): 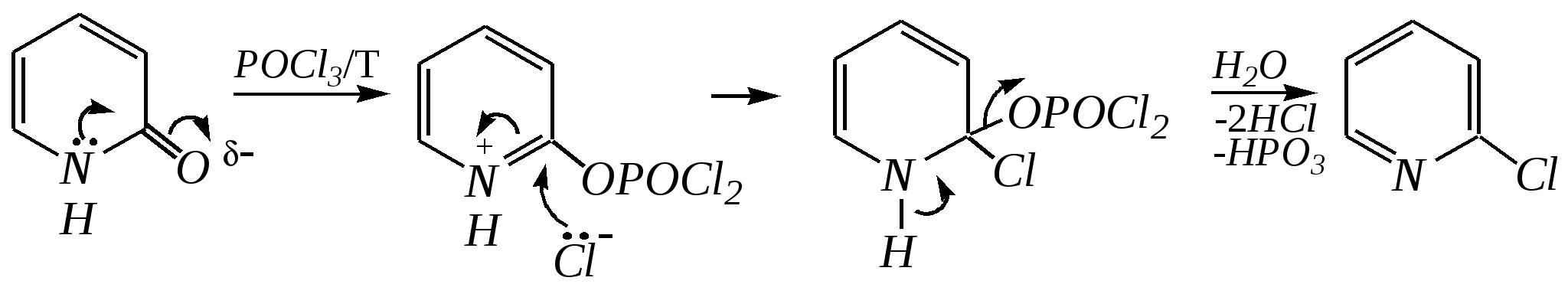 Алкилирование гидроксипиридинов может протекать по атому азота (например, CH3I, (CH3)2SO4) или по атому кислорода (например, диазометаном CH2N2). Все изомерные аминопиридины проявляют оснóвные свойства в большей степени, чем незамещённый пиридин, и образуют при протонировании по кольцевому атому азота кристаллические соли. Производные пиридина с аминогруппами в - и -положениях одноосновны, так как положительный заряд делокализуется между двумя атомами азота, что препятствует повторному протонированию. 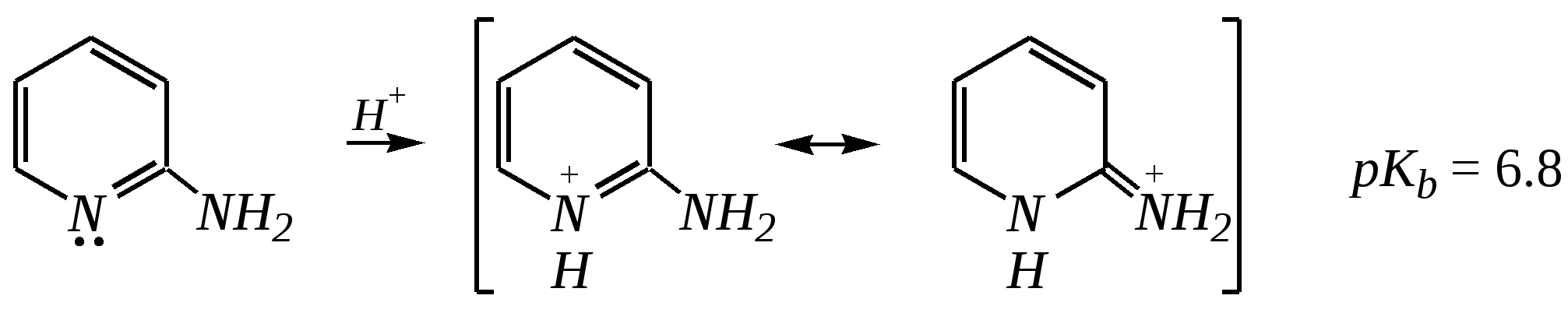 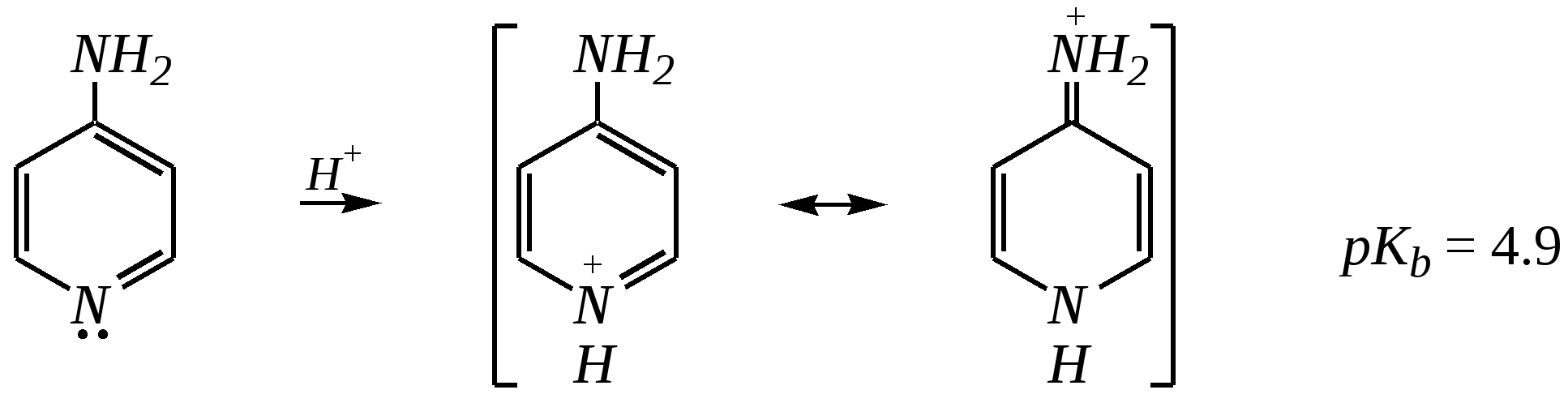 У -изомера основность выражена слабее, что объясняется отсутствием донорного мезомерного влияния аминогруппы в -положении на кольцевой атом азота (рКb = 7.4), но в сильнокислых средах 3-аминопиридин способен дважды протонироваться с образованием дикатиона. 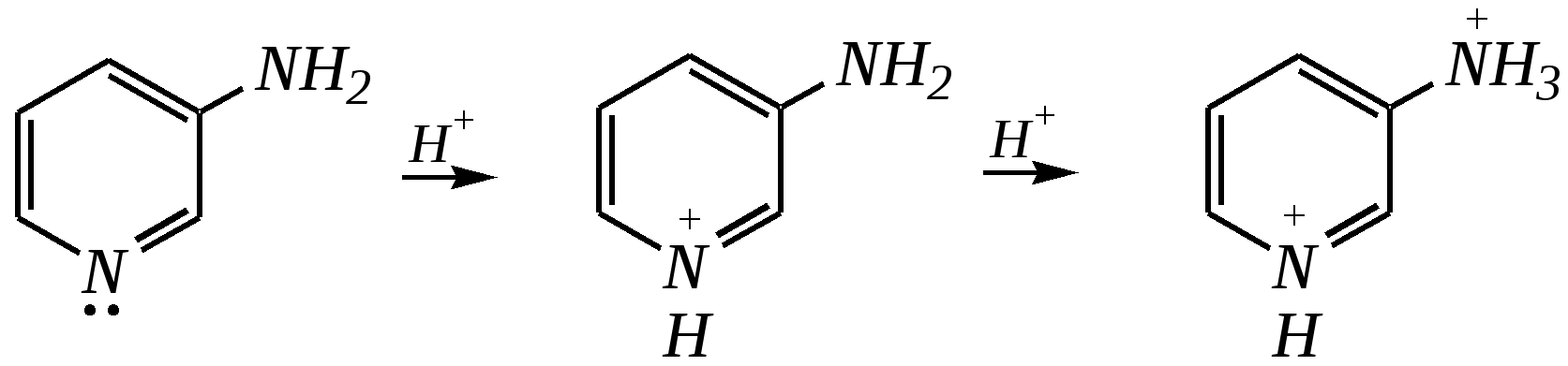 Алкилирование аминопиридинов протекает по кольцевому атому азота, а ацилирование — по азоту аминогруппы. Все аминопиридины легко вступают в SE-реакции по кольцу, причём место вступления электрофила определяется ориентацией аминогруппы. -Аминопиридин при взаимодействии с азотистой кислотой превращается в соответствующую соль диазония. В случае - и -аминопиридинов соли диазония легко гидролизуются в пиридоны. Причиной тому можно считать высокие эффективные положительные заряды на - и -атомах пиридинового кольца, создаваемые акцепторным влиянием азота, что в свою очередь приводит к дестабилизации катиона диазония. Здесь, как и в гидроксильных производных пиридина, -изомер в большей степени проявляет свойства функциональных производных ароматического ряда, чем - и -производные. Свойства галогенопроизводных пиридина также в значительной степени зависят от положения атома галогена в пиридиновом кольце. В - и -положениях нуклеофильное замещение протекает значительно легче (возможна прямая нуклеофильная атака по этим атомам углерода — механизм SN2), а галоген в -положении, как и в неактивированном бензольном кольце, может замещаться только в очень жёстких условиях, по ариновому механизму. Например, для 2,3-дихлорпиридина нагревание с метиламином даёт исключительно продукт замещения по -атому: 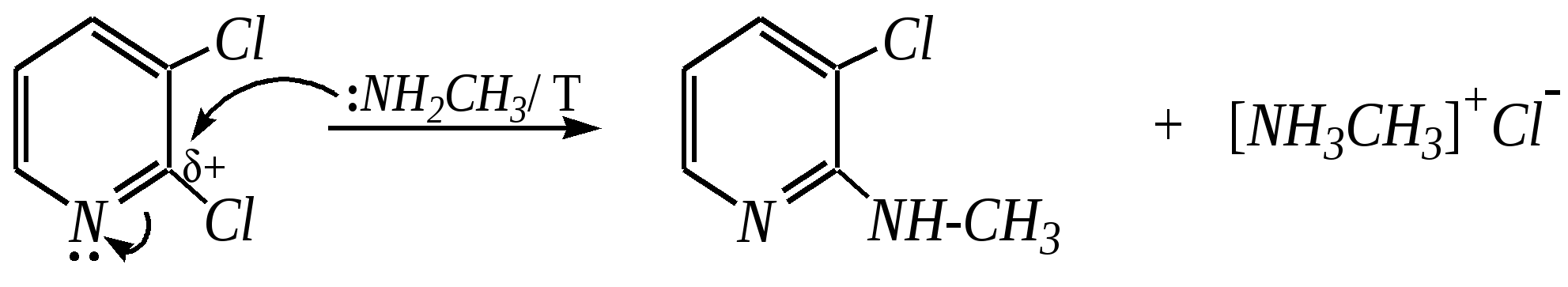 Пиридинкарбоновые кислоты (пиколиновая, никотиновая и изоникотиновая) во многом представляют собой типичные ароматические карбоновые кислоты. Однако из-за наличия в их молекулах атома азота в качестве основного центра они могут существовать и в виде внутренней соли (как типичные аминокислоты). Различия в свойствах карбоксильных групп, находящихся в различных положениях пиридинового цикла, проявляются по отношению к нагреванию, и это можно проиллюстрировать следующим примером: 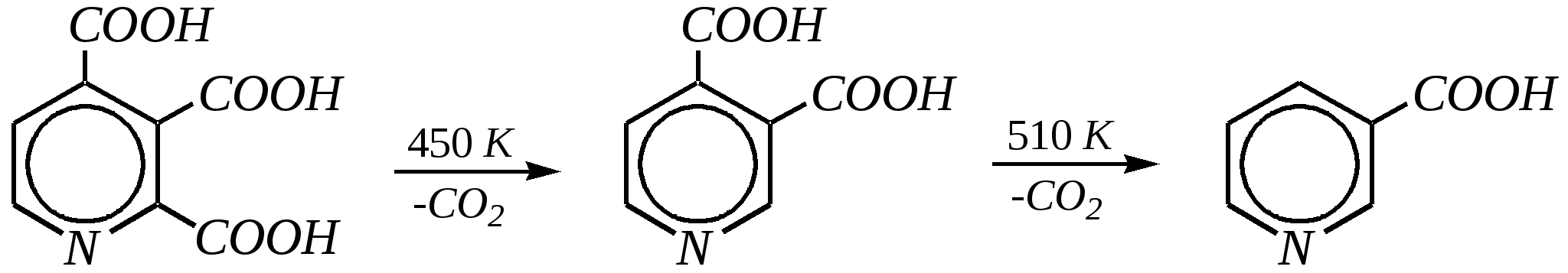 2,3,4-пиридинтрикарбоновая 3,4-пиридиндикарбоновая никотиновая кислота (цинхомеровая) кислота кислота 12.4.5. хинолин и изохинолин Хинолин и изохинолин — это конденсированные системы, состоящие из пиридинового цикла и бензольного кольца. Поэтому их названия как конденсированных систем: 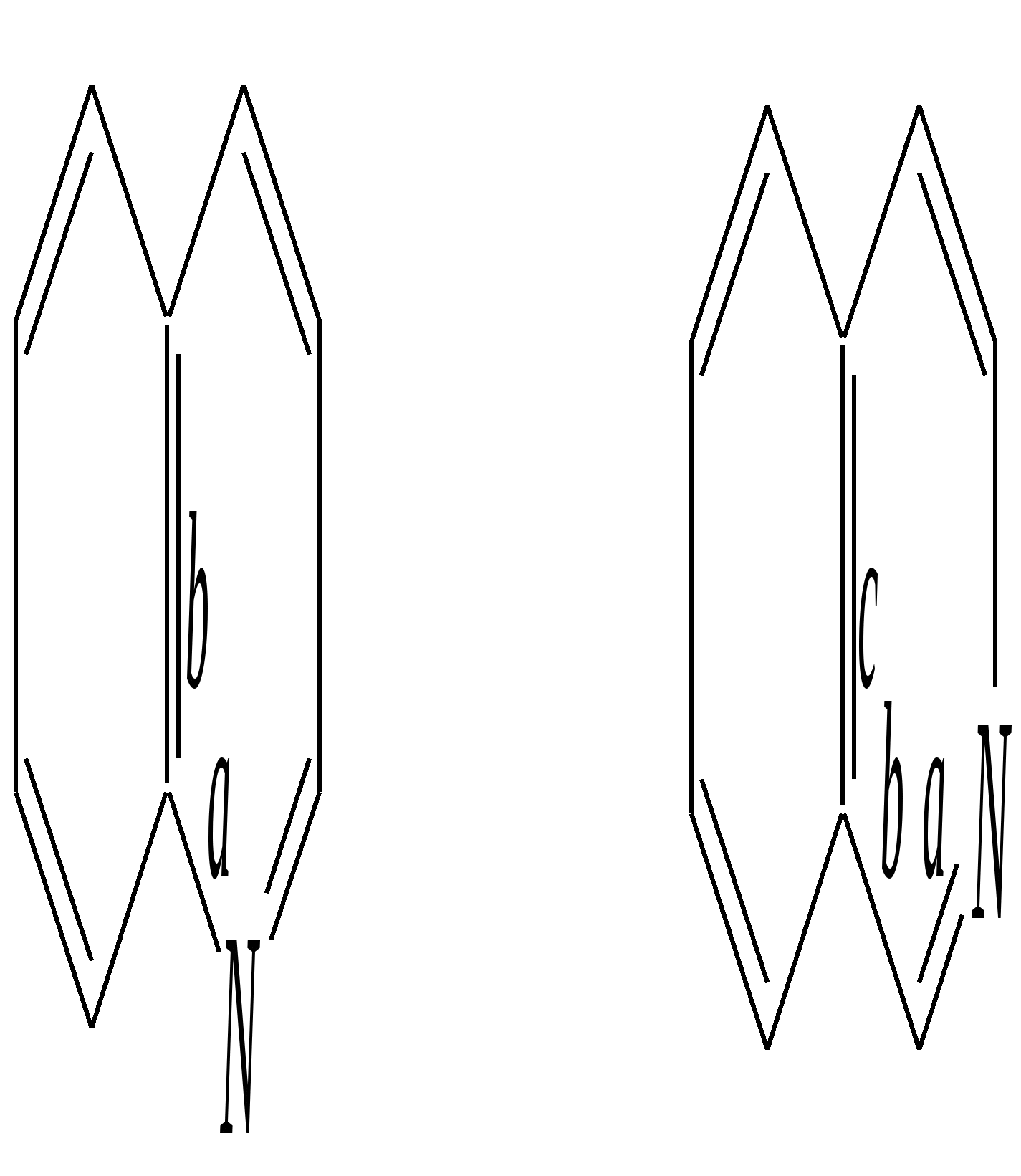 хинолин изохинолин (бензо[b]азин) (бензо[c]азин) Хинолин и изохинолин являются азотоаналогами нафталина, и нумерация атомов в их молекулах проводится так же, как и в молекуле нафталина: в хинолине, начиная с гетероатома, а в изохинолине атом азота имеет номер 2. 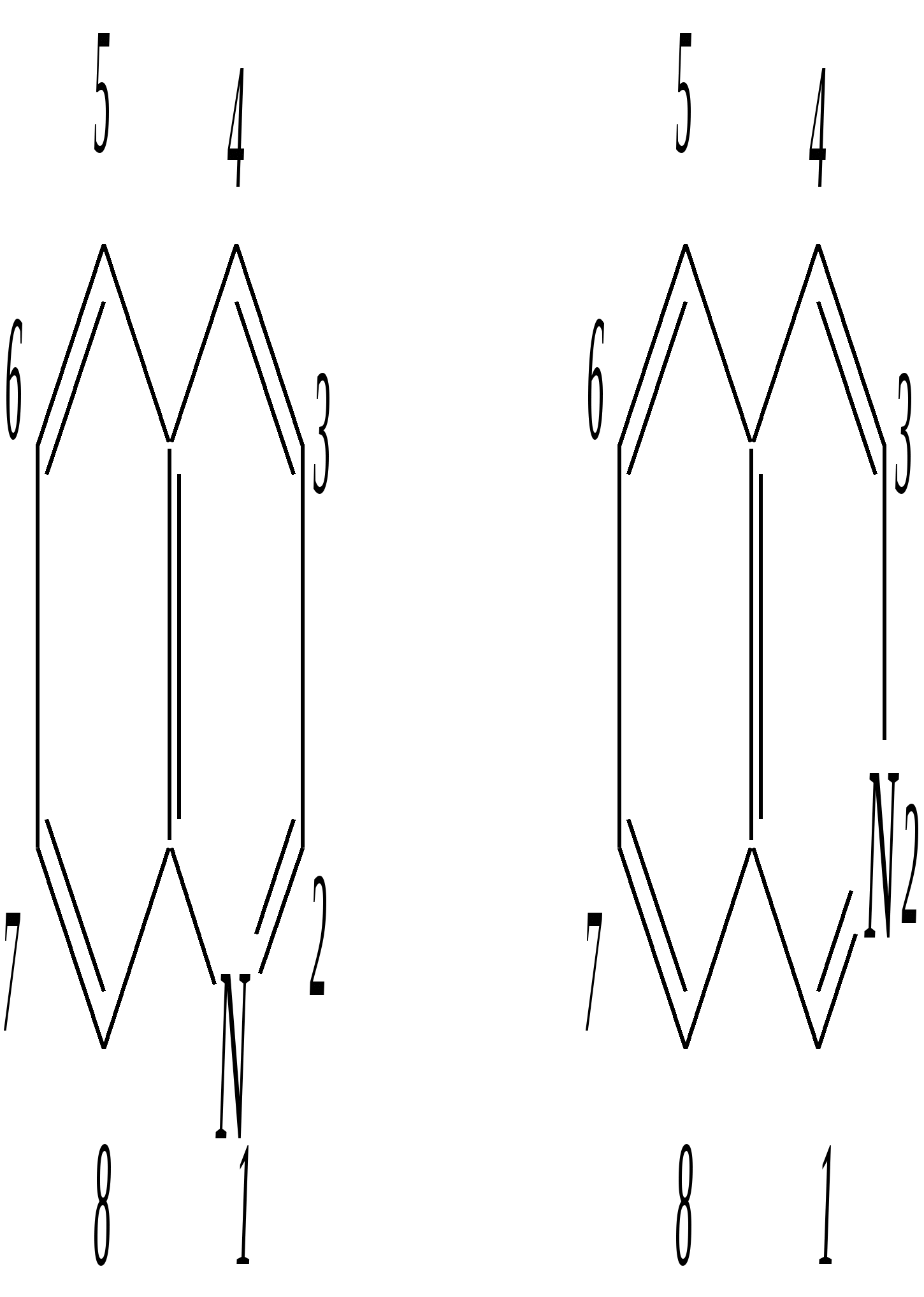 Хинолин, изохинолин и их производные — это бесцветные жидкости и низкоплавкие вещества, малорастворимые в воде и имеющие своеобразный запах. 12.4.5.1. Строение Хинолин и изохинолин, так же, как и их углеродный аналог нафталин, представляют бициклические сопряжённые системы из 10 -электронов. Присутствие атома азота значительно изменяет распределение электронной плотности. Электроноакцепторное влияние атома азота главным образом распространяется на цикл пиридина. Поэтому электронная плотность на бензольном кольце понижена в незначительной степени, а наибольший положительный заряд возникает в положении 2 молекулы хинолина и в положении 1 изохинолина:  12.4.5.2. Химические свойства Как и пиридин, хинолин и изохинолин являются типичными основаниями с константами основности, близкими к таковым для пиридина. Образование солей протекает аналогично пиридину. Например, для хинолина: 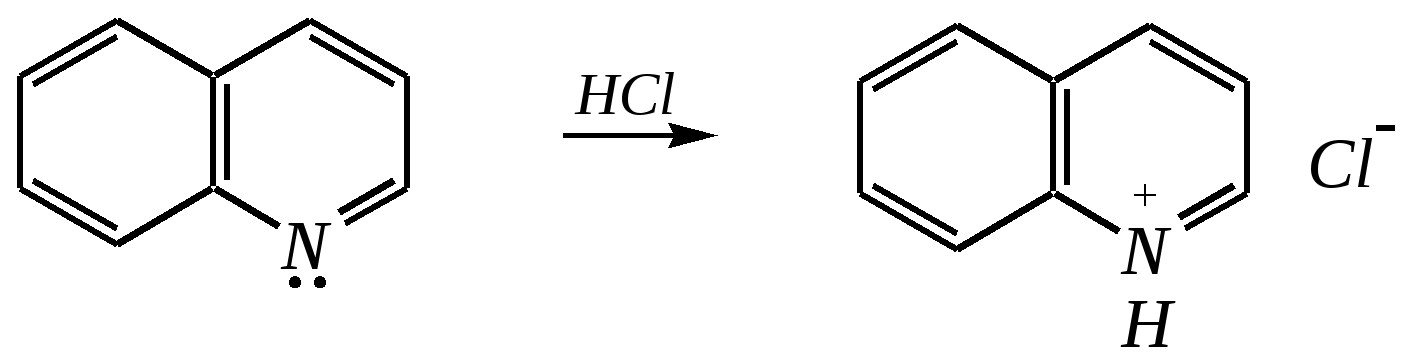 хлорид хинолиния Реакции алкилирования и окисления по атому азота протекают в тех же условиях и при участии тех же реагентов, что и для пиридина. Например, для хинолина:
Однако хинолин и изохинолин могут окисляться под действием сильных окислителей (KMnO4, HNO3) с разрушением одного цикла, обычно бензольного. Но окисление изохинолина щелочным раствором перманганата калия приводит к смеси двух кислот. 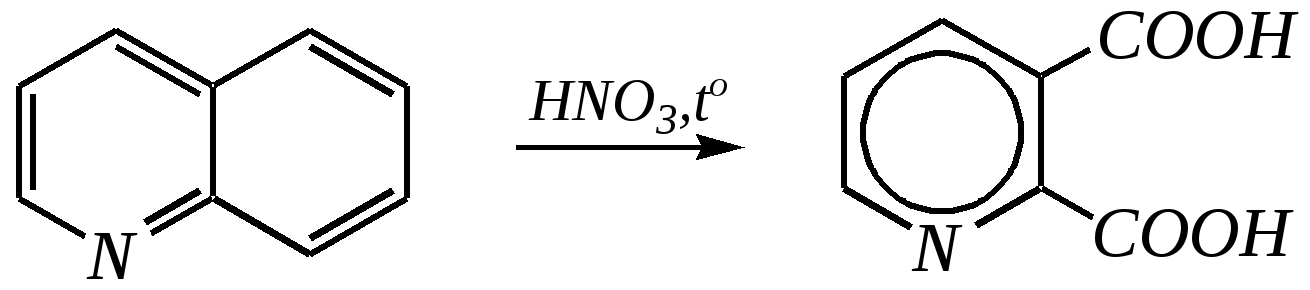 хинолиновая кислота 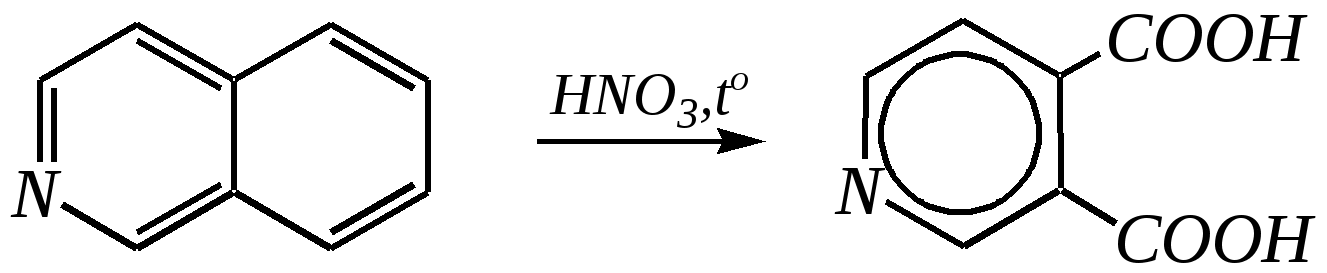 цинхомеровая кислота 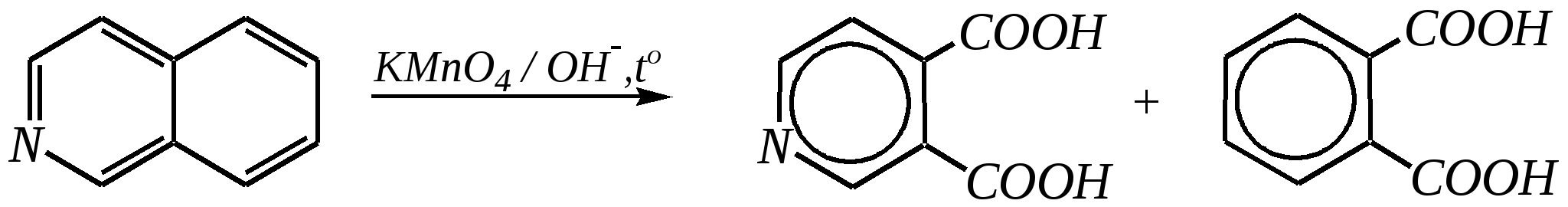 Реакции электрофильного замещения для обоих соединений протекают по бензольному кольцу, обычно по атомам С5 и С8. Но если при нитровании хинолина образуется примерно эквимолярная смесь 5- и 8-нитрохинолинов, то нитрование изохинолина даёт преимущественно 5-нитропроизводное: 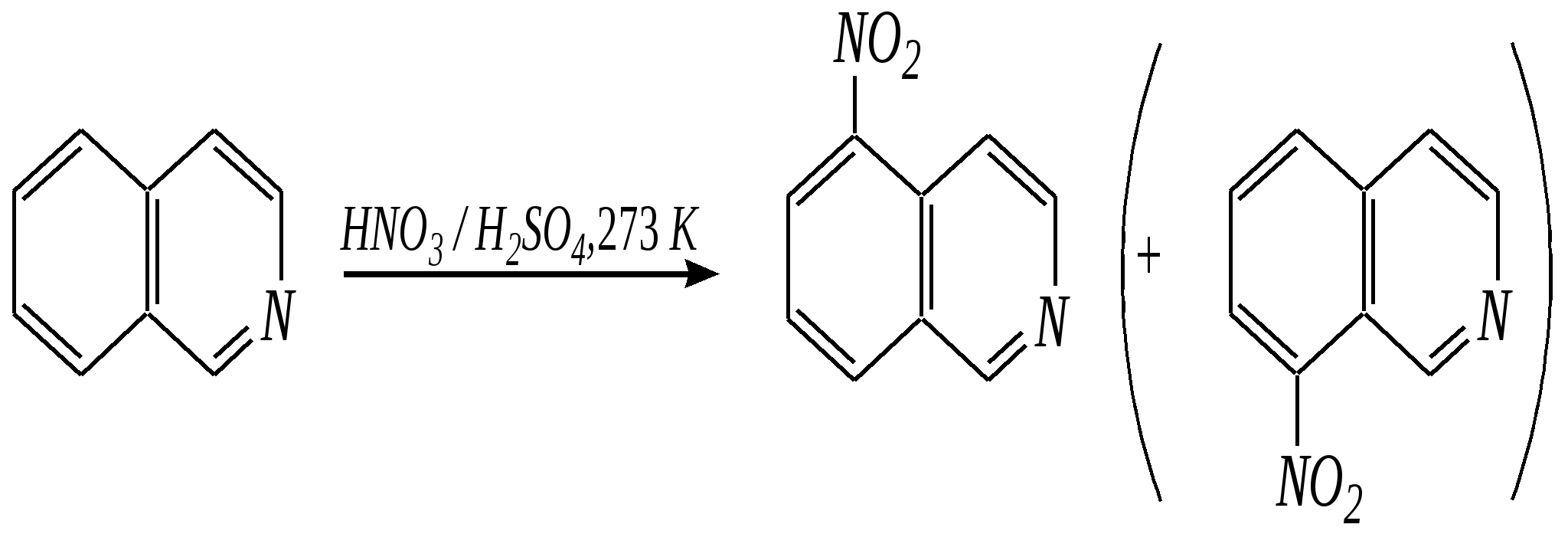 5-нитроизохинолин 8-нитроизохинолин 5-нитроизохинолин 8-нитроизохинолин90% 10% Сульфирование при обычных температурах (360—500 К) также приводит к образованию 5- и 8-хинолинсульфокислот (главным образом, 8-производного), но эти изомеры при нагревании выше 530 К переходят в более термодинамически стабильную 6-сульфоновую кислоту. Галогенирование хинолина и изохинолина в условиях реакции электрофильного замещения (в присутствии кислотных катализаторов) также приводит к 5- и 8-производным. Введение атома галогена в пиридиновое кольцо происходит в значительно более мягких условиях. Так, бромирование хинолина и изохинолина в присутствии незначительных количеств HClдаёт 3-бромхинолин и 4-бромизохинолин соответственно. Механизм процесса на примере изохинолина можно представить в следующем виде: 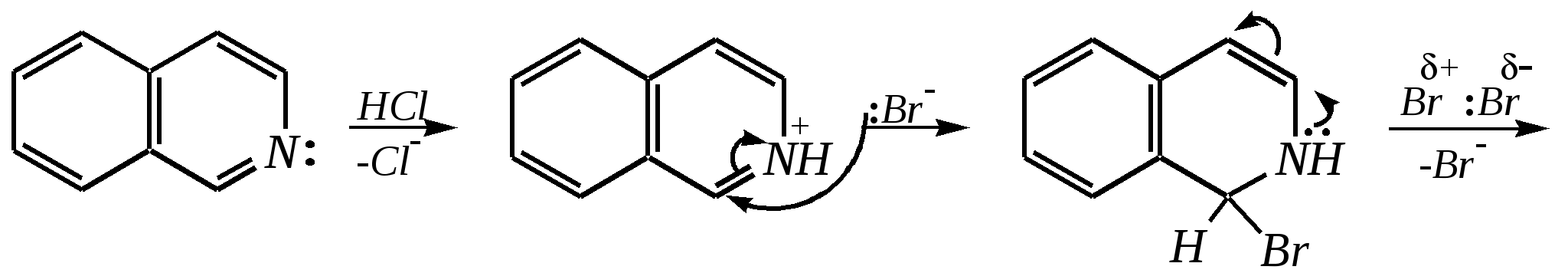 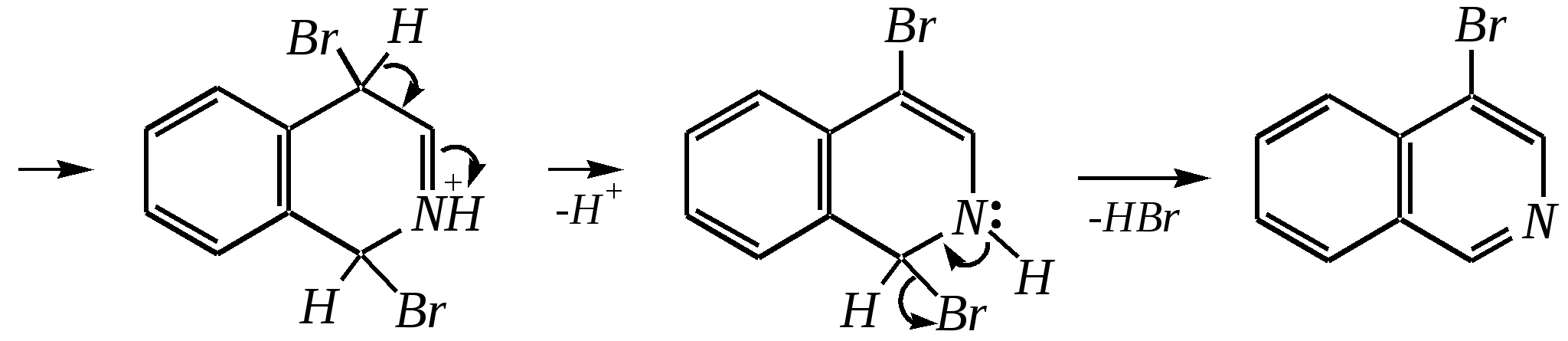 4-бромизохинолин Нуклеофильное замещение атома водорода идёт наиболее легко в положение С2 хинолина и С1 изохинолина. Так, например, протекают реакция А.Е. Чичибабина и взаимодействие со щёлочью для хинолина: 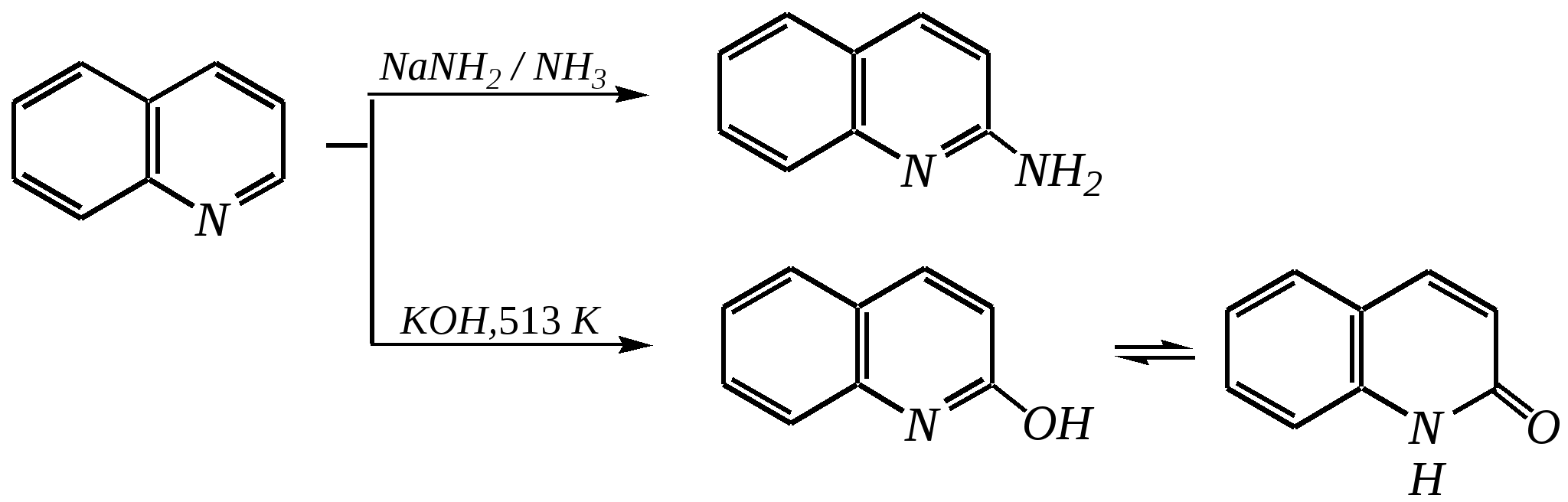 хинолон-2 Для хинолина и изохинолина возможно гидрирование как пиридинового цикла, так и бензольного кольца. Восстановить пиридиновый цикл до тетрагидропиридинового можно боргидридами металлов или каталитически водородом в метаноле. Однако каталитическое гидрирование в растворе сильных кислот приводит к первоначальному селективному восстановлению бензольного кольца, а затем — к продукту исчерпывающего гидрирования — декагидропроизводному. Например, для хинолина: 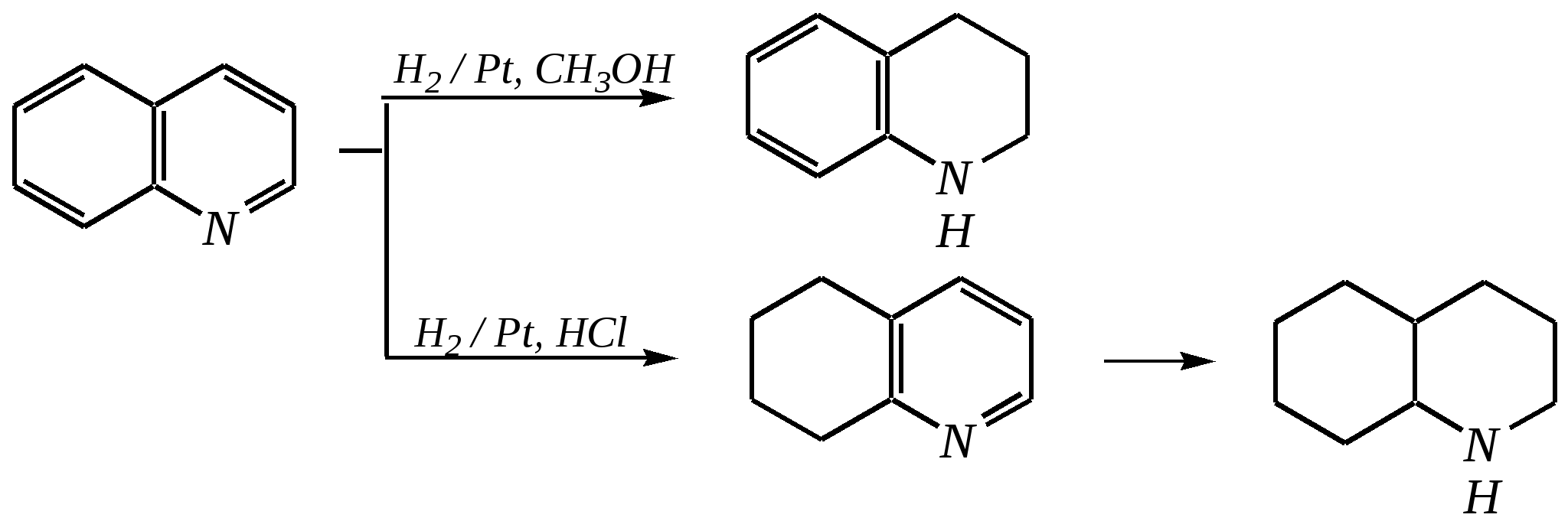 12.4.6. -Пиран и -пиран и их производные Пираны — это ненасыщенные гетероциклические кислородосодержащие соединения. Возможно существование двух таких изомеров — -пирана и -пирана:  -пиран -пиран Циклы пиранов содержат один насыщенный атом углерода (-атом в -пиране и, соответственно, -атом в -пиране), поэтому в их молекулах отсутствует полное циклическое сопряжение и эти соединения не могут относиться к ароматическим. Пираны широкого распространения и практического использования не имеют. Однако более распространены соли катиона пирилия и оксопроизводные пиранов — пироны: 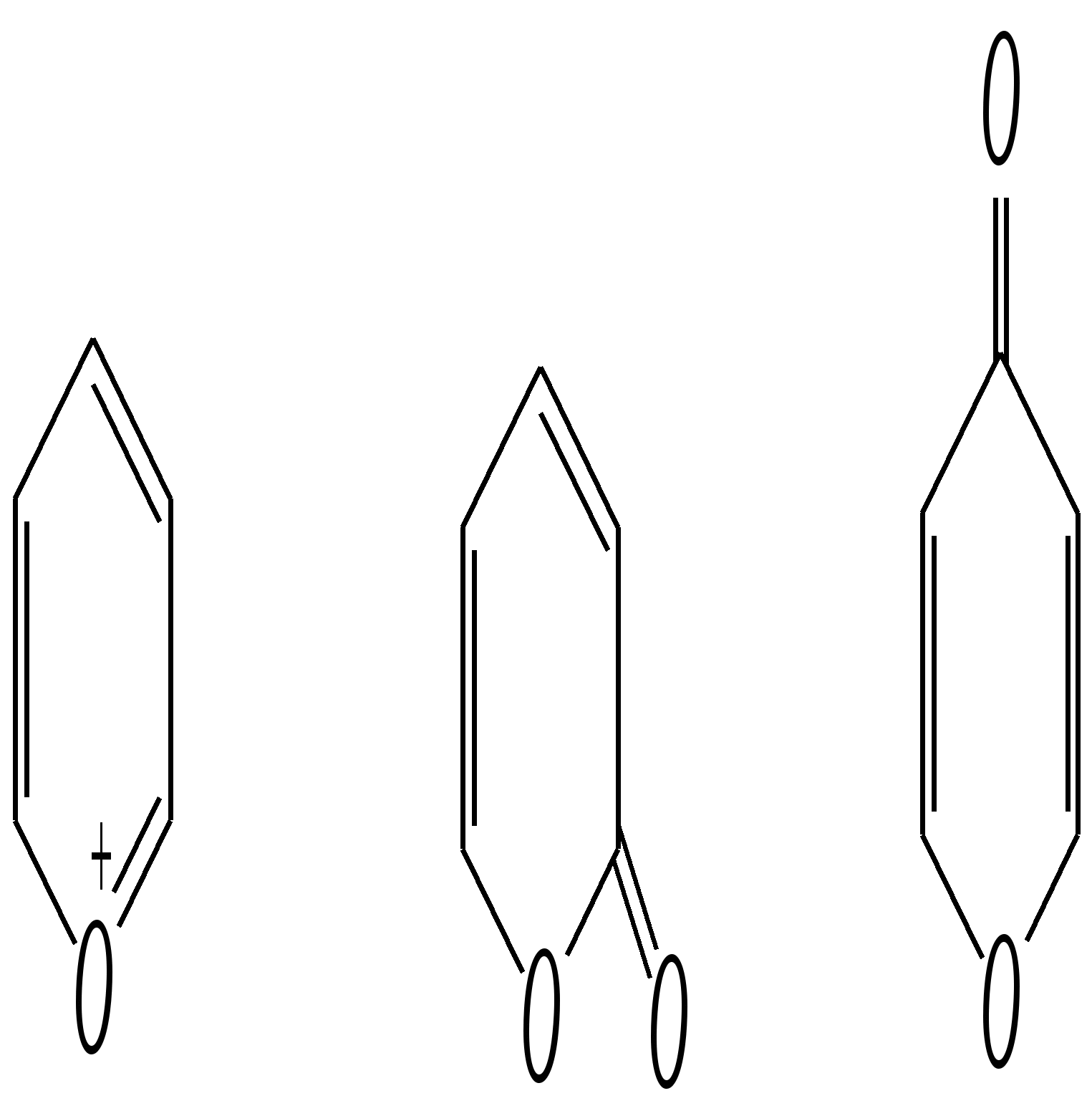 пирилий-катион -пирон -пирон Строение катиона пирилия подобно строению катиона пиридиния (и молекулы пиридина). Здесь имеет место циклическая сопряжённая 6--электронная система. Отличие от молекулы пиридина — это присутствие в катионе пирилия сильно электроотрицательного атома кислорода в оксониевой форме. Это вызывает сильнейшую поляризацию связей и высокую реакционную способность по отношению к нуклеофилам. Реакции электрофильного замещения для них неизвестны. Обычно местом нуклеофильной атаки в катионе пирилия является атом С2, но возможны реакции и по атому С4. Присоединение нуклеофила в положение 2 влечёт за собой, как правило, раскрытие цикла, но возможно последующее его замыкание с образованием другой циклической системы: 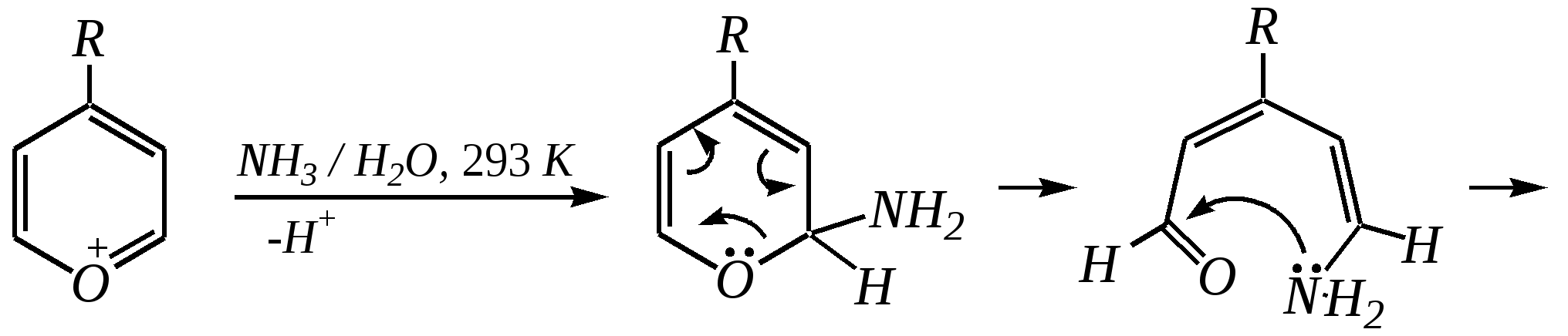 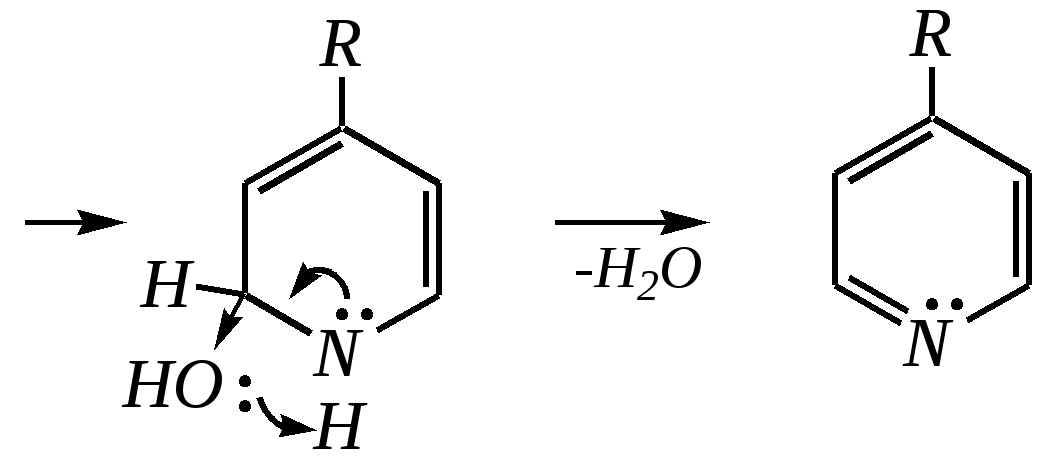 -Пироны являются одновременно -лактонами и сопряжёнными диенами. Поэтому они проявляют свойства сложных эфиров и вступают, например, в реакцию диенового синтеза как сопряжённые диены. -Пироны способны расщепляться под действием щёлочи, аммиака, аминов. Местом нуклеофильной атаки является положение 2. Механизм процесса аналогичен приведённому выше взаимодействию катиона пирилия с аммиаком. 12.4.7. способы получения Пиридин, хинолин, изохинолин и их метильные производные содержатся в каменноугольной смоле, откуда их выделяют при промышленном получении. Пиридиновое кольцо входит в структуру многих природных соединений — витаминов, алкалоидов, нуклеиновых кислот, и поэтому некоторые производные пиридина могут быть получены путём превращений исходных природных соединений. Для синтетического получения пиридина, хинолина, изохинолина, их производных, а также кислородосодержащих гетероциклических соединений используют исходные вещества, содержащие структурные фрагменты необходимого гетероцикла. Приведём некоторые примеры таких синтезов.
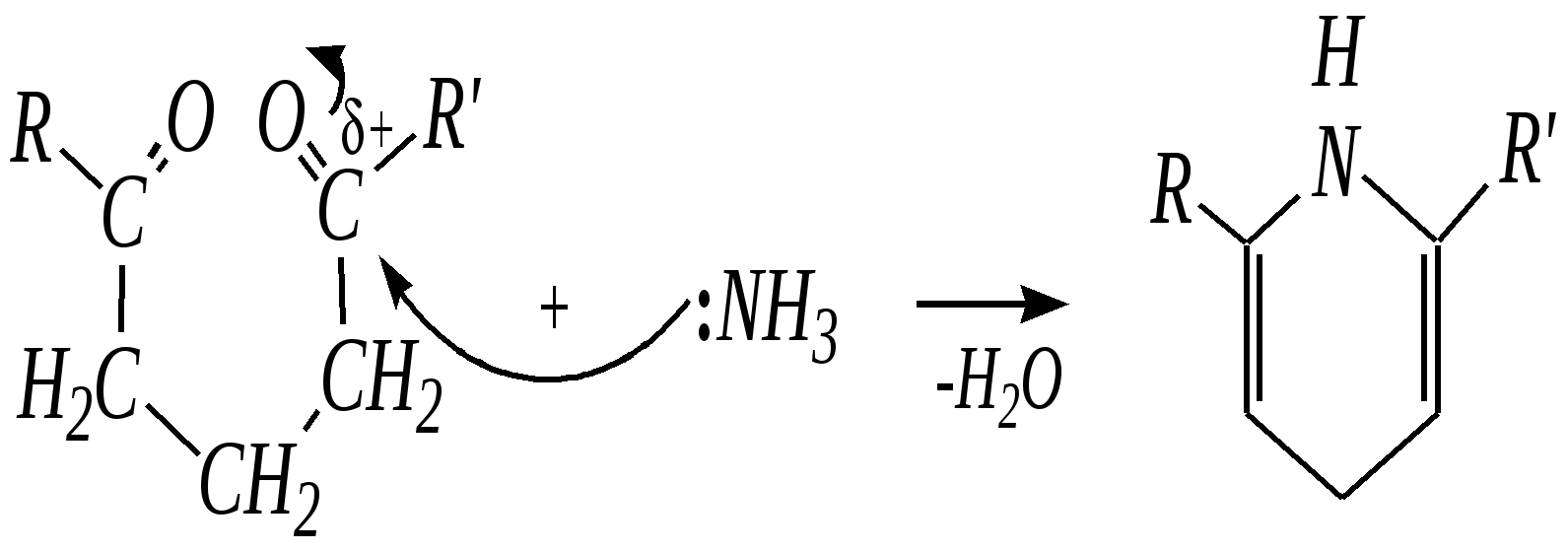 Реакция начинается как нуклеофильное присоединение аммиака к молекуле дикарбонильного соединения, образованием иминосоединения и затем внутримолекулярное нуклеофильное присоединение с атакой иминогруппы по карбонильной группе.
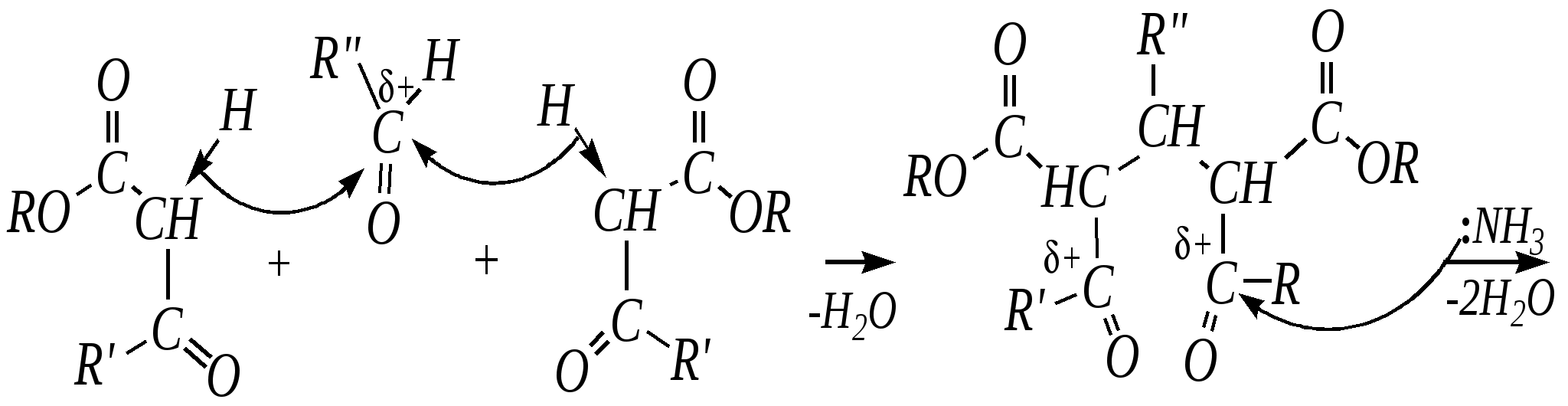 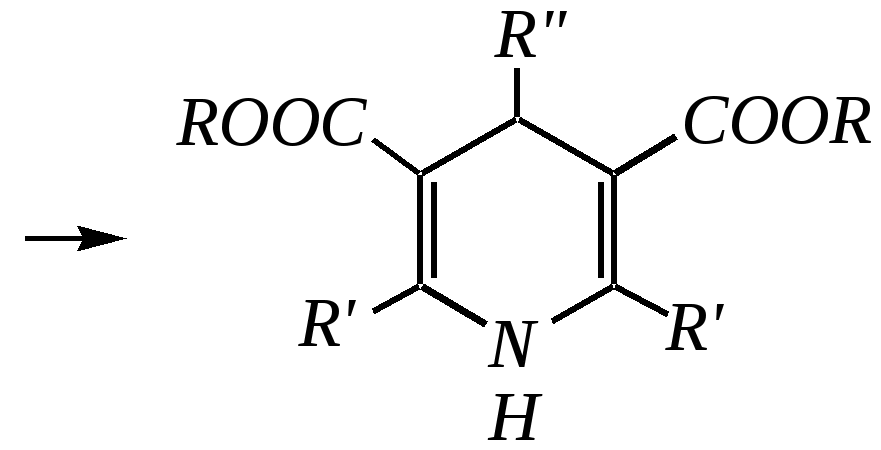 Образовавшийся по данной схеме цикл дигидропиридина может быть далее дегидрирован до пиридинового цикла. Вместо эфира -кетокислот здесь могут быть использованы другие -дикарбонильные соединения (малоновый эфир, ацетилацетон) и эфиры циануксусной кислоты.
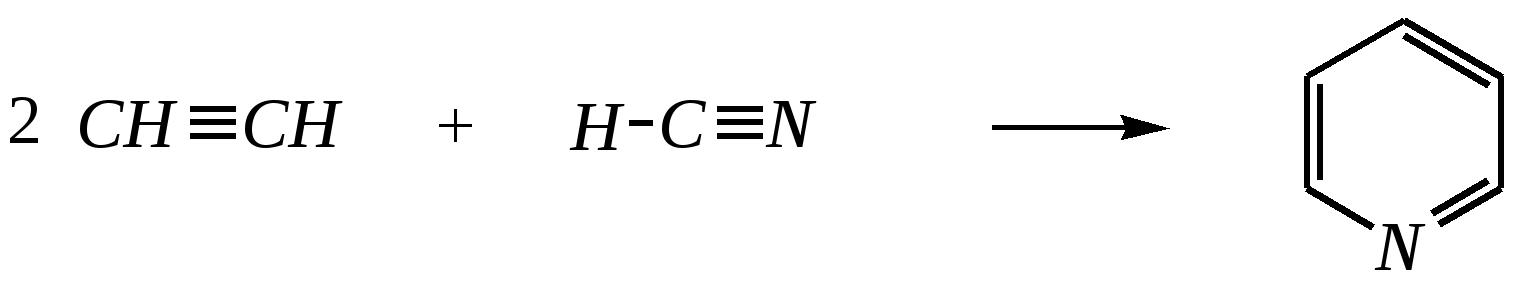 |