Методические указания к организации самостоятельной работы студентов по теме: "Гидролиз солей". Методические указания к организации самостоятельной работы студе. Конспект по теме Гидролиз солей
 Скачать 126.5 Kb. Скачать 126.5 Kb.
|
|
Методические указания к организации самостоятельной работы студентов по теме: «Гидролиз солей» Опорный конспект по теме: «Гидролиз солей»
Растворение многих солей в воде сопровождается образованием растворов с нейтральной реакцией среды (рН = 7). Однако в процессе растворения ряда солей их водные растворы обнаруживают кислую или щелочную реакцию. Кроме того, при хранении разбавленных водных растворов солей часто наблюдается появление тонкодисперсного осадка. Иногда же контакт соли с водой ведет к ее полному разрушению (прочерк в таблице растворимости). Основная реакция получения солей – это реакция нейтрализации между кислотой и основанием: m Katn+(OH)n + n HmAnm- → KatmAnn + m n H2O Связывание гидроксильных ионов с протоном с образованием малодиссоциированного соединения – воды необратимо смещает равновесие реакции вправо (реакция идет «до конца»). Логично предположить, что растворение кристаллов соли в воде представляет собой процесс, противоположный реакции нейтрализации, в ходе которого происходит химическое взаимодействие ионов соли с молекулами воды, ведущее к образованию малодиссоциированных, труднорастворимых или летучих соединений. Молекулы воды при этом выполняют две функции: среды, в которой протекает реакция, и реагента. Соль разрушается при активном участии молекул воды, поэтому такой процесс был назван гидролизом соли. Рассмотрим реакцию нейтрализации с точки зрения активности взаимодействующих кислот и оснований.
Cлучай 1. Сильное основание + сильная кислота. Отсутствие гидролиза. Растворение соли сопровождается диссоциацией на ионы. Химического взаимодействия между ионами соли и молекулами воды не происходит, так как протолиз сильных кислот и оснований необратим: KI = K+ + I- - диссоциация соли; КОН → K+ + OH- протолиз основания; HI + H2O → H3O+ + I- протолиз кислоты. Случай 2. Слабое основание + сильная кислота. Гидролиз по катиону. Соли однозарядных катиона и аниона: NH4Cl → NH4+ + Cl- диссоциация соли; NH4+ + 2HOH ↔ NH3∙Н2О + H3O+ - КК, pH < 7 , протолиз катиона. K.1 |______↑ O.2 O.1 ↑______|K.2 В системе сопряженных кислот и оснований образуется слабое основание – гидроксид аммония, которое легко разлагается с выделением газообразного аммиака: NH3∙Н2О = NH4OH → NH3 ↑ + H2O CuCl2 → Cu2+ + 2Cl- Cu2+ + HOH ↔ CuOH+ +H+ - среда кислая, образуется малодиссоциированный гидроксокатион. Слабыми кислотами являются катионы переходных металлов. В водном растворе они гидратированы с образованием аквакомплексов. Одна из молекул воды гидратной оболочки отдает протон свободной молекуле воды - растворителя, выполняя функцию кислоты: Fe(NO3)3 = Fe3+ + 3NO3 - - диссоциация соли; Fe3+ + H2O = Fe3+ ∙H2O – гидратация катиона; Fe3+ ∙H2O + H2O ↔ [FeOH]2+ + H3O+ - КК, pH < 7, протолиз катиона. K.1|______↑ O.2 O.1↑_________|K.2 Гидроксоанионы двухзарядных катионов металлов, как правило, образуют труднорастворимые соли с различными анионами, что способствует смещению равновесия реакции гидролиза вправо. (Появление осадка при хранении разбавленных растворов!!!) Случай 3. Сильное основание + слабая кислота кислота. Гидролиз по аниону. Соли однозарядных катиона и аниона: СН3СООК → СН3СОО- + К+ - диссоциация соли; СН3СОО- + НОН ↔ СН3СООН + ОН- , КО, рН > 7. Протолиз аниона. О.1↑_________|K.2 K.1 |_______↑O.2 В системе сопряженных пар кислот и оснований образуется слабая малодиссоциированная уксусная кислота. Соли многоосновных кислот подвергаются гидролизу ступечато. При этом, как правило, преобладает первая ступень: Na2CO3 → 2Na+ + CO32- - диссоциация соли; CO32- + HOH ↔ HCO3- + OH- - , КО, рН > 7. Протолиз аниона. O.1↑_____| K.2 K.1|_____↑O.2 Таким образом, анионы многих солей являются слабыми основаниями, так как сопряжены со слабыми кислотами. КО легко находится из соотношения: KW = KK × KO, где KK - константа диссоциации кислоты, справочная величина для температуры 25оС. Случай 4. Слабая кислота + слабое основание. Идут оба процесса одновременно: гидролиз по катиону и гидролиз по аниону. а) Реакция растворов солей однокислотных оснований и одноосновных кислот определяется соотношением констант диссоциации продуктов гидролиза: CH3COONH4 + HOH ↔ CH3COOH + NH4OH K(основания) = [NH4+][ OH-] /[ NH4OH] = 1,8 10-5, K(кислоты) = [СН3СОО-] [ Н+] / [ СН3СООН] = 1,8 10-5. Так как константы диссоциации кислоты и основания совпали, среда оказалась нейтральной. NH4CN + HOH ↔ NH4OH + HCN К(кислоты) = [ Н+][СN]/[ HCN] = 7,9 10-10. Константа кислоты оказалась на несколько порядков меньше, то есть кислота намного слабее основании. Реакция среды раствора такой соли будет щелочной. б) Если в результате гидролиза соли слабого основания и слабой кислоты образуются газообразные или труднорастворимые вещества, равновесие гидролиза практически полностью смещается в сторону продуктов реакции и делает его необратимым. В таблице растворимости в клеточке, соответствующей такой соли, как правило, ставится прочерк. Такую соль нельзя получить «мокрым путем», то есть взаимодействием соответствующих кислоты и основания в водном растворе. Al2S3 + 6HOH = 2 Al(OH)3↓ + 3H2S ↑. !!! Внимание При осуществлении реакций ионного обмена между растворами двух солей необходимо учитывать возможность последующего гидролиза вновь образуемой соли, если эта соль содержит анион слабой кислоты и катион слабого основания. При этом стоит запомнить такое эмпирическое правило: двухзарядные катионы склонны к образованию гидроксоанионов, а для трехзарядных характерен необратимый гидролиз: 2CuSO4 +2Na2CO3 + HOH → (CuOH)2CO3 ↓ + CO2↑ + Na2SO4 2FeCl3 + 3Na2CO3 + 3HOH → 2Fe(OH)3↓+ 6NaCl + 3CO2↑.
Любой равновесный процесс можно оценить величиной константы равновесия. Однако процесс гидролиза можно описать с помощью трех констант: константы воды, константы гидролиза и константы диссоциации слабой кислоты или основания. Константа гидролиза – величина, не зависящая от концентрации раствора соли. Ее выражение легко получить, применив закон действующих масс к обратимому процессу гидролиза соли. Под степенью гидролиза понимают отношение числа гидролизованных молекул к общему числу молекул в исходном растворе. Эта величина определяется температурой раствора, концентрацией соли, константами диссоциации соответствующих данной соли кислот или оснований. Константа и степень гидролиза (h) связаны между собой соотношением, подобным закону разведения Оствальда: Кг= сh2/1-h . При значениях h << 1 выражение упрощается: Кг = сh2. Рассмотрим возможные варианты гидролиза. Гидролиз по аниону Гидролиз аниона: А- + Н2О ↔ НА + ОН-, ↑__Н+__ǀ Диссоциация слабой кислоты: НА + Н2О ↔ А- + Н3О+ Взаимосвязь между константами вода, кислоты и гидролиза: 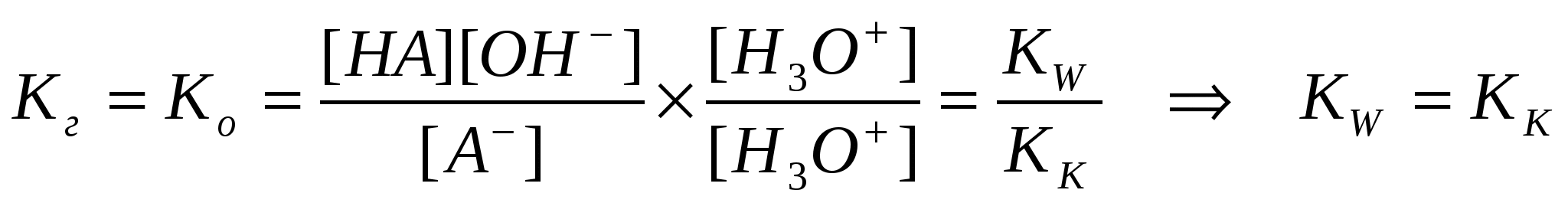 Полученное соотношение характеризует кислотно - основную пару в реакции протолиза. Пример 1. Рассчитайте константы гидролиза нитрита, бензоата и цианида натрия. Константы диссоциации азотистой, бензойной и циановодородной кислот найдите в табл.2 Приложения. Решение:
Гидролиз аниона: NO2- + H2O ↔ HNO2 + OH-, KГ = Ko = Kw/K(HNO2) = 10×10-15/4×10-4 = 2,5 × 10-11
Гидролиз аниона: C6H5COO- + H2O ↔ C6H5COOH +OH-, KГ = Ko = Kw/K(C6H5COOH ) = 10×10-15/6×10-5 = 1,63 × 10-10
Гидролиз аниона: CN- + H2O ↔ HCN + OH- KГ = Ko = Kw/K(HCN) = 10×10-15/5×10-10 = 2,0 × 10-5 Вывод №1 : Чем слабее кислота, тем глубже протекает гидролиз по аниону! Гидролиз солей двухосновных кислот Пример 2. Оцените глубину гидролиза водного раствора сульфида натрия, если известны константы диссоциации сероводородной кислоты по первой и второй ступеням: К1 = 6×10-8, К2 = 1×10-14 Решение: Диссоциация соли: Na2S → 2 Na+ + S2- Гидролиз по аниону 1 ступень: S2- + H2O ↔ HS- + OH- KГ1 = KO1 = Kw/KK2= 10-1/1×10-14 = 1 Гидролиз по аниону 2-я ступень: HS- + H2O ↔ H2S + OH- KГ2 = 10×10-15/6×10-8 = 1,6 × 10-7 KГ2 ˃˃ KГ2 Вывод №2: Для водных растворов солей двухосновных кислот преобладает гидролиз по первой ступени! Гидролиз по катиону Гидролиз гидратированного катиона: М+∙Н2О + Н2О ↔ МОН + Н3О+ КГ = КК = Kw/Kо ǀ__Н+__↑ Связь между константой гидролиза, концентрацией соли (сs ) и рН водного раствора гидролизующихся солей Условимся, что диссоциация соли протекает на 100%. В таком случае легко рассчитать концентрацию аниона или катиона подвергающегося далее гидролизу в водной среде: [A-] = [M+] = cs Гидролиз по аниону Гидролиз аниона: А- + Н2О ↔ НА + ОН-, КГ = КО = Kw/Kк ↑__Н+__ǀ 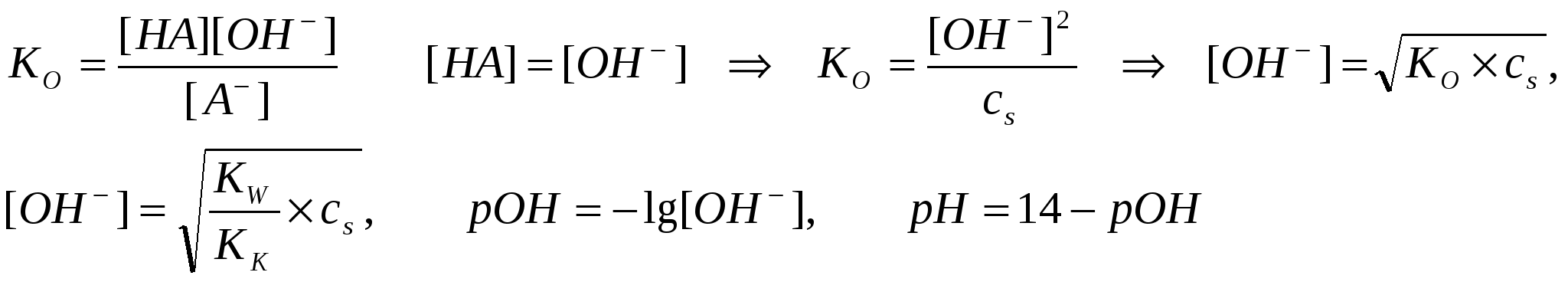 Вывод окончательной формулы: 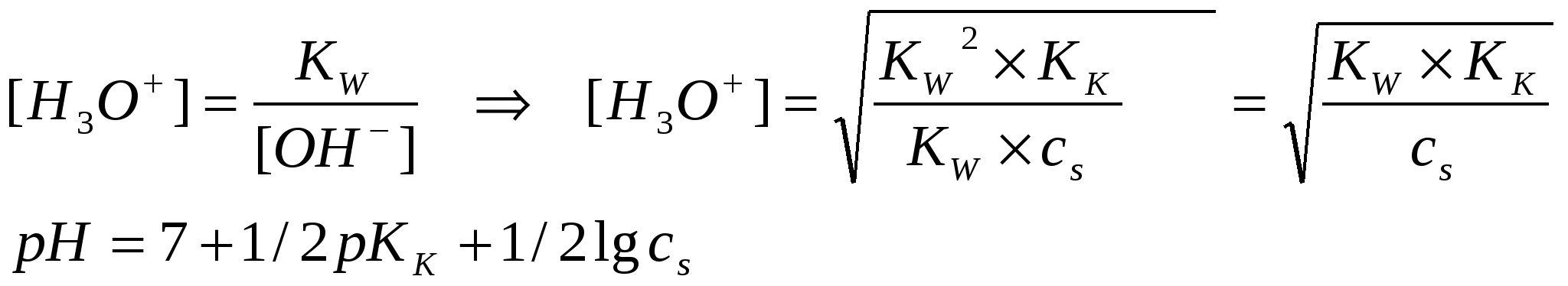 Пример 3: Чему равно значение рН 0,002 М раствора Ba(CN)2? Известно, что KK = 4,93 10-10 Решение: Ba(CN)2 = Ba2+ + 2CN- , 0,002 моль ---0,004 моль CN- + H2O ↔ HCN + OH-, KO, pH > 7, [OH-] = [HCN] KO = [HCN][OH-]/[CN-] = [OH-]2/[CN-], КO = KW/КК [OH-] = √ KO[CN-] = pH = 14 – pOH , pOH = -lg [OH-] , pH = 14 - 3,54 = 10,46 Гидролиз по катиону Гидролиз гидратированного катиона: М+∙Н2О + Н2О ↔ МОН + Н3О+ КГ = КК = Kw/Kо ǀ__Н+__↑ Так как [H3O+] = [M∙OH], a [A-] = cs → K =[H3O+]2/cs [H3O+] = 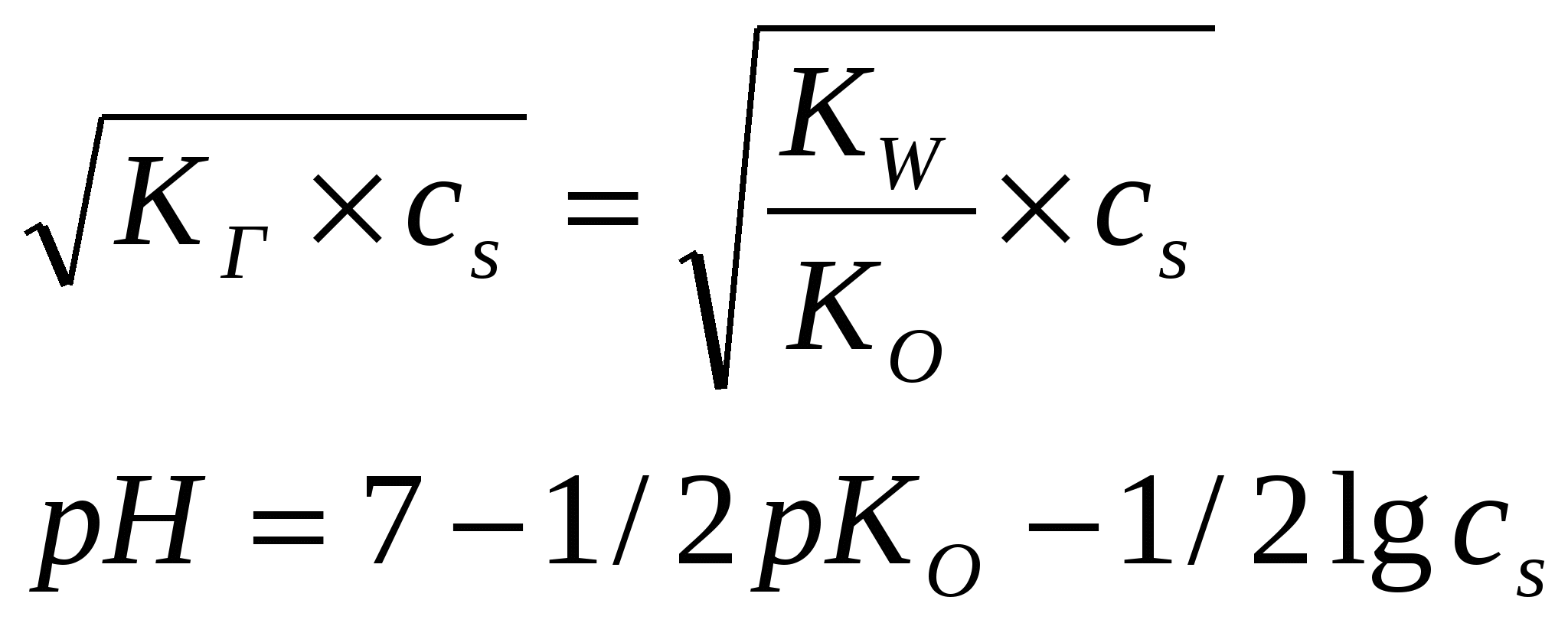 Одновременный гидролиз по катиону и аниону Суммирование первых двух случаев приводит к уравнению вида: рН = 7 + ½ рКК - ½ рКО Вывод №3: рН среды водного раствора соли слабого основания и слабой кислоты зависит от соотношения констант диссоциации соответствующих кислоты и основания. Пример 4. Какова среда водного раствора децимолярного раствора цианида аммония? Решение: Сравним значения констант диссоциации гидроксида аммония и циановодородной кислоты: К(HCN) = 6,9 ×10-10 , K(NH4OH) = 1,8×10-5? Так как КО ˃ КК, то среда раствора будет щелочной.
Вопросы для самостоятельной работы 1. Как вы думаете, насколько удачным является выражение «молекулярное уравнение» для каждой из таких записей: а) NaOH + HCl = NaCl + H2O; б) 2Н2 + О2 = 2H2O; в) 2Mg + O2 = 2MgO; г) AgNO3 + NaCl = AgCl ↓ + NaNO3 ? 2. Насколько точным является выражение «ионно-молекулярное уравнение» для следующих записей: а) Н+ + ОН- = H2O; б) Мg2+ + 2OH- = Mg(OH)2↓ ; в) 2H+ + SiO32- = H2SiO3↓; г) 3Сa2+ + 2PO43- = Ca3(PO4)2 ↓ ? 3. В какую сторону смещено равновесие при гидролизе соли слабого основания и сильной кислоты, соли сильного основания и слабой кислоты? Имеет ли значение концентрация соли? 4. Какие факторы способствуют усилению гидролиза? 5. Какие условия необходимы для приготовления и хранения водных растворов легко гидролизующихся солей? 6. Какие из перечисленных солей подвергаются гидролизу: сульфат алюминия, сульфид калия, нитрат свинца, йодид натрия? Напишите молекулярные и ионные уравнения гидролиза. 7. Можно ли считать, что нейтральная среда раствора свидетельствует об отсутствии гидролиза? 8. Какой реакцией среды должны обладать растворы солей аммония: цианид, ацетат, нитрит, карбонат, ортофосфат? Для ответа используйте справочную таблицу, в которой приведены значения констант диссоциации слабых кислот и оснований. 9. Отличаются ли по кислотности среды (если да, то, как именно) растворы с одинаковой молярной концентрацией солей: гидросульфид натрия, гидрокарбонат натрия, гидросульфат натрия? Обоснуйте ответ. 10. Расположите в порядке усиления гидролиза соли калия: формиат, цианид, нитрит, перхлорат. 11. При действии нашатыря (хлорид аммония) на раствор силиката натрия выделяется газ и образуется осадок. Объясните наблюдаемые явления и составьте уравнение реакции. 12. Почему раствор дигидрофосфата натрия в воде имеет слабокислую, раствор гидрофосфата - слабощелочную, а раствор фосфата сильнощелочную реакцию? Для ответа воспользуйтесь величинами констант диссоциации ортофосфорной кислоты по трем ступеням. Универсальное задание для домашней работы Задана натриевая соль слабой кислоты.* Эквивалентная концентрация 0,1 моль/л. 1.Запишите уравнение реакции гидролиза. 2. Вычислите константу и степень гидролиза. 3. Рассчитайте концентрацию водородных ионов и рН среды. 4. Повторите задания 1 – 3 для соли аммония слабой кислоты. * соль задается индивидуально. Задание для контрольной работы Даны водные растворы солей: 1 - ацетат натрия, 2 – хлорид аммония, 3 – цианид калия, 4 – нитрит натрия, 5 – ортофосфат натрия, 6 – сульфат меди (П), 7 – хлорид алюминия, 8 – сульфид калия, 9 – карбонат аммония, 10 – карбонат натрия, 11 - цианид аммония, 12 – гидрокарбонат натрия.
12. Предложите возможный механизм гидролиза солей типа Na3[Al(OH)6] и K2[Zn(OH)4]. 13. Как влияет кипячение на гидролиз солей? Что будет наблюдаться при кипячении водных растворов 8 и 2? Контрольный тест повышенной сложности
а) гидролиз – это реакция ионного обмена между малодиссоциированными кислотой и основанием; б) гидролиз – это реакция, обратная реакции нейтрализации; в) гидролиз – это реакция взаимодействия ионов соли с ионами воды, сопровождающаяся, как правило, изменением рН среды за счет образования малодиссоциирующих веществ; г) гидролиз – это реакция ионного обмена с участием соли и воды?
а) слабым основанием и сильной кислотой; б) сильным основанием и сильной кислотой; в) сильным основанием и слабой кислотой; г) слабым основанием и слабой кислотой.
а) увеличилось, б) уменьшилось, в) осталось без изменения?
а) увеличилось, б) уменьшилось, в) осталось без изменения?
а) увеличилось, б) уменьшилось, в) осталось без изменения?
а) увеличилось, б) уменьшилось, в) осталось без изменения?
| |||||||||||||||||||||
