Лабораторные органическая химия. Лабораторная работа 1 окси, оксокислоты гидроксикарбоновые кислоты опы Свойства молочной кислоты
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
Лабораторная работа №1 1. ОКСИ-, ОКСОКИСЛОТЫ 1.1.ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ Опыт1. Свойства молочной кислоты Реактивы и оборудование: молочная кислота, 1%-ный раствор хлорида железа (III), 30%-ный раствор серной кислоты, фуксинсернистая кислота, концентрированная уксусная кислота, универсальная индикаторная бумага; кипятильники, пробки с изогнутыми газоотводными трубками, химические стаканы на 50 мл, фильтровальная бумага, лед, пробирки. 1.1. Получение лактата железа (III).В две пробирки вносят по 2—3 капли 1%-ного раствора хлорида железа (III) и по 1 мл дистиллированной воды. В одну из пробирок вносят 1 каплю молочной кислоты. При этом содержимое приобретает зеленовато-желтый цвет в связи с образованием молочнокислого железа. Вторая пробирка служит для контроля. 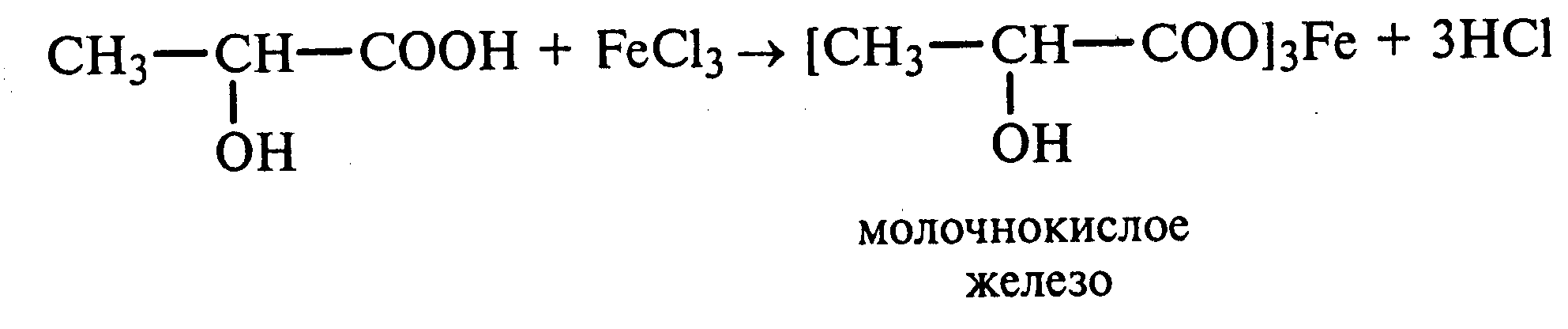 1.2. Разложение молочной кислоты при нагревании с разбавленной серной кислотой. В пробирку помещают кипятильники и наливают 1 мл молочной кислоты и 3 мл 30%-ного раствора серной кислоты. Пробирку закрывают пробкой с изогнутой газоотводной трубкой, конец которой погружают в пробирку с фуксинсернистой кислотой, охлаждаемую в стакане со льдом. Реакционную смесь нагревают до кипения. Раствор фуксинсернистой кислоты приобретает розово-фиолетовую окраску, что свидетельствует о выделении уксусного альдегида: 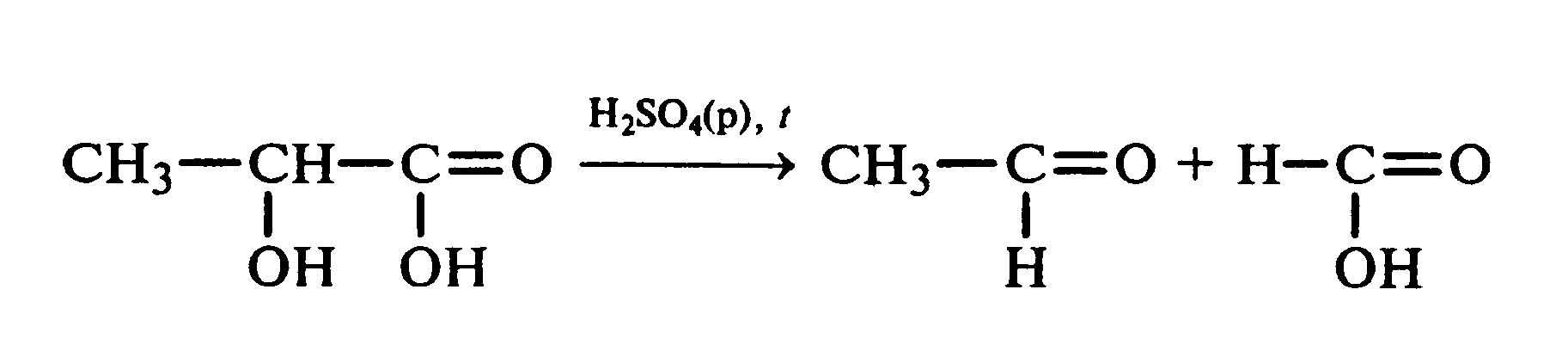 Опыт 2. Свойства винной кислоты. Реактивы и оборудование: 1М раствор винной кислоты, 2М раствор гидроксида калия, 15%-ный раствор гидроксида натрия, 10%-ный раствор аммиака, 5%-ный раствор хлорида кальция, 5%-ный раствор сульфата меди (II), 5%-ный раствор винной кислоты, 35%-ный раствор виннокислого калия, натрия (сегнетова соль), красная лакмусовая бумага; пробирки. 2.1. Образование калиевых солей винной кислоты. К 3 мл 1М раствора винной кислоты приливают 1,5 мл 2М раствора гидроксида калия. При встряхивании выпадает белый мелкокристаллический осадок кислой калиевой соли винной кислоты. Если осадок не выпадает, необходимо потереть стеклянной палочкой по стенке пробирки. При дальнейшем добавлении раствора щелочи осадок растворяется вследствие образования средней соли винной кислоты. 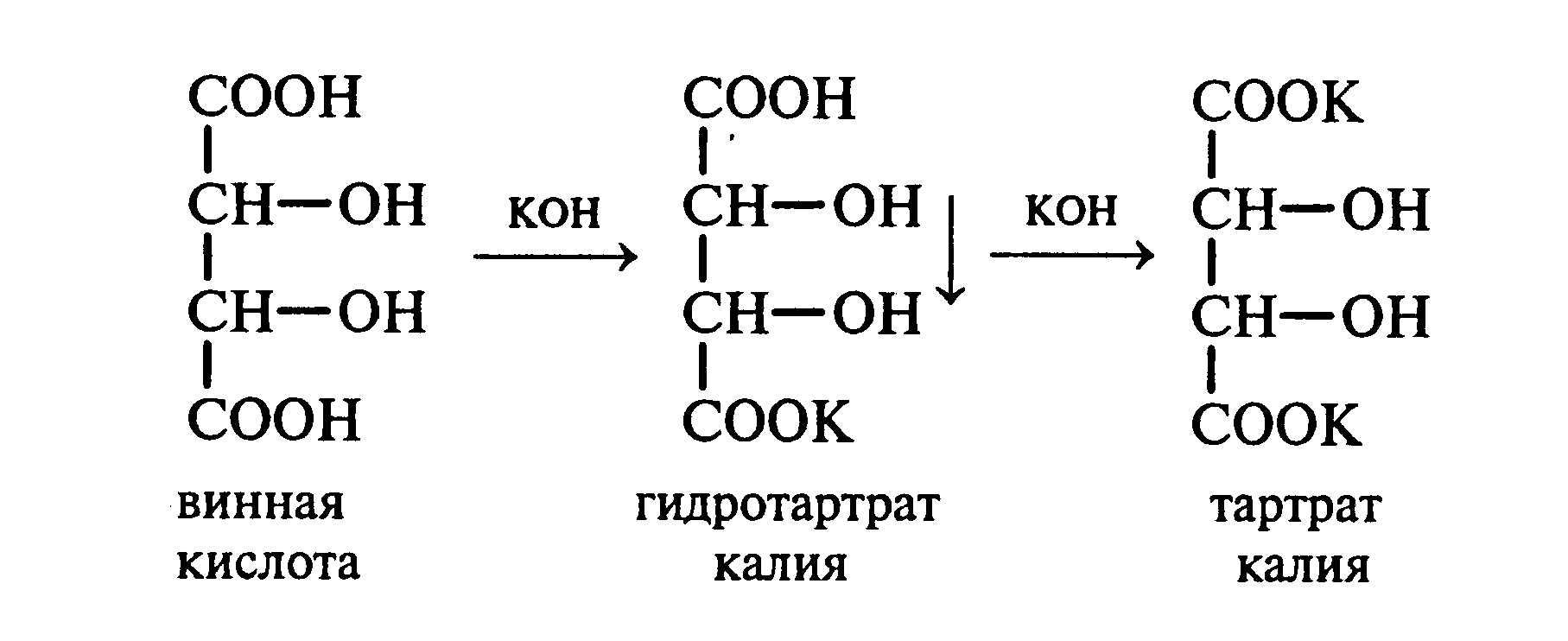 Кислая калиевая соль винной кислоты выпадает в осадок при приготовлении виноградного вина, и поэтому ее называют «винный камень». Плохая растворимость гидротартрата калия используется в качественном анализе для обнаружения ионов калия. 2.2. Получение кальциевой соли винной кислоты. В пробирку наливают 1 мл 5%-ного раствора винной кислоты и нейтрализуют ее, добавляя по каплям 10%-ный раствор аммиака (контроль по лакмусовой бумаге). Затем в пробирку приливают по каплям 5%-ный раствор хлорида кальция. Появляется белый осадок средней кальциевой соли винной кислоты. 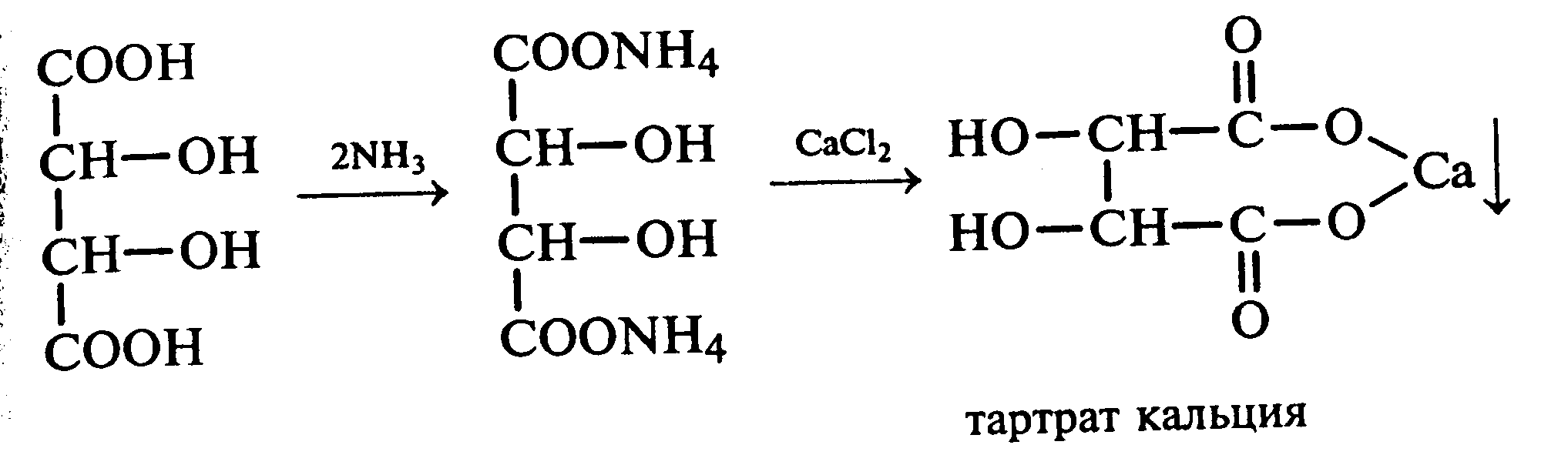 2.3. Взаимодействие сегнетовой соли с гидроксидом меди (II). К 1 мл 35%-ного раствора сегнетовой соли (натриево-калиевая соль винной кислоты) приливают 1 мл 15%-ного раствора гидроксида натрия. Полученный раствор хорошо перемешивают и по каплям добавляют 5%-ный раствор сульфата меди (II). Сначала появляется голубой осадок гидроксида меди (II), который при встряхивании растворяется, и образуется интенсивно окрашенный раствор василькового цвета. 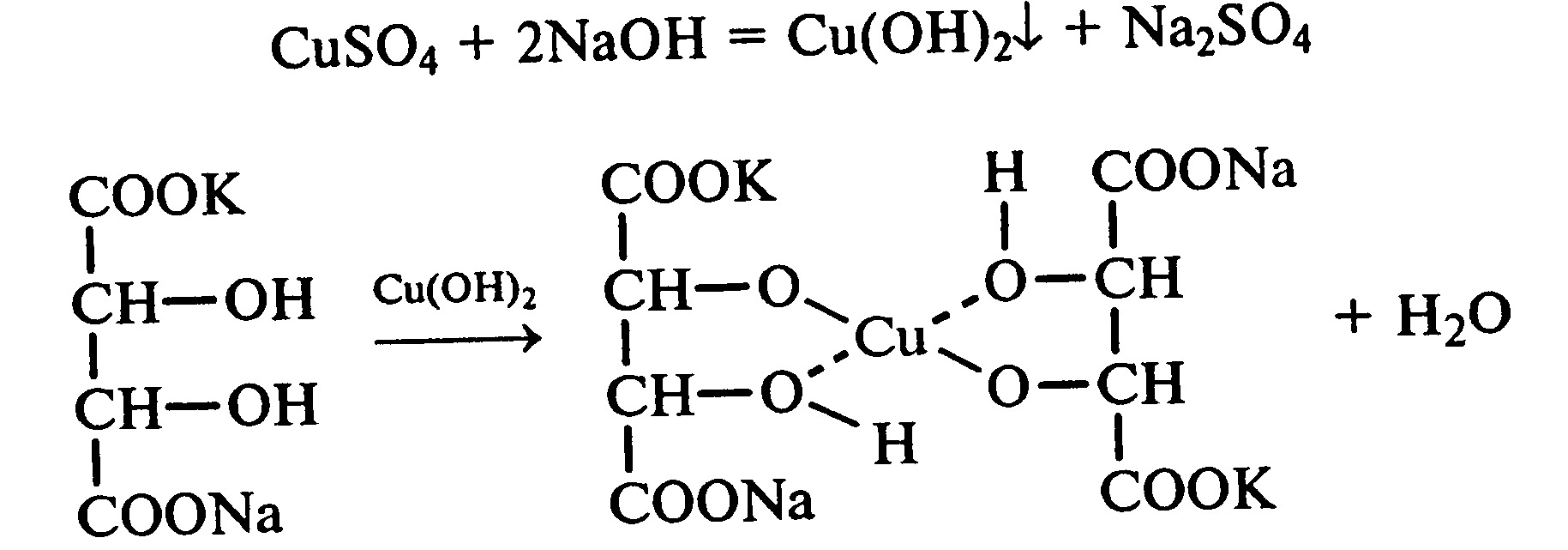 Винная кислота содержит две гидроксильные группы и в щелочном растворе способна образовывать комплексное соединение с гидроксидом меди (II) подобно многоатомным спиртам. Щелочной раствор комплексного соединения двухвалентной меди с солью винной кислоты называют фелинговой жидкостью (по имени немецкого ученого Фелинга), которую широко используют для качественного и количественного анализа Сахаров и обнаружения альдегидов. Опыт 3. Получение цитрата кальция Реактивы и оборудование: 5%-ный раствор лимонной кислоты, 5%-ный раствор хлорида кальция, 10%-ный раствор аммиака, лакмусовая бумага; пробирки. В пробирку вносят 1 мл раствора лимонной кислоты, который затем нейтрализуют 10%-ным раствором аммиака, приливая его по каплям при перемешивании до нейтральной реакции среды (лакмус). К полученному раствору цитрата аммония добавляют 1 мл 5%-ного раствора хлорида кальция. Раствор осторожно нагревают в пламени горелки до кипения. Выпадает осадок цитрата кальция. При охлаждении раствора осадок растворяется, так как эта соль в горячей воде растворяется хуже, чем в холодной. 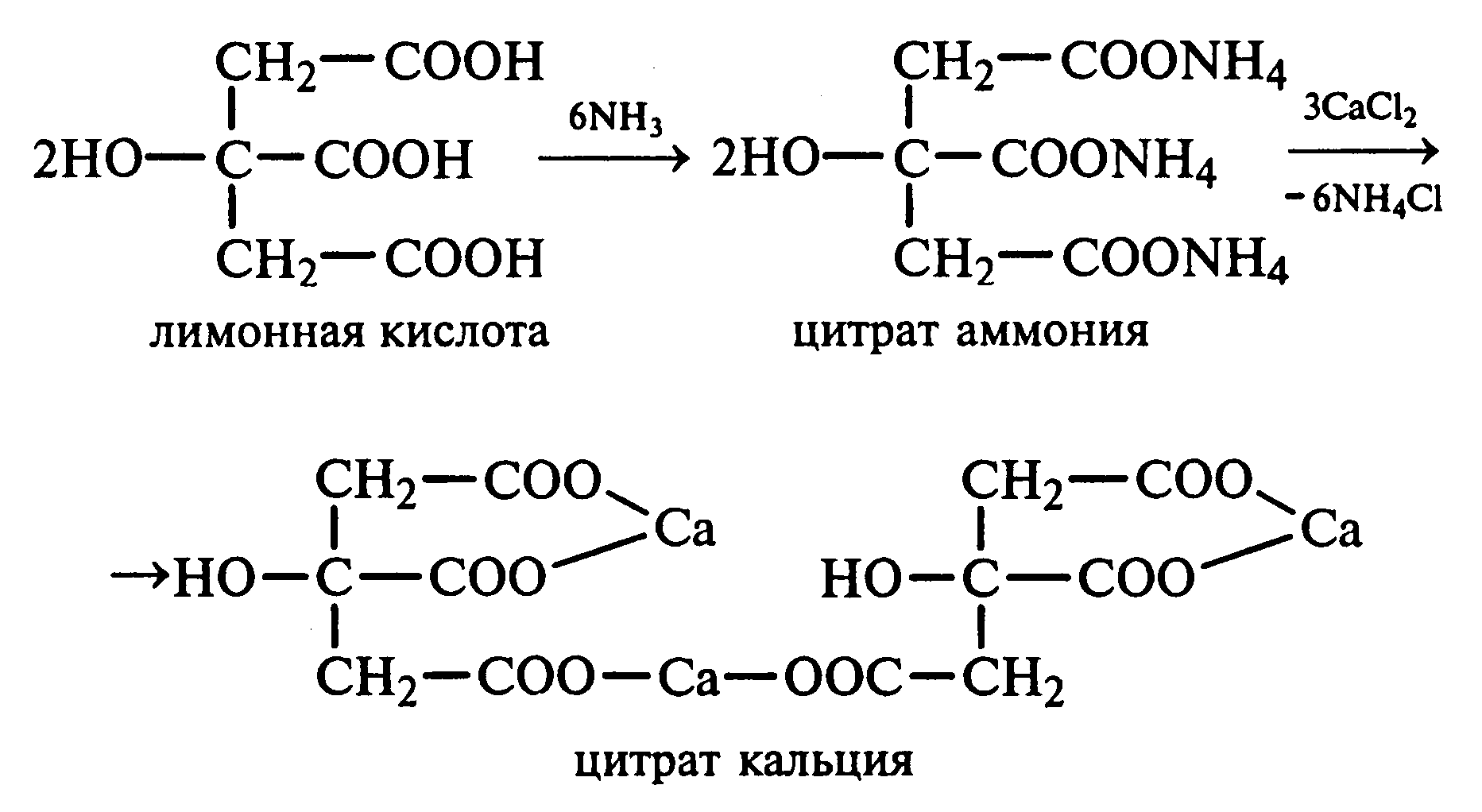 2.1. КЕТОКИСЛОТЫ. АЦЕТОУКСУСНЫЙ ЭФИР Опыт 4. Получение пировиноградной кислоты окислением молочной кислоты Реактивы и оборудование: 5%-ный раствор молочной кислоты, 1%-ный раствор перманганата калия, 10%-ный раствор карбоната натрия, 2%-ный раствор нитропруссида натрия, 10%-ный раствор гидроксида натрия, универсальная индикаторная бумага; фильтровальная бумага, химические воронки, пробирки. В пробирку наливают 0,5 мл молочной кислоты, которую нейтрализуют, прибавляя по каплям 10%-ный раствор карбоната натрия (контроль рН среды осуществляют по универсальной индикаторной бумаге). Затем добавляют 2—3 мл 5%-ного раствора перманганата калия. Содержимое пробирки тщательно перемешивают и доводят до кипения на газовой горелке. Фиолетово-розовая окраска перманганата калия исчезает, и выпадает бурый осадок оксида марганца (IV). 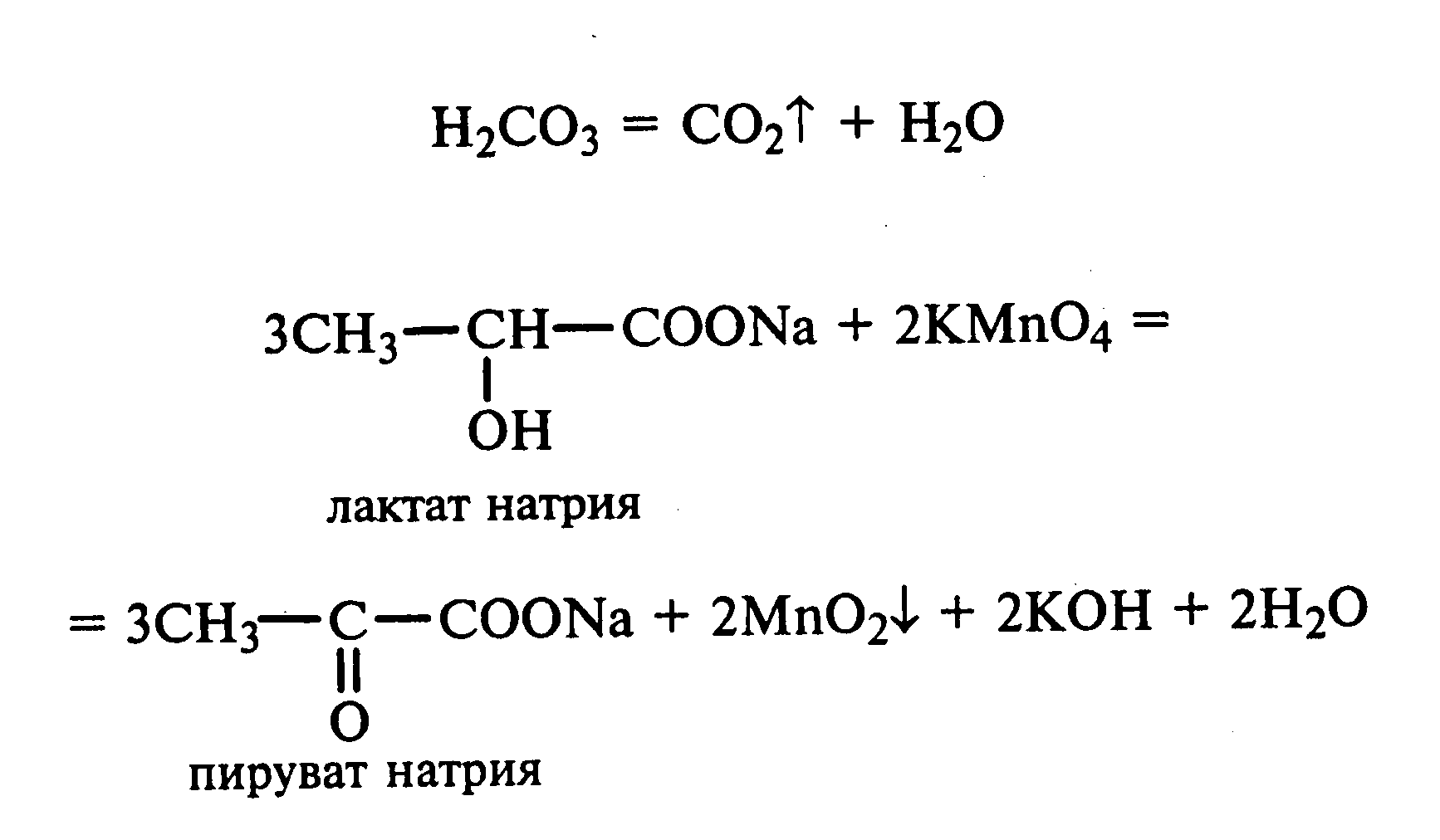 Полученный раствор фильтруют. Для обнаружения пировиноградной кислоты проводят качественную реакцию на кетогруппу. Для этого к фильтрату приливают 1 мл 2%-ного раствора нитропруссида натрия и 1 мл 10%-ного раствора гидроксида натрия. Раствор окрашивается в оранжево-красный цвет. При добавлении нескольких капель концентрированной уксусной кислоты раствор становится вишнево-красным. Опыт 5. Свойства ацетоуксусного эфира Реактивы и оборудование: ацетоуксусный эфир, натрий металлический, бромная вода (насыщенная), 2%-ный раствор хлорида железа (III); лед, фильтровальная бумага, скальпели, пинцеты, химические стаканы на 100 мл, пробирки. 5.1. Кето-енольная таутомерия ацетоуксусного эфира. В пробирку вносят 1—2 капли ацетоуксусного эфира и приливают 2 мл дистиллированной воды. Смесь энергично перемешивают и добавляют 1 каплю 2%-ного раствора хлорида железа (III). Постепенно развивается фиолетовое окрашивание, которое свидетельствует о наличии енольной группы в растворе ацетоуксусного эфира. Хлорид железа (III) образует с енольной формой окрашенное комплексное соединение. При добавлении нескольких капель бромной воды раствор обесцвечивается, так как бром присоединяется по двойной связи, и гидроксильная группа утрачивает енольный характер: 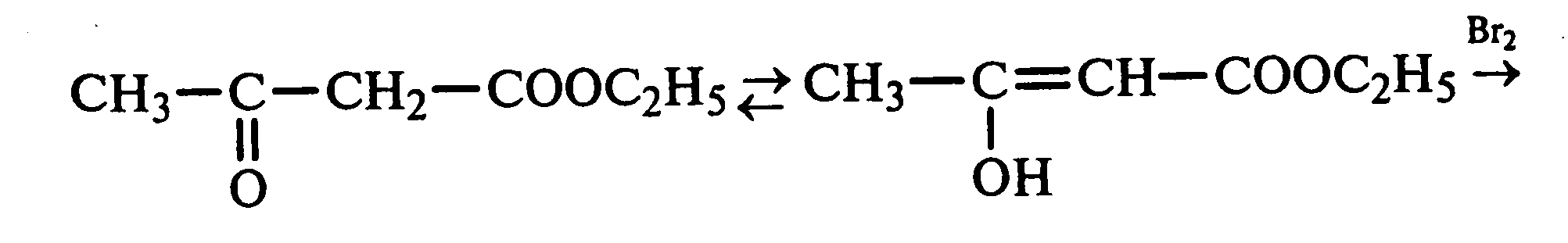 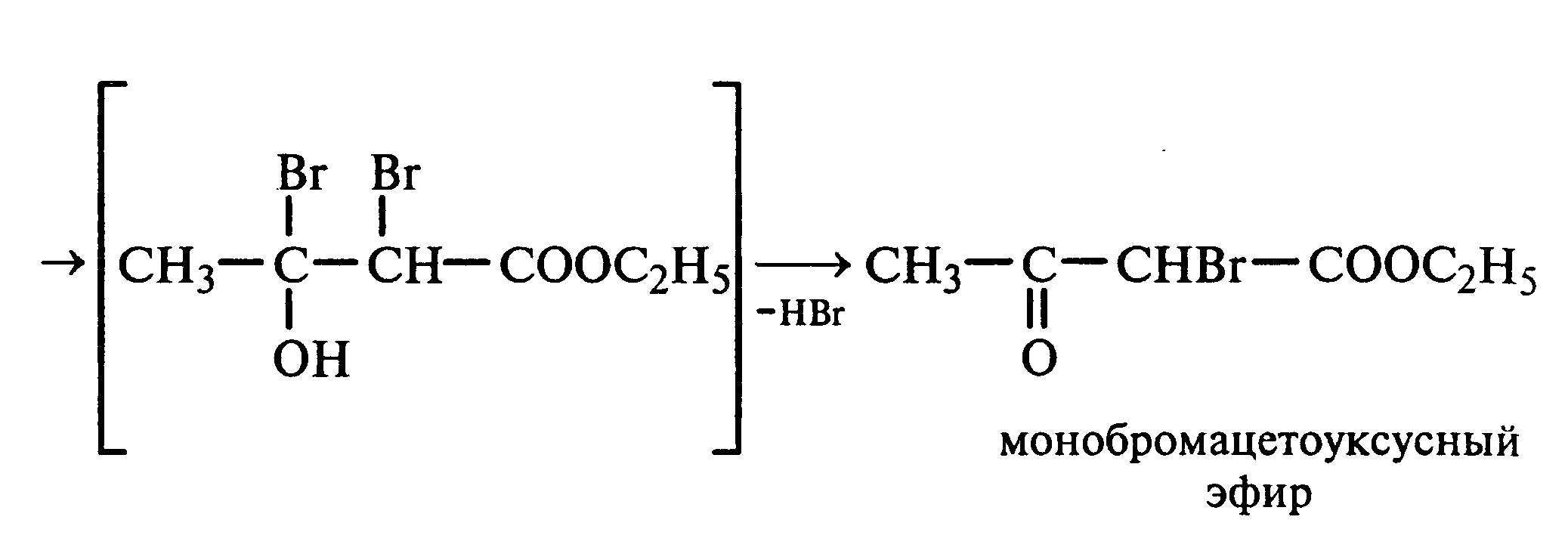 Через некоторое время раствор вновь окрашивается в фиолетовый цвет, так как связывание енольной формы нарушает динамическое равновесие, и часть оставшейся кетонной формы ацетоуксусного эфира переходит в енольную, образующую окрашенный комплекс с ионами Fe3+. В енольную форму может также переходить монобромацетоуксусный эфир. При повторном добавлении бромной воды снова наблюдают обесцвечивание раствора с последующим возобновлением фиолетовой окраски. Этот процесс может продолжаться до полного замещения подвижных атомов водорода на бром, т. е. до получения дибромацетоуксусного эфира, не способного к таутомерным превращениям. 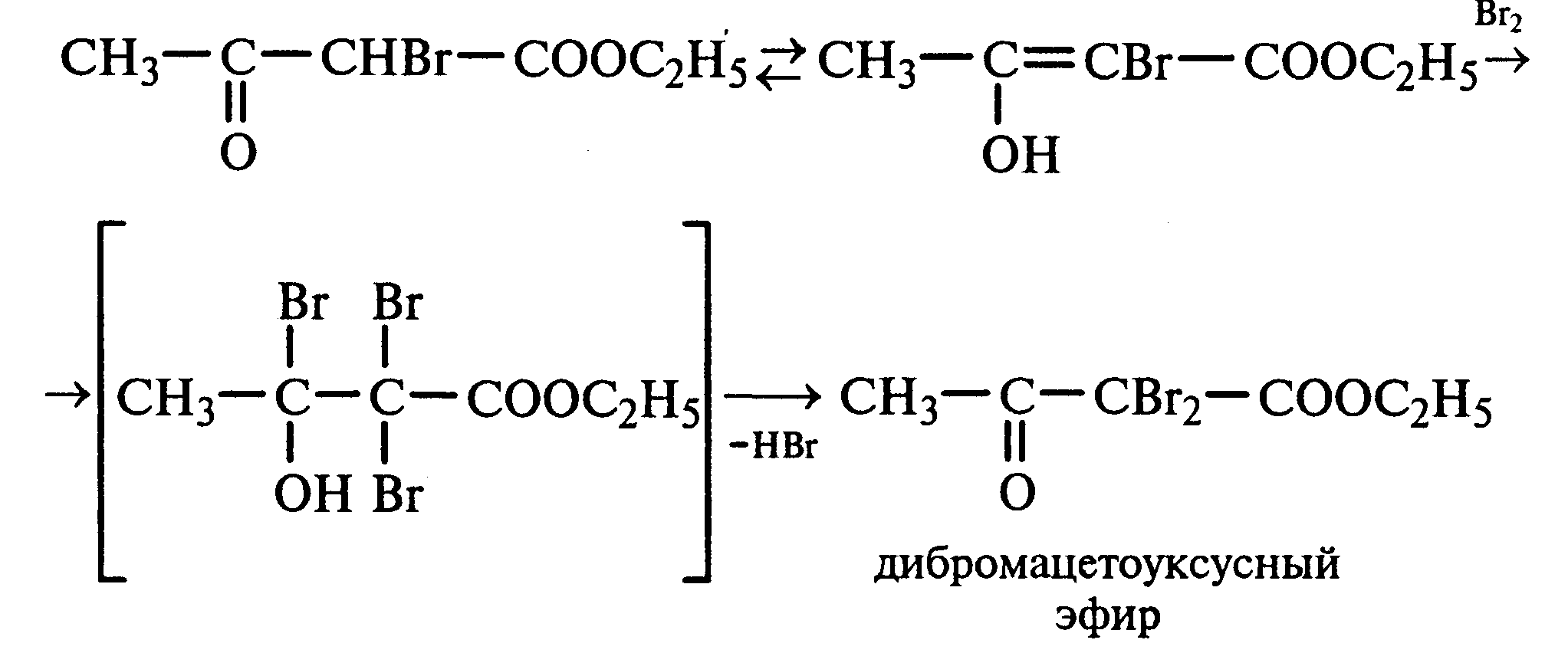 5.2. Взаимодействие ацетоуксусного эфира с металлическим натрием. В пробирку наливают 2 мл свежеперегнанного ацетоуксусного эфира и бросают в него небольшой кусочек (1/4 горошины) металлического натрия, очищенного от оксидной пленки и отжатого в фильтровальной бумаге. Идет довольно интенсивная реакция с выделением водорода. После ее окончания пробирку охлаждают в стакане со льдом. Натрийацетоуксусный эфир выпадает в осадок: 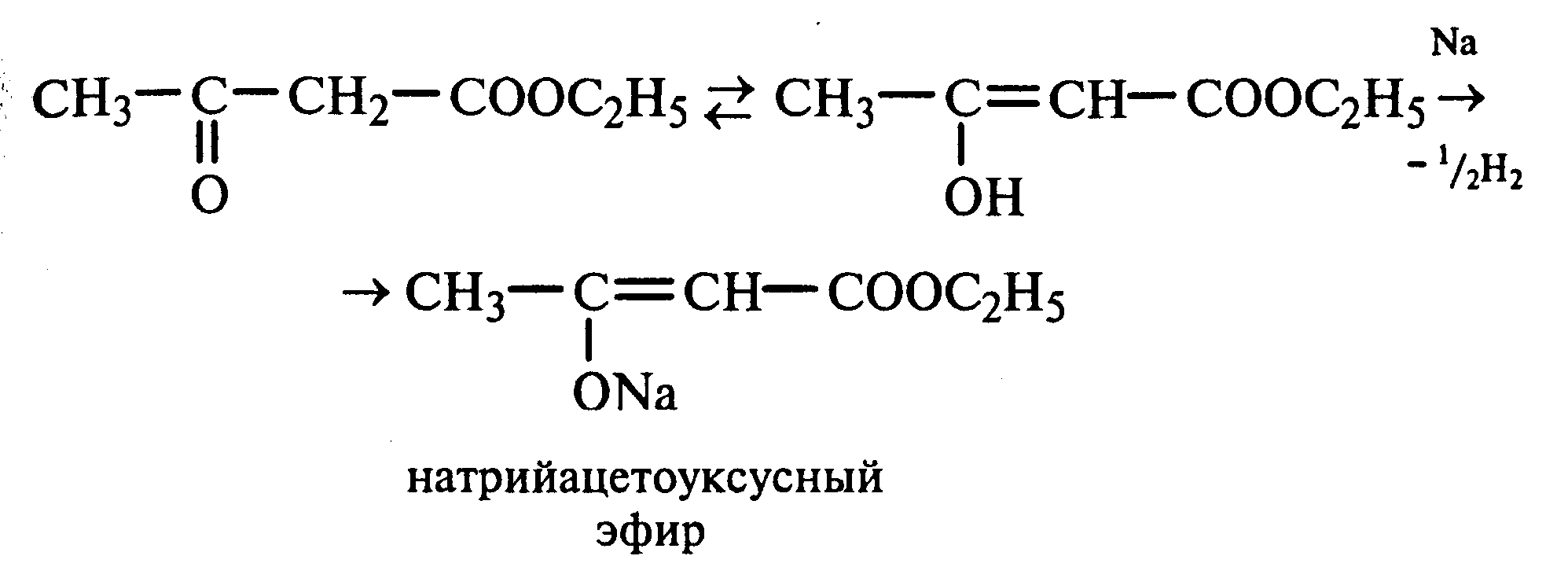 1.3. АРОМАТИЧЕСКИЕ ОКСИКИСЛОТЫ Опыт 6. Взаимодействие бензойной, коричной и салициловой кислот с бромной водой Реактивы и оборудование: насыщенные растворы бензойной, коричной и салициловой кислот, бромная вода (насыщенная); пипетки, пробирки. В три пробирки наливают по 1—2 мл насыщенных растворов бензойной, коричной и салициловой кислот. В каждую пробирку добавляют по несколько капель насыщенной бромной воды. В пробирке с бензойной кислотой бромная вода не обесцвечивается, так как бензойная кислота бромируется только в присутствии катализатора. Коричная и салициловая кислоты обесцвечивают бромную воду: 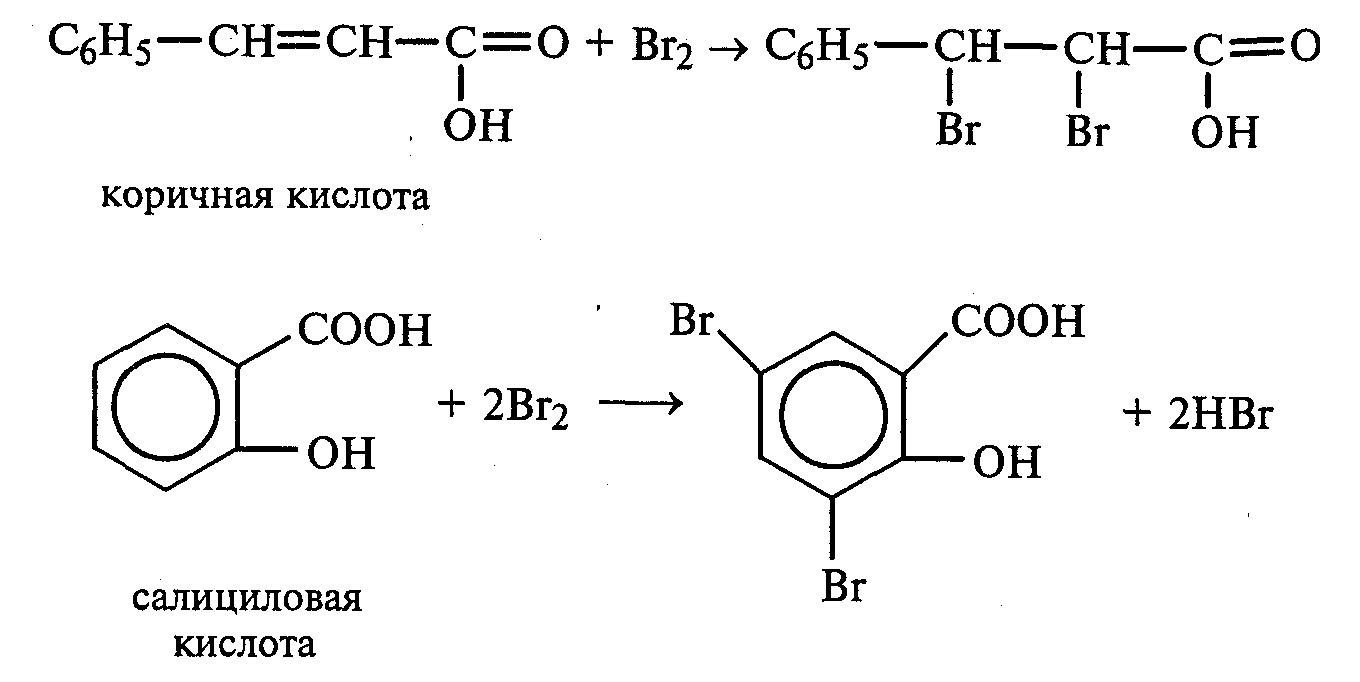 Напишите механизмы данных реакций. Объясните, почему бензойная кислота не взаимодействует с бромом при данных условиях. Опыт 7. Отношение бензойной и коричной кислот к перманганату калия Реактивы и оборудование: бензойная кислота, коричная кислота, 10%-ный раствор карбоната натрия, 5%-ный раствор перманганата калия, пробирки. Небольшие количества (по 0,1 г) бензойной и коричной кислот растворяют в минимальном объеме 10%-ного раствора карбоната натрия. В оба раствора при перемешивании добавляют раствор перманганата калия. Лишь в пробирке с коричной кислотой окраска перманганата калия исчезает, и появляются бурые хлопья оксида марганца (IV). Бензойная кислота устойчива к действию окислителей: 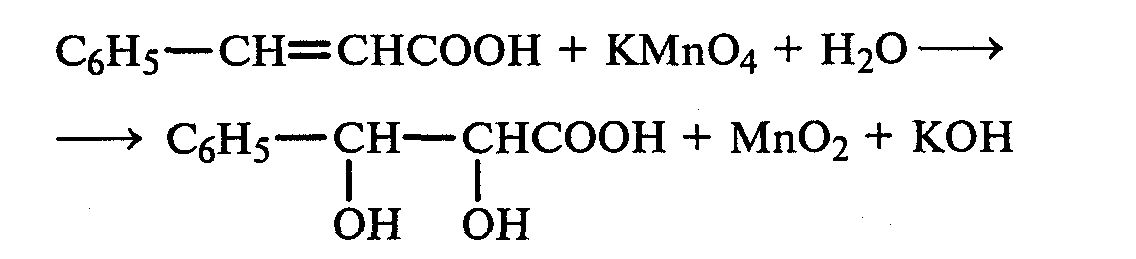 В приведенном уравнении реакции определите степени окисления атомов и расставьте коэффициенты. Опыт 8. Реакции бензойной и салициловой кислот с хлоридом железа (III) Реактивы и оборудование: насыщенные растворы бензойной и салициловой кислот, 1%-ный раствор хлорида железа (III); пипетки, пробирки. В две пробирки наливают по 1 мл насыщенных растворов бензойной и салициловой кислот, добавляют по 1 мл воды, а затем по 1—2 капли 1%-ного раствора хлорида железа (III). Бензойная кислота не взаимодействует с хлоридом железа (III), а в пробирке с салициловой кислотой в результате образования комплексного соединения появляется фиолетовая окраска. Опыт 9. Взаимодействие эфиров салициловой кислоты с хлоридом железа (III) Реактивы и оборудование: ацетилсалициловая кислота, фенилсалицилат (салол), этиловый спирт, 1%-ный раствор хлорида железа (III); пробирки. В одной пробирке растворяют 0,1 г ацетилсалициловой кислоты (аспирина) в 3—4 мл воды. Полученный раствор делят на две части. В другой пробирке к 1,5—2 мл этанола прибавляют несколько кристаллов фенилсалицилата (салола). В одну из пробирок с раствором ацетилсалициловой кислоты и в пробирку с фенилсалицилатом приливают по 1—2 капли 1%-ного раствора хлорида железа (III). Раствор фенилсалицилата окрашивается в ярко-фиолетовый цвет, а в пробирке с аспирином окраска отсутствует. Однако следует помнить, что при длительном хранении аспирин может гидролизоваться, и в этом случае будет появляться фиолетовая окраска. Реакция с хлоридом железа (III) служит для определения чистоты аспирина. Вторую пробирку с раствором ацетилсалициловой кислоты кипятят несколько минут на газовой горелке, а затем добавляют 1—2 капли раствора хлорида железа (III). Появляется фиолетовая окраска, которая свидетельствует о том, что при нагревании происходит высвобождение фенольного гидроксила в результате гидролиза: 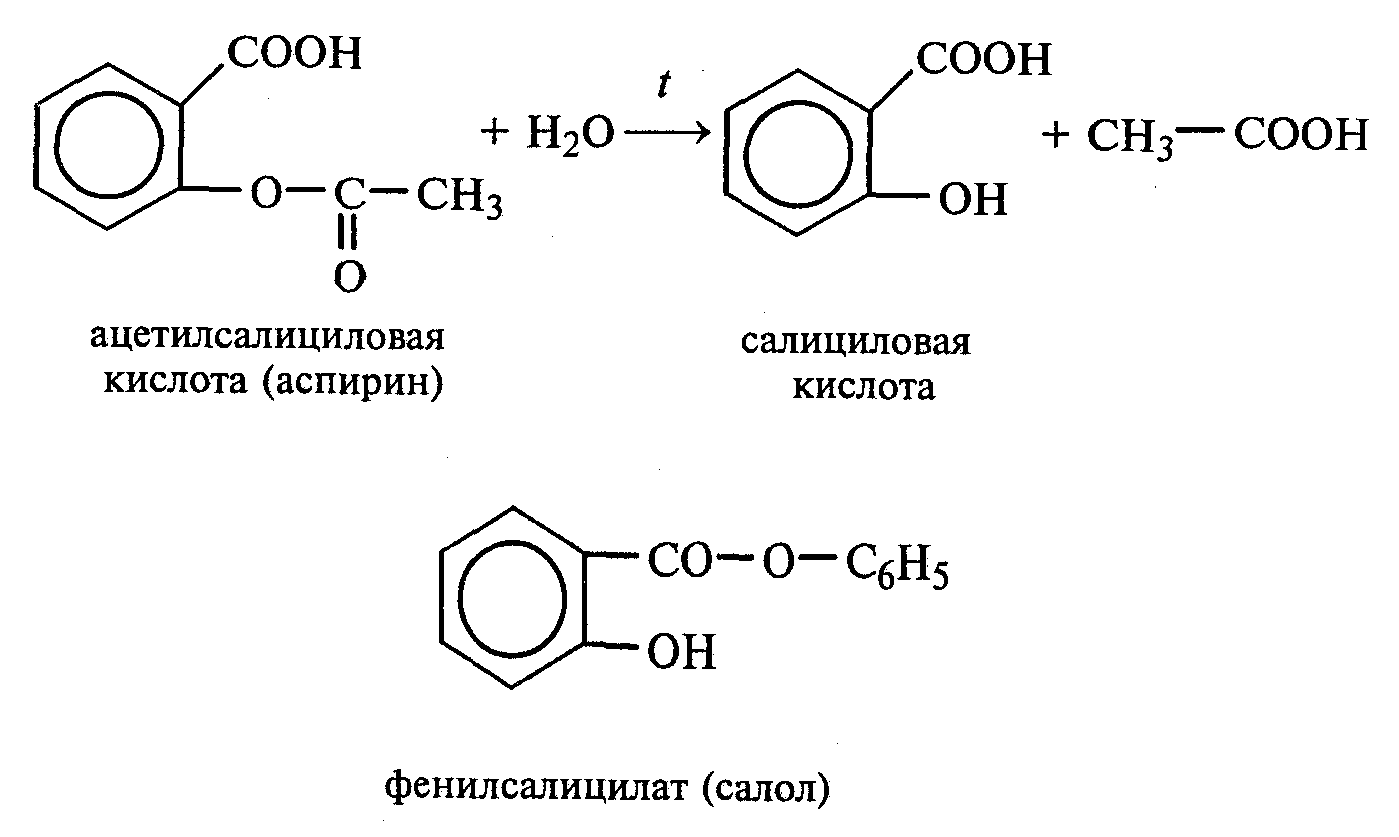 Опыт 10. Образование фталевого ангидрида Реактивы и оборудование: фталевая кислота; пробирки. В сухую пробирку помещают 0,5 г фталевой кислоты и нагревают на небольшом пламени. При этом образуется фталевый ангидрид, который возгоняется и оседает на холодных стенках пробирки в виде белых кристаллов: 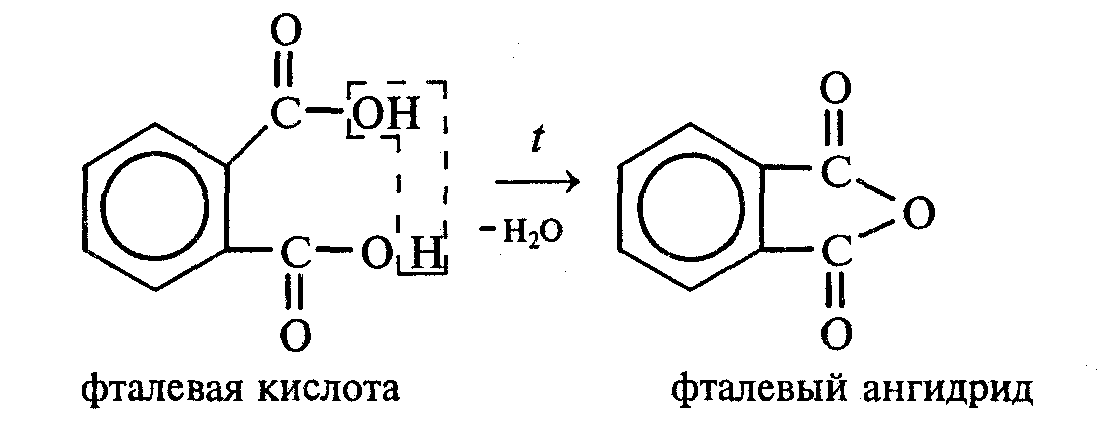 Лабораторная работа №2 2. АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ 2.1. АМИНЫ АЛИФАТИЧЕСКОГО РЯДА Опыт 11. Свойства аминов Реактивы и оборудование: 0,2М растворы (в капельницах): аммиака, первичного, вторичного и третичного аминов, универсальная индикаторная бумага со шкалой рН, хлорид метиламмония, натронная известь, концентрированная соляная кислота, 3%-ный раствор хлорида железа (III), 3%-ный раствор сульфата меди (II), 10%-ный раствор нитрита натрия, ледяная уксусная кислота; изогнутые газоотводные трубки, пробирки. 11.1. Сравнение основных свойств первичных, вторичных, третичных аминов и аммиака. На полоски универсальной индикаторной бумаги наносят по капле растворов первичного, вторичного, третичного аминов и аммиака. Сравнивают окраску пятен на индикаторных бумажках со шкалой рН и определяют значение рН исследуемых аминов и аммиака. 11.2. Образование солей аминов. В сухую пробирку помещают 0,5—1 г хлорида метиламмония и 1—2 г натронной извести. Смесь тщательно перемешивают стеклянной палочкой. Пробирку закрывают пробкой с газоотводной трубкой и закрепляют в лапке штатива. Реакционную смесь нагревают на газовой горелке. 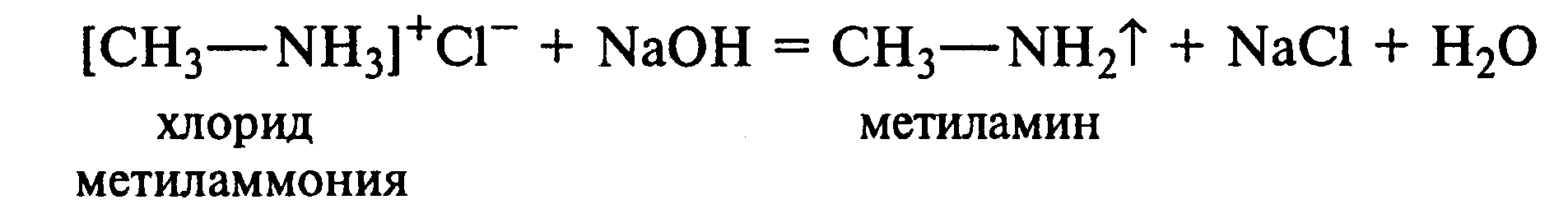 К отверстию пробирки, из которой выделяется газообразный метиламин, подносят стеклянную палочку, смоченную концентрированной соляной кислотой. Палочка окутывается туманом: CH3 - NH2 + HCl = [CH3 - NH3]+Cl- Метиламин (основание) взаимодействует с соляной кислотой с образованием твердой соли — хлорида метиламмония, частички которой воспринимаются как туман. В две пробирки наливают по 2 мл 3%-ного раствора хлорида железа (III) и 3%-ного раствора сульфата меди (II). Через оба раствора пропускают газообразный метиламин. В пробирке с хлоридом железа (III) выпадает бурый осадок, в пробирке с сульфатом меди (II) — осадок голубого цвета, который растворяется в избытке метиламина с образованием комплексной соли ярко-синего цвета. Метиламин, пропускаемый через водные растворы солей, прекрасно растворяется в воде с образованием гидроксида метиламмония: 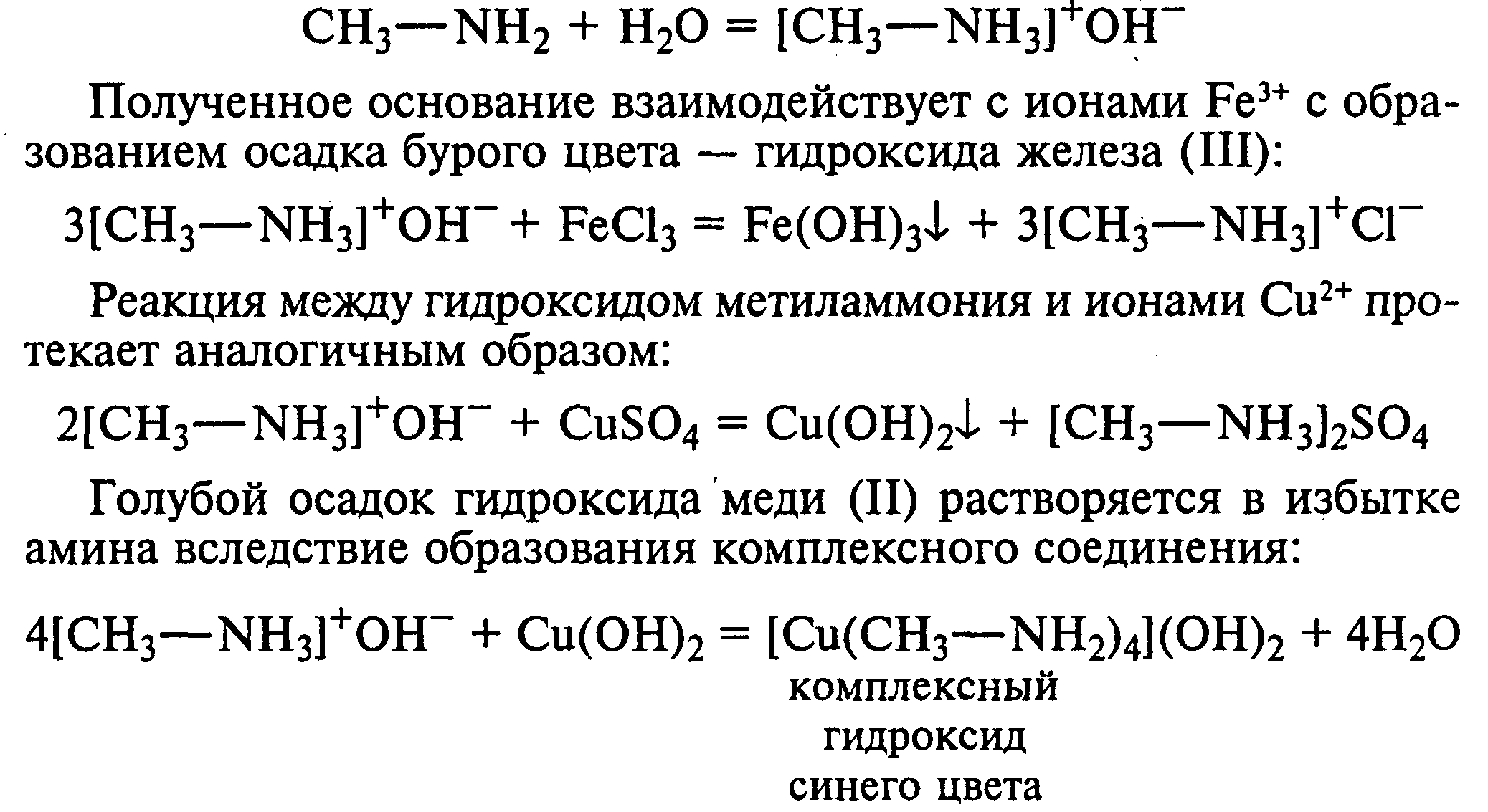 11.3. Взаимодействие первичных аминов с азотистой кислотой. Эту реакцию используют как качественную реакцию на первичные амины алифатического ряда. В пробирку с 0,2 г хлорида метиламмония приливают 1 мл воды, а затем, после растворения соли, вносят 1 мл 10%-ного раствора нитрита натрия. Смесь тщательно перемешивают. При добавлении к реакционной смеси нескольких капель ледяной уксусной кислоты выделяется азот в виде мелких пузырьков. 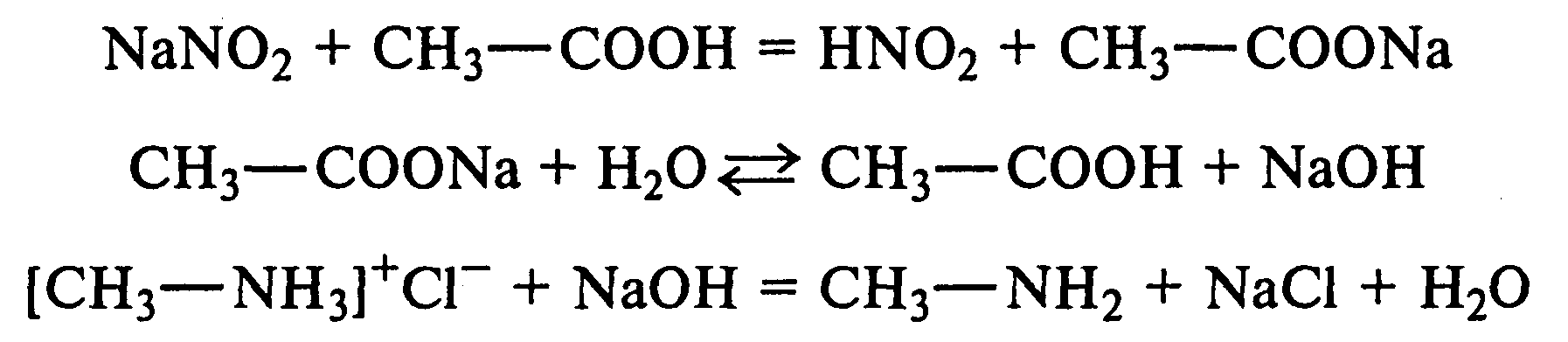 2.2. АМИНОКИСЛОТЫ Опыт 12. Свойства аминокислот Реактивы и оборудование: 2%-ный раствор аминоуксусной кислоты (глицина), 10%-ный раствор аминоуксусной кислоты, 1%-ный раствор аминоуксусной кислоты, растворы индикаторов (метиловый оранжевый, метиловый красный, лакмус), карбонат меди (II), 10%-ный раствор гидроксида натрия, 10%-ный раствор нитрита натрия, ледяная уксусная кислота, 0,1%-ный раствор нингидрина в ацетоне; химические стаканы на 100 мл, лед, водяные бани, пробирки. 12.1. Отношение аминокислот к индикаторам. В три пробирки наливают по 1 мл 2%-ного раствора глицина и добавляют по 12 капли растворов индикаторов: в первую пробирку — метиловый оранжевый, во вторую — метиловый красный, в третью -лакмус. Окраска индикаторов не изменяется. Это объясняется тем, что моноаминомонокарбоновые кислоты (в частности глицин) в водных растворах существуют в виде биполярных ионов, при- чем кислотность карбоксильной группы уравновешивается основностью аминогруппы, поэтому водные растворы этих аминокислот имеют нейтральную реакцию среды: 12.2. Образование медной соли аминоуксусной кислоты. В сухую пробирку вносят 0,5 г карбоната меди (II) и 1,5—2 мл 2%-ного раствора аминоуксусной кислоты. Реакционную смесь нагревают на пламени горелки. После нагревания хорошо видна синяя окраска раствора. Часть раствора переливают в другую пробирку и добавляют к нему 2 капли 10%-ного раствора гидроксида натрия. Выпадает ли осадок гидроксида меди (II)? Приведите объяснение. Оставшуюся часть жидкости охлаждают в стакане с ледяной водой. Постепенно выпадают кристаллы труднорастворимой медной соли аминоуксусной кислоты. Обычно для ускорения процесса кристаллизации стенку пробирки потирают стеклянной палочкой. 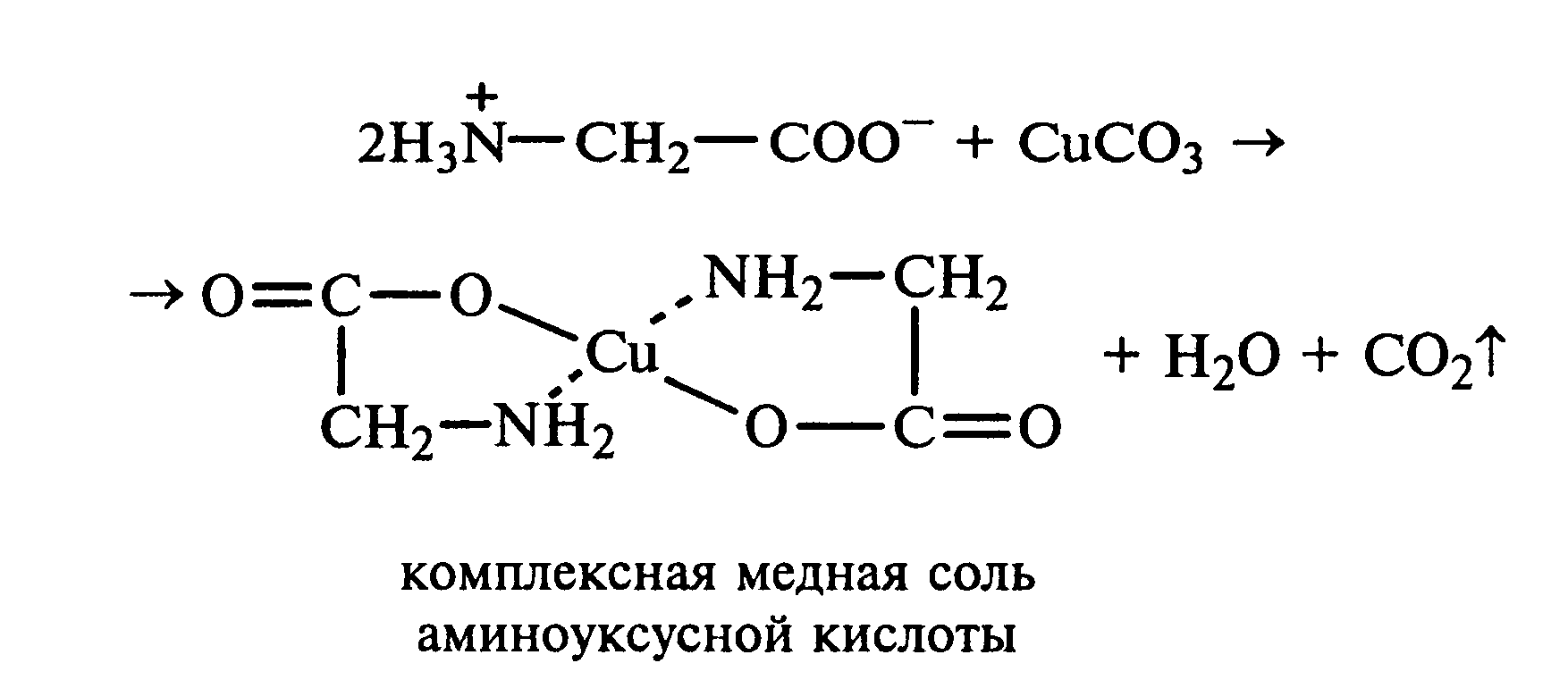 Образование комплексных окрашенных в синий цвет медных солей характерно для α -аминокислот. 12.3. Взаимодействие аминокислот с азотистой кислотой. Аминокислоты, как и первичные амины, взаимодействуют с азотистой кислотой с выделением азота. Эту реакцию используют для количественного определения аминокислот. К 1 мл 10%-ного раствора глицина приливают 1 мл 10%-ного раствора нитрита натрия и 1—2 капли ледяной уксусной кислоты. При встряхивании пробирки наблюдается выделение азота в виде мелких пузырьков. 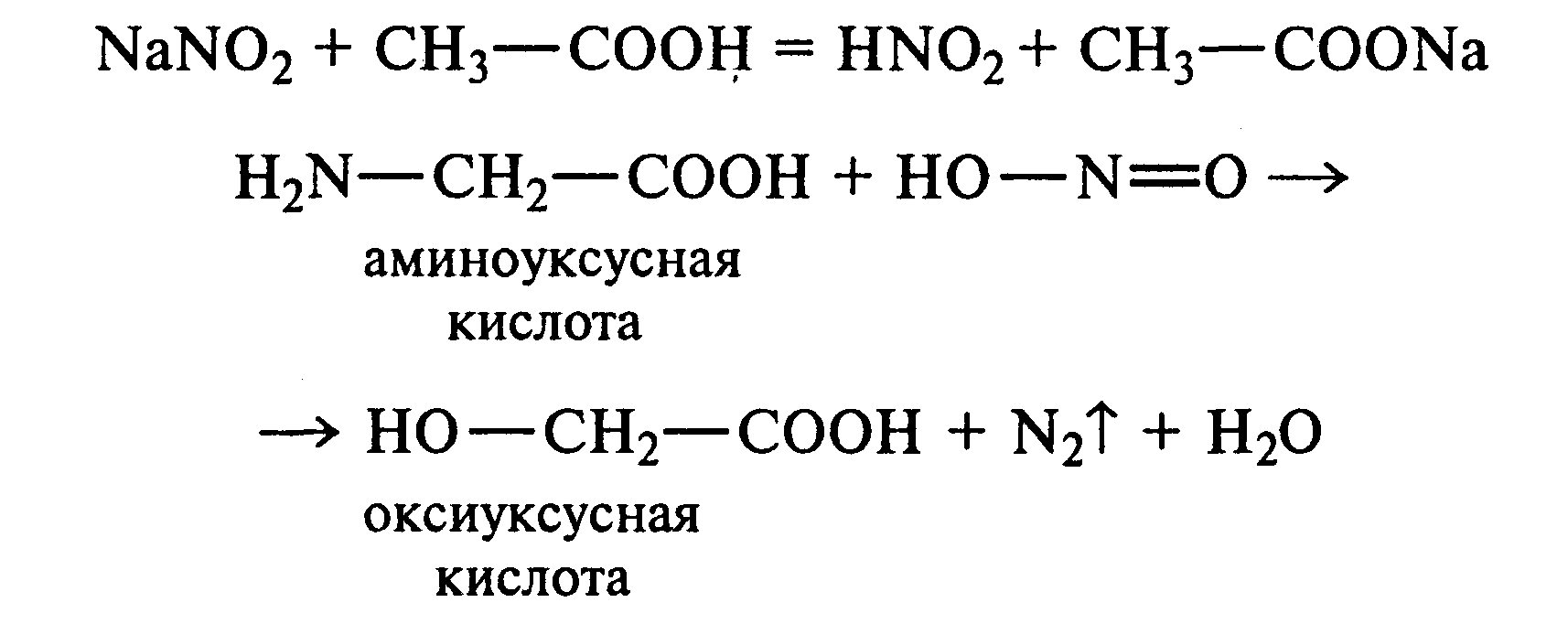 12.4. Цветная реакция аминокислот с нингидрином. Реакция с нингидрином очень чувствительна, поэтому ее часто применяют для качественного и количественного анализа α -аминокислот. К 2—3 мл 1%-ного раствора аминоуксусной кислоты добавляют 2—3 капли 0,1%-ного раствора нингидрина в ацетоне. Содержимое пробирки встряхивают и нагревают на горячей водяной бане. Через некоторое время появляется фиолетовая окраска с синим оттенком. Различные α -аминокислоты с нингидрином образуют окрашенные соединения, отличающиеся оттенком. Механизм реакции α -аминокислот с нингидрином подробно рассматривается в курсе биохимии. 2.3. МОЧЕВИНА Опыт 13. Свойства мочевины Реактивы и оборудование: мочевина кристаллическая, 20%-ный раствор мочевины, концентрированная азотная кислота, ледяная уксусная кислота, концентрированный раствор гидроксида натрия, насыщенный раствор щавелевой кислоты, насыщенный раствор гидроксида бария, 20%-ный раствор нитрита натрия, 10%-ный раствор гидроксида натрия, 1%-ный раствор сульфата меди, бром, лакмусовая бумага (синяя и красная); лед, пипетки, изогнутые газоотводные трубки, химические стаканы на 100 мл, пробирки. 13.1. Растворимость мочевины в воде и образование ее солей. В пробирку вносят 0,2—0,5 г мочевины и добавляют несколько капель воды до полного ее растворения. По капле раствора наносят на синюю и красную лакмусовую бумагу. Раствор мочевины нейтрален на лакмус. Тем не менее основные свойства мочевины можно обнаружить при взаимодействии ее с кислотами. Полученный концентрированный раствор мочевины делят на две части. К первой части добавляют 2—3 капли концентрированной азотной кислоты, а ко второй — 2—3 капли насыщенного раствора щавелевой кислоты. Через несколько секунд наблюдают выпадение кристаллов солей мочевины: 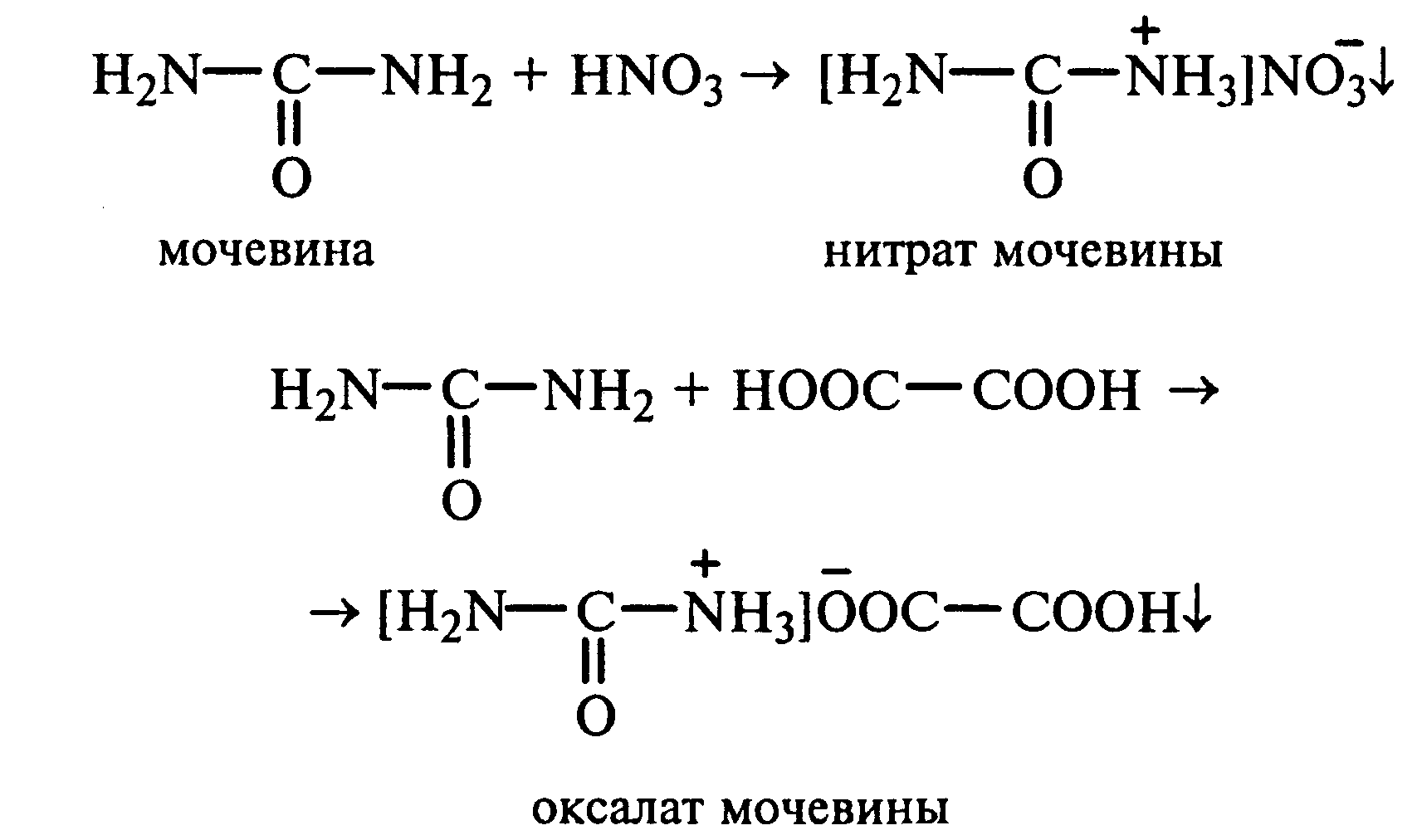 Почему мочевина дает соль только по одной аминогруппе? Способность мочевины образовывать труднорастворимую соль с азотной кислотой используют для обнаружения мочевины в моче. В сутки с мочой из организма человека выделяется около 30 г мочевины. 13.2 Гидролиз мочевины. В пробирку вносят 0,1—0,2 г мочевины и добавляют 1—2 мл баритовой воды (насыщенный раствор гидроксида бария). Раствор кипятят до выпадения в осадок карбоната бария. Влажная красная лакмусовая бумажка, поднесенная к отверстию пробирки во время кипячения раствора, синеет в связи с выделением аммиака: 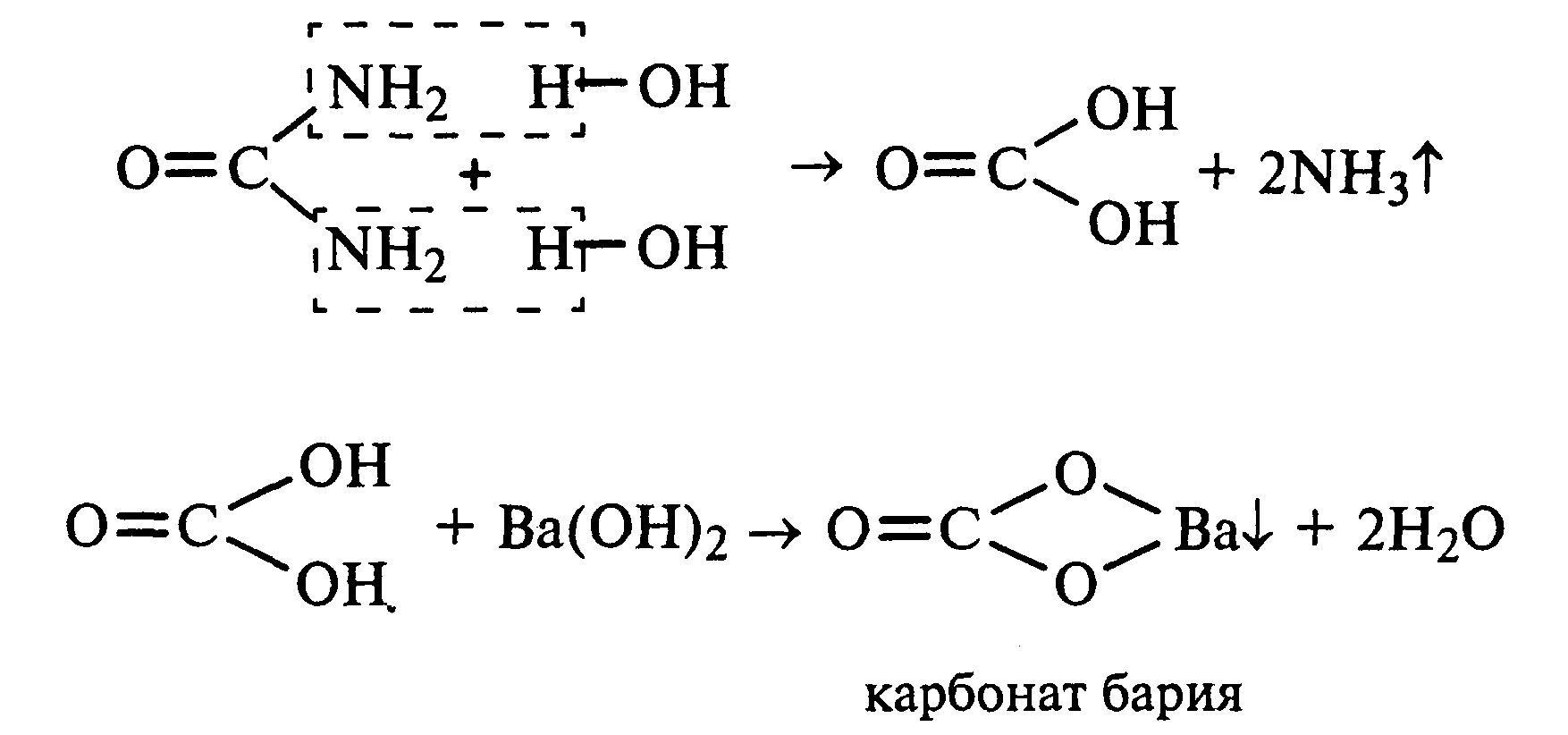 В живых организмах гидролиз мочевины происходит под действием фермента уреазы (urea — лат. мочевина). 13.3. Реакция мочевины с азотистой кислотой. В пробирку наливают 1 мл 20%-ного раствора мочевины, 1,5 мл 20%-ного раствора нитрита натрия и 2—3 капли ледяной уксусной кислоты. Пробирку закрывают пробкой с изогнутой газоотводной трубкой, конец которой опускают в пробирку с баритовой водой. Пробирку с реакционной смесью встряхивают и наблюдают интенсивное выделение пузырьков газов — азота и оксида углерода (IV). Последний обнаруживают по помутнению баритовой воды. 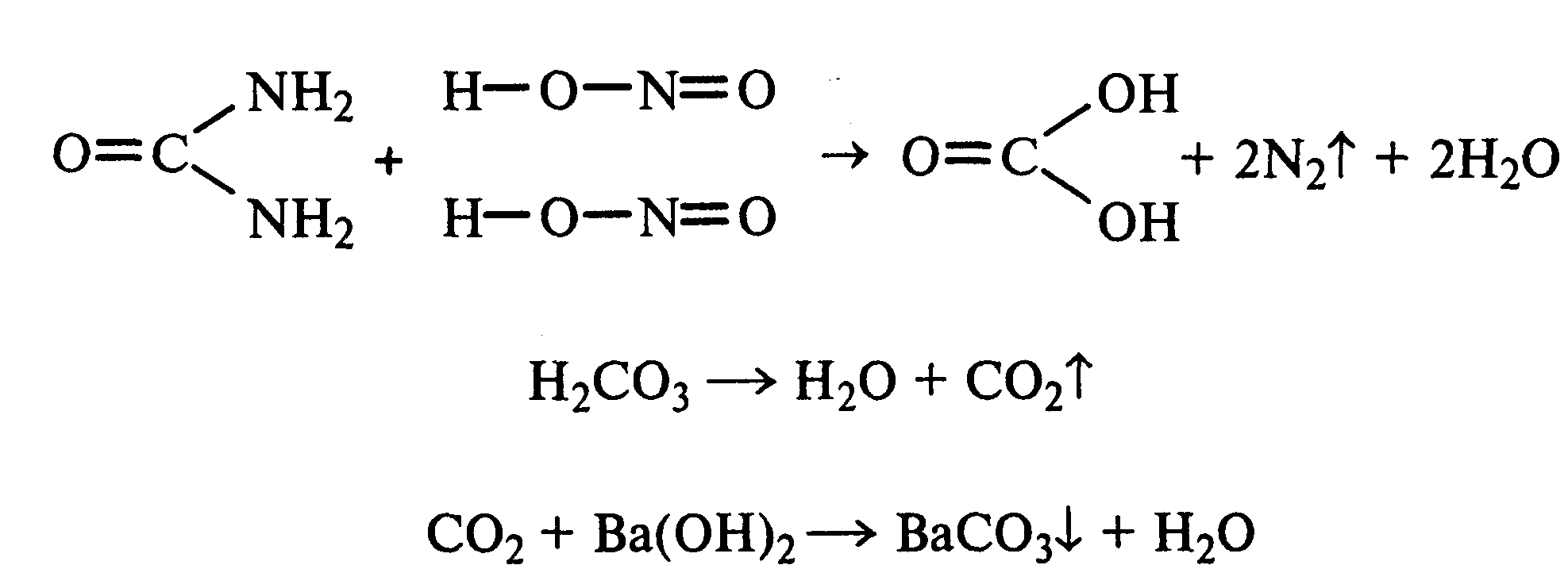 Эта реакция подобна реакции с азотистой кислотой первичных аминов алифатического ряда и аминокислот. Ее также используют для количественного определения мочевины по методу Ван-Сляйка (масса мочевины рассчитывается по объему выделившегося азота). 13.4. Разложение мочевины гипобромитом натрия (тяга). Для приготовления раствора гипобромита натрия в пробирку наливают 1—2 мл концентрированного раствора гидроксида натрия и при охлаждении добавляют 3—4 капли брома. Смесь встряхивают до растворения брома и исчезновения его окраски. К 1 мл 20%-ного раствора мочевины добавляют по каплям раствор гипобромита натрия. В пробирке наблюдают бурное выделение азота и оксида углерода (IV): 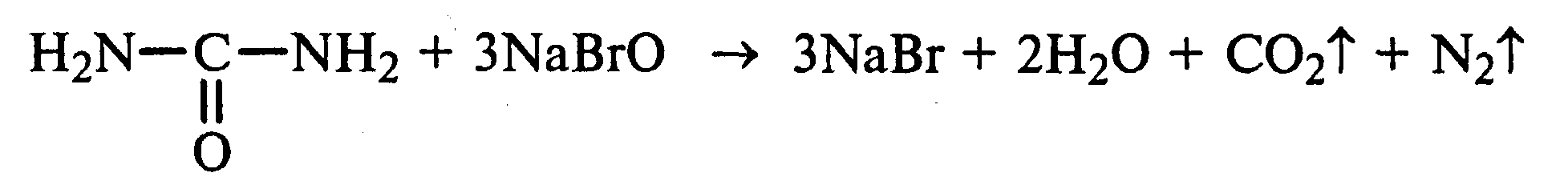 Эта реакция лежит в основе количественного определения мочевины по методу Бородина (массу мочевины рассчитывают по объему выделившегося азота). 13.5. Образование биурета. В сухую пробирку насыпают 0,2 г мочевины и нагревают ее в пламени горелки. Мочевина сначала плавится, а потом при дальнейшем нагревании разлагается с выделением аммиака, который обнаруживают по посинению влажной красной лакмусовой бумажки, поднесенной к отверстию пробирки, и по запаху. Через некоторое время плав в пробирке затвердевает, несмотря на продолжающееся нагревание: 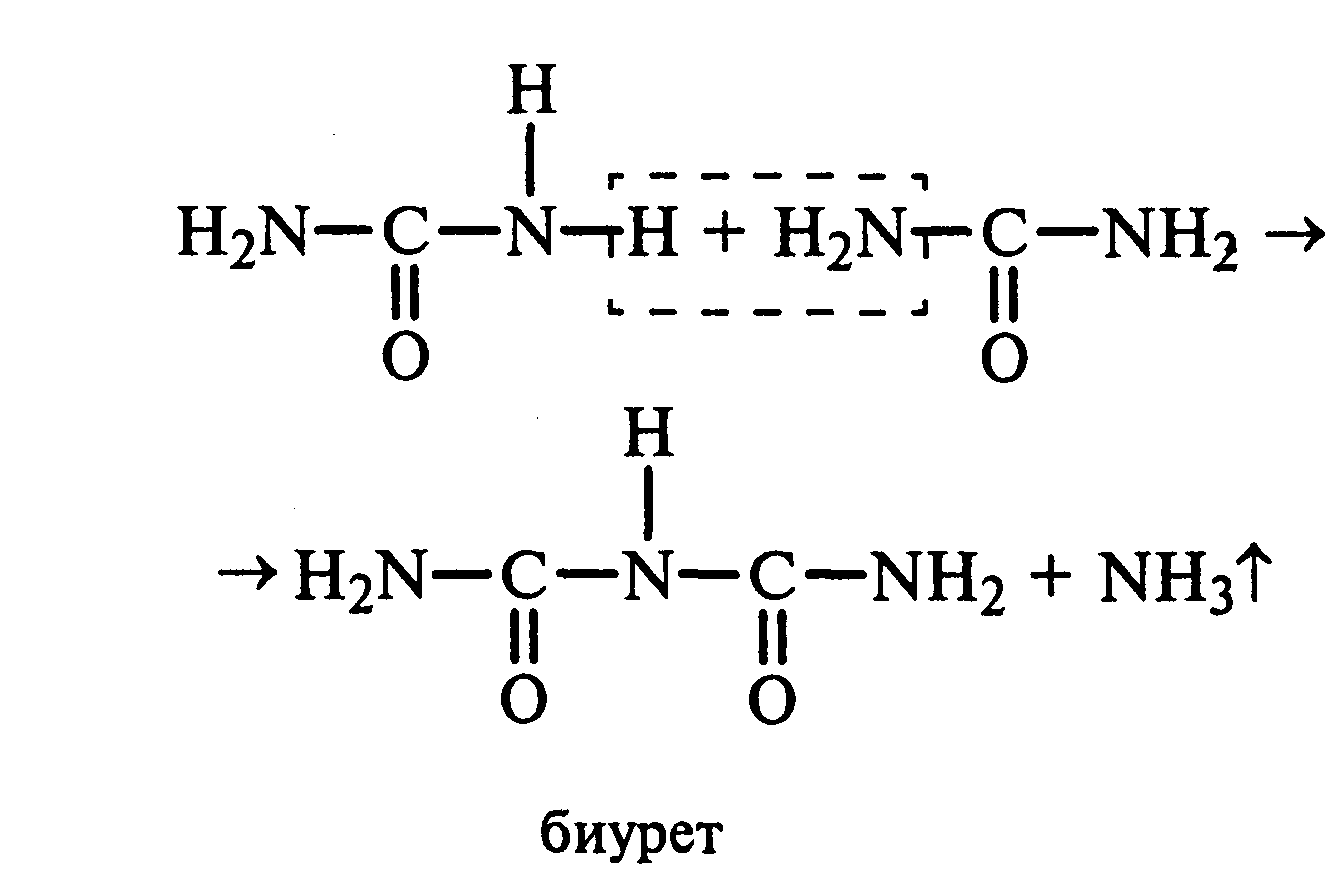 Пробирку охлаждают, добавляют в нее 2 мл воды и при слабом нагревании растворяют полученный биурет. Когда осадок отстоится, сливают с него раствор биурета и добавляют несколько капель 10%-ного раствора гидроксида натрия и 1—2 капли 1%-ного раствора сульфата меди. Раствор окрашивается в розово-фиолетовый цвет вследствие образования комплексной медной соли биурета. Схема таутомерных превращений биурета: 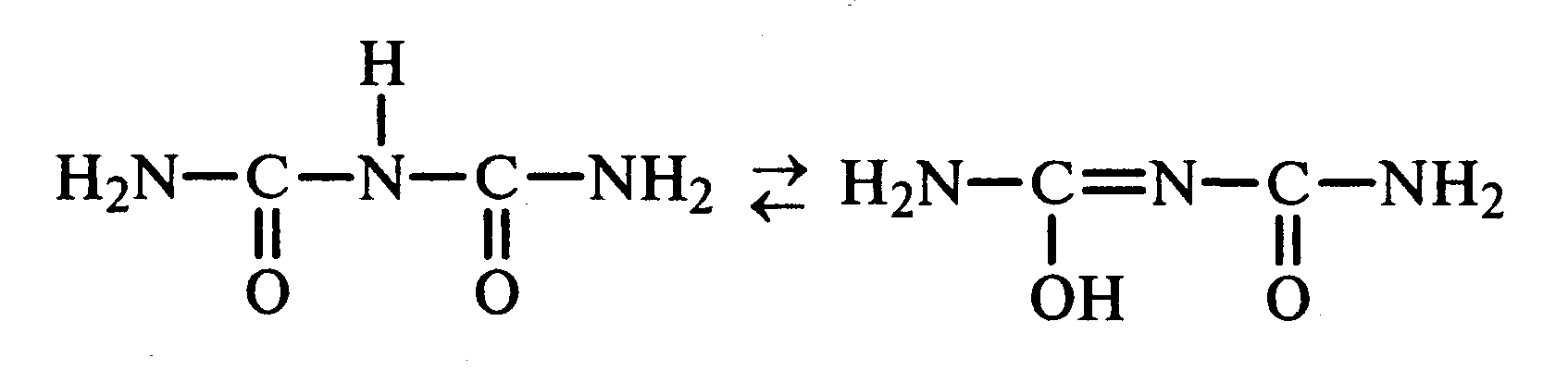 Уравнение реакции биурета с гидроксидом меди (II): 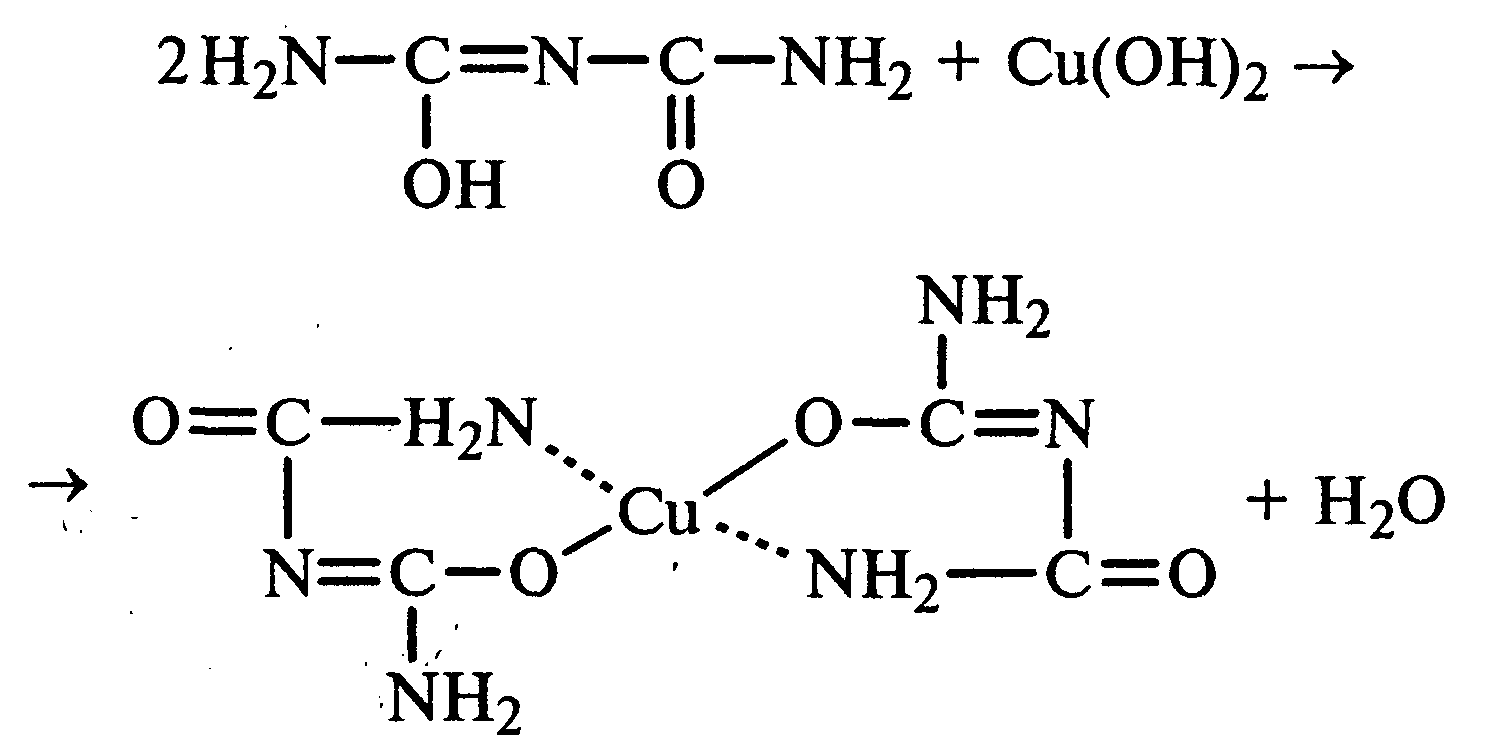 комплексная медная соль биурета. Эта реакция называется биуретовой. Она также является цветной реакцией на пептиды и белки.
Опыт14. Растворимость анилина и его солей в воде. Основные свойства анилина Реактивы и оборудование: анилин, концентрированная соляная кислота, 10%-ный раствор серной кислоты, раствор гидроксида натрия, синяя и красная лакмусовая бумага; пробирки. К 5—6 каплям анилина приливают 2—3 мл воды. После тщательного перемешивания получают мутную жидкость — эмульсию анилина в воде. Анилин плохо растворяется в воде, поэтому иногда его называют анилиновым маслом. В полученную эмульсию опускают красную, а затем синюю лакмусовые бумажки. Изменение цвета индикаторов не наблюдается. Кислотно-основные свойства анилина выражены слабо. Однако основные свойства анилина четко проявляются в его способности образовывать соли с минеральными кислотами. Эмульсию анилина разливают в две пробирки. К одной части по каплям при встряхивании добавляют концентрированную соляную кислоту. Постепенно происходит просветление мутной жидкости вследствие образования легко растворимой в воде соли — хлорида фениламмония: В пробирку с полученной солью приливают раствор гидроксида натрия. Наблюдают помутнение жидкости вследствие выделения анилина: Во вторую пробирку с эмульсией анилина прибавляют по каплям 10%-ный раствор серной кислоты. После ее встряхивания и охлаждения наблюдают выпадение белого осадка трудно растворимого в воде гидросульфата фениламмония: При добавлении раствора гидроксида натрия осадок растворяется, и жидкость мутнеет. Опыт 15. Взаимодействие анилина с бромной водой Реактивы и оборудование: анилин, насыщенная бромная вода; пробирки. В пробирку наливают 2—3 мл воды, добавляют 1—2 капли анилина и тщательно перемешивают. К полученной эмульсии по каплям при перемешивании прибавляют бромную воду. Выпадает белый осадок триброманилина: 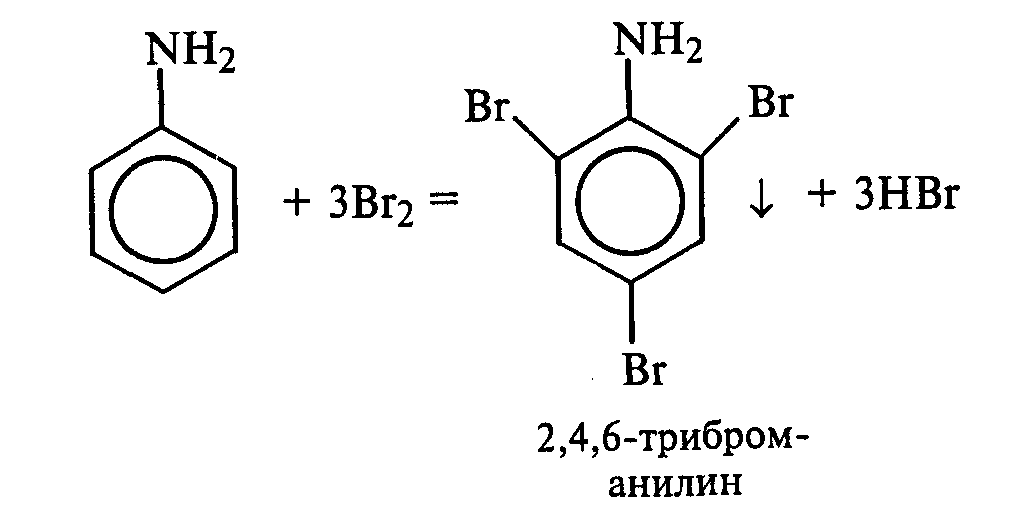 Аминогруппа — это электронодонорная группа, она увеличивает электронную плотность в бензольном кольце, поэтому реакции электрофильного замещения идут очень легко и без катализатора. Рассмотрите механизм монобромирования анилина и объясните влияние аминогруппы с точки зрения статического и динамического факторов. Опыт 16. Ацилирование анилина Реактивы и оборудование: анилин, уксусный ангидрид; пробирки. В пробирку наливают 0,5 мл анилина и 1,5 мл воды и энергично перемешивают. К полученной смеси добавляют 0,5 мл уксусного ангидрида. Пробирку закрывают пробкой и сильно встряхивают ют. Разогревшуюся пробирку охлаждают водой. Выпадает белый осадок ацетанилида: 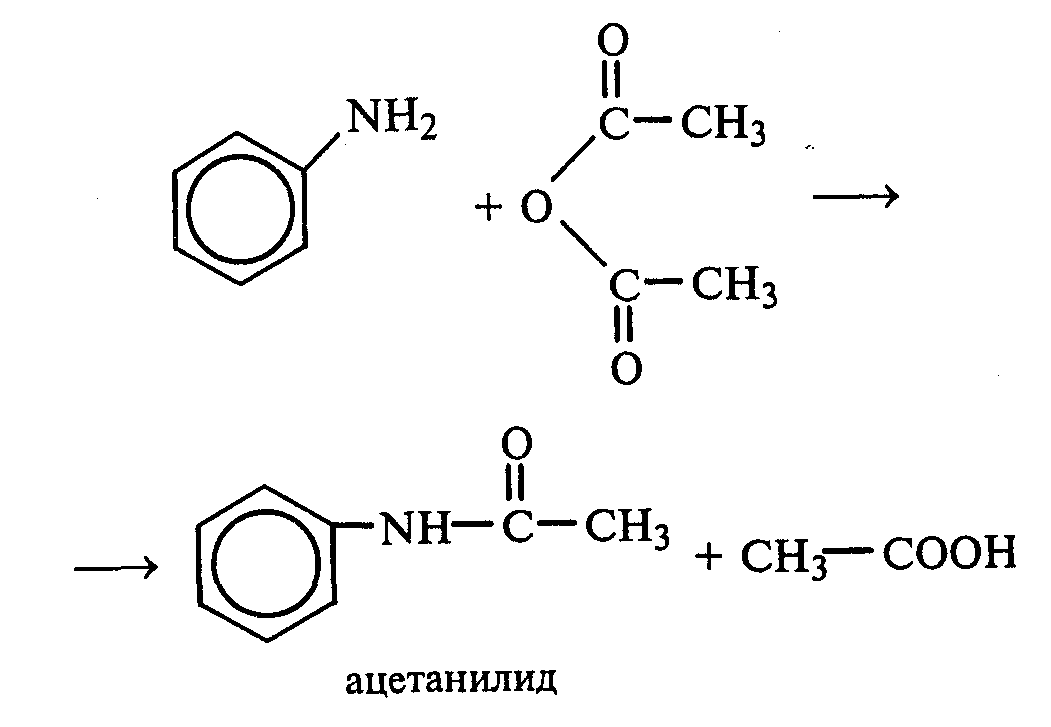 В медицине ацетанилид известен под названием антифебрин. Он применялся как средство от лихорадки и в настоящее время снят с производства ввиду его токсичности. Напишите механизм реакции ацилирования анилина. Опыт 17. Окисление анилина Реактивы и оборудование: анилин, хромовая смесь; пробирки. В пробирку наливают 1 мл воды и 2—3 капли анилина, тщательно перемешивают и добавляют 1—2 мл хромовой смеси (раствор дихромата калия в разбавленной серной кислоте). Окраска раствора меняется от оранжевой до зеленой, а затем наблюдается почернение реакционной смеси. Конечным продуктом окисления анилина является краситель сложного строения — «черный анилин», который используют для окрашивания тканей и получения красящего слоя копировальной бумаги. 2.5. ДИАЗО- И АЗОСОЕДИНЕНИЯ Опыт 18. Реакция диазотирования анилина (получение соли диазония) Реактивы и оборудование: анилин, концентрированная серная кислота, 30%-ный раствор нитрита натрия (свежеприготовленный), иодкрахмальная бумага; плоскодонные колбы на 50 мл, кристаллизаторы, лед. В небольшую плоскодонную колбу вносят около 10 мл воды со льдом, приливают 2 мл анилина и перемешивают. Колбу ставят в кристаллизатор со льдом, приливают 3 мл концентрированной серной кислоты и снова перемешивают. Выпадает белый осадок гидросульфата фениламмония. К реакционной смеси по каплям при перемешивании и охлаждении добавляют 5 мл 30%-ного раствора нитрита натрия (свежеприготовленного). По мере образования соли диазония (гидросульфата фенилдиазония) осадок соли анилина растворяется, и жидкость становится прозрачной: 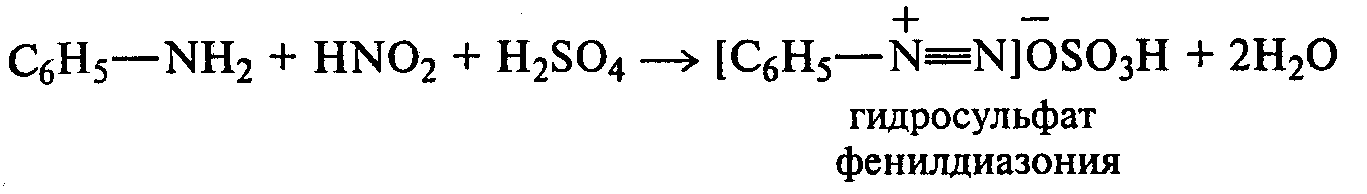 Окончание реакции диазотирования устанавливают по наличию в растворе избытка азотистой кислоты с помощью иодкрахмальной бумаги. Посинение индикатора свидетельствует об окончании реакции диазотирования: 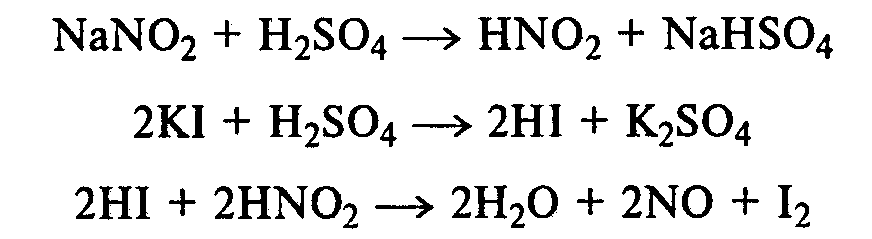 Иодид калия, содержащийся в иодкрахмальной бумаге, реагирует с серной кислотой с образованием иодоводорода. В результате взаимодействия последнего с азотистой кислотой выделяется свободный иод, который с крахмалом образует окрашенные в синий цвет «комплексы включения». Если иодкрахмальная бумага не синеет, то в реакционную смесь добавляют раствор нитрита натрия. Напишите механизм реакции диазотирования анилина и объясните, почему эта реакция идет при низких положительных температурах и в кислой среде. Соль фенилдиазония оставляют на холоду для использования в следующих опытах. Опыт 19. Разложение соли диазония (реакция с выделением азота) Реактивы и оборудование: раствор соли фенилдиазония, бромная вода; водяные бани, изогнутые газоотводные трубки, стаканы на 100 мл, пробирки. |
