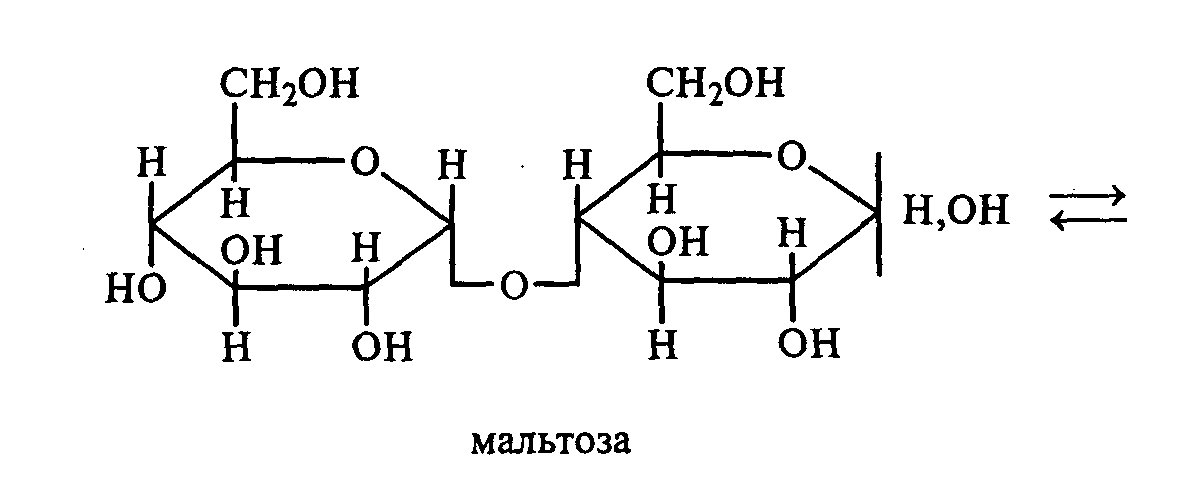
Лабораторные органическая химия. Лабораторная работа 1 окси, оксокислоты гидроксикарбоновые кислоты опы Свойства молочной кислоты
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
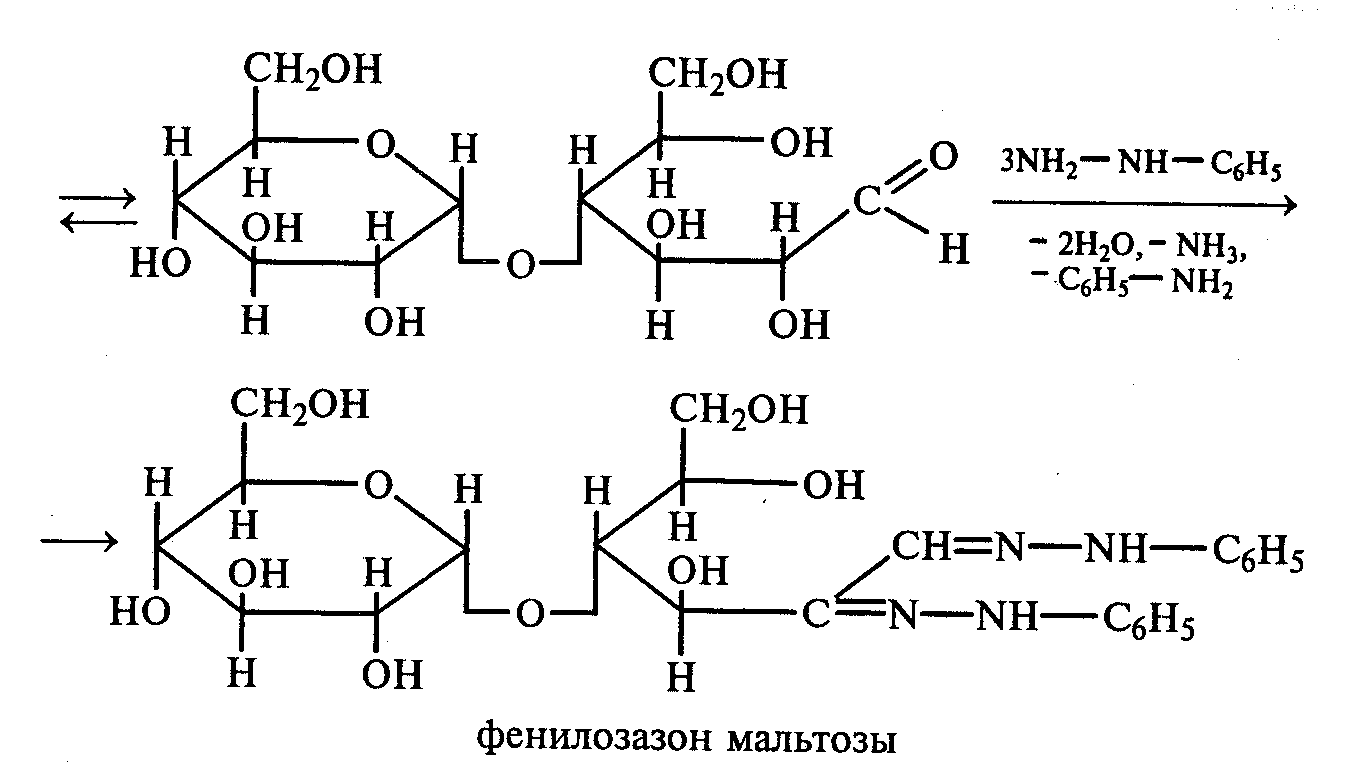
3.2. ДИСАХАРИДЫ Опыт 27. Реакции на гидроксильные группы дисахаридов Реактивы и оборудование: 1%-ный раствор сахарозы, 1%-ный раствор мальтозы (или лактозы), мальтоза (безводная), 10%-ный раствор гидроксида натрия, 5%-ный раствор сульфата меди (II), ацетат натрия (безводный), уксусный ангидрид; химические стаканы на 50 мл, лед, пробирки. 27.1. Реакция дисахаридов с гидроксидом меди (II) в щелочной среде. В одну пробирку наливают 1 мл 1%-ного раствора сахарозы, а в другую — 1 мл 1%-ного раствора мальтозы (или лактозы). В каждую из них добавляют по 1 мл 10%-ного раствора гидроксида натрия. Растворы перемешивают, и в обе пробирки по каплям добавляют 5%-ный раствор сульфата меди (II). В обеих пробирках образуется бледно-голубой осадок гидроксида меди (II), который после встряхивания растворяется, и растворы приобретают светло-синюю окраску вследствие образования комплексных сахаратов меди (II): 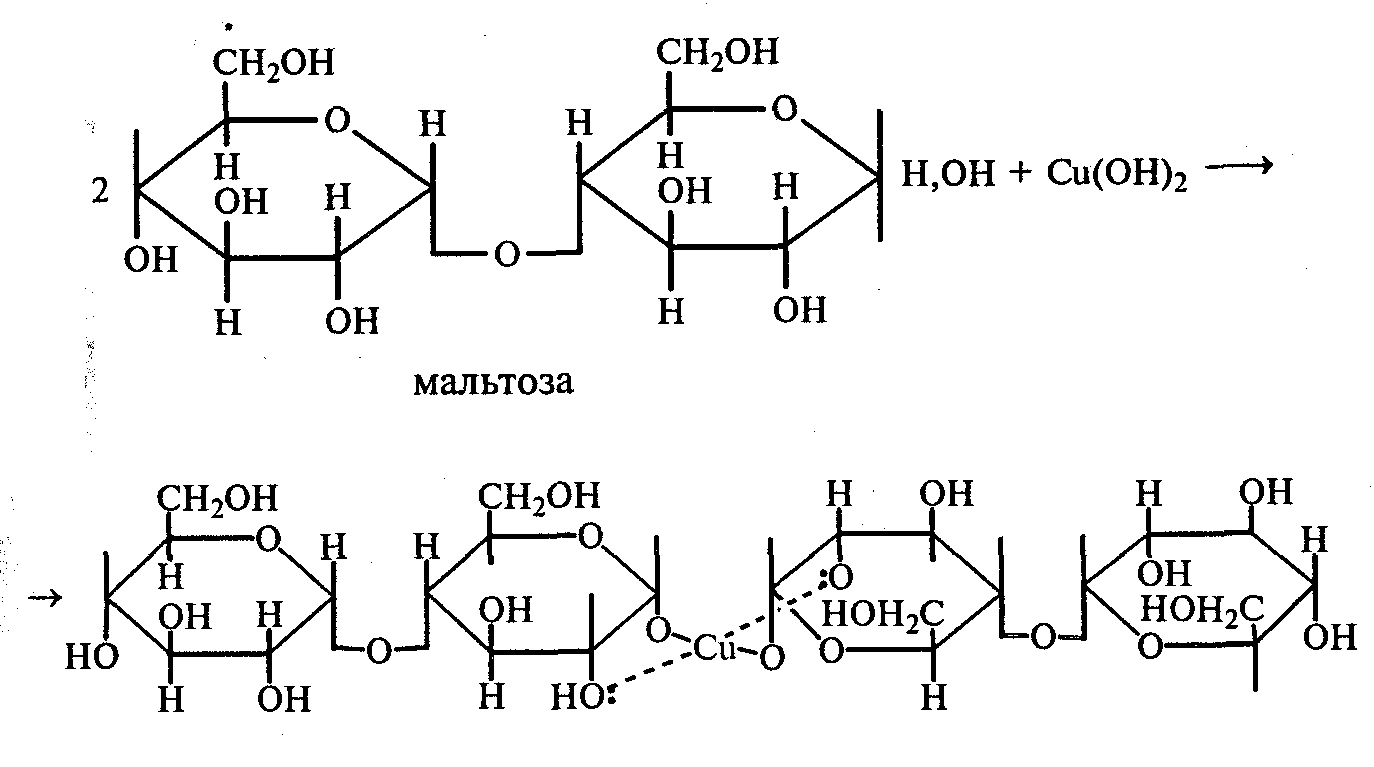 27.2. Ацилирование дисахаридов (тяга). В сухой пробирке смешивают 0,5 г безводной лактозы и 0,5 г безводного ацетата натрия. К полученной смеси приливают 2,5 мл уксусного ангидрида, содержимое пробирки перемешивают и нагревают 5 мин при непрерывном встряхивании. Реакционную смесь охлаждают на воздухе и выливают в стакан с водой и льдом при тщательном перемешивании: 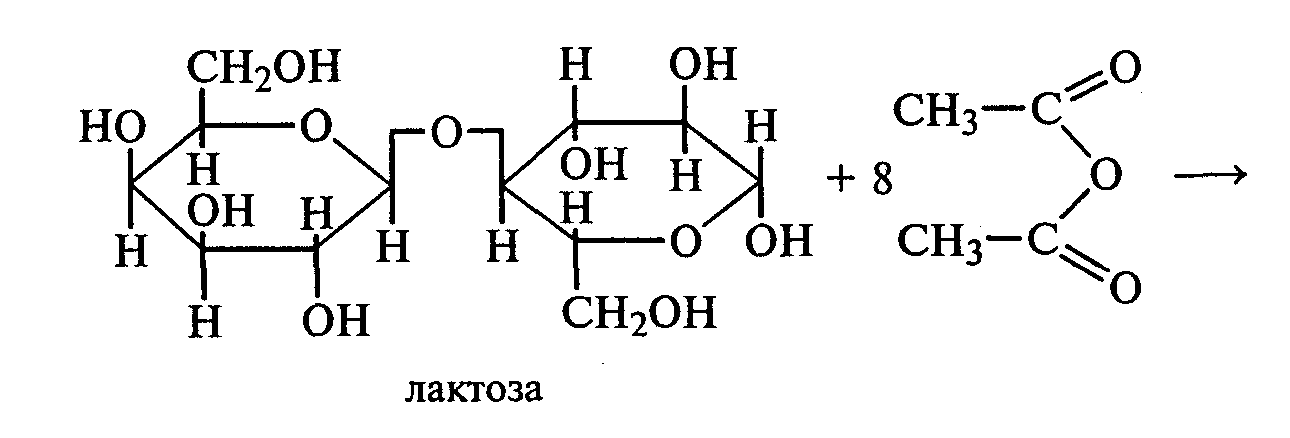 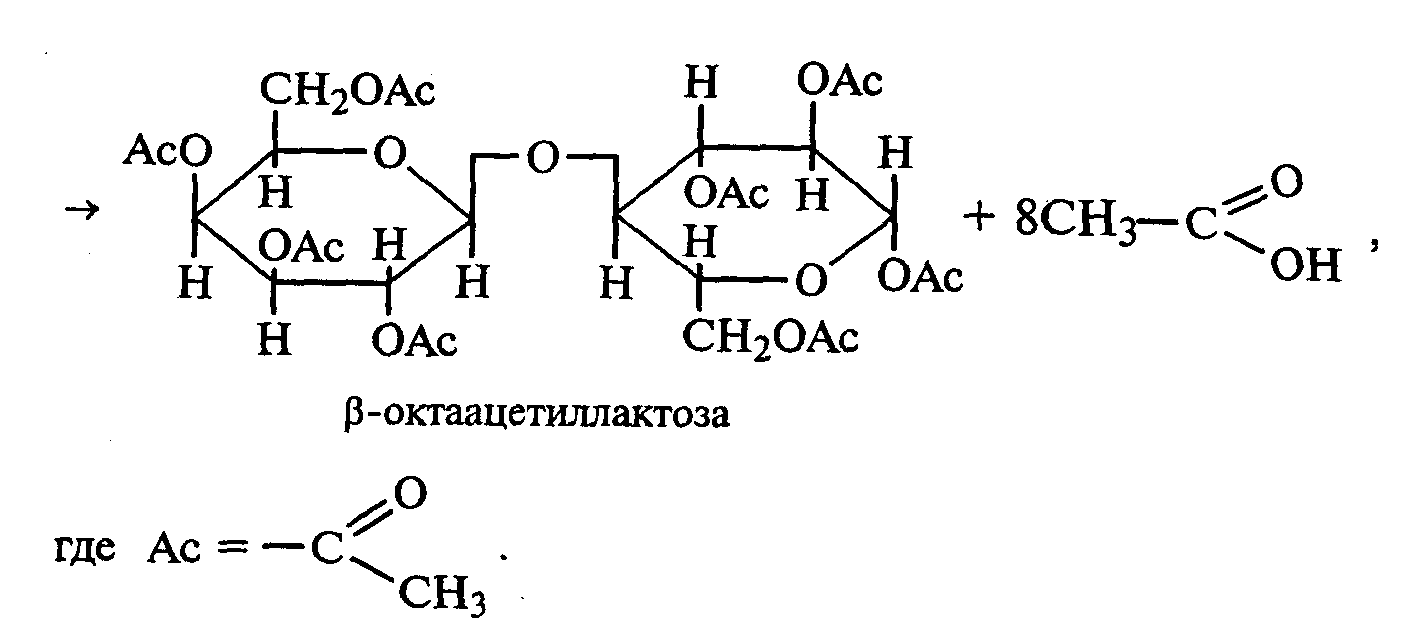 По какому механизму идет эта реакция? Опыт 28. Реакции дисахаридов по карбонильной группе. Сравнение свойств восстанавливающих и невосстанавливающих дисахаридов Реактивы и оборудование: 1%-ный раствор мальтозы, 1%-ный раствор лактозы, 1%-ный раствор сахарозы, реактив Фелинга, солянокислый фенилгидразин, ацетат натрия; водяные бани, химические стаканы на 100 мл, лед, предметные и покровные стекла, микроскоп, пробирки. 28.1. Окисление дисахаридов реактивом Фелинга. В три пробирки наливают по 1,5 мл 1%-ных растворов мальтозы, лактозы и сахарозы. В каждую пробирку добавляют по 1,5 мл реактива Фелинга, жидкости перемешивают и нагревают верхнюю часть растворов на газовой горелке до начинающегося кипения. В пробирках с мальтозой и лактозой появляются оранжево-красные осадки оксида меди (I). Схема реакции окисления мальтозы реактивом Фелинга: 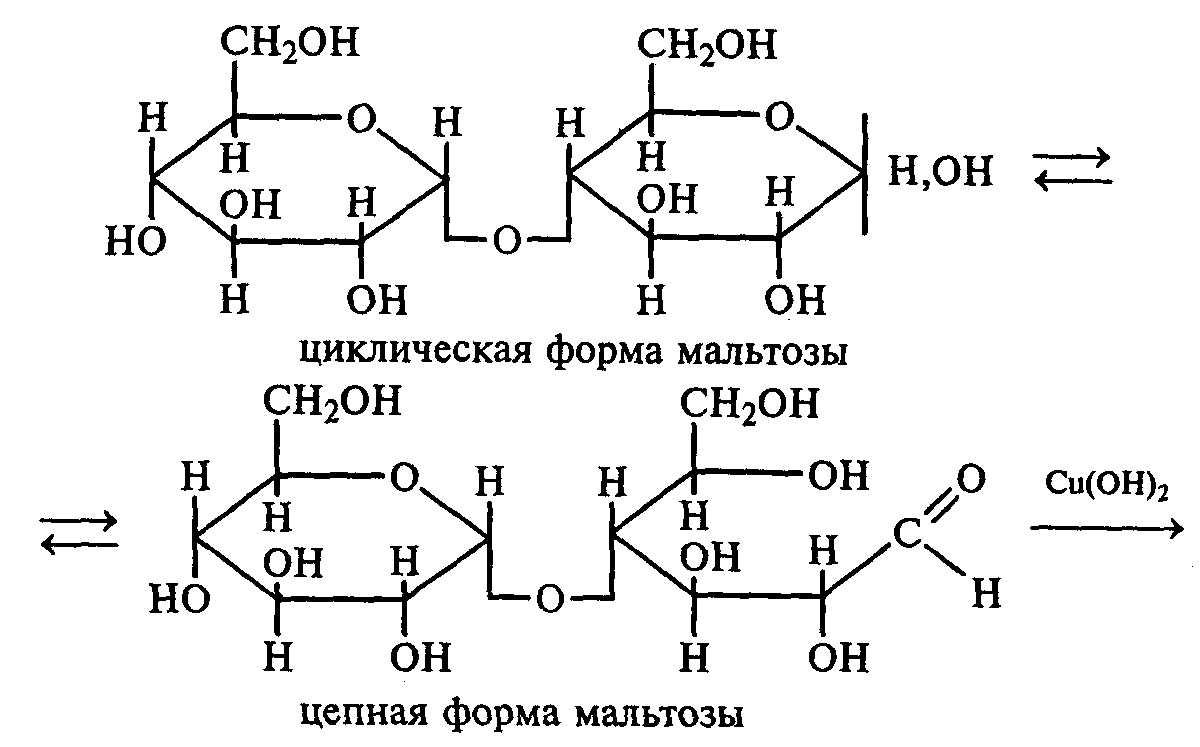 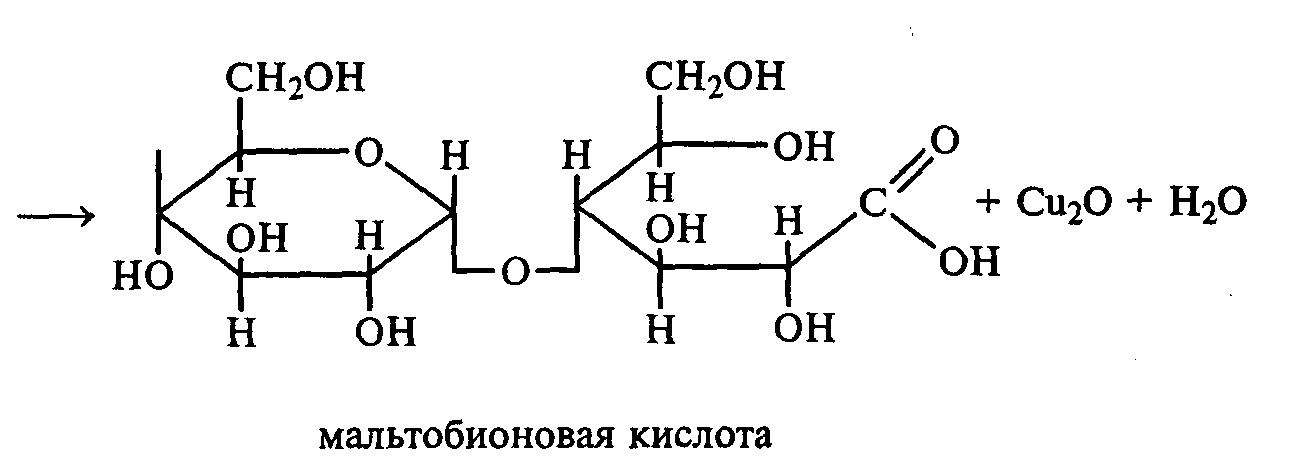 Положительную реакцию с фелинговой жидкостью дают восстанавливающие дисахариды (мальтоза и лактоза), в водных растворах которых вследствие таутомерных переходов имеются свободные альдегидные группы. Раствор, содержащий сахарозу, при нагревании до начинающегося кипения не изменяет своей окраски, так как сахароза относится к невосстанавливающим дисахаридам и не окисляется реактивом Фелинга. Следует помнить, что длительное кипячение раствора сахарозы в щелочной среде приводит к ее расщеплению, и продукты гидролиза могут восстанавливать реактив Фелинга до оксида меди (I). Напишите уравнение реакции окисления лактозы реактивом Фелинга. 28.2. Получение фенилозазонов мальтозы и лактозы. В две сухие пробирки помещают по 100 мг (на кончике шпателя) смеси солянокислого фенилгидразина и безводного ацетата натрия (1:3). Затем в одну пробирку добавляют 1 мл 1%-ного раствора мальтозы, а в другую — 1 мл 1%-ного раствора лактозы при тщательном перемешивании. Пробирки помещают на кипящую водяную баню на 15—20 мин. При охлаждении на воздухе, а потом в стакане со льдом в реакционной смеси выпадают кристаллы фенилозазонов мальтозы и лактозы.
Напишите уравнение реакции образования фенилозазона лактозы. Кристаллы фенилозазонов мальтозы и лактозы рассматривают под микроскопом. Кристаллы озазона мальтозы имеют форму игл, частично образующих сферические скопления, а кристаллы фенилозазона лактозы — форму пластинок, образующих розетки. Зарисуйте кристаллы фенилозазонов мальтозы и лактозы в рабочий журнал. Опыт 29. Гидролиз (инверсия) сахарозы Реактивы и оборудование: 1%-ный раствор сахарозы, 10%-ный раствор серной кислоты, реактив Фелинга, реактив Селиванова, 10%-ный раствор гидроксида натрия, универсальная индикаторная бумага; пробирки. В пробирку наливают 3 мл 1%-ного раствора сахарозы и 1 мл 10%-ного раствора серной кислоты. Для равномерного кипения в реакционную смесь добавляют фарфоровые кипятильники. Содержимое пробирки кипятят 3—5 мин, а затем охлаждают. При кипячении раствора сахарозы в кислой среде происходит ее гидролитическое расщепление: 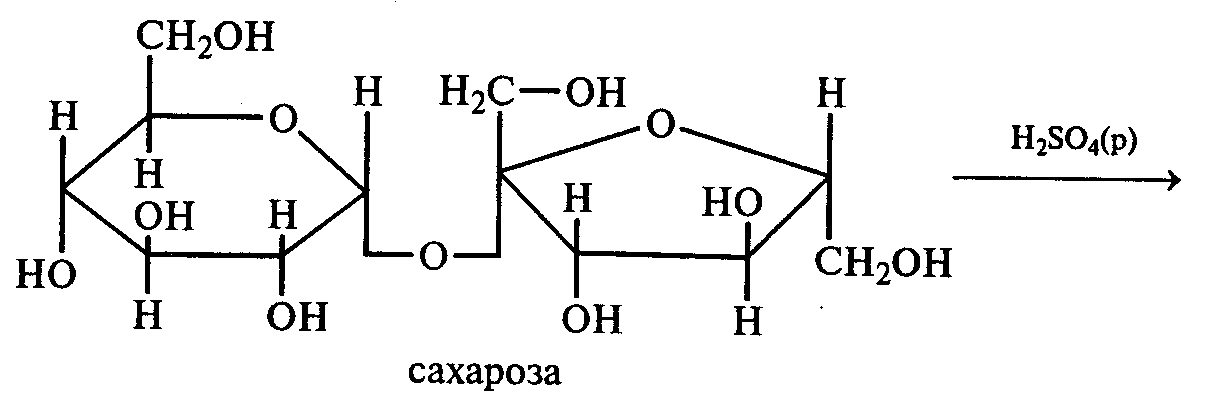 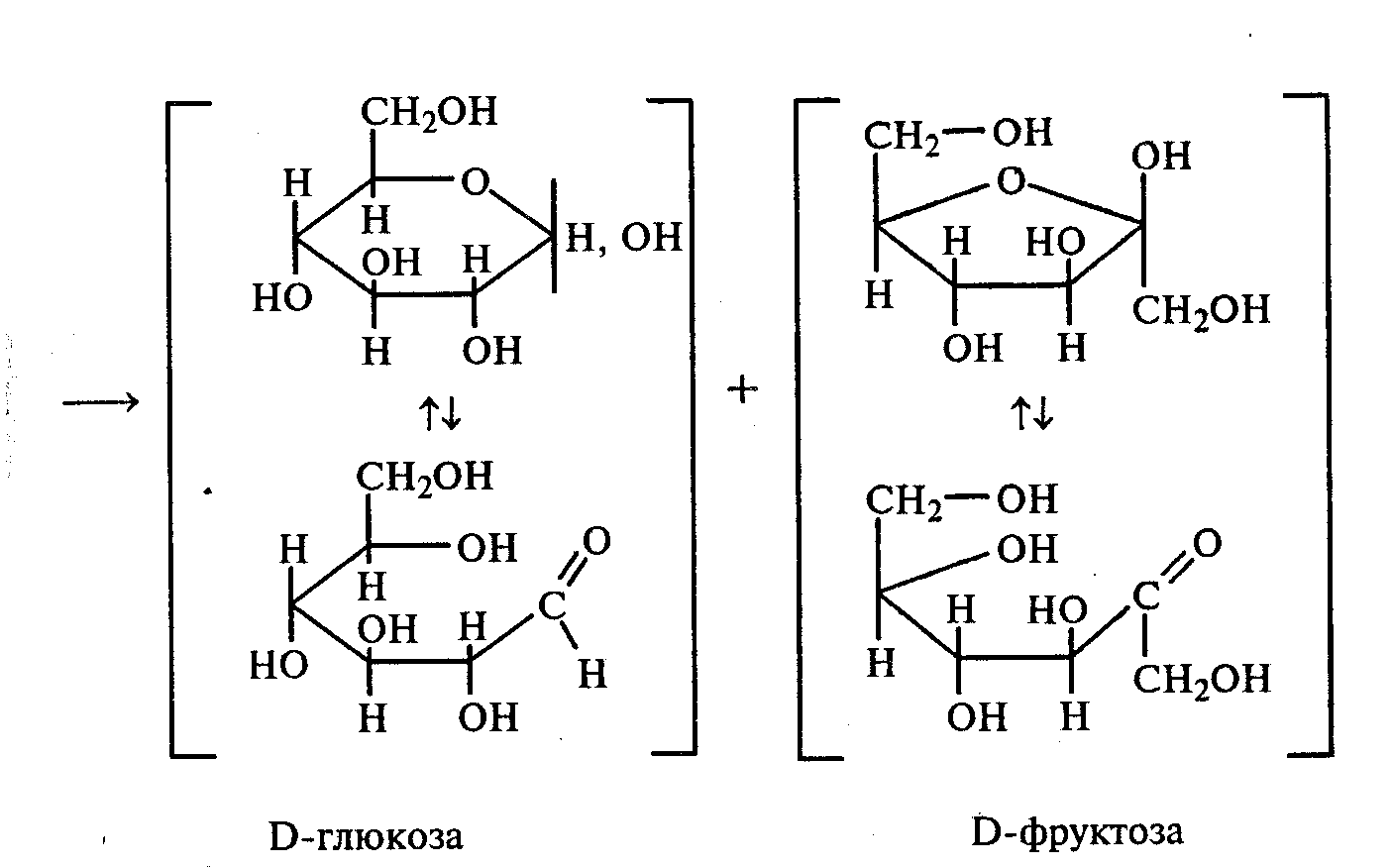 Для доказательства гидролитического расщепления сахарозы необходимо провести реакции, подтверждающие наличие в содержимом пробирки продуктов гидролиза. Для этого содержимое пробирки делят на две части. Первую часть раствора нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге), а затем добавляют равный объем реактива Фелинга и нагревают верхнюю часть жидкости. Наблюдают образование красного осадка оксида меди (I). Для сравнения нагревают смесь исходного раствора сахарозы с равным объемом реактива Фелинга. Окраска раствора не изменяется. Этот опыт показывает, что в результате гидролиза сахарозы, не способной восстанавливать реактив Фелинга, образуется смесь моносахаридов, окисляющихся фелинговой жидкостью. Со второй частью гидролизата проводят реакцию Селиванова на наличие фруктозы, входящей в состав сахарозы (см. опыт 26.1). Опыт 30. Реакция сахарозы с сульфатами кобальта и никеля Реактивы и оборудование: 10%-ный раствор сахарозы, 5%-ный раствор сульфата кобальта, 5%-ный раствор сульфата никеля, 5%-ный раствор гидроксида натрия; пробирки. В две пробирки наливают по 2 мл 10%-ного раствора сахарозы и по 0,5 мл 5%-ного раствора гидроксида натрия. В одну из пробирок добавляют несколько капель 5%-ного раствора сульфата кобальта, а в другую — несколько капель 5%-ного раствора сульфата никеля. В пробирке с сульфатом кобальта развивается фиолетовое окрашивание, а в пробирке с сульфатом никеля — зеленое. 3.3. ВЫСШИЕ ПОЛИСАХАРИДЫ Опыт 31. Отношение полисахаридов к реактиву Фелинга Реактивы и оборудование: 1%-ный раствор крахмала, 1%-ный раствор гликогена, реактив Фелинга, пробирки. В две пробирки наливают по 1 мл 1%-ных растворов полисаха-Ридов: в первую — крахмала, во вторую — гликогена. Затем добавляют равный объем реактива Фелинга. Жидкости тщательно перемешивают и нагревают верхнюю часть растворов до начинающегося кипения. Цвет растворов не изменяется. Молекулы полисахаридов содержат в своем составе большое число соединенных друг с другом при помощи гликозидных связей остатков моносахаридов. Молекулы крахмала (амилоза и амилопектин) содержат в среднем от 1000 до 300000 остатков D-глюкозы, в гликогене число остатков D-глюкозы доходит до нескольких миллионов. Однако в макромолекулах амилозы и амилопектина содержится всего по одному свободному гликозидному гидроксилу, который в растворе может дать альдегидную группу, поэтому концентрация альдегидных групп в растворе настолько мала, что крахмал не восстанавливает реактив Фелинга. В молекулах гликогена общее число глюкозных остатков выше, чем в молекулах амилопектина, поэтому он, как и крахмал, не обладает восстанавливающими свойствами. Опыт 32. Взаимодействие крахмала и гликогена с иодом Реактивы и оборудование: 1%-ный раствор крахмала, 1%-ный раствор гликогена, сильно разбавленный раствор иода в иодиде калия; пробирки. В две пробирки наливают по 1 мл 1%-ного раствора крахмала и 1%-ного раствора гликогена и добавляют в каждую по несколько капель сильно разбавленного раствора иода в иодиде калия. В пробирке с раствором крахмала развивается интенсивное синее окрашивание. При нагревании этого раствора до кипения синяя окраска исчезает, а при охлаждении появляется вновь. Гликоген с раствором иода дает красно-бурое окрашивание. Реакция крахмала и гликогена с иодом представляет собой сложный процесс. Синюю окраску с иодом дает амилоза — одна из фракций крахмала. Амилоза — полисахарид линейного строения, состоящий из остатков а, D-глюкопиранозы. Ее молекулы имеют структуру спирали, внутри которой есть свободный канал диаметром около 5 мкм, в него внедряются молекулы иода, образуя окрашенные комплексы («соединения включения») за счет взаимодействия с гидроксильными группами моносахаридных остатков. При нагревании молекулы амилозы теряют свою спиралевидную структуру, и окрашенные комплексы разрушаются, при охлаждении спиралевидная структура амилозы и, следовательно, окрашенные комплексы восстанавливаются. Для полисахаридов с разветвленными цепями (амилопектин и гликоген) наряду с процессами образования комплексов большое значение имеет процесс адсорбции иода на поверхности боковых цепей. Если боковые цепи в молекуле гликогена короткие, то развивается бурая окраска, если они длинные, то темно-красная. Опыт 33. Гидролиз крахмала Реактивы и оборудование: 1%-ный раствор крахмала, 10%-ный раствор серной кислоты, разбавленный раствор иода в иодиде калия (раствор Люголя), 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; конические колбы на 100 мл, пипетки, мерные цилиндры на 50 и 10 мл, пробирки. В коническую колбу на 100 мл вносят 20—30 мл 1%-ного раствора крахмала и 5—7 мл 10%-ного раствора серной кислоты. В 8 пробирок наливают по 1 мл очень разбавленного раствора иода в иодиде калия (светло-желтого цвета), пробирки ставят в штатив. В первую пробирку вносят 1 каплю подготовленного для опыта раствора крахмала. Отмечают образовавшуюся окраску. Затем колбу с реакционной смесью нагревают на асбестовой сетке над небольшим пламенем. Через каждые 2—3 мин отбирают пипеткой пробы раствора и вносят в пробирки с раствором Люголя. Отмечают постепенное изменение окраски растворов при реакции с иодом. Вначале окраска раствора будет интенсивно синей, затем фиолетовой (амилодекстрины), далее — от красно-бурой (эритродекстрины) до оранжево-желтой и, наконец, желтой (в дальнейшем эта окраска изменяться не будет). Декстрины расщепляются до дисахарида мальтозы, которая гидролизуется с образованием конечного продукта — D-глюкозы. Схема гидролиза крахмала: 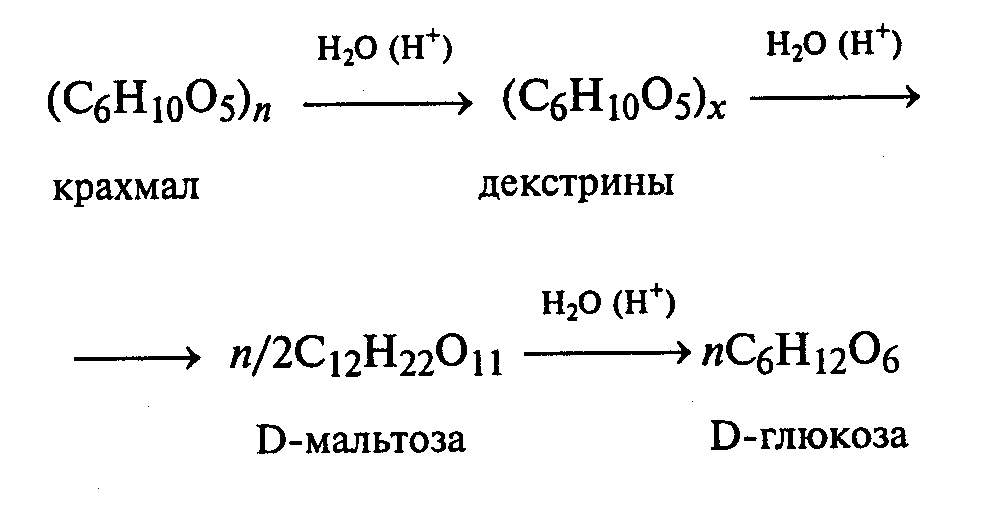 После того как реакционная смесь перестанет давать окраску с иодом, ее кипятят еще несколько минут, охлаждают и нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге). Отливают в пробирку 1—2 мл гидролизата и добавляют равный объем реактива Фелинга. Верхнюю часть жидкости нагревают на пламени горелки до начинающегося кипения. Выпадает красный осадок оксида меди (I), что свидетельствует о наличии в растворе продуктов глубокого гидролиза крахмала — глюкозы и мальтозы. Напишите уравнения реакций окисления продуктов гидролиза крахмала фелинговой жидкостью. Опыт 34. Кислотный гидролиз клетчатки Реактивы и оборудование: концентрированная серная кислота, 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; мелко нарезанная фильтровальная бумага, стеклянные палочки, водяные бани, пробирки. В сухую пробирку помещают несколько мелко нарезанных кусочков фильтровальной бумаги и приливают 1 мл концентрированной серной кислоты. Содержимое пробирки тщательно перемешивают стеклянной палочкой до полного разрушения бумаги и образования бесцветного вязкого раствора. После этого к нему осторожно при перемешивании по каплям добавляют 1 мл дистиллированной воды. Пробирку ставят на кипящую водяную баню. Смесь нагревают 10—15 мин при регулярном перемешивании. После охлаждения жидкость нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге) и проводят с ней реакцию с фелинговой жидкостью (см. опыт 55.3) для обнаружения в продуктах гидролиза восстанавливающих Сахаров. Напишите уравнение реакции гидролиза целлюлозы и объясните опыт. Лабораторная работа №4
Опыт 35. Получение фурфурола и его свойства Реактивы и оборудование: древесные опилки, разбавленная (1:1) соляная кислота, анилин, уксусная кислота, 1%-ный раствор нитрата серебра, 5%-ный раствор аммиака; обратные холодильники к пробиркам, изогнутые газоотводные трубки, фильтровальная бумага, водяные бани, пробирки. 35.1. Пробирку заполняют на 1/10 часть сухими опилками и добавляют разбавленную (1:1) соляную кислоту (кислота должна пропитать и покрыть опилки). Пробирку закрывают пробкой с обратным воздушным холодильником и нагревают на кипящей водяной бане 10 мин. Затем холодильник меняют на пробку с изогнутой газоотводной трубкой, пробирку закрепляют в лапке штатива и нагревают на газовой горелке. Отгоняют в пустую пробирку-приемник 1—2 мл жидкости. Фурфурол образуется из пентозанов, которые вместе с клетчаткой входят в состав древесины: 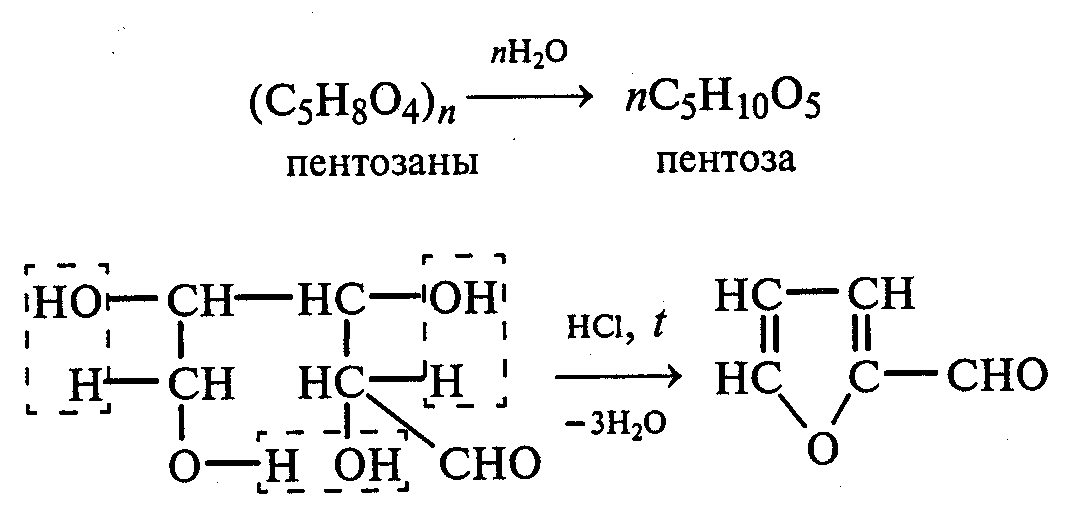 С полученным раствором фурфурола проводят некоторые реакции. 35.2. На полоску фильтровальной бумаги наносят каплю анилина. В это же место добавляют каплю уксусной кислоты, а затем раствора фурфурола. Появляется пятно, окрашенное в красный цвет. 35.3. В пробирку наливают 1 мл аммиачного раствора гидроксида серебра (см. опыт 22.1) и добавляют 1—2 капли раствора фурфурола. Раствор нагревают на горячей водяной бане. Выпадает черный осадок металлического серебра. Напишите уравнение реакции взаимодействия фурфурола с аммиачным раствором гидроксида серебра. Подберите коэффициенты методом электронного баланса. Опыт 36. Получение «белого» индиго и кубовое крашение Реактивы и оборудование: индиго, этанол, раствор гидросульфита натрия, 40%-ный раствор гидроксида натрия; пипетки, стеклянные палочки, кусочки белой хлопчатобумажной ткани. К нескольким крупинкам индиго добавляют несколько капель этанола и растирают стеклянной палочкой, затем приливают 1—2 мл теплой воды и перемешивают. К полученной суспензии добавляют раствор гидросульфита натрия и несколько капель 40%-ного раствора гидроксида натрия. Реакционную смесь нагревают на небольшом пламени. Раствор светлеет и становится желто-коричневым («белое» индиго). Если цвет раствора грязно-зеленый, то необходимо добавить еще немного гидросульфита натрия. Полоску белой хлопчатобумажной ткани смачивают водой, отжимают, а затем опускают в раствор «белого» индиго. Через несколько минут ткань вынимают, отжимают от избытка раствора и оставляют развешенной на воздухе. Постепенно «белое» индиго окисляется кислородом воздуха, и ткань окрашивается в синий цвет: 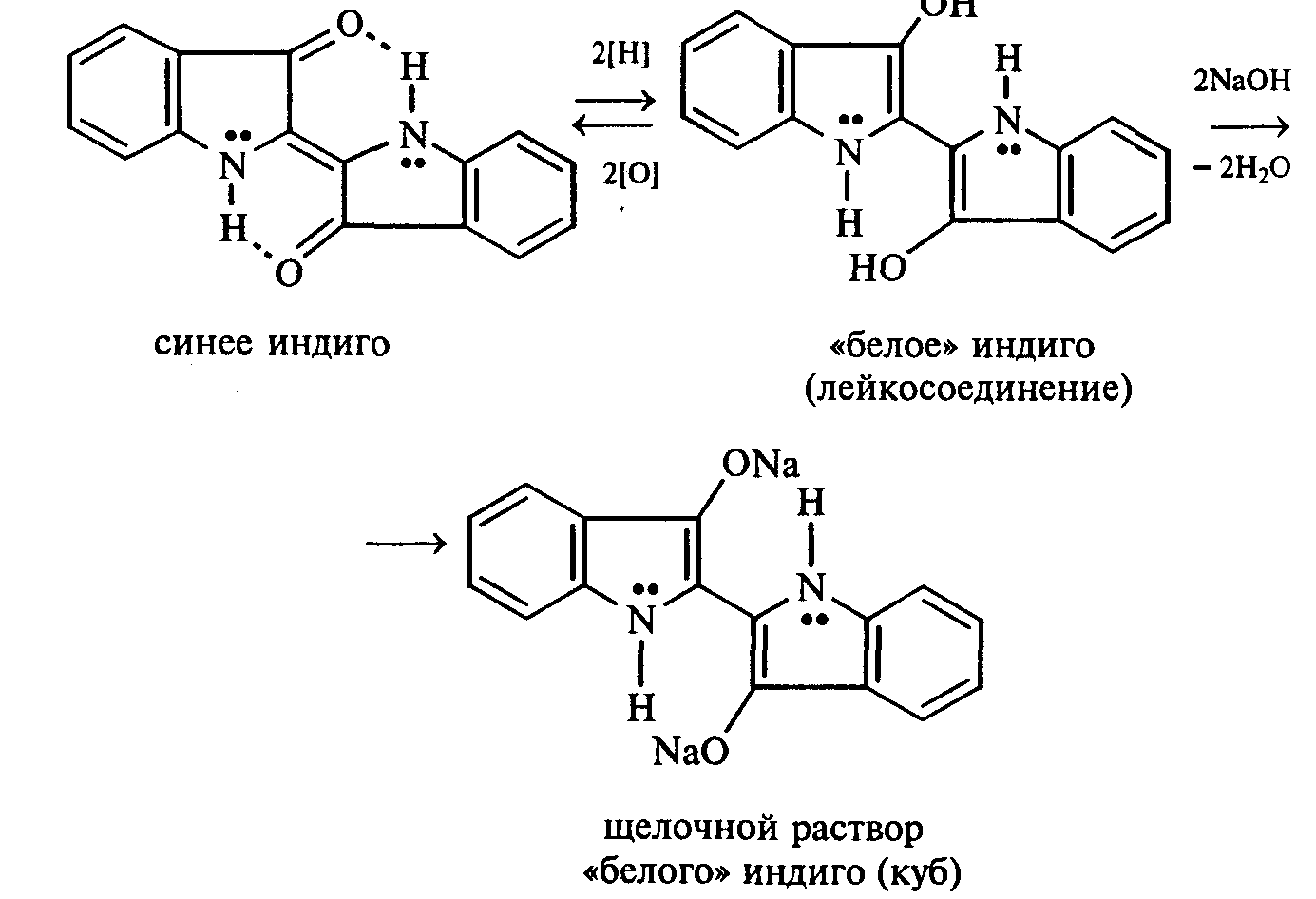 Опыт 37. Пиридин и его свойства Реактивы и оборудование: пиридин, 2%-ный раствор хлорида железа (III), 2%-ный раствор сульфата меди, насыщенный раствор пикриновой кислоты (свежеприготовленный), красная лакмусовая бумага; пробирки. 37 1. Растворимость пиридина в воде и его основные свойства. Пиридин быстро и в любых соотношениях растворяется в воде. К 1 мл пиридина приливают 5 мл воды. Каплю полученного раствора наносят на красную лакмусовую бумагу. Водный раствор пиридина проявляет слабые основные свойства: 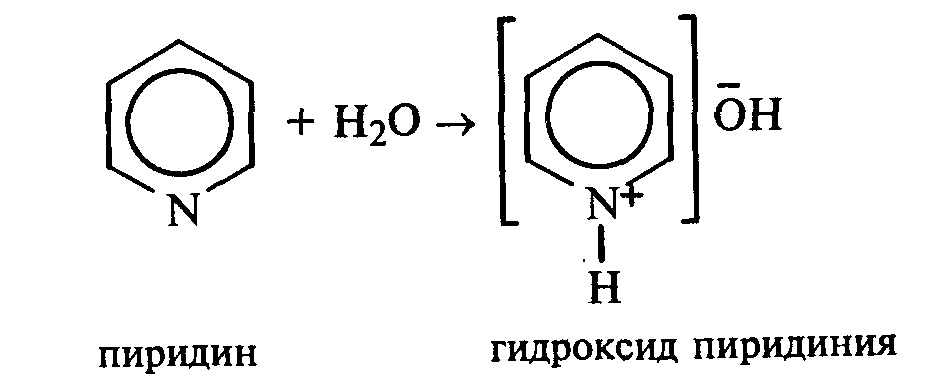 К капле пиридина осторожно прибавляют концентрированную соляную кислоту. Реакционная смесь сильно разогревается, и выпадает белый осадок. К полученному осадку приливают воду. Наблюдают его растворение. Напишите уравнение реакции пиридина с соляной кислотой. 37.2. Образование солей пиридина. В две пробирки наливают по 1мл 2%-ных растворов хлорида железа (III) и сульфата меди и добавляют по 1—2 капли раствора пиридина, полученного в предыдущем опыте. В пробирке с хлоридом железа (III) выпадает осадок бурого цвета: 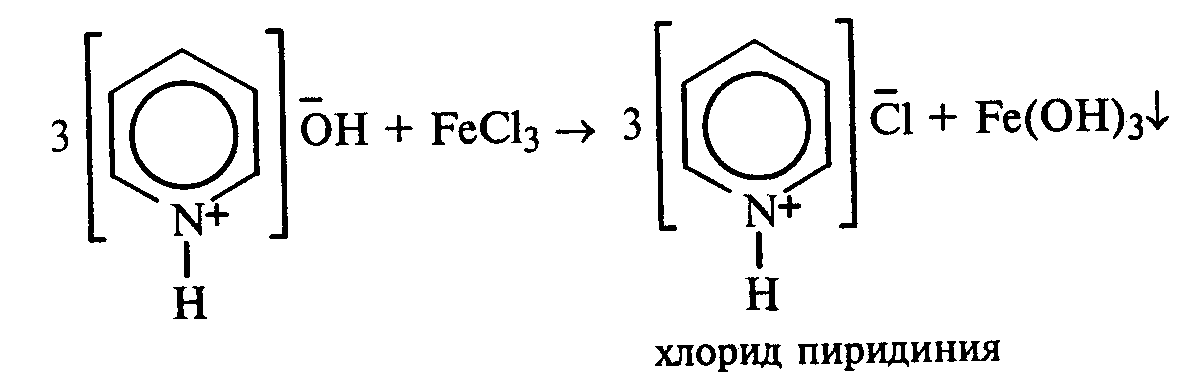 В пробирке с сульфатом меди сначала выпадает голубой осадок гидроксида меди (II): 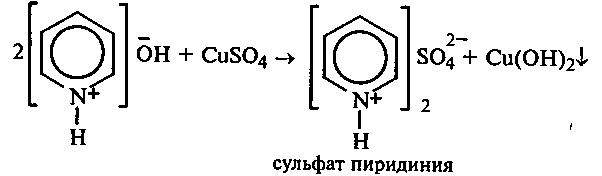 В избытке пиридина осадок гидроксида меди (II) быстро ра- створяется с образованием комплексной соли ярко-синего цвета. Опыт 38. Мочевая кислота Реактивы и оборудование: мочевая кислота, 10%-ный раствор гидро- ксида натрия, разбавленная соляная кислота, реактив Фелинга; про- бирки. 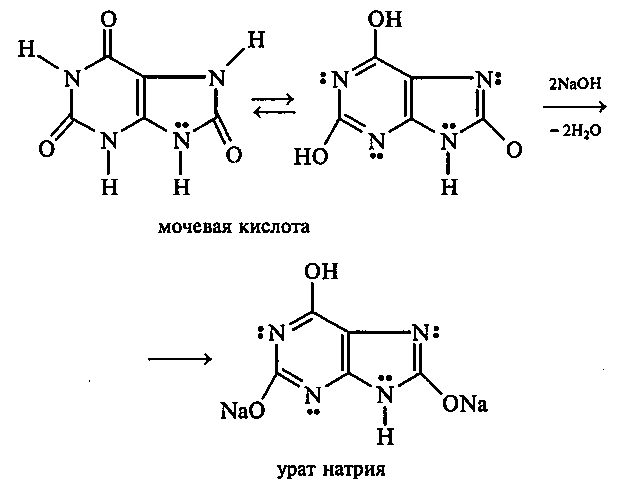 Несколько кристаллов мочевой кислоты растворяют в 1—2 мл воды. Смесь нагревают и отмечают, что даже при нагревании мо- чевая кислота плохо растворима в воде. После охлаждения про- бирки в нее приливают 10%-ный раствор гидроксида натрия до полного растворения мочевой кислоты. Образуется двузамещен- ная соль урат натрия. Необходимо отметить, что мочевая кислота реагирует только как двухосновная кислота: Полученный щелочной раствор урата натрия разливают на две пробирки. В первую пробирку по каплям добавляют разбавленную соляную кислоту. Сначала выпадают кристаллы малорастворимой соли — кислого урата натрия, а при дальнейшем подкислении раствора — малорастворимой в воде мочевой кислоты: 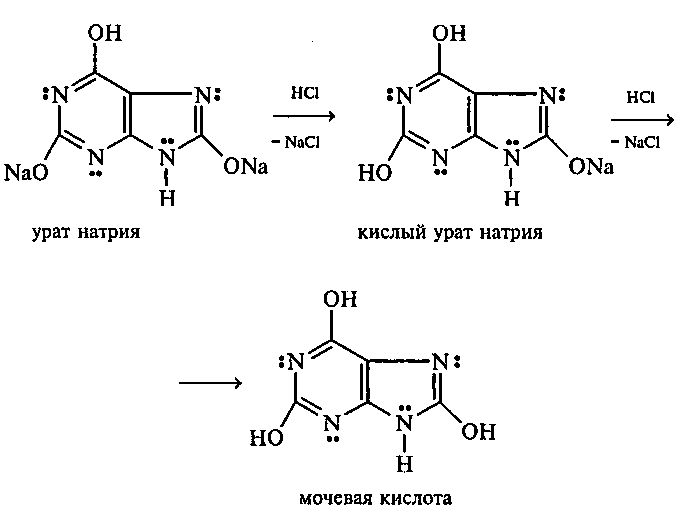 Кристаллы мочевой кислоты имеют форму удлиненных призм. Во вторую пробирку добавляют равный объем фелинговой жидкости. Смесь нагревают на газовой горелке. Выпадает красный осадок оксида меди (I). Таким образом, мочевая кислота легко окисляется даже слабыми окислителями: 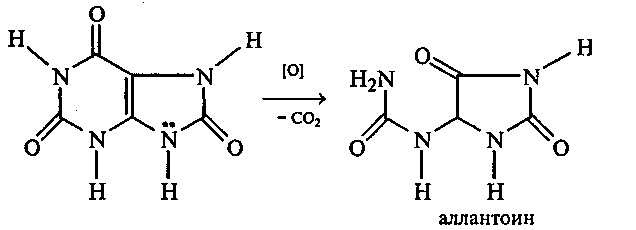 |