Лабораторные органическая химия. Лабораторная работа 1 окси, оксокислоты гидроксикарбоновые кислоты опы Свойства молочной кислоты
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
Часть раствора соли фенилдиазония, полученного в опыте 18, переливают в пробирку и нагревают на горячей водяной бане (или в стакане с горячей водой). Наблюдают выделение газа — азота. После окончания выделения азота ощущается запах фенола: Образовавшийся фенол отгоняют. Для этого пробирку закрепляют в лапке штатива, кладут в нее кипятильники, закрывают пробкой с изогнутой газоотводной трубкой, конец которой опущен в пустую охлаждаемую пробирку-приемник, и осторожно нагревают на газовой горелке. Фенол отгоняется с водой и собирается в пробирке в виде эмульсии. В пробирку-приемник с отогнанным фенолом добавляют несколько капель бромной воды. Выпадает белый осадок трибромфенола. Напишите механизм реакции разложения соли диазония при нагревании ее водного раствора и уравнение реакции взаимодействия фенола с бромной водой. Опыт 20. Реакции солей диазония без выделения азота (реакции азосочетания) Реактивы и оборудование: раствор гидросульфата фенилдиазония, N.N-диметиланилин, насыщенный раствор ацетата натрия, 2М соляная кислота, 2М раствор гидроксида натрия, β-нафтол, сульфаниловая кислота, нитрит натрия; пипетки, химические стаканы на 50 мл, кристаллизаторы, лед, мерные цилиндры на 10 мл, стеклянные палочки, иод-крахмальная бумага, пробирки. 20.1. Получение диметиломиноазобензола. Часть раствора (около 1 мл) гидросульфата фенилдиазония, полученного в опыте 96, наливают в пробирку, а затем добавляют 1—2 капли N,N-диметиланилина и несколько капель насыщенного раствора ацетата натрия. Смесь энергично встряхивают. При этом выпадает желто-оранжевый осадок N,N-диметиламиноазобензола: 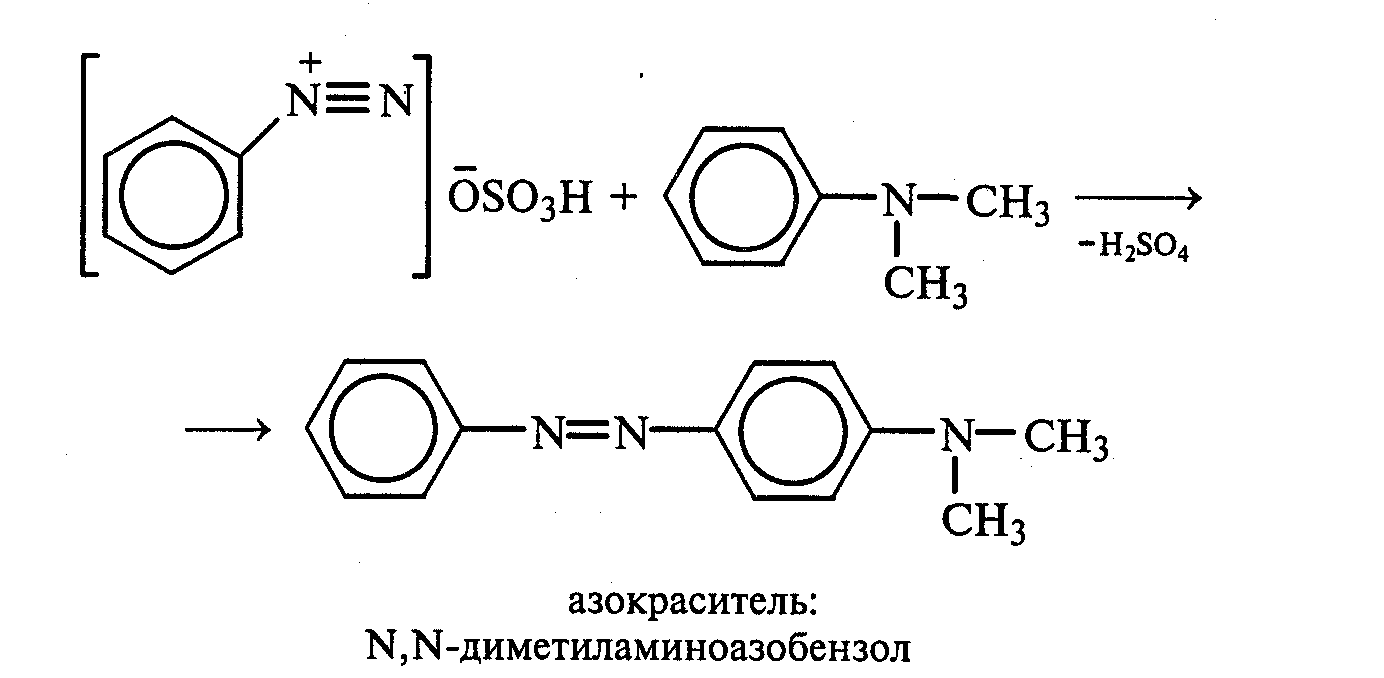 Образование азокрасителей происходит в результате реакции азосочетания соли диазония с ароматическими аминами или фенолами. Азосочетание относится к реакциям электрофильного замещения, в которых соль диазония является электрофильным реагентом. Напишите механизм этой реакции. Одну каплю полученного красителя переносят в другую пробирку и добавляют 2—3 мл воды. К полученному раствору приливают 2—3 капли 2М соляной кислоты. Раствор приобретает ярко-красную окраску. Часть раствора отливают в другую пробирку и подщелачивают его 3—4 каплями 2М раствора гидроксида натрия. Снова появляется желто-оранжевая окраска: 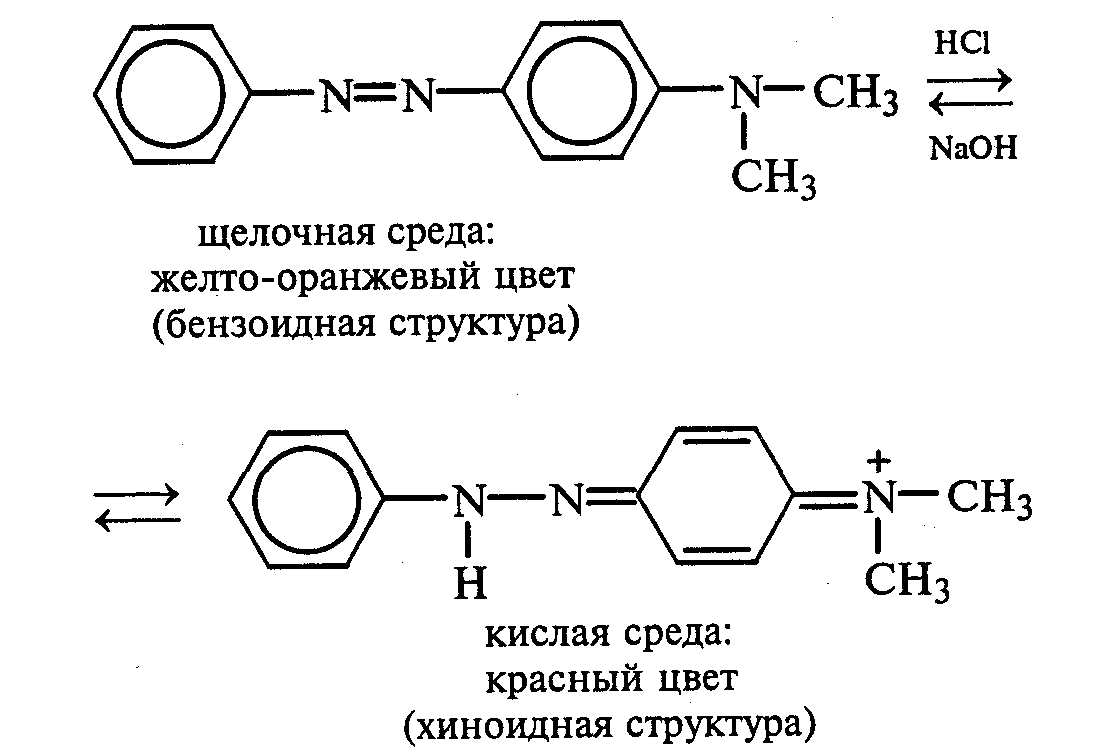 Раствор N,N -диметиламиноазобензола применяется в качестве индикатора, и в частности для титрования свободной соляной кислоты при анализе желудочного сока. Переход красного цвета в желтый происходит при рН = 4,0. 20.2. Получение красителя нафтолового оранжевого (β-нафтолоранжа). Исходные растворы готовят в трех небольших химических стаканах. В первом стакане растворяют 0,7 г – нафтола в 10 мл 2М раствора гидроксида натрия при нагревании, во втором — 1 г сульфаниловой кислоты в 2,5мл 2М раствора щелочи при слабом нагревании. К раствору натриевой соли сульфаниловой кислоты добавляют 0,4 г нитрита натрия в 5 мл воды. Полученную смесь охлаждают в кристаллизаторе со льдом и приливают ее при перемешивании в третий стакан с 10 мл предварительно охлажденной 2М соляной кислоты. Окончание реакции диазотирования конт- ролируют по иодкрахмальной бумаге: 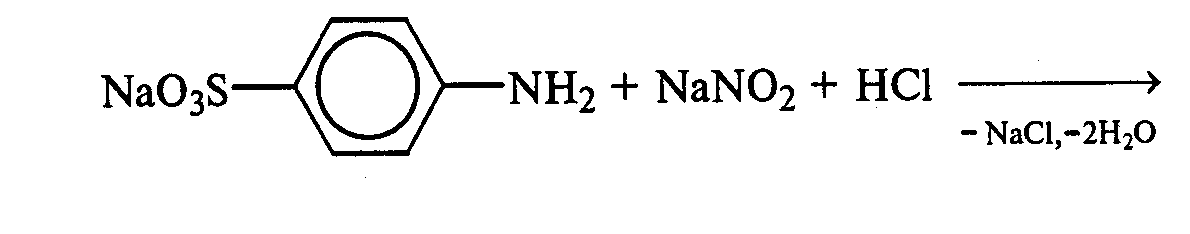 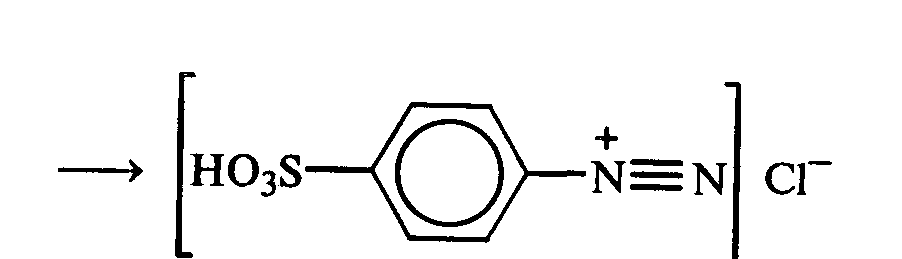 К раствору соли диазония добавляют щелочной раствор β -нафтола. находящийся в первом стакане. Выпадает осадок красителя β -нафтолоранжа: 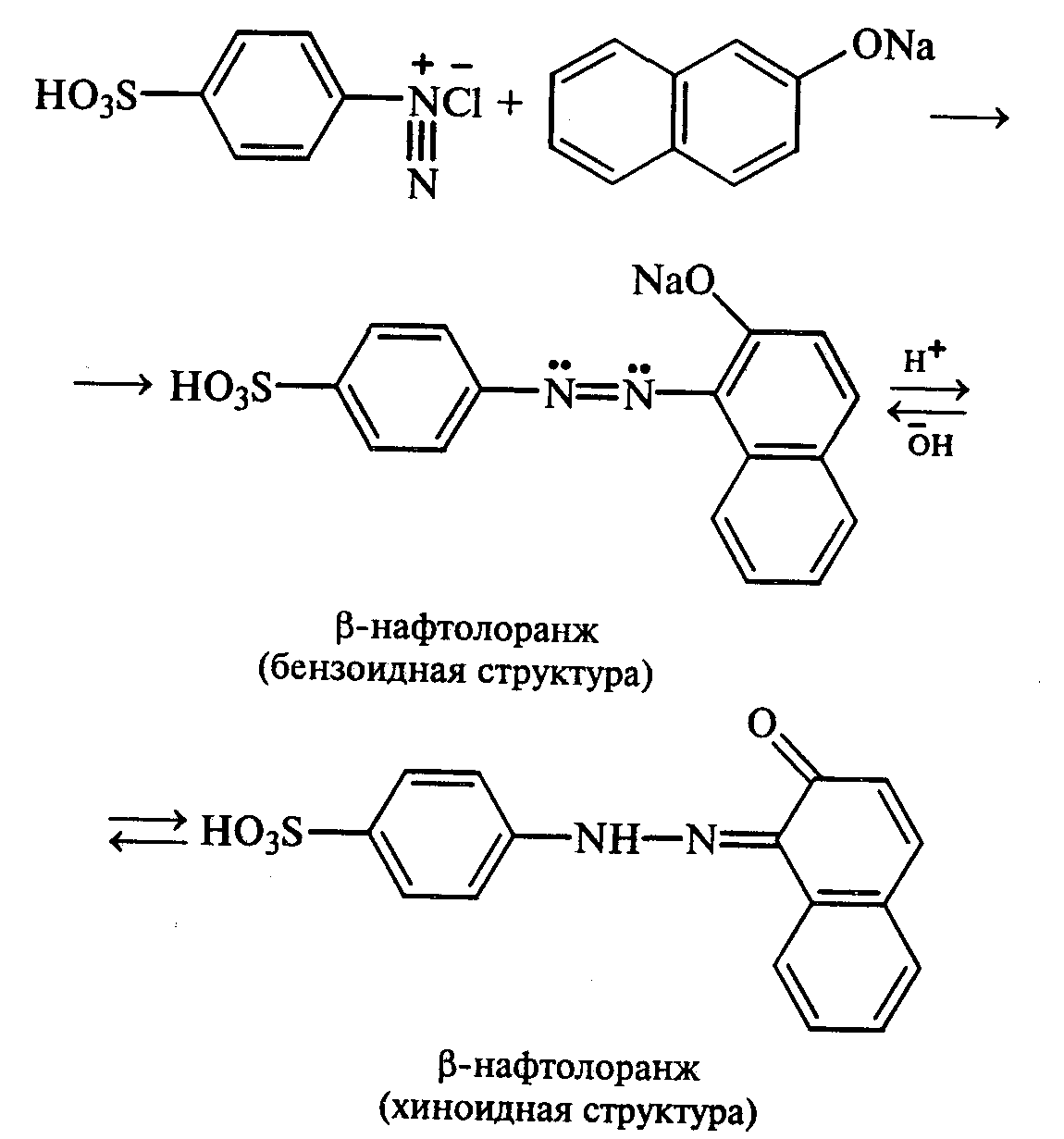 Напишите механизм реакции азосочетания соли диазония с β -нафтолом. В какой среде проводят реакцию азосочетания с фенолами? Опыт 21. Крашение шерсти и шелка кислотными азокрасителями Реактивы и оборудование: метиловый оранжевый, 2М раствор серной кислоты; химические стаканы на 100 мл, кусочки белой шерстяной или шелковой ткани. В состав кислотных азокрасителей входят кислые солеобразующие группы (—СООН; —ОSO3H; — ОН). Шерсть и шелк — природные белковые полимеры, имеющие в своем составе амидные (основные) группы, которые могут связываться с кислотными группировками молекул красителя. Обычно красители получают в виде натриевых солей, поэтому для высвобождения кислотных групп и для более эффективного крашения добавляют кислоту (Н2SО4,). Растворяют 0,1 г метилового оранжевого в 50 мл воды.  Раствор разливают в два стакана. В один из них добавляют 5 мл 2М раствора серной кислоты. В оба стакана опускают по кусочку белой шерстяной или шелковой ткани. Растворы кипятят 5мин. Затем ткани вынимают, промывают водой и высушивают на воздухе. Окраска ткани, полученная в присутствии серной кислоты, значительно интенсивнее, чем та, что образовалась без добавления кислоты. Опыт 22. Крашение хлопчатобумажной ткани (ледяное крашение) Реактивы и оборудование: β-нафтол, 1М раствор гидроксида натрия, 2М раствор ацетата натрия, раствор n-нитрофенилдиазонийхлорида; кусочки белой хлопчатобумажной ткани, химические стаканы на 50 мл. В отличие от шерсти и шелка, хлопчатобумажная ткань, состоящая из целлюлозы, не содержит групп, обладающих сродством к кислотным и основным красителям. Взаимодействие красителя и ткани происходит за счет сорбции, поэтому ледяное крашение применяют в тех случаях, когда краситель нерастворим или плохо растворим в воде. Полоску белой хлопчатобумажной ткани пропитывают 2%-ным раствором β -нафтола в 1М растворе гидроксида натрия. Ткань отжимают и сушат над плиткой или газовой горелкой. Высушенную ткань помещают в стаканчики приливают к ней раствор n-нитрофенилдиазонийхлорида и добавляют 2М раствор ацетата натрия. Ткань окрашивается в красный цвет: 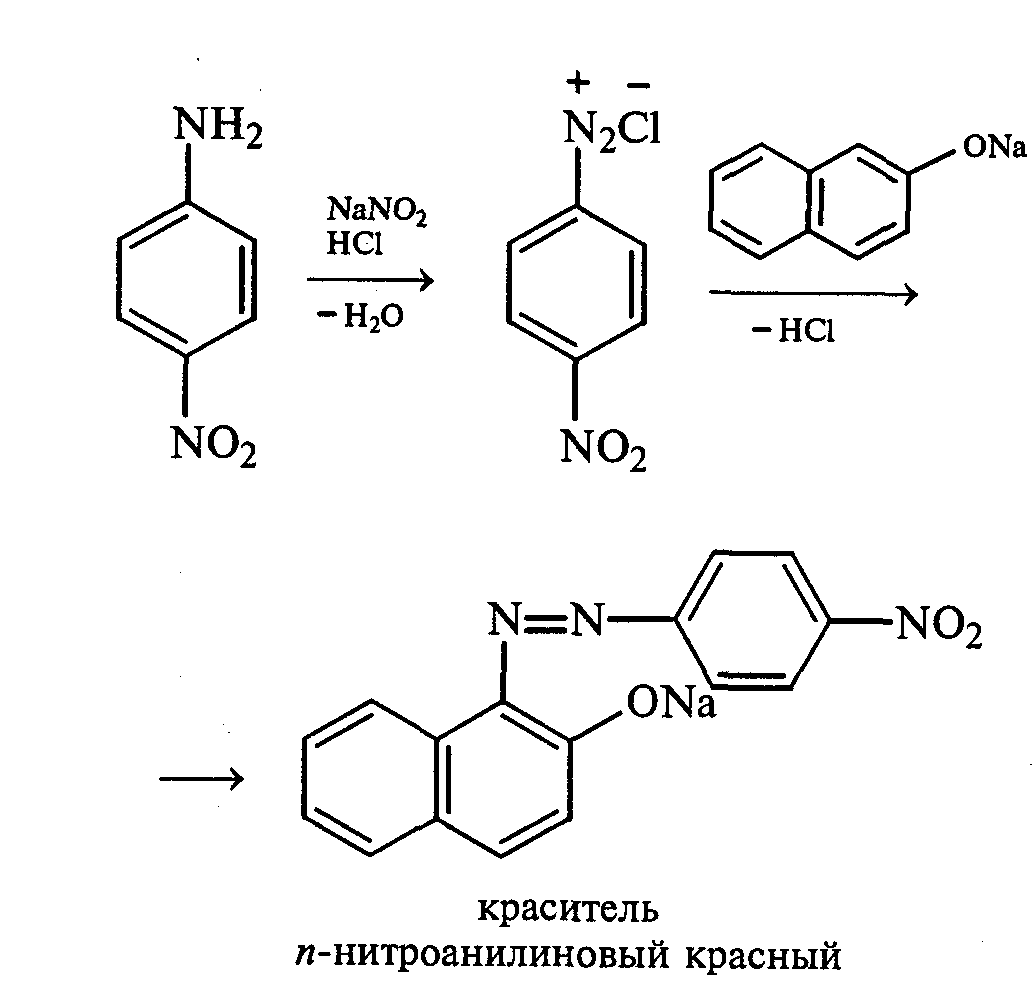 Азосочетание с фенолами (нафтолами) проводят в слабощелочной среде, так как нафтолятанион является более сильной электронодонорной группой по сравнению с гидроксильной. За счет этого в щелочной среде в α -положении у нафтолята натрия образуется избыточная электронная плотность, которая является объектом атаки для электрофильной частицы. Лабораторная работа №3 3. УГЛЕВОДЫ Углеводы — важнейшие природные органические соединения, в состав которых входят карбонильная и не менее двух гидроксильных групп. По составу и строению углеводы делят на несколько групп. Простые углеводы, или моносахариды, — это вещества, не способные гидролизоваться (например, глюкоза, фруктоза и т.д.). Углеводы, состоящие из двух и более остатков моносахаридов, называются олигосахаридами. В эту группу углеводов входят дисахариды (сахароза, лактоза и др.). Полисахариды, или полиозы, состоят из большого числа остатков моносахаридов, определенным образом связанных между собой (крахмал, клетчатка, гликоген и др.). 3.1. МОНОСАХАРИДЫ Опыт 23. Качественная реакция на углеводы с α -нафтолом (реакция Молиша) Реактивы и оборудование: концентрированные растворы углеводов: арабинозы, глюкозы, сахарозы и крахмала, 15%-ный спиртовой раствор α -нафтола, концентрированная серная кислота; пипетки, пробирки. При взаимодействии с концентрированной серной кислотой все углеводы разлагаются с образованием различных веществ, в частности фурфурола и его производных, которые конденсируются с α -нафтолом с образованием окрашенных соединений. В четыре пробирки наливают по 1 мл концентрированных растворов углеводов: в первую — арабинозы, во вторую — глюкозы, в третью — сахарозы, в четвертую — крахмала. В каждую пробирку добавляют по 1—2 капли 15%-ного спиртового раствора α -нафтола, а затем осторожно по стенке при помощи пипетки приливают по 1 мл концентрированной серной кислоты. Серная кислота опускается на дно пробирки, и на границе двух слоев постепенно образуется кольцо красно-фиолетового цвета. 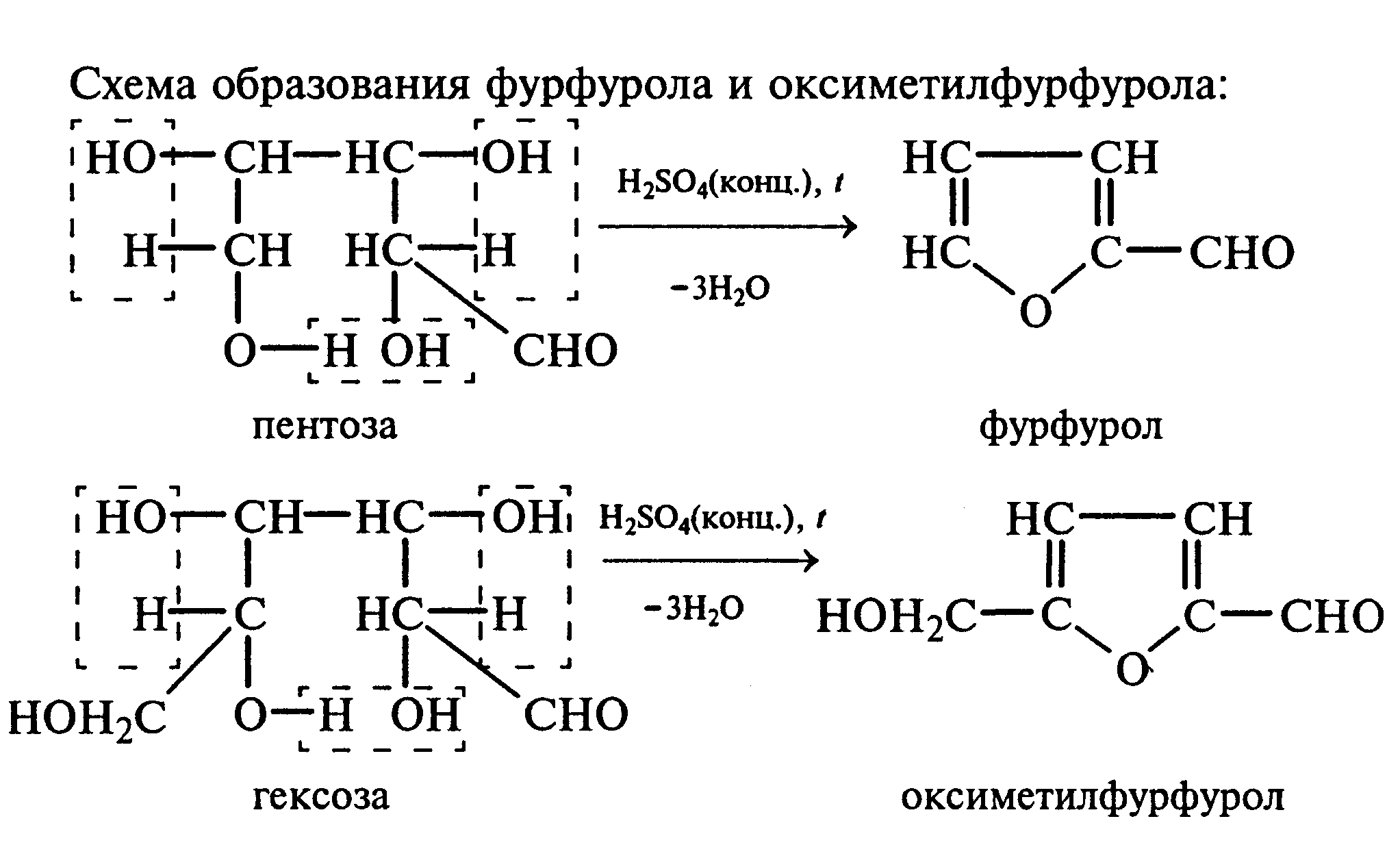 Опыт 24. Реакции моносахаридов по карбонильной группе Реактивы и оборудование: 10%-ный раствор глюкозы, 10%-ный раствор формальдегида, нитропрусид натрия, 1%-ный раствор глюкозы, 1%-ный раствор фруктозы, 5%-ный раствор сульфата меди, 10%-ный раствор гидроксида натрия, реактив Фелинга, 1%-ный раствор нитрата серебра, 5%-ный раствор аммиака, солянокислый фенилгидразин, ацетат натрия; водяные бани, пипетки, предметные и покровные стекла, микроскоп, пробирки. 24.1. Взаимодействие моносахаридов и формальдегида с нитропрусидом натрия. В две пробирки наливают по 1 мл раствора фуксинсернистой кислоты. В одну из них добавляют 1 мл 10%-ного раствора формальдегида, а во вторую — 1 мл 10%-ного раствора глюкозы. После перемешивания в пробирке с формальдегидом появляется розово-фиолетовое окрашивание, а в пробирке с глюкозой раствор остается бесцветным. Моносахариды существуют в виде циклических полуацетальных форм. Таутомерные им цепные формы, содержащие свободные карбонильные группы, присутствуют в растворах в концентрациях порядка десятых долей процента. Именно этим можно объяснить отсутствие реакции глюкозы с фуксинсернистой кислотой, а также и с гидросульфитом натрия. Напишите схему таутомерных превращений глюкозы при растворении в воде. 24.2. Окисление моносахаридов гидроксидом меди (II). В пробирку наливают 2 мл 1%-ного раствора глюкозы и 1 мл 10%-ного раствора гидроксида натрия. Раствор перемешивают и по каплям добавляют 5%-ный раствор сульфата меди до появления не исчезающей при встряхивании мути. Необходимо помнить, что избыток гидроксида меди (II) при нагревании разлагается с образованием оксида меди (II) черного цвета, который маскирует красный осадок оксида меди (I). При недостатке гидроксида меди (II) не связанная им глюкоза при нагревании осмоляется, и продукты осмоления темного цвета также маскируют реакцию. Верхнюю часть реакционной смеси нагревают до начинающегося кипения (нижнюю часть оставляют для контроля). В нагретой части раствора появляется желтый осадок гидроксида меди (I), который вскоре переходит в красный осадок оксида меди (I). Одним из продуктов окисления глюкозы является глюконовая кислота. 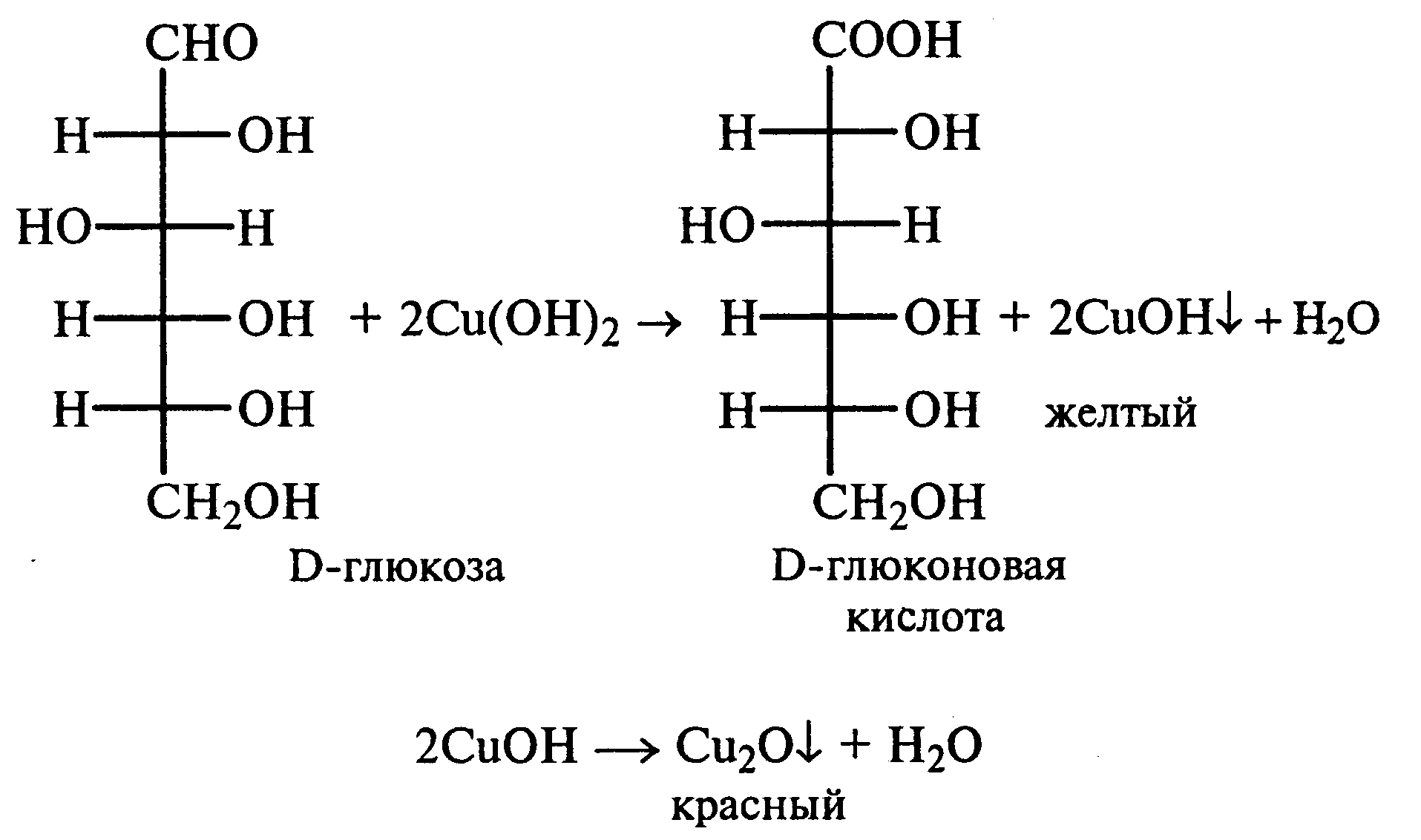 Реакция окисления гидроксидом меди (II) характерна как для альдоз (глюкоза), так и для кетоз (фруктоза). Это связано с тем, что в щелочной среде в присутствии окислителя углеродные цепочки молекул моносахаридов расщепляются с образованием смеси веществ, которые легко окисляются гидроксидом меди (II) с образованием красного осадка оксида меди (I). 24.3. Окисление моносахаридов реактивом Фелинга. Реактивом Фелинга легко окисляются как альдозы, так и кетозы. Следует отметить, что в реакцию окисления с данным реактивом вступают не сами кетозы, а продукты их щелочной деструкции в присутствии окислителя. В две пробирки наливают по 1 мл 1%-ного раствора глюкозы и 1%-ного раствора фруктозы. В каждую из них добавляют по 1 мл реактива Фелинга. Содержимое пробирок тщательно перемешивают и нагревают верхнюю часть раствора до начинающегося кипения. В обоих случаях в верхней части жидкости появляется желтый осадок гидроксида меди (I), переходящий в красно-оранжевый осадок оксида меди (I). Цвет нижней части пробирок не изменяется. 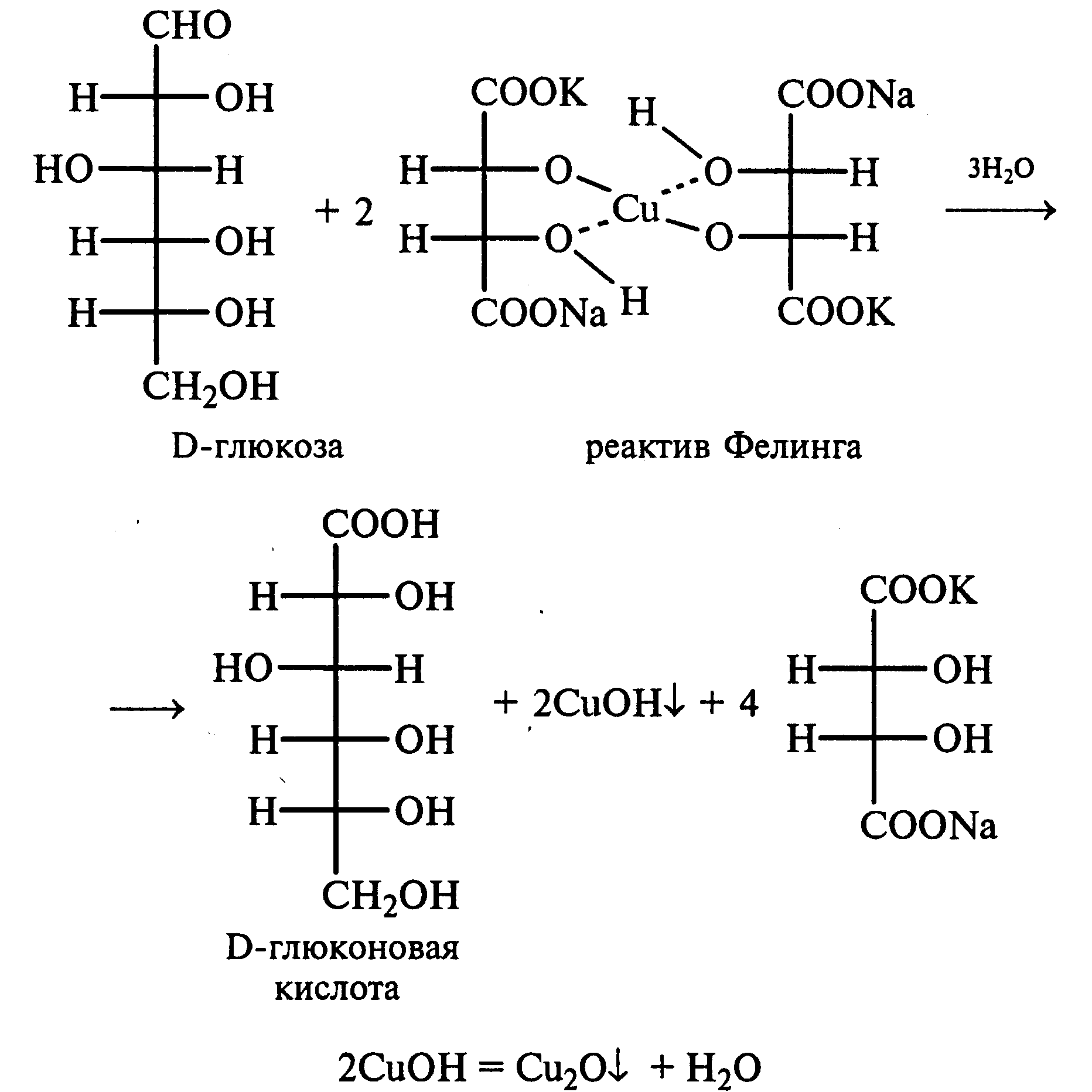 Реактивом Фелинга пользоваться удобнее, чем гидроксидом меди (II), так как при нагревании этого реактива с раствором моносахарида не происходит образование черного осадка оксида меди (II), маскирующего красно-оранжевый цвет осадка оксида меди(I). Реакция с фелинговой жидкостью протекает быстрее, поэтому ее широко используют для качественного и количественного определения моносахаридов. 24.4. Окисление моносахаридов аммиачным раствором гидроксида серебра (реакция «серебряного зеркала»). В две чистые пробирки, предварительно прокипяченные с раствором щелочи, наливают по 2—3 мл аммиачного раствора гидроксида серебра. В одну из них добавляют 1,5 мл 1%-ного раствора глюкозы, а во вторую — столько же 1%-ного раствора фруктозы. Пробирки нагревают на водяной бане (70—80 °С) 10 мин. Металлическое серебро выделяется на стенках обеих пробирок в виде зеркального слоя. Следует помнить, что во время нагревания пробирки нельзя встряхивать, иначе серебро выпадет в виде черного осадка. 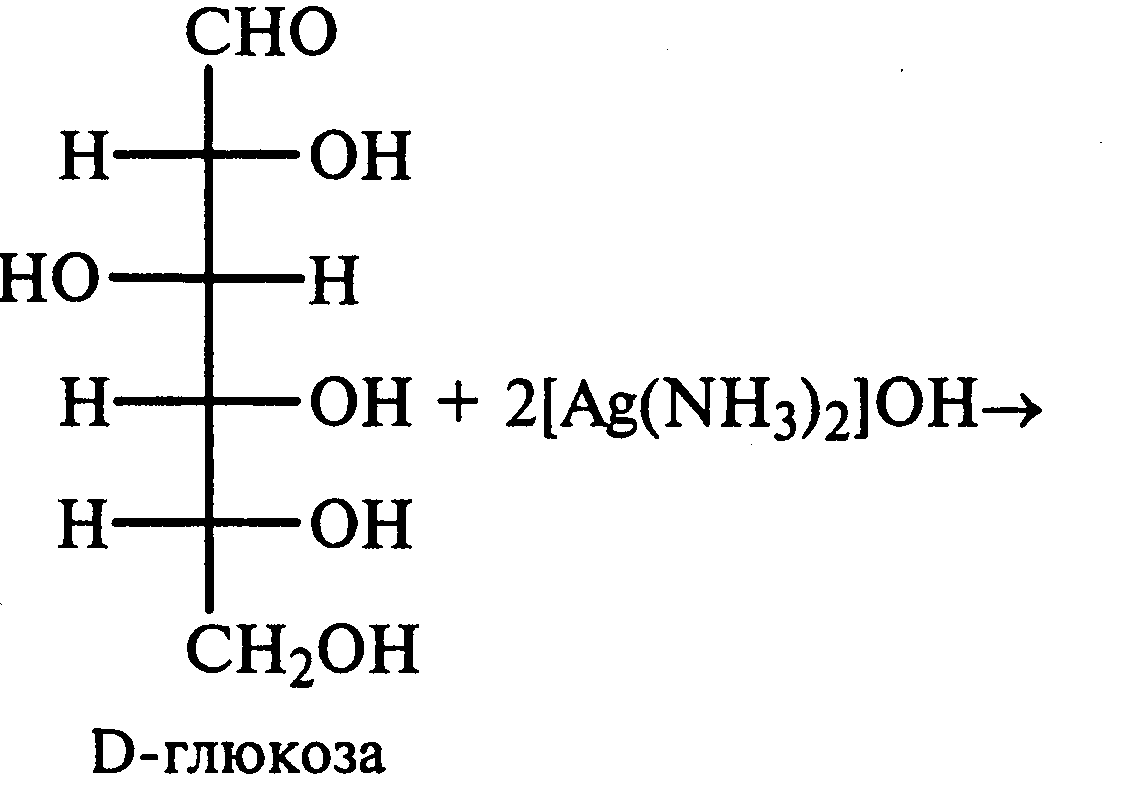 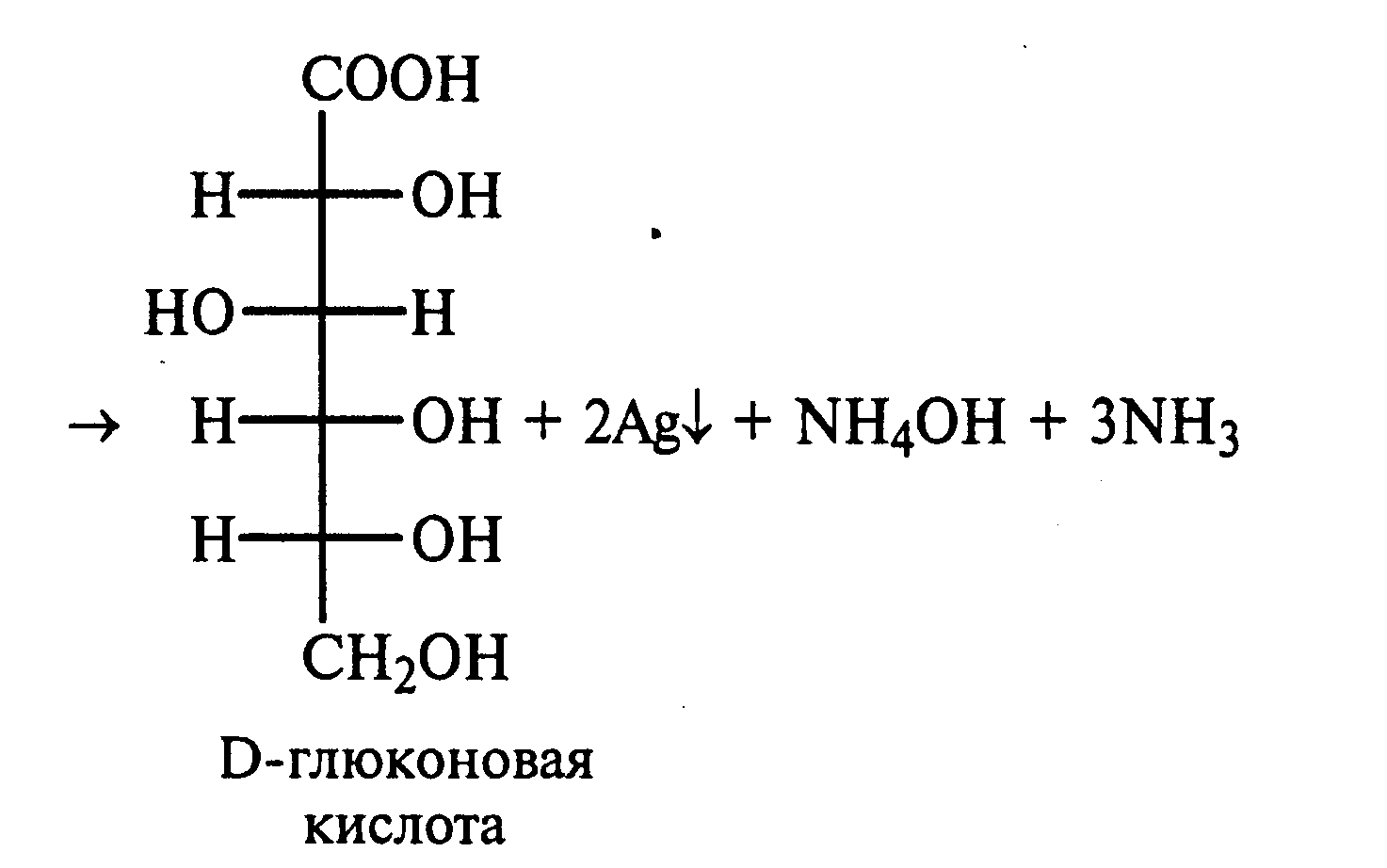 Как отмечалось в опытах 24.2 и 24.3, при нагревании моносахаридов в щелочной среде с окислителем происходит расщепление их углеродных цепей, и образующиеся продукты деструкции окисляются аммиачным раствором гидроксида серебра до соответствующих карбоновых кислот. Поэтому в реакцию «серебряного зеркала» вступают как альдозы, так и кетозы. 24.5. Реакция замещения карбонильного кислорода в моносахаридах (получение фенилозазонов). В сухую пробирку вносят 100 мг (на кончике шпателя) смеси солянокислого фенилгидразина и ацетата натрия (соотношение 1:3), а затем добавляют 1 мл 1%-ного раствора глюкозы. Содержимое пробирки тщательно перемешивают и помещают в кипящую водяную баню. Через 15—20 мин содержимое пробирки окрашивается в желтый цвет, и появляется желтый кристаллический осадок фенилглюкозазона. Реакция протекает по следующей схеме: 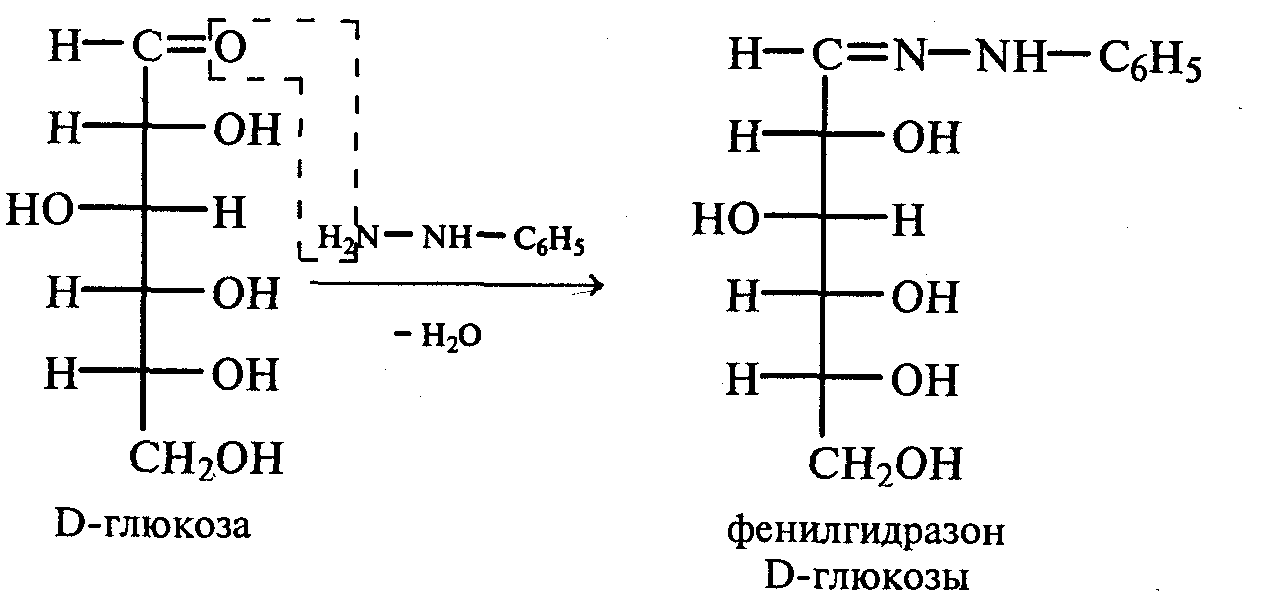 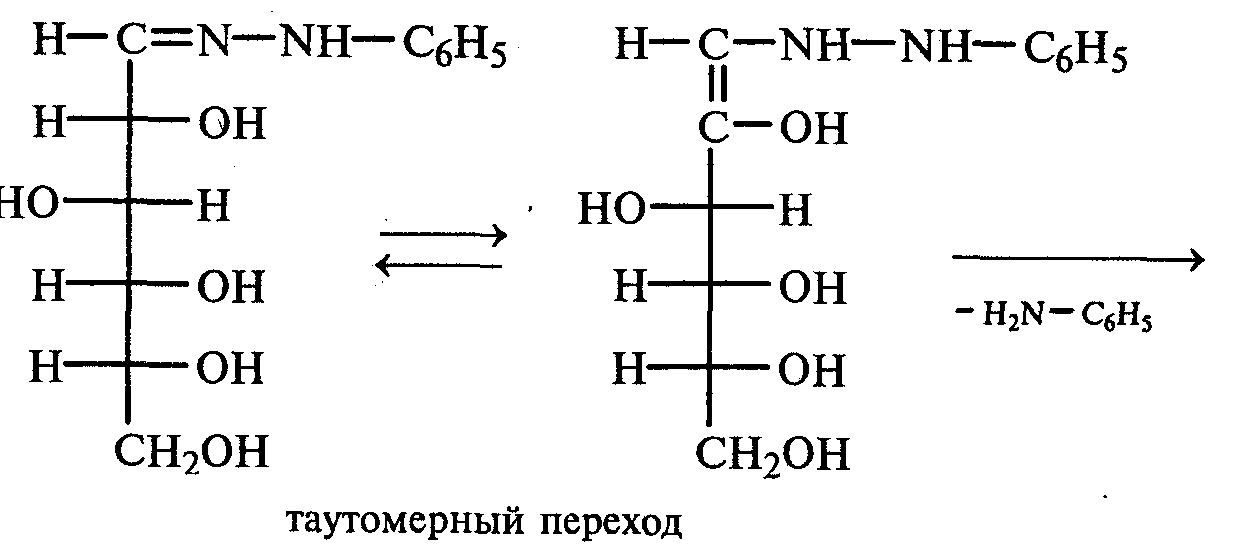 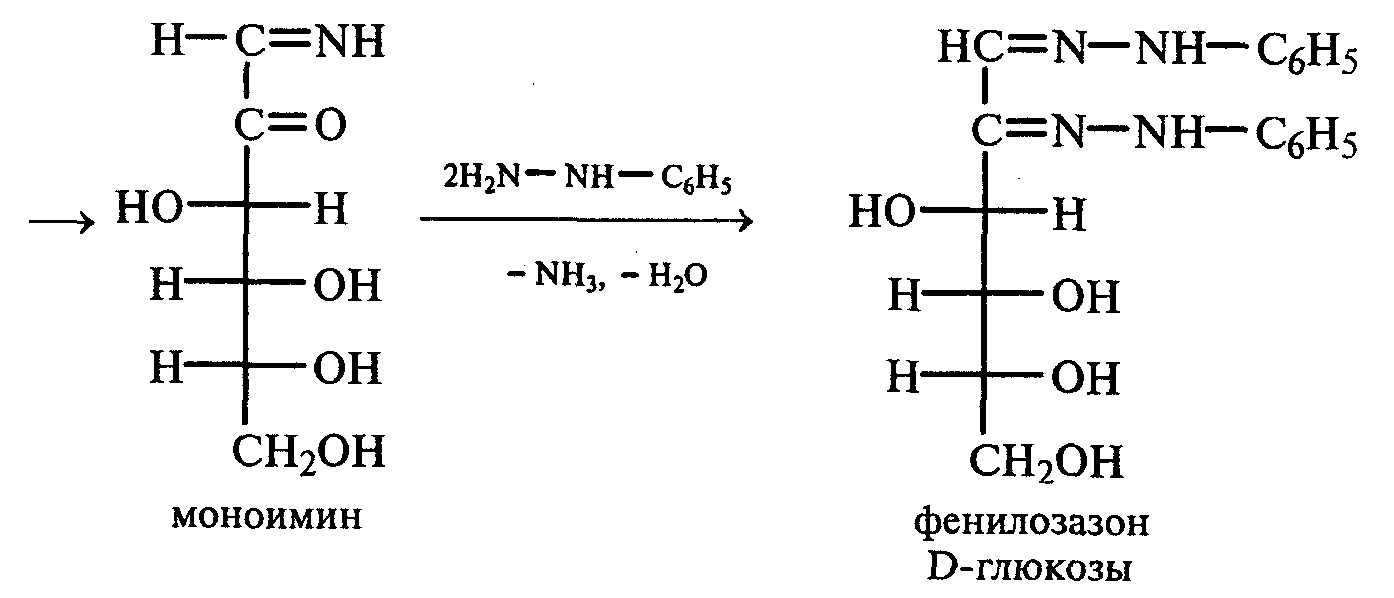 При встряхивании и охлаждении реакционной смеси количество осадка увеличивается. Каплю жидкости с осадком переносят на предметное стекло, накрывают его покровным и рассматривают форму кристаллов глюкозазона под микроскопом. Кристаллы фенилозазона D-глюкозы имеют форму удлиненных иголок, соединенных в снопы. Зарисуйте кристаллы глюкозазона в лабораторном журнале. Следует отметить, что D-фруктоза и D-манноза образуют тот же фенилозазон, что и D-глюкоза, так как у указанных моносахаридов пространственное расположение групп у третьего, четвертого и пятого атомов углерода одинаково. Опыт 25. Реакции на гидроксильные группы в моносахаридах Реактивы и оборудование: глюкоза, 1%-ный раствор глюкозы, 10%-ный раствор гидроксида натрия, 5%-ный раствор сульфата меди (II), ацетат натрия (безводный), уксусный ангидрид; лед, стеклянные палочки, обратные холодильники к пробиркам, пипетки, химические стаканы на 100 мл, пробирки. 25.1. Образование сахарата меди (II). В пробирке смешивают 1 мл 1%-ного раствора глюкозы и 0,5 мл 10%-ного раствора гидроксида натрия. Затем по каплям добавляют 5%-ный раствор сульфата меди. Образующийся вначале голубой осадок гидроксида меди (II) при встряхивании растворяется, и получается синий прозрачный раствор сахарата меди. 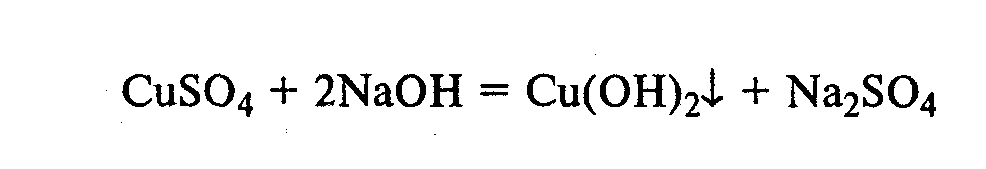 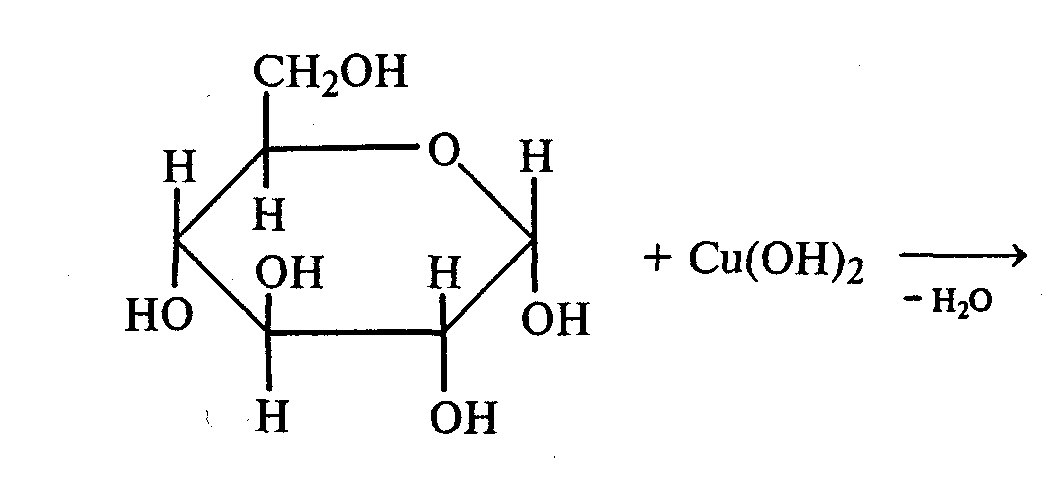 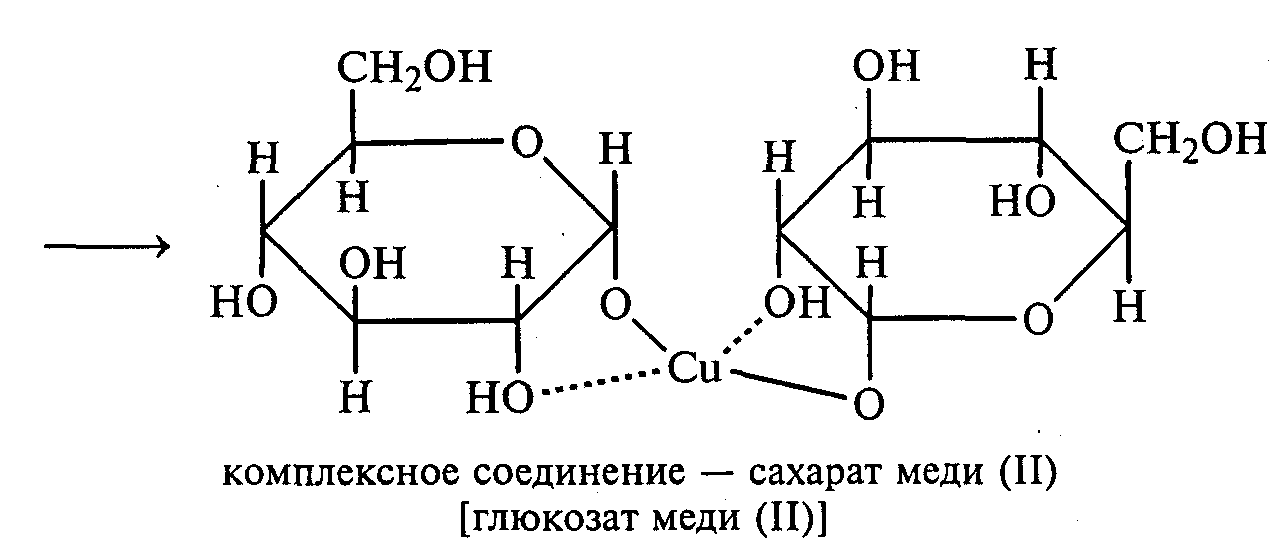 Эта реакция доказывает присутствие в молекуле глюкозы нескольких гидроксильных групп и является качественной реакцией, характерной для многоатомных спиртов (см. опыт 19). 25.2. Получение пентаацетилглюкозы (тяга). В сухой пробирке смешивают 1 г глюкозы и 0,5 г прокаленного ацетата натрия. К смеси добавляют 5 мл уксусного ангидрида. Содержимое пробирки тщательно перемешивают стеклянной палочкой. Пробирку закрывают пробкой с обратным холодильником и при встряхивании осторожно нагревают на газовой горелке 5—10 мин. Затем реакционную смесь охлаждают и выливают в стакан, содержащий 25 мл ледяной воды. Содержимое стакана перемешивают и через некоторое время наблюдают образование кристаллов пентаацетилглюкозы. 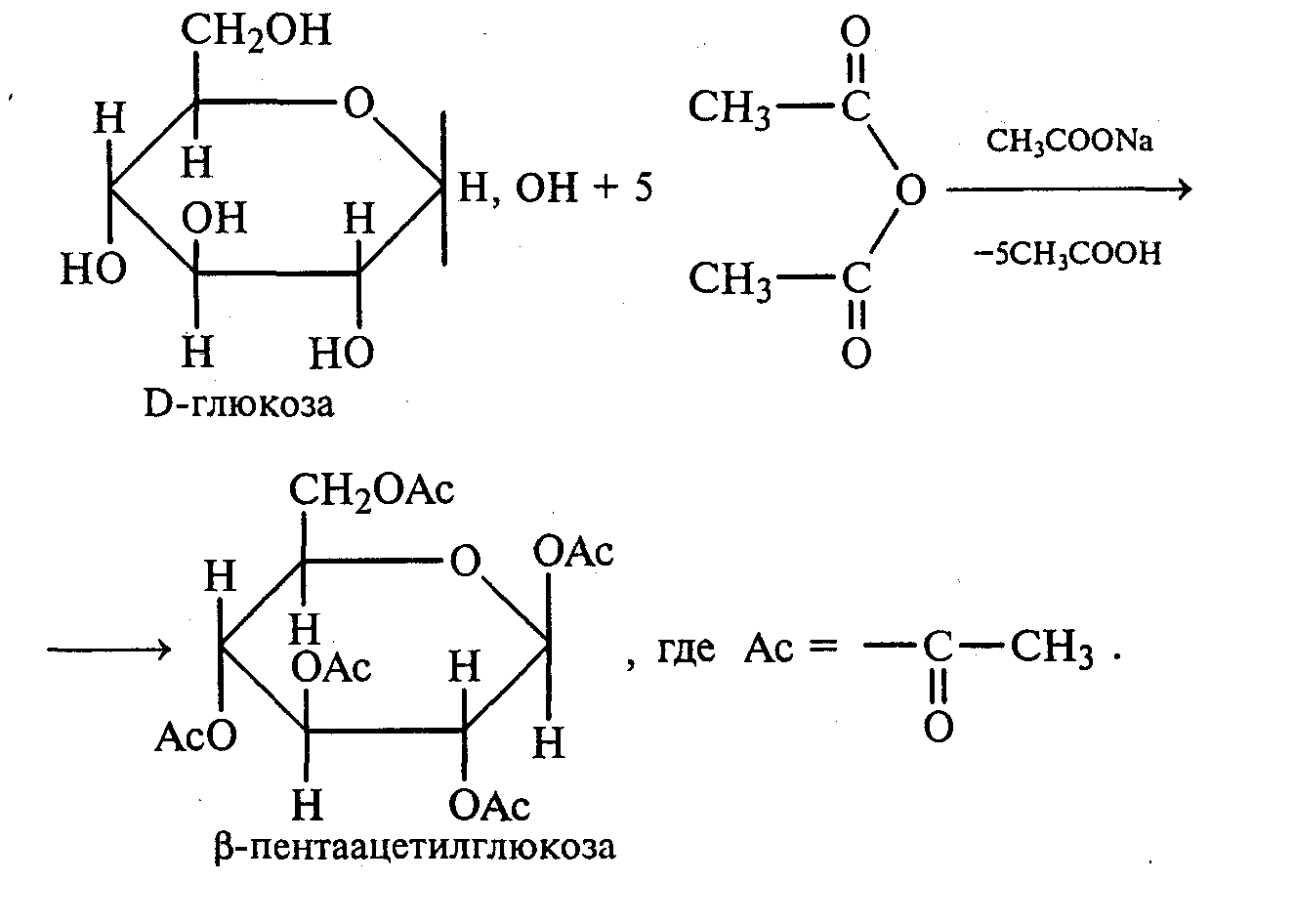 Опыт 26. Цветные реакции на моносахариды Реактивы и оборудование: 2%-ный раствор глюкозы, 2%-ный раствор фруктозы, 5%-ный раствор меда, реактив Селиванова, арабиноза, соляная кислота, разбавленная водой в объемном соотношении 1:1, анилин (свежеперегнанный), ледяная уксусная кислота, 0,1%-ный раствор арабинозы, орциновый реактив (см. приложение 1); пипетки, водяные бани, пробирки. 26.1. Реакция Селиванова на кетогексозы. В две пробирки наливают по 2мл реактива Селиванова. В одну из них добавляют 3—4 капли 2%-ного раствора фруктозы, а в другую — столько же 2%-ного раствора глюкозы. Обе пробирки нагревают на горячей водяной бане (80 °С) 5—10 мин. В пробирке с фруктозой появляется оранжевое, а затем розово-красное окрашивание. Раствор, содержащий глюкозу, не окрашивается. 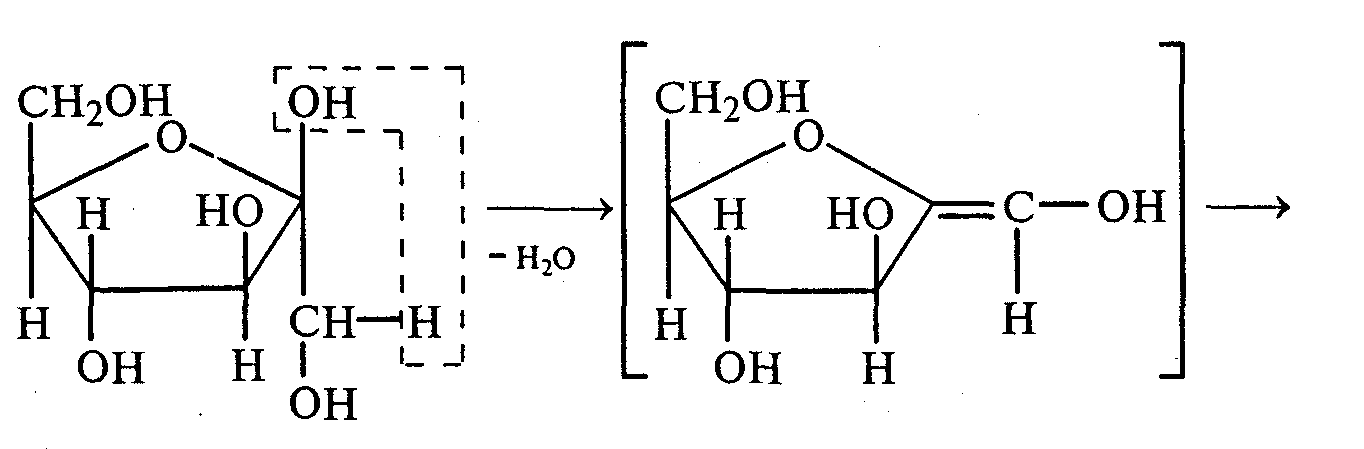 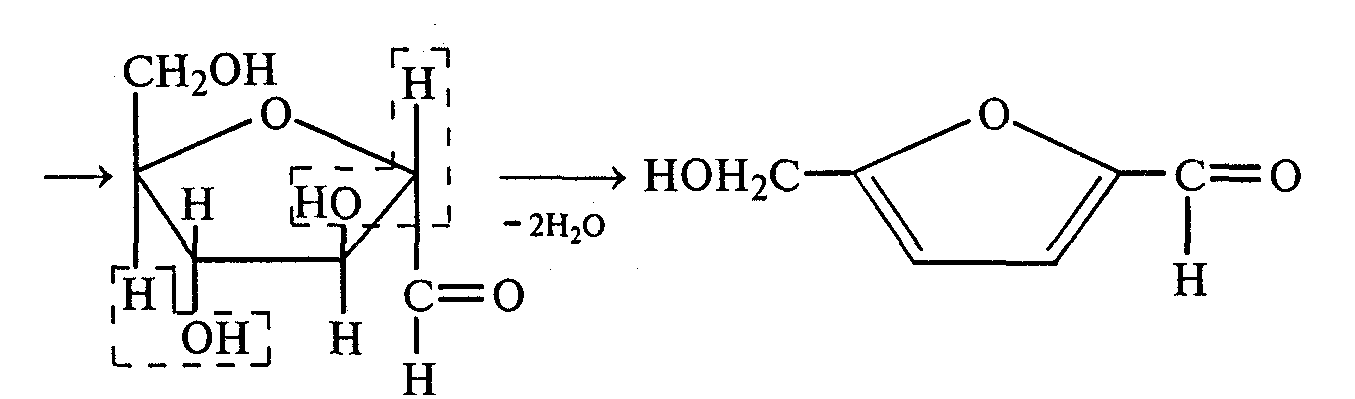 Эта реакция позволяет различить альдозы и кетозы. При нагревании с соляной кислотой фруктоза (кетоза) превращается в оксиметилфурфурол, который вступает в реакцию конденсации с резорцином, входящим в состав реактива Селиванова, в результате чего получается окрашенное в розово-красный цвет соединение. Альдозы также дают эту реакцию, но протекает она медленнее, при более высокой температуре (длительное кипячение). Этот опыт повторяют с 5%-ным раствором меда. 26.2. Реакция на пентозы с анилином. В сухую пробирку помещают несколько крупинок арабинозы или другой пентозы, добавляют 1 мл раствора соляной кислоты (1:1) и 1 мл свежеперегнанного анилина. Реакционную смесь нагревают до кипения на газовой горелке. Через некоторое время появляется интенсивное розово-красное окрашивание раствора. 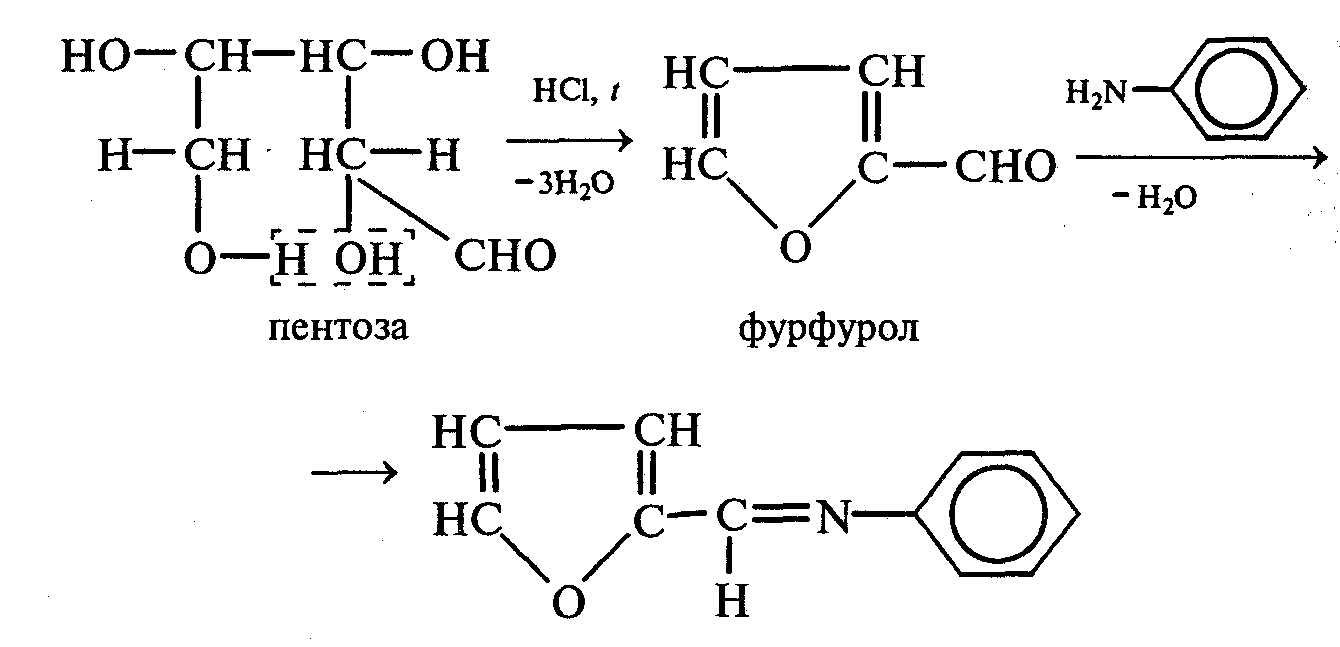 |
