Лекция 1. Осн понятия и законы химии 2020. Лекции Основные понятия и законы химии
 Скачать 46.43 Kb. Скачать 46.43 Kb.
|
|
Дополнительный материал к лекции «Основные понятия и законы химии» для самостоятельной работы студента (СРС) «Призывая к теоретическим химическим занятиям, я убежден, что зову людей к полезнейшему труду, к навыку правильно обращаться с природой, к готовности… сделаться практиками. А для этого необходимо усвоить химическую практику, т. е. мастерство предмета, искусство спрашивать природу и слышать ее ответы в лабораториях и книгах…» Д.И. Менделеев Современная химия является одной из естественных наук и представляет собой систему отдельных научных дисциплин: общей и неорганической химии, аналитической химии, органической химии, физической и коллоидной химии, геохимии, радиохимии, космохимии и др. Химия – это наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры, а также взаимные переходы между этими процессами и другими формами движения материи. Окружающий нас мир представлен материей, которая имеет две формы существования: вещество и поле. Вещество – это материальное образование, состоящее из элементарных частиц, имеющих собственную массу или массу покоя. Поле – это материальная среда, в которой осуществляется взаимодействие материальных частиц. Оно не является непосредственным объектом химии и проявляется прежде всего энергетическими характеристиками. Центральным объектом химии как науки являются вещества и их превращения. Основные понятия химииОбъектами изучения химии являются вещества и их мельчайшие частицы – молекулы и атомы. Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Атомы – составные части молекул. Химический элемент – совокупность атомов c одинаковым зарядом ядра. Если соединяются друг с другом атомы одного и того же элемента, то образуются простые вещества. Простые вещества являются формой существования химических элементов в свободном виде. Известно свыше 400 разновидностей простых веществ. Это могут быть металлы (Na, Mg, Al, Bi и т.д.); неметаллы (H2, N2, Br2, Si т.д.); молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода; иод (I2) и т.д. Сочетание атомов различных элементов дает сложные вещества, которые могут иметь постоянный состав (стехиометрические соединения, или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения, или бертоллиды). Моль – это единица измерения количества вещества, содержащая столько молекул, атомов или других структурных единиц, сколько их содержится в 12 г изотопа углерода 12С. Количество вещества (моль) можно рассчитать по формуле: = m / M = N / NA (моль), где m - масса вещества (г); М - молярная масса вещества (г/моль); N - количество структурных единиц; NA - число Авогадро (моль-1). Молярная масса вещества (М, г/моль) – масса 1 моль вещества. M = m / ν Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества. Число Авогадро (NA) – число структурных единиц, содержащееся в 1 моль вещества, NA = 6,021023 моль-1. Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных соотношений к молярным. Пример: Сколько молекул содержится в 6,4 г оксида серы (IV)? Решение: Молярная масса оксида серы (IV) М(SО2) = 64 г/моль. Определяем количество моль вещества в 6,4 г оксида серы (IV): n(SО2) = m(SО2) / M(SО2) = 6,4г / 64г/моль = 0,1 моль Определим число структурных единиц (молекул), используя постоянную Авогадро NА: N(SО2) = n(SО2) · NА = 0,1· 6,02· 1023 = 6,02· 1022 Ответ: В 6,4 г оксида серы (IV) содержится 6,02· 1022 молекул. Основные законы химии I. Газовые законы. Газообразное состояние вещества характеризуется давлением (Р), температурой (Т) и объемом (V). 1. Закон Бойля-Мариотта. Согласно закону Бойля-Мариотта, при постоянной температуре давление данной массы газа обратно пропорционально его объему: P1 / P2 = V2 / V1 или PV = Const. 2. Закон Гей-Люссака В соответствии с законом Гей-Люссака, давление газа прямо пропорционально абсолютной температуре: P1 / Т1 = Р2 / Т2 или P / Т = Const. 3. Объем, давление и температура газа связаны объединенным газовым законом: 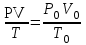 . .4. Закон Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Следствие 1. 1 моль любого газа при нормальных условиях (Р0 = 101325 Па и Т0 = 273 К) занимает объем 22,4 л (VМ – молярный объем). Следствие 2 Массы двух одинаковых объемов различных газов при одинаковых условиях будут относиться как их молярные массы: 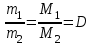 (относительная плотность первого газа по второму). (относительная плотность первого газа по второму).5. Уравнение Менделеева-Клапейрона: 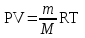 , , где R – универсальная газовая постоянная (R = 8,314 Дж/мольК). Численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К. Термин впервые введён в употребление Д.И. Менделеевым в 1874 г. 6. Закон Дальтона. По закону Дальтона парциальное давление газа в смеси равно тому давлению газа, которым обладал бы данный газ, если бы при той же температуре он занимал объем всей газовой смеси. Робщ. = Р1 + Р2 + … + Рn. Парциальным давлением газа называется та часть общего давления газовой смеси, которая приходится на долю данного газа. II. Закон сохранения массы веществ. Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в процессе реакции. Закон впервые сформулирован М.В. Ломоносовым в 1748 году (в 1789 году независимо от Ломоносова установлен французским химиком А. Лавуазье) и экспериментально подтвержден в 1756 году. III. Закон постоянства состава веществ. Все индивидуальные вещества имеют постоянный качественный и количественный состав независимо от способа их получения. Закон сформулирован Жозефом Луи Прустом в 1808 году и справедлив только для веществ с молекулярными кристаллическими решетками. IV. Закон кратных отношений. Если два элемента образуют между собой несколько различных соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого элемента, относятся между собой как небольшие целые числа. Закон сформулирован Дж. Дальтоном в 1803 году и связан с существованием переменных валентностей химических элементов. V. Закон эквивалентов. Вещества реагируют друг с другом в количествах, пропорциональных их эквивалентам: ν1 = ν2 (ν – число эквивалентов). Химический эквивалент – реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна (т.е. химически равноценна) одному иону Н+, а в окислительно-восстановительной реакции – одному электрону. Молярная масса эквивалента (МЭ) – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества Х МЭ = fM (f – фактор эквивалентности). Молярная масса эквивалента имеет размерность «г/моль-экв». Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента(VmЭ) – объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента. Размерность «л/моль-экв». Число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции, называется фактором эквивалентности (fЭ).Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. fЭ ≤ 1. Формулы расчета фактора эквивалентности приведены в таблице 1. Число в знаменателе дроби, равное числу принимаемых (отдаваемых) протонов или электронов называют числом эквивалентности – z. Число эквивалентности (эквивалентное число) z показывает, какое число эквивалентов вещества условно «содержится» в одной формульной единице этого вещества. z ≥ 1. Фактор эквивалентности связан с числом эквивалентности следующим соотношением: fэ = 1/z. Таблица 1. Расчет фактора эквивалентности
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl2, б) КНСО3, в) (MgOH)2SO4. Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1. а) ZnCl2 (средняя соль): fЭ(ZnCl2) = 1/2, поэтому эквивалентом ZnCl2 является частица 1/2ZnCl2. б) КНСО3 (кислая соль): fЭ(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3. в) (MgOH)2SO4 (основная соль): fЭ((MgOH)2SO4 ) = 1/2, поэтому эквивалентом (MgOH)2SO4 является частица 1/2(MgOH)2SO4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
Молярный объем эквивалента(VmЭ)газообразного вещества равен произведению фактора эквивалентности на молярный объем. При н.у. получаем:
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
где m1 и m2 – массы реагентов и (или) продуктов реакции, г; МЭ1, МЭ2 – молярные массы эквивалентов реагентов и (или) продуктов реакции, г/моль; V1, V2 – объемы реагентов и (или) продуктов реакции, л; VmЭ1,VmЭ2 – молярные объемы эквивалентов реагентов и (или) продуктов реакции, л/моль. |

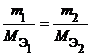 или
или 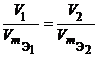 или
или 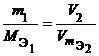 ,
,