Лекция 12 12. Биохимия мышечной ткани
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
Лекция 1212. Биохимия мышечной тканиМышечная ткань составляет 40% от веса тела человека. Биохимические процессы, протекающие в мышцах, оказывают большое влияние на весь организм человека. 12.1. Функции и виды мышечной ткани Важнейшей особенностюь функционирования мышц является то, что в процессе мышечного сокращения происходит преобразование химической энергии АТФ непосредственно в механическую энергию сокращения и движения. У животных и человека имеется два основных типа мышц: поперечно-полосатые и гладкие. Поперечно-полосатые мышцы прикрепляются к костям, т.е. к скелету, и поэтому ещё называются скелетными. Поперечно-полосатые мышечные волокна также составляют основу сердечной мышцы – миокарда, хотя имеются определённые различия в строении миокарда и скелетных мышц. Гладкие мышцы образуют мускулатуру стенок кровеносных сосудов, кишечника, пронизывают ткани внутренних органов и кожу. 12.2. Морфологическая структура поперечно-полосатых мышц Каждая поперечно-полосатая мышца состоит из нескольких тысяч волокон, объединенных прослойками из соединительной ткани и такой же оболочкой – фасцией. Мышечные волокна (миоциты) представляют собой сильно вытянутые многоядерные клетки крупного размера: длина их достигает от 0,1 до 2-3 см, а в некоторых мышцах – более 10 см. Толщина мышечных клеток 0,1-0,2 мм (рис. 12.1):  Рис. 12.1. Структура поперечно-полосатой мышцы и мышечного волокна Как и любая клетка, миоцит содержит такие обязательные органеллы, как ядра, митохондрии, цитоплазматическую сеть (саркоплазматическая сеть), клеточную оболочку (плазмолемму) мышечной клетки – сарколемму. Строение саркоплазматической сети Необходимо отметить, что саркоплазматическая сеть состоит из трубочек, канальцев и пузырьков, образованных мембранами и соединённых друг с другом. Саркоплазматическая сеть с помощью особых трубочек, называемых Т-системой, связана с оболочкой мышечной клетки – сарколеммой. 12.2.1. Особенности структуры и состава миоцитов 1. Основной особенностью миоцитов, отличающих их от других клеток, является наличие сократительных элементов – миофибрилл. Миофибриллы занимают большую часть мышечных клеток, их диаметр около 1 мм. 2. Наличие в саркоплазме белка миоглобина, который по строению идентичен субъединице гемоглобина. Функция миоглобина заключается в связывании кислорода. Благодаря этому белку в мышцах создаётся определённый запас кислорода. 3. Основной углевод мышечной ткани – гликоген. Концентрация гликогена колеблется в приделах от 0,2 до 3%. 4. Каждое мышечное волокно окружено клеточной оболочкой – сарколеммой. К сарколемме подходят окончания двигательных нервов. Место контакта двигательных нервов с сарколеммой называется нервно-мышечным синапсом. 12.2.1. Молекулярная структура поперечно-полосатых мышц Микроскопическое изучение строения миофибрилл показало, что они состоят из чередующихся светлых и тёмных участков, или дисков, что создаёт под микроскопом видимую исчерченность всего мышечного волокна (рис. 12.2):  Рис.12.2. Структура саркомера При изучении структуры миофибрилл с помощью электронного микроскопа было установлено, что миофибриллы являются сложными структурами, простроенными, в свою очередь, из большого числа мышечных нитей двух типов – толстых и тонких. Толстые нити имеют диаметр 15 нм, тонкие – 7 нм. Миофибриллы состоят из чередующихся пучков параллельно расположенных толстых и тонких нитей, которые концами заходят друг в друга (рис. 12.2). Участок миофибриллы, состоящий из толстых нитей и находящихся между ними концов тонких нитей, обладают двойным лучепреломлением. При микроскопии этот участок задерживает видимый свет и поэтому кажется тёмным. Такие участки получили название анизотропные или тёмные диски (А-диски). Светлые участки миофибрилл состоят из центральных частей тонких нитей. Они сравнительно легко пропускают лучи света и называются изотропными или светлыми дисками (I-диски). В середине пучка тонких нитей поперечно располагается тонкая пластинка из белка, которая фиксирует положение мышечных нитей в пространстве. Эта пластинка хорошо видна под микроскопом в виде линии, идущей поперёк I-диска, и называется Z-линией. !!! Участок миофибриллы между соседними Z-линиями называется саркомер. Длина саркомера достигает 2,5-3 мм. Каждая миофибрилла состоит из нескольких тысяч саркомеров (до 1000). Саркомер можно рассматривать в качестве функциональной единицы миофибриллы. Изучение мышечного состава показало, что толстые и тонкие нити состоят только из белков. 12.2.2. Структура толстых и тонких нитей миофибрилл Толстая нить. Состоит из молекул белка миозина. Миозин - крупный олигомерный белок, молекулярная масса которого достигает 500 кДа, состоит из 6 субъединиц, попарно одинаковых: пара тяжёлых цепей и 2 пары лёгких цепей (рис. 12.3): 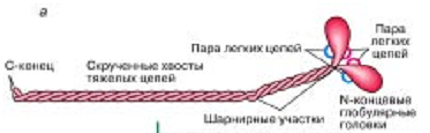 Рис. 12.3. Структура миозина Тяжелая цепь: на С-конце - α-спираль, на N-конце - глобула. При соединении двух тяжелых цепей С-концевыми участками образуется суперспираль. Две легкие цепи входят в состав глобулы (головки). Стержневой участок суперспирали имеет 2 отдела, где спирали оголены - эти места открыты для действия протеолитических ферментов и имеют повышенную подвижность. Свойства миозина. В физиологических условиях (оптимальные pH, температура, концентрации солей) молекулы миозина спонтанно взаимодействуют между собой своими стержневыми участками ("конец в конец", "бок в бок") с помощью слабых нековалентных, а их головки выступают из толстой нити по правильной спирали (рис. 12.4):  Рис. 12.4. Структура толстых нитей миофибрилл В головках миозина имеется два важных центра: - первый катализирует гидролитическое расщепление АТФ, т.е. соответствует активному центру фермента; - второй участок головки миозина обеспечивает во время мышечного сокращения связь толстых нитей с белком тонких нитей – актином. Тонкие нити. В состав тонких нитей входят три белка: сократительный белок актин и регуляторные белки тропомиозин и тропонин. Актин - небольшой глобулярный белок, его молекулярная масса - 42 кDа. G-актин представляет собой глобулу. В физиологических условиях его молекулы способны к спонтанной агрегации, образуя F-актин (Рис. 12.5):  Рис. 12.5. Структура белков тонких нитей: актина, тропомиозина и тропонина Основой тонкой нити является двойная спираль, состоящая из двух цепей F-актина (фибриллярного актина), содержащих около 300 молекул G-актина (глобулярного актина), как бы две нити бус, закрученных в двойную спираль. Регуляторный белок тонких нитей - тропомиозин – также имеет форму двойной спирали. Однако эта спираль образована полипептидными цепями и по длине соответствует 7 звеньям двойной спирали актина. Тромиозин располагается в желобке двойной спирали актина. Регуляторный белок тропонин присоединяется к тропомиозину и фиксирует его положение в желобке актина, при котором блокируется взаимодействие миозиновых головок с молекулами глобулярного актина тонких нитей. Тропомиозин. Фибриллярный белок, молекулярная масса - 70 кДа. Имеет вид α-спирали. В тонкой нити на одну молекулу тропомиозина приходится 7 молекул G-актина. Располагается тропомиозин в желобке между двумя спиралями G-актина. Соединяется тропомиозин "конец в конец", цепочка непрерывная. Молекула тропомиозина закрывает активные центры связывания актина на поверхности глобул актина. Тропонин. Глобулярный белок, молекулярная масса 80 кДа, имеет 3 субъединицы: тропонин "Т", тропонин "С" и тропонин "I". Располагается на тропомиозине с равными промежутками, длина которых равна длине молекулы тропомиозина. Тропонин Т (ТнТ) - отвечает за связывание тропонина с тропомиозином, через тропонин "Т" конформационные изменения тропонина передаются на тропомиозин. Тропонин С (ТнС) - Ca2+-связывающая субъединица, содержит 4 участка для связывания кальция, по строению похожа на белок кальмодулин. Тропонин I (ТнI) - ингибиторная субъединица - это ненастоящий ингибитор - он только лишь создает пространственное препятствие, мешающее взаимодействию актина и миозина в момент, когда тропонин "С" не связан с Са2+. 12.3. Механизм мышечного сокращения Мышечное сокращение является сложным процессом, в ходе которого происходит преобразование энергии химических связей АТФ в механическую работу, совершаемую мышцей. В настоящее время этот механизм ещё полностью не изучен. Однако достоверно известно следующее: 1. Источником энергии, необходимой для сокращения мышц, является АТФ. 2. Гидролиз АТФ, сопровождающийся выделением энергии, катализируется глобулярной головкой миозина, которая обладает ферментативной активностью. 3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов Ca2+ в саркоплазме миоцитов, вызываемое двигательным нервным импульсом. 4. Во время сокращения между толстыми и тонкими нитями миофибрилл возникают поперечные мостики или спайки. 5. Во время мышечных сокращений происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом. Существует много гипотез, пытающихся объяснить механизм мышечного сокращения. Наибольшее распространение получила гипотеза «вёсельной лодки» Х. Хаксли. 12.3. Регуляция сокращения и расслабления мышц в живой клетке.В мышце, находящейся в состоянии покоя, толстые и тонкие нити фибрилл друг с другом не соединены, так как участки связывания на молекулах актина закрыты молекулами тропомиозина.Сокращение. Мышечное сокращение начинается под воздействием двигательного нервного импульса, который передаётся от отростков нервных клеток (аксонов) на мембрану миоцитов через нервно-мышечный синапс, что приводит к резкому повышению проницаемости мембраны для ионов кальция. 1. Са2+ поступает в саркоплазму (цитоплазму) мышечной клетки из депо – цистерн саркоплазматической сети . Концентрация Са2+ в саркоплазме мгновенно увеличивается в 100 раз (с 10-7М до 10-5М). 2. Ионы кальция связываются с тропонином и меняют его конформацию. В результате конформационных изменений тропонина молекулы тропомиозина смещаются вдоль желобка актина и освобождают тот участок актиновых молекул, который предназначен для связывания с миозиновыми головками (рис. 12.6):  Рис. 12.6. Молекулярный механизм мышечного сокращения 3. В результате этого между актином и миозином возникает поперечный мостик, расположенный под углом 90º. Поскольку в толстые и тонкие нити входит большое количество молекул миозина и актина (около 300 в каждую), то между мышечными нитями образуется большое количество спаек. 4. Образование мостика между актином и миозином сопровождается проявлением ферментативной активности головок миозина, которая заключается в расщеплении молекулы АТФ: АТФ + H2O = AДФ + Фн – ΔG 5. За счёт энергии, выделившейся при расщеплении АТФ, происходят конформационные изменения в головке в результате чего она, подобно шарниру, поворачивается и мостик между толстыми и тонкими нитями оказывается под углом 45º, что приводит к скольжению мышечных нитей навстречу друг другу (Рис. 12.7):  Рис. 12.7. Стадии взаимодействия миозина с актином 6. Совершив поворот, мостики между тонкими и толстыми нитями разрываются. АТФазная активность вследствие этого резко снижается и гидролиз АТФ прекращается. 7. Однако, если двигательный импульс продолжает поступать в мышцу и в саркоплазме сохраняется высокая концентрация ионов кальция, поперечные мостики образуются вновь, АТФазная активность миозина возрастает и снова происходит гидролиз АТФ, дающий энергию для поворота поперечных мостиков и т. д. Это ведёт к дальнейшему движению толстых и тонких нитей навстречу друг другу и, как результат, корочению миофибрилл и мышечного волокна. Расслабление. Чтобы произошло расслабление мышцы, необходимы следующие условия: - освобождение тропонина от Са2+ - для этого работает мембрано-связанный фермент Са2+-зависимая АТФаза. Этот фермент использует энергию гидролиза АТФ для переноса Са2+ обратно в цистерны против градиента их концентраций. Запасы АТФ в клетке значительны, но их хватает для обеспечения мышечной работы только в течение 0, секунды. Однако в мышечной клетке идет очень быстрый ресинтез АТФ. Особенность мышечной ткани - очень быстрые изменения концентрации АТФ (в 100 и более раз). 12.4. Механизмы энергообеспечения мышечной тканиИсточники энергии следующие.
1. Специальные реакции субстратного фосфорилирования. Участие специальных реакций субстратного фосфорилирования в обеспечении энергией мышечной клетки различна - это зависит от интенсивности, продолжительности, мощности и длительности мышечной работы. 1.1. Креатинфосфокиназная реакция. Это самый быстрый способ ресинтеза АТФ. Запасов креатинфосфата хватает для обеспечения мышечной работы в течение 20 с. Максимально эффективен. Не требует присутствия кислорода, не дает побочных нежелательных продуктов, включается мгновенно. Его недостаток - малый резерв субстрата (хватает только на 20 с работы). Обратная реакция может протекать в митохондриях с использованием АТФ, образовавшейся в процессе окислительного фосфорилирования. Мембрана митохондрий хорошо проницаема как для креатина, так и для креатин-фосфата, а креатинфосфокиназа есть и в саркоплазме, и в межмембранном пространстве митохондрий. 1.2. Миокиназная реакция. Протекает только в мышечной ткани! АДФ --------> АТФ + АМФ. Реакция катализируется миокиназой (аденилаткиназой). Главное значение этой реакции заключается в образовании АМФ - мощного аллостерического активатора ключевых ферментов гликолиза, гликогенолиза, ГБФ-пути. 1.3. Гликолиз, гликогенолиз. Не требуют присутствия кислорода (анаэробные процессы). Обладают большим резервом субстратов. Используется гликоген мышц (2 % от веса мышцы) и глюкоза крови, полученная из гликогена печени. Недостатки следующеи.
Преимущества.
Недостаток: требует повышенных количеств кислорода. Важную роль в обеспечении мышечной клетки кислородом играет миоглобин, у которого сродство к кислороду больше, чем у гемоглобина: при парциальном давлении кислорода, равном 30 мм.рт.ст., миоглобин насыщается кислородом на 100 %, а гемоглобин - всего на 30 %. Поэтому миоглобин эффективно отнимает у гемоглобин доставляемый им кислород.
12.5. Изменение метаболизма при мышечной работеУменьшение концентрации АТФ смещает равновесие креатинфосфокиназной реакции вправо: используется креатинфосфат. Далее включается гликолиз, так системе окислительного фосфорилирования необходима 1 мин для запуска. Это пусковая фаза мышечной работы.
Таким образом, энергетическое обеспечение разных видов мышечной работы различно. Поэтому существует специализация мышц, причем обеспечение энергией у разных мышечных клеток принципиально различается: есть "красные" мышцы и "белые" мышцы. Красные мышцы - "медленные" оксидативные мышцы. Они имеют хорошее кровоснабжение, много митохондрий, высокая активность ферментов окислительного фосфорилирования. Предназначены для работы в аэробном режиме. Например, такие мышцы служат для поддержания тела в определенном положении (позы, осанка). Белые мышцы - "быстрые", гликолитические. В них много гликогена, у них слабое кровоснабжение, высока активность ферментов гликолиза, креатинфосфокиназы, миокиназы. Они обеспечивают работу максимальной мощности, но кратковременную. У человека нет специализированных мышц, но есть специализированные волокна: в мышцах-разгибателях больше "белых" волокон, в мышцах спины больше "красных" волокон. Существует наследственная предрасположенность к мышечной работе - у одних людей больше "быстрых" мышечных волокон - им рекомендуется заниматься теми видами спорта, где мышечная работа максимальной интенсивности, но кратковременная (тяжелая атлетика, бег на короткие дистанции и тому подобное). Люди, в мышцах которых больше "красных" ("медленных") мышечных волокон, наибольших успехов добиваются в тех видах спорта, где необходима длительная мышечная работа средней интенсивности, например, марафонский бег (дистанция 40 км). Для определения пригодности человека к определенному типу мышечных нагрузок используется пункционная биопсия мышц. В результате скоростных тренировок (bodybuilding) утолщаются миофибриллы, кровоснабжение возрастает, но непропорционально увеличению массы мышечных волокон, количество актина и миозина возрастает, увеличивается активность ферментов гликолиза и креатинфосфокиназы. Более полезны для организма тренировки "на выносливость". При этом мышечная масса не увеличивается, но увеличивается количество миоглобина, митохондрий и активность ферментов ГБФ-пути. |
