14-15 Матричные биосинтезы. Матричные биосинтезы
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
|
МАТРИЧНЫЕ БИОСИНТЕЗЫ Основной фигурой матричных биосинтезов являются нуклеиновые кислоты. Они представляют собой полимерные молекулы, в состав которых входят азотистые ос- нования пяти типов, пентозы двух типов и остатки фосфорной кислоты. Азотистые основания в нуклеиновых кислотах могут быть пуриновыми (аденин, гуанин) и пиримидиновыми (цитозин, урацил, тимин). В зависимости от строения углевода выделяют рибонуклеиновые кислоты – со- держат рибозу (РНК), и дезоксирибонуклеиновые кислоты – содержат дезоксирибо- зу (ДНК). О СНО ВНОЙ ПО СТУЛАТ МОЛЕК У ЛЯ РНОЙ БИОЛОГИИВ подавляющем большинстве случаев передача наследственной информации от материнской клетки к дочерней осуществляется при помощи ДНК. Для использо- вания генетической информации самой клеткой необходимы РНК, образуемые на матрице ДНК. Далее РНК непосредственно участвуют на всех этапах синтеза белко- вых молекул, обеспечивающих структуру и деятельность клетки. На вышесказанном основана центральная догма молекулярной биологии, со- гласно которой перенос генети- ческой информации осуществля- ется только от нуклеиновой ки- слоты (ДНК и РНК). Получателем   информации может быть другая нуклеиновая кислота (ДНК или РНК) и белок. С ТРО Е НИ Е ДЕЗОКСИ - РИБО НУК Л ЕИНОВОЙ КИСЛО Т ЫДНК – наиболее важная часть хромосом: две двухцепочечные молекулы ДНК образуют одну хромосому. Наиболее хорошо хромосомы видны перед митозом и во время его. В покоящихся клетках хромосомный материал выглядит нечетко и распределен по всему ядру. В таком состоя- нии он получил название "хрома- тин". В составе хроматина выде- ляют 60% белка (гистоны и кис- лые белки), 35% ДНК и около 5% РНК. 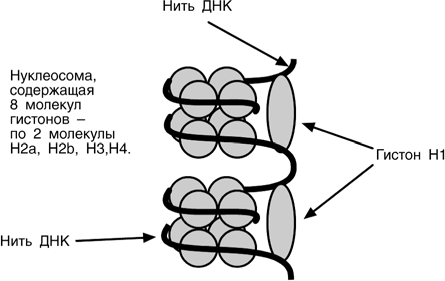  Хроматин уложен в виде сферических частиц – нуклеосом, соединенных друг с другом нитью ДНК. Нуклеосома представляет собой комплекс участка молекулы ДНК и восьми молекул гистонов. В составе нуклеосомы находятся по 2 молекулы гисто- нов Н2, Н2, Н3, Н4. Нить ДНК последовательно контактируя с гистонами Н2, Н2, Н4, Н3, Н3, Н4, Н2, Н2, наматывается на гистоновое ядро, которое "маскирует" 146 пар оснований ДНК. Гистон Н1 связывается с нуклеосомой на участке входа и выхода ДНК, "склеивая" 2 оборота и "маскируя" еще 20 пар оснований. Всего за- маскировано 166 пар оснований. Кроме нуклеосом, в ядре присутствуют еще 2 структуры: фибриллы диаметром 10 нм, состоящие из цепочки нуклеосом, и волокна, диаметром 30 нм, об- разующиеся при закручивании фибрилл в спираль. На виток спирали приходится 6-7 нуклеосом. Участок ДНК между нуклеосомами называется спейсерным (англ: space – пространство), его длина варьирует в зависи- мости от вида организма и типа клеток. У человека она составляет около 50 пар нуклеотидов.  Благодаря наличию нуклеосом достигается уменьшение размеров хромосомы в 7 раз, далее про- исходит укладка в суперспираль и „суперсуперспи- раль". Таким образом, благодаря гистонам размеры ДНК уменьшаются в тысячи раз: если длина ДНК дос- тигает 6-9 см (10-1), то размеры хромосом – всего не- сколько микрометров (10-6). Хроматин может быть активным (эухроматин) и неактивным (гетерохроматин). Активный хроматин содержит активные гены, т.е. те гены, с которых счи- тывается информация. В активном хроматине нук- леосомная структура изменена или вообще отсутству- ет, благодаря чему ДНК становится доступной для со- ответствующих ферментов. СТРОЕНИЕ РИБОНУКЛЕИНО - ВЫХКИСЛОТ Рибонуклеиновая кислота (РНК) представляет со- бой последовательность рибонуклеозидмонофосфа- тов, связанных друг с другом 5’-3’-фосфодиэфирными связями. РНК отличается от ДНК однонитевой струк- турой, наличием урацила вместо тимина и рибозы вместо дезоксирибозы В клетке присутствует четыре типа РНК: Рибосомальные РНК (рРНК) у прокариот и эукариот различны и отличаются ве- личиной седиментации (S, величиной скорости оседания молекулы). У прокариот три разновидности рРНК: 5S, 16S и 23S. У эукариот четыре разновидности: 5S, 5,8S, 18S и 28S. Рибосомальные РНК участвуют в построении рибосом, внутриклеточных бе- локсинтезирующих органелл. Рибосомы состоят из двух неравных субчастиц, малой и большой. У прокариот
У эукариот
Матричные РНК (мРНК) представляют собой линейную последовательность нуклеотидов. К 5’-концу молекулы присоеди- нен метилгунозиндифосфат, на 3’-конце име- ется полиадениловая последовательность. Их функция – информационная, т.е. перенос ин- формации о структуре белков от ДНК к месту их синтеза. 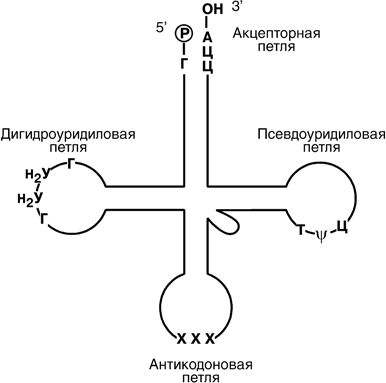 Транспортные РНК (тРНК) бактерий и эу- кариот включают 73-93 нуклеотида. Они пере- носят аминокислоты из цитозоля к рибосомам. Вторичная структура тРНК напоминает кле- верный лист, а третичная – латинскую букву L. В «клеверном листе» выделяют четыре участ- ка (или ветви, петли), каждый из которых име- ет собственную функцию: антикодоновый, псевдоуридиловый, дигидроуридиловый, ак- цепторный. На 5’-конце тРНК находится гуани- ловый нуклеотид, на 3’-конце – триплет Ц-Ц-А.
РЕПЛИКАЦИЯ ДН КСинтез ДНК в клетке происходит не беспорядоч- но, а в строго определенный период жизни клетки. Всего выделяют 4 фазы: митоз (М), синтетическую (S), пресинтетическую (G1, от англ. gap - интервал), постсинтетическую (G2).  Важное участие в регуляции смены фаз клеточно- го цикла занимают циклины – белки массой 35-90 кДа, уровень которых меняется в ходе клеточ- ного цикла. По функции циклины – это активаторные субъединицы ферментов циклин-зависимых киназ (ЦЗК). Активные комплексы циклин-ЦЗК фосфорили- руют внутриклеточные белки, изменяя их активность. Этим обеспечивается продви- жение по клеточному циклу. Синтез (репликация, удвоение) ДНК про- исходит в S-фазу клеточного цикла. Механизм репликации, как установили экс- перименты Мэтью Мезельсон и Франклин Сталь в 1957 г, полуконсервативный, т.е. на каждой нити материнской ДНК синтезиру- ется дочерняя копия.  Весь процесс репликации идет в S-фазу клеточного цикла, в то время, когда клетка готовится к делению. Как матричный биосинтез, репликация требует наличия нескольких условий:
Синтез ДНК начинается в определенных участках, получивших название точка ori (англ. origin - начало). На каждой ДНК млекопитающих точек ori насчитывается около 100. Репликация распространяется от этих участков в обе стороны по нитям ДНК с образованием "репликативных пузырей". В каждом таком "пузыре" имеются две "репликативные вилки", в которых происходит расплетание, раскручивание и непосредственный синтез ДНК. Репликативные вилки удаляются друг от друга. В це- лом вся репликация ДНК у эукариот заканчивается за 9 часов.  В каждой репликативной вилке идет синтез ДНК в направлении от 5'-конца к 3'-концу, т.е. 5'-конец новой ДНК остается свободным, следующие нуклеотиды при- соединяются к 3'-гидроксильной группе предыдущего нуклеотида. Поскольку нити ДНК антипараллельны, то непрерывно синтезируется только одна нить, а именно та, на которой направление движения репликативной вилки совпадает с направлением 3' 5'. По мере расплетания и движения репликативной вилки на нити открываются участки, где возможен синтез новой нити в направлении 5' 3'. 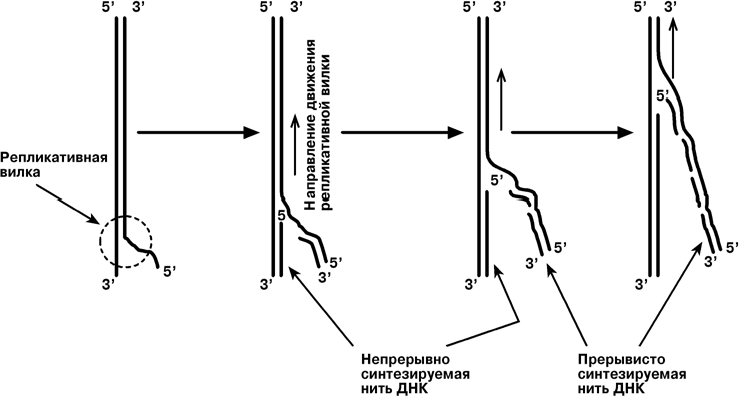 Направление 5' 3' другой материнской нити ДНК совпадает с направлением движения репликативной вилки. Поэтому синтез дочерней нити (в направлении 5' 3') возможен только после расплетания части ДНК и освобождения участка для синтеза. Таким образом, синтез дочерней ДНК на одной из нитей материнской ДНК идет фрагментарно. По имени японского исследователя синтезируемые на отстающей цепи отрезки ДНК назвали фрагменты Оказаки. В целом для синтеза ДНК необходим ряд ферментов. Ферменты репликации эукариот и их функция
Роль ферментов репликации ДНК 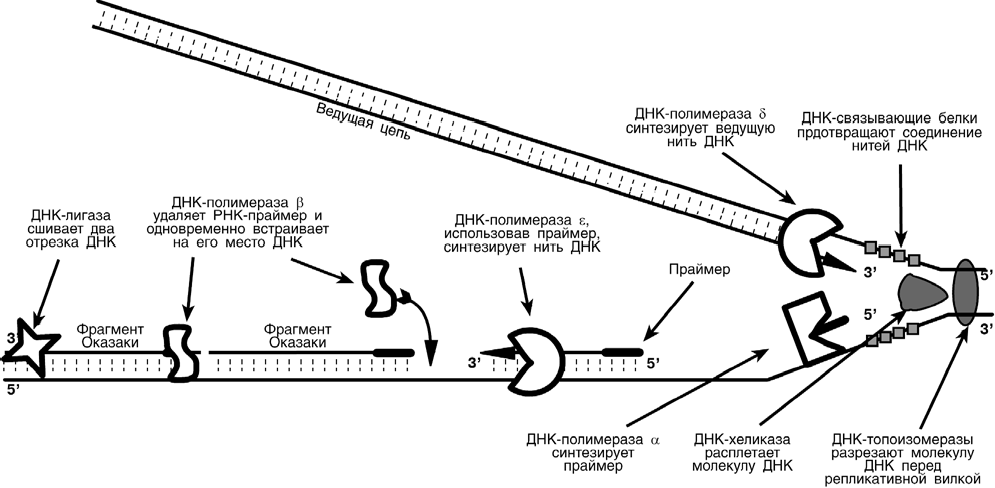 Дополнение – движение репликативной вилки и синтез нитей ДНК:  П ОВ РЕЖДЕН И Я И РЕПАРАЦ ИЯ ДНК . Так как на геном любой неделящейся клетки постоянно оказывает влияние окру- жающая среда, то вполне вероятны повреждения в составе генома: изменение нук- леотида (например, дезаминирование), сшивки азотистых оснований друг с другом, разрывы цепей, отрыв пуриновых нуклеотидов и т.п. Такие изменения быстро опре- деляются специальными ферментами, пораженный участок удаляется экзонуклеа- зами, заполняется ДНК-полимеразой и сшивается ДНК-лигазой. В делящейся клетке мутации могут также возникать во время синтеза ДНК. По- этому в клетках существует двойная система проверки точности репликации: одна непосредственно при ДНК-полимеразной реакции, другая – анализ уже синтезиро- ванной ДНК. Г ИБРИДИЗАЦИЯ ДНК – ДНК И ДНК – РНК Если нагреть раствор ДНК выше температуры 90С или сдвинуть рН в резко ще- лочную или резко кислую стороны, то водородные связи между нитями ДНК разру- шаются, двойная спираль расплетается. Происходит денатурация ДНК или, по- другому, плавление. Если удалить агрессивный фактор, то происходит ренатура- ция или отжиг. При отжиге нити ДНК "отыскивают" комплементарные участки друг у друга и, в конце концов, вновь сворачиваются в двойную спираль. Если в одной "пробирке" провести плавление и отжиг смеси ДНК человека и мы- ши, то некоторые участки цепей ДНК мыши будет воссоединяться с комплементар- ными участками цепей ДНК человека с образованием гибридов. Число таких участ- ков зависит от степени родства видов. Чем ближе виды между собой, тем больше участков комплементарности нитей ДНК. Это называется гибридизация ДНК-ДНК. Если в растворе присутствует РНК, то можно осуществить гибридизацию ДНК- РНК. Это помогает установить близость определенных последовательностей ДНК с какой-либо РНК. Гибридизация ДНК-ДНК и ДНК-РНК используется как эффективное средство в молекулярной генетике. Например, на основе знания белковой последовательности можно искусственно синтезировать РНК. При гибридизации такой РНК с образцами ДНК вполне реально определить участок ДНК, ответ- ственный за синтез исходного белка. ТРАНСКРИПЦИЯТранскрипция (англ. transcription – переписывание), – это биосинтез РНК на мат- рице ДНК. Биосинтез РНК происходит в участке ДНК, который называется транс- криптом, с одного края он ограничен промотором (начало), с другого – терминато- ром (конец). Как в любом матричном биосинтезе в транскрипции выделяют 5 необходимых элементов:
Существует три основных типа РНК-полимераз: для синтеза пре-рРНК (РНК- полимераза I), для синтеза пре-мРНК (РНК-полимераза II), для синтеза пре-тРНК и 5S-рРНК (РНК-полимераза III). В составе РНК-полимеразы E.coli выделяют четыре субъединицы: две -субъединицы, по одной - и ’-субъединице. Имеется также дополнительный бел- ковый -фактор Последний необходим только для связывания с промотором и не участвует в удлинении цепи РНК. Строение РНК-полимераз эукариот имеет много общего со структурой бактери- ального фермента: они имеют по две больших субъединицы и несколько малых субъединиц. С ТАДИ И ТРАНКРИПЦИИИнициация Промотор содержит стартовый сигнал транкрипции ТАТА-бокс – определенную последовательность нуклеотидов ДНК, присоединяющий инициирующий ТАТА-фактор. Этот ТАТА-фактор обеспечивает присоединение РНК-полимеразы к той нити ДНК, которая будет использоваться в качестве шаблона для транскрипции. Так как промотор ассиметричен, то он связывает РНК-полимеразу только в одной ориентации, что определяет направление транскрипции от 5’-конца к 3’-концу (5’ 3’). Другие факторы инициации раскручивают спираль ДНК перед РНК-полимеразой. После синтеза затравочного фрагмента РНК длиной 8-10 рибонуклеотидов -фактор отрывается от фермента.  Элонгация Белковые факторы элонгации обеспечивают продвижение РНК-полимеразы вдоль ДНК и расплетание нитей ДНК на протяжении примерно 17 нуклеотидных пар. РНК-полимераза продвигается со скоростью примерно 40-50 нуклеотидов в секунду в направлении 5’ 3’. Используя одновременно в качестве субстрата и источника энергии АТФ, ГТФ, ЦТФ, УТФ. ТерминацияРНК-полимераза остановится, когда достигнет терминирующих кодонов. С по- мощью белкового фактора терминации, так называемого -фактора (греч. - "ро"), от матрицы ДНК отделяются фермент и синтезированная молекула РНК, которая является первичным транскриптом, предшественником мРНК или тРНК или рРНК. ПРОЦЕССИНГ РНК .Снтезированные молекулы РНК являются и в дальнейшем претерпевают ряд изменений, которые называются процессингом. У эукариот процессингу подверга- ются все виды пре-РНК, у прокариот – только предшественники рРНК и тРНК. П РОЦ Е ССИНГ ПРЕДШЕСТВЕННИКА М РНК

П РОЦ Е ССИНГ ПРЕДШЕСТВЕННИКА Р РНКПредшественники рРНК являются более крупными молекулами по сравнению со зрелыми рРНК У прокариот большая прерибосомная 30S-РНК расщепляется специфичными нуклеазами с образованием 5S-рРНК, 16S-рРНК, и 23S-рРНК. У эукариот большая прерибосомная 45S-РНК расщепляется специфичными нуклеазами с образованием 5,8S-рРНК, 18S-рРНК, и 28S-рРНК. П РОЦ Е ССИНГ ПРЕДШЕСТВЕННИКА Т РНК
РЕГУЛЯЦИЯ ТРАНСКРИПЦИИП РОК А РИОТЫРегуляция биосинтеза белка у прокариот осуществляется на уровне транскрип- ции мРНК. В настоящее время принята теория оперона, сформулированная Франсуа Жакобом и Жако Моно. В основе теории лежат следующие понятия:
висимо от ее активности
нов и один ген-оператор), которые регулируют образование ферментов в орга- низме.
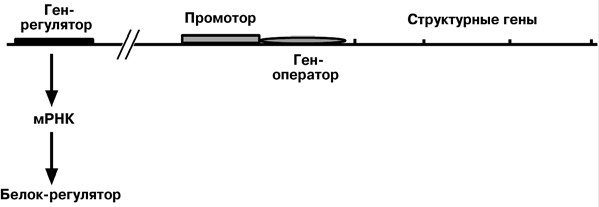 Лактозный оперон При изучении E.coli было замечено, что активность одного из ферментов катабо- лизма лактозы низка, если в среде имеется глюкоза. При отсутствии же глюкозы и при наличии лактозы активность фермента резко повышается. На основании этих наблюдений была предложена схема регуляции оперона по механизму индукции. В отсутствие лактозы активный белок-репрессор связывается с оператором и блокирует синтез мРНК, кодирующей ферменты катаболизма лактозы. В результате эти ферменты не образуются.  Если глюкозы нет, и есть лактоза, то последняя связывается с белком- репрессором и модифицирует его, не позволяя связаться с геном-оператором. Это позволяет РНК-полимеразе считывать информацию, отвечающую за синтез фер- ментов катаболизма лактозы, и синтезировать мРНК. Таким образом, лактоза является индуктором транскрипции. Триптофановый оперонФункционирование триптофанового оперона, в некотором смысле, противопо- ложно работе лактозного. В данном случае, в отличие от лактозного оперона, белок- репрессор синтезируется в неактивном состоянии и не может заблокировать транс- крипцию генов, кодирующих ферменты синтеза триптофана. Синтез аминокислоты будет в клетке продолжаться до тех пор, пока в среде не появится триптофан.  Триптофан соединяется с белком-репрессором и активирует его. Далее такой активный комплекс присоединяется к гену-оператору и блокирует транскрипцию. Та- ким образом, при наличии триптофана в среде, прекращается его внутриклеточный синтез, экономятся ресурсы и энергия бактериальной клетки. В этом случае триптофан является репрессором транскрипции. Регуляция осу- ществляется по механизму репрессии. Э УК АР ИОТЫСущественное усложнение эукариотических организмов повлекло за собой появ- ление новых способов регуляции активности матричных биосинтезов: Амплификация – это увеличение количества генов, точнее многократное копи- рование одного гена. Естественно, все полученные копии равнозначны и одинаково активно обеспечивают транскрипцию. Например, противоопухолевый препарат метотрексат препятствует работе ди- гидрофолатредуктазы, фермента, необходимого для синтеза дезоксирибонуклеоти- дов. При этом в опухолевых клетках происходит амплификация гена этого фермен- та, что приводит к многократному увеличению синтеза дигидрофолатредуктазы и невосприимчивости опухолевых клеток к метотрексату. Энхансеры (англ. to enhance - усиливать) – участки ДНК в 10-20 пар оснований, способные значительно усиливать экспрессию генов той же ДНК. В отличие от про- моторов они значительно удалены от транскрипционного участка и могут распола- гаться от него в любом направлении (к 5’-концу или к 3’-концу). Сами энхансеры не кодируют какие-либо белки, но способны связываться с регуляторными белками. Сайленсеры (англ. silence - молчание) – участки ДНК, в принципе схожие с эн- хансерами, но они способны замедлять транскрипцию генов, связываясь с регуля- торными белками. Перестройка генов. Нуклеотидные последовательности, кодирующие белковую молекулу могут оказаться разделенными на отдельные сегменты, не связанные ме- жду собой. Например, иммуноглобулины состоят из тяжелой и легкой цепей, каждая из которых включает собственные вариабельную и константную части. Существует множество вариантов как вариабельной, так и константной частей. Генетическая информация об этих вариантах локализована подчас в разных хромосомах. При дифференцировке В-лимфоцитов значительно удаленные сегменты генетического материала переносятся и группируются рядом – происходит генетическая реком- бинация. Процессинг мРНК – некоторые пре-мРНК подвергаются разным вариантам сплайсинга (альтернативный сплайсинг) в результате чего образуются разные мРНК, и соответственно, белки с разной функцией. Примером может служить обра- зование двух типов тяжелых цепей IgM в В-лимфоцитах, один из которых удержива- ет IgM на мембране, другой позволяет антителу нормально секретироваться наружу. Изменение стабильности мРНК – чем выше продолжительность жизни мРНК в цитозоле клетки, тем больше соответствующего белка наработается. Например, ус- тановлено, что при наличии пролактина в клетках молочной железы время полужиз- ни мРНК белка казеина значительно увеличивается, а эстрадиол продлевает время полужизни мРНК белка вителлогенина в десятки раз. Транспорт из ядра в цитоплазму –Л Е К АР СТ ВЕ ННОЕ И Н ГИБИ Р О ВАНИ Е
Л ЕКАРСТВЕННАЯ АКТИВАЦИЯАктивация транскрипции используется в клинике намного реже и заключается в применении аналогов стероидных гормонов для достижения анаболического эффек- та в органе-мишени (см тему "Гормоны"/"Механизм действия стероидных гормонов"). БИОЛОГИЧЕСКИЙ КОДБиологический код – это способ перевода четырехзначного языка нуклеотидов в двадцатизначный язык аминокислотной последовательности. С ВОЙСТВА БИОЛОГИЧЕСКОГО КОДА :Триплетность – три нуклеотида формируют кодон, кодирующий аминокислоту. Всего насчитывают 61 кодон. Специфичность (или однозначность) – каждому кодону соответствует только одна аминокислота. Вырожденность – одной аминокислоте может соответствовать несколько кодо- нов. Универсальность – биологический код одинаков для всех видов организмов на Земле (однако в митохондриях млекопитающих есть исключения). Колинеарность – последовательность кодонов соответствует последовательно- сти аминокислот в кодируемом белке. Неперекрываемость – триплеты не накладываются друг на друга, располагаясь рядом. Отсутствие знаков препинания – между триплетами нет дополнительных нук- леотидов или каких-либо иных сигналов. При синтезе белка считывание кодонов идет последовательно, без пропусков или возвратов назад. Однонаправленность – ??? АДАПТОРНАЯ РОЛЬ ТРАНСПОРТНЫХ РНКТранспортные РНК является единственным посредником между 4-х буквенной последовательностью нуклеиновых кислот и 20-ти буквенной последовательностью белков. Именно от наличия того или иного антикодона в тРНК зависит, какая амино- кислота включится в белковую молекулу, т.к. ни рибосома, ни мРНК не узнают ами- нокислоту. Присоединение аминокислоты к тРНК осуществляется ферментом аминоацил- тРНК-синтетазой, имеющей специфичность одновременно к двум соединениям: ка- кой-либо аминокислоте и соответствующей ей тРНК. 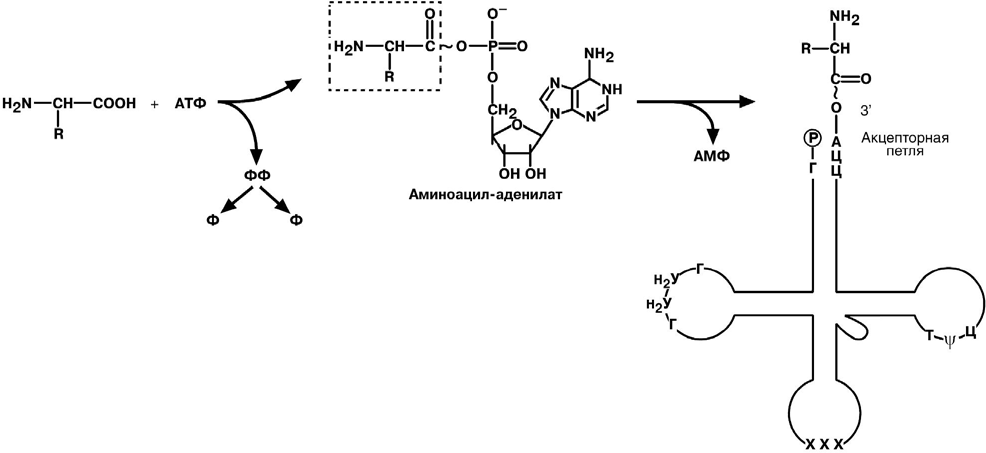 Так как существует около 60 различных тРНК, то некоторым аминокислотам со- ответствует две или более тРНК. Транспортные РНК, способные присоединять одну и ту же аминокислоту называют изоакцепторными БИОСИНТЕЗ БЕЛКОВПосле считывания информации с ДНК и переноса ее на матричную РНК начина- ется синтез белков. Каждая зрелая мРНК несет информацию только об одной поли- пептидной цепи. Если клетке необходимы другие белки, то необходимо транскриби- ровать мРНК с иных участков ДНК. Биосинтез белков или трансляция происходит на рибосомах, внутриклеточных белоксинтезирующих органеллах, и включает 5 ключевых элементов:
Выделяют три основных стадии трансляции: инициация, элонгация, терминация. И НИЦИ АЦИЯДля инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосо- мы, три белковых фактора инициации (ИФ-1, ИФ-2, ИФ-3), метионин и тРНК для ме- тионина В начале этой стадии формируются два тройных комплекса: первый – мРНК, ма- лая субъединица, ИФ-3; второй – мет-тРНК, ИФ-2, ГТФ. После их объединения и присоединения большой субъединицы начинается стадия элонгации.  Э ЛОНГАЦИЯДля этой стадии необходимы все 20 аминокислот, тРНК для всех аминокислот, белковые факторы элонгации, ГТФ. Элонгация представляет собой циклический процесс, повторяющийся столько раз, сколько аминокислот необходимо включить в полипептидную цепь. Удлинение цепи происходит со скоростью примерно 20 амино- кислот в секунду. 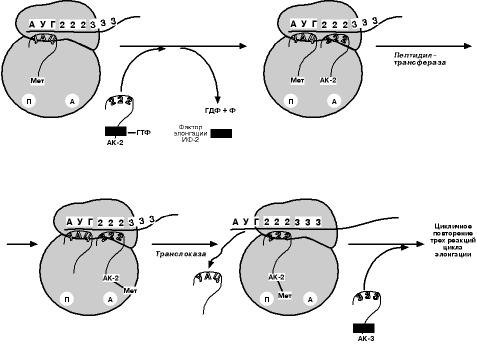 Т ЕРМИ Н АЦИЯСинтез белка будет продолжаться до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные три- плеты не кодируют ни одной из аминокислот, их также называют нонсенс-кодоны. Кроме стоп-кодонов для окончания синтеза белка требуются ГТФ и белковые факто- ры терминации, которые последовательно катализируют
 П ОЛИРИБОСО МЫПо причине того, что продолжительность жизни матричной РНК невелика, перед клеткой стоит задача использовать ее максимально эффективно, т.е. получить мак- симальное количество «белковых копий». Для достижения этой цели на каждой мРНК может располагаться не одна, а несколько рибосом, встающих последова- тельно друг за другом и синтезирующих пептидные цепи. Такие образования назы- ваются полирибосомы. ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ БЕЛКОВЧаще всего в результате трансляции полипептидные цепи образуются в неак- тивной форме, поэтому необходимы дополнительные изменения – процессинг. К ним относятся:
предшественников тиреоидных гормонов йодтиронинов.
ФОЛДИНГ БЕЛКОВФолдинг – это процесс сворачивания полипептидной цепи в правильную про- странственную структуру. Для обеспечения фолдинга используется группа вспомо- гательных белков под названием шапероны (chaperon, франц. – спутник). Они пре- дотвращают взаимодействие новосинтезированных белков друг с другом, изолируют гидрофобные участки белков от цитоплазмы, способствуют переходу вторичной структуры в третичную. При нарушении функции шаперонов и отсутствии фолдинга в клетке формируют- ся белковые отложения – развивается амилоидоз. Насчитывают около 15 вариан- тов амилоидоза. ЛЕКАРСТВЕННАЯ РЕГУЛЯЦИЯ
ГЕНОТИПИЧЕСКАЯ ГЕТЕРОГЕННОСТЬВ результате того, что каждый ген у человека имеется в двух копиях (аллелях), может подвергаться мутациям (замена, делеция, вставка) и рекомбинациям, серьез- но не затрагивающим функцию кодируемого белка, то возникает полиморфизм ге- нов, и, соответственно, полиморфизм белков. Возникают целые семейства родст- венных белков, обладающих схожими, но не одинаковыми свойствами и функцией. Например, существует около 300 разных типов гемоглобина, часть из них явля- ется необходимой на разных этапах онтогенеза: например, HbE – эмбриональный, образуется в первые месяцы развития, HbF – фетальный, необходим на более поздних сроках развития плода, HbA и HbA2 – гемоглобин взрослых. Разнообразие обеспечивается разным набором глобиновых цепей: в гемоглобине E присутствуют 2 и 2 цепи, в HbF – 2- и 2- цепи, в HbА – 2- и 2-цепи, в HbА2 – 2- и 2-цепи. Группы крови АВО зависят от строения особого углевода на мембране эритро- цитов. Лица с группой крови А0 на эритроците имеют олигосахарид с присоединен- ным к нему N-ацетилгалактозамином, с группой крови В0 – олигосахарид с галакто- зой, 00 – имеют только «чистый» олигосахарид. АВ – оба вида сахаридов. Такие раз- личия обусловлены разной специфичностью и активностью фермента гликозил- трансферазы, способного модифицировать исходный олигосахарид. Белки главного комплекса гистосовместимости обеспечивают транспланта- ционную несовместимость тканей. Они обладают чрезвычайно высоким полимор- физмом и насчитывают несколько миллионов аллелей этих белков. Благодаря тако- му разнообразию каждый человек обладает практически уникальным набором алле- лей. 1–Антитрипсин – |

