Основные вопросы темы
1. Определение ВМС.
ВМС получили такое название благодаря большой относительной молекулярной массе, которая измеряется десятками и сотнями тысяч единиц.
Пример: Н2О – 18 г/моль СО2 - 44 г/моль
Натуральный каучук (С5Н8)n 74·106 г/моль
Макромолекула построена из одинаковых многократно повторяющихся звеньев - мономеров,
Пример: натуральный каучук - С5Н8 - мономер
крахмал - С5Н10 О5 - мономер
ВМС нелетучи, не существуют в парообразном состоянии. Характерно три физических состояния:
-стеклообразное
-высокоэластичное
- вязкотекучее
Действие света, кислорода, температуры приводит к старению полимера.
2. Классификация ВМС и методы получения.
а) природные
Природные ВМС – белки, полисахариды, натуральный каучук.
Синтетические – полиэтилен (С2Н4 ) n
Молекулярная масса 25000-100000;
Полипропилен (-СН2- СН- )n ,молекулярная масса 18.10 – 30.10;
СН3
поливинилхлорид (-СН2 – СН –) n , молекулярная масса 60000- 200000
Cl
n – степень полимеризации или многократно повторяющееся звено группы атомов, мономеров.
б) органические и неорганические.
Органические – целлюлоза, крахмал, полипропилен и т.д.
Неорганические – слюда, глина, графит, алмаз.
в) по составу главной цепи.
Карбоцепные, гетероцепные, элементоорганические.
г) по строению цепи
- линейные,
- разветвленные,
- сетчатые,
- спиральные.
По форме макромолекулы ВМС бывают линейные, разветвленные и сетчатые.
Макромолекулы линейных полимеров представляют собой длинные цепи, толщина которых значительно меньше длины. Линейная форма макромолекул объясняет типичные свойства полимеров: каучукоподобная эластичность, способность давать нити, образовывать пленки и др. Эти типичные для полимеров свойства определяются гибкостью линейных молекул, способностью к колебательно- вращательному движению отдельных звеньев вокруг соединяющих их одинарных связей(-С-С-). Вращение вокруг связи С-С возможно только при высоких температурах, т.к. необходима энергия активации для преодоления энергетического барьера, зависящего от природы атомов, из которых построена цепь.
Наличие в цепи макромолекулы двойных или тройных связей благоприятно влияют на подвижность смешанных с этой связью атомов или групп.
Наличие в макромолекуле полярных заместителей (-Cl;-OH; CN; -NH2) делает макромолекулу менее гибкой, т.к. взаимодействие между заместителями повышает энергетический барьер.
Пример: жесткие макромолекулы - целлюлоза, полиакрилонитрил, поливинилхлорид.
Разветвление цепи увеличивает жесткость вследствие возрастания энергетического барьера вращения отдельных звеньев.
На гибкость макромолекулы могут влиять не только соседние молекулы того же полимера, но и молекулы растворителя и пластификатора.
Молекулярная масса ВМС.
Большинство полимеров полимолекулярны и для них пользуются понятием средней молекулярной массы. Различают средневесовую молекулярную массу, усредненную по массе частиц и среднечисленную молекулярную массу, усредненную по числу частиц.
Методы получения:
а) биосинтез,
б) полимеризация, поликонденсация.
ВМС растительного и животного происхождения получаются биосинтезом.
ВМС синтетические – реакцией полимеризации и поликонденсации.
3. Процесс растворения.
Первым этапом растворения ВМС с линейными гибкими молекулами, в отличие от низкомолекулярных соединений, является набухание. Причиной набухания является диффузия молекул растворителя в высокомолекулярное вещество, т.к. подвижность маленьких молекул растворителя во много раз больше подвижности макромолекул. Связь между макромолекулами ослабляется, и они отрываются от основной массы вещества и диффундируют в растворитель, образуя истинный раствор.
Например: «каучук + бензин»
Процесс растворения усложняется, когда молекулы растворителя взаимодействуют с молекулами ВМС.
Например: «желатин + вода»
«агар-агар + вода»
На первой стадии набухания происходит сольватация макромолекул. Эта стадия характеризуется выделением тепла и упорядочением расположения молекул растворителя около макромолекул.
Вторая стадия – проникновение молекул растворителя в вещество, разрушение связей между отдельными макромолекулами, вследствие чего цепи становятся свободными и способны совершать тепловое движение в целом.
Существует молекулярная теория растворов ВМС. Один из авторов этой теории, Штаудингер, предположил, что макромолекулы в растворе находятся в виде жестких палочек.
Растворение ВМС проникает самопроизвольно, часто с выделением тепла.
Растворы термодинамически устойчивы, при растворении полимеров всегда образуется гомогенная система. Растворение полимера не требует присутствия в системе специального стабилизатора. Растворы полимеров находятся в термодинамическом равновесии и являются обратимыми
системами.
В концентрированных растворах ВМС, как и в низкомолекулярных растворах, возможно образование ассоциатов за счет межмолекулярных взаимодействий, возникновения водородных связей, электростатических сил притяжения.
n (СН2 =СН2) → (-СН 2 -СН2 -) n
NH2 - CH2 – COOH + HNH – CH2 - COOH→
→NH 2 - CH2 -CO – NH - CH2COOH + H2O
4. Агрегативная устойчивость растворов ВМС.
Растворы ВМС агрегативно устойчивы. Нарушить устойчивость растворов полимеров можно путем понижения растворимости ВМС – введением электролитов или неэлектролитов (жидкостей, плохо растворяющих данный полимер - этанол, ацетон).
а) высаливание
Высаливание – процесс уменьшения растворимости ВМС при добавлении концентрированного раствора электролита.
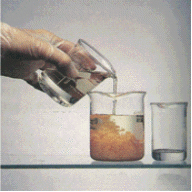
Причина - дегидратация молекул ВМС.
Порог высаливания – минимальная концентрация электролита, при которой наступает осаждение полимера.
Внешне процесс сходен с коагуляцией, однако требует большей концентрации электролита, не подчиняется правилу Шульце–Гарди и является обратимым процессом!!!
Максимальный высаливающий эффект вызывают первые члены лиотропных рядов:
SO42– > Cl– > NO3–> Br– > I– > CNS–
Li+ > Na+ > К+ > Rb +> Cs+
Последние члены лиотропного ряда анионов препятствуют высаливанию, поскольку адсорбируются на молекулы ВМС, привнося собственную гидратную оболочку!
Процесс высаливания (в комбинации с растворителями и температурой) позволяет выделить из сыворотки крови
до 12 различных белков!
Высаливание имеет большое практическое значение в целом ряде технологических процессов: в мыловарении, в производстве красителей, канифоли и многих искусственных волокон.
б) коацервация
Коацервация - процесс самопроизвольного расслоение на две несмешивающиеся фазы в растворах с достаточно высокой концентрацией ВМС.
Одна фаза представляет собой концентрированный раствор полимера- коацерват, другая - разбавленный раствор полимера
Явление коацервации, разделения раствора ВМС на две фазы, наблюдается при изменении температуры или рН при введении низкомолекулярных веществ. Обычно, при длительном стоянии системы образуются 2 гомогенных жидких слоя, состоящих из фаз с различным содержанием ВМС.
Поскольку растворы ВМС агрегативно устойчивы, то процесс коацервации есть процесс частичного уменьшения растворимости при изменении внешних условий.
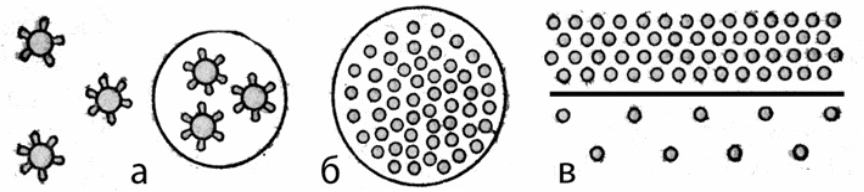
Схема коацервации:
а — образование первичной ультрамикроскопической капельки из гидратированных макромолекул;
б — вторичная капелька из «роя» первичных;
в — расслоение раствора с коацерватом наверху
Самопроизвольное образование коацерватов в мировом океане лежит в основе гипотезы А.И.Опарина (1922) о происхождении жизни.
5. Полиэлектролиты.
Диссоциация. Изоэлектрическое состояние белка.
Т.к. молекулы многих ВМС содержат иногенные группы,
то в растворах они могут распадаться на ионы.
Различат растворы ВМС :
-неэлектролты (каучуки, целлюлоза, ацетилцеллюлоза)
- электролиты (белки).
H2 N- R- COOH ↔ H 2N- R- COO- + H+ ↔ +NH3 -R- COO-
Заряд белковой молекулы определяется соотношением кислых и основных групп в нейтральной среде.
6. Влияние рН среды на заряд белка.
рН = ИЭТ белок нейтрален
рН ‹<ИЭТ положителен
рН > ИЭТ отрицательный
Методы определения ИЭТ.
1) электрофоретическая подвижность равна нулю
2) скорость желатинирования - максимальна
3) степень набухания - минимальна
4) вязкость раствора- минимальна
5) осмотическое давление- минимально
Вязкость и осмотическое давление растворов полиэлектролитов в ИЭТ понижается, т.к. макромолекулы теряют гибкость в этом состоянии.
4. Свойства растворов ВМС.
Методы определения размеров и молекулярной массы.
а) диффузионный
Растворы ВМС по молекулярно-кинетическим свойствам имеют сходство с коллоидными системами, потому для определения размеров и массы частиц можно применять общее методы.
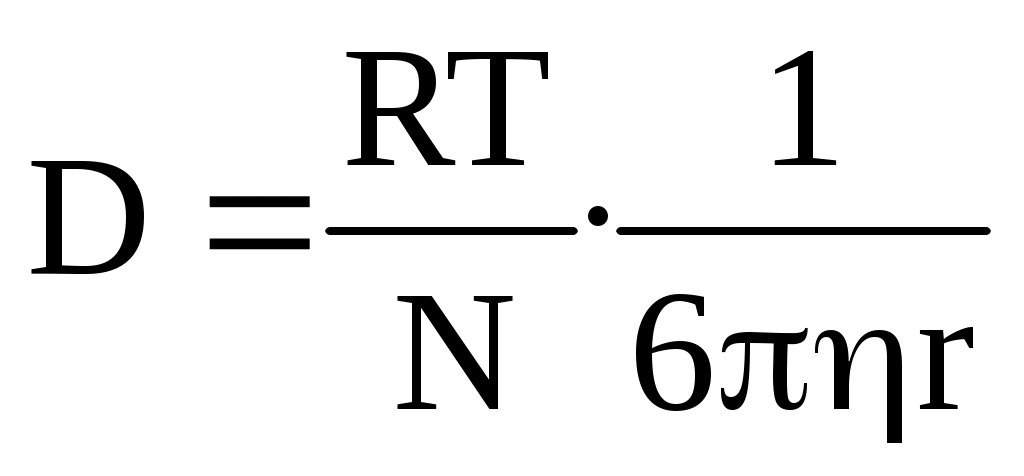
Для сферической частицы:
r → 4/3 πr3 - объем одной частицы
4/3 πr3d - масса одной частицы
М=4/3 πr3 dNА
б) седиментационный
Расчет молярной массы после нахождения радиуса аналогичен диффузионному методу.
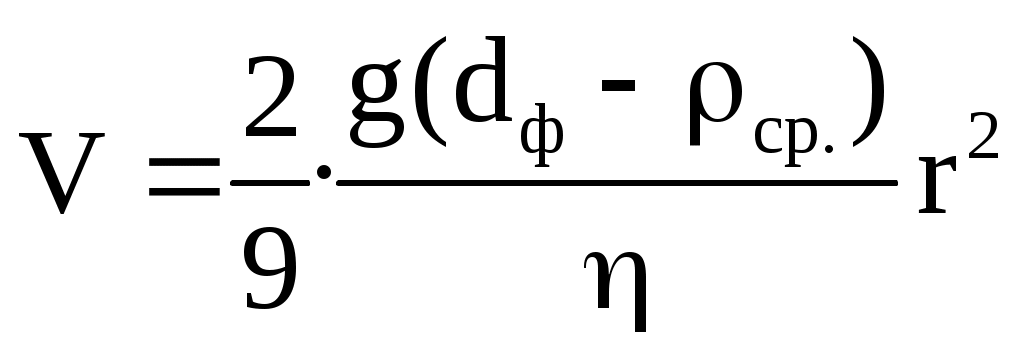
в)ультрацентрифугирование
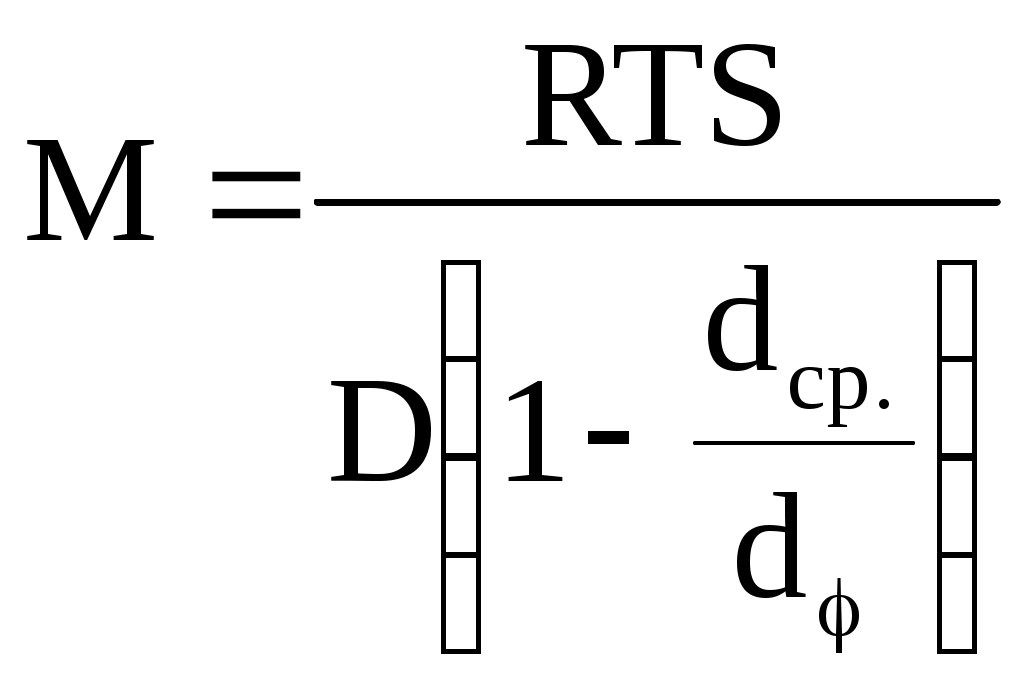
г) оптический
Растворы ВМС способны рассеивать свет, хотя и в меньшей степени, чем коллоидные р-ры. Светорассеивание обусловлено неоднородностью растворов полимеров, возникающей вследствие непрерывных небольших отклонений концентрации. Растворы ВМС помимо светорассеивания способны избирательно поглощать световые лучи
Метод основан на измерении мутности τ разбавленных растворов по уравнению Дебая:
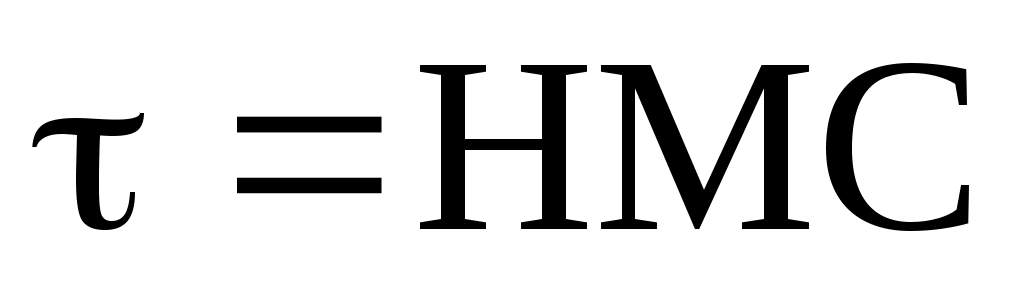
Н- константа, включающая величину показателя преломления
раствора с изменением концентрации
С - кмоль/ м 3
τ - мутность растовора
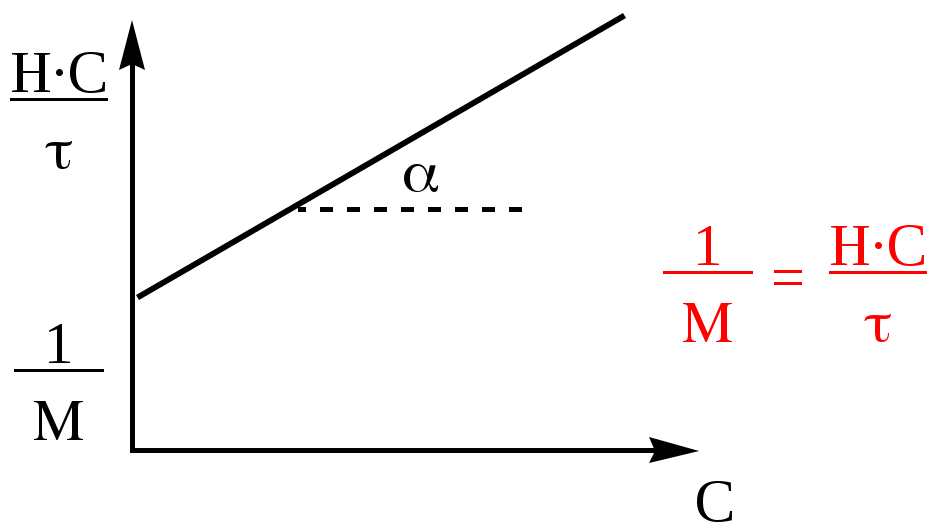
д) осмотический
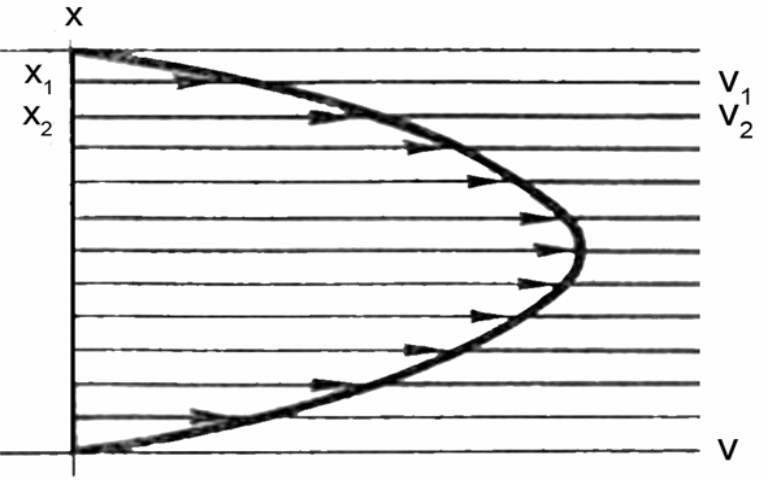
Осмотическое давление растворов ВМС рассчитывается по уравнению Галлера и существенно отличается от рассчитываемого согласно уравнению Вант-Гоффа
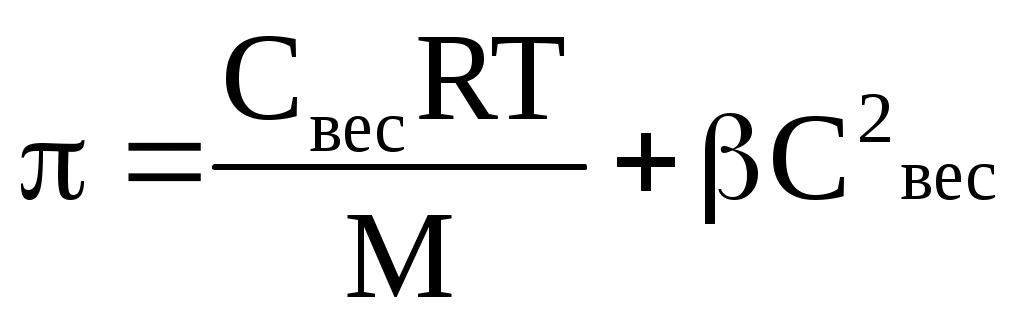
где β- степень гибкости молекулы
Причина - относительная независимость теплового движения отдельных участков полимерной молекулы.
Для однотипных молекул ВМС, количество таких участков будет тем большим, чем больше молекулярная масса М

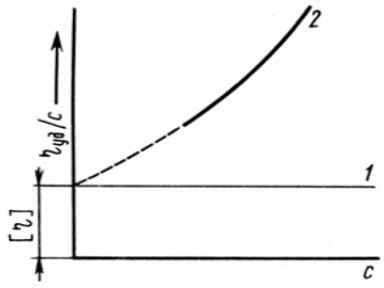
Верхняя кривая - раствор ВМС
Нижняя кривая – электролит
Из уравнения Галлера ( после деления всех членов уравнения на С
графически находят степень гибкости и молярную массу:
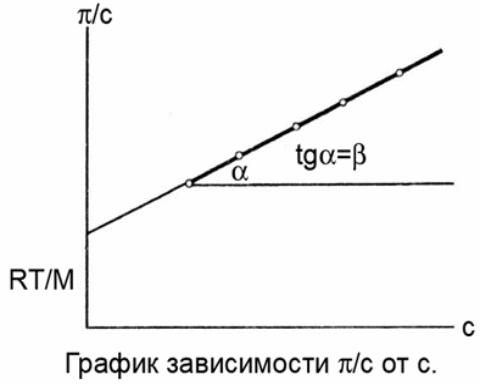
Измерение осмотического давления р-ра полимера в различных растворителях используется для определения молекулярной массы полимера, причем получают усредненную молекулярную массу, поскольку осмотическое давление пропорционально числу молекул растворимого полимера.
Осмометрический метод наиболее чувствителен при определении молекулярной массы полимеров.
Значение осмотического давления.
Осмотическое давление в жидкостях организма (кровь, лимфа, спинномозговая жидкость) влияет на распределение в тканях организма воды, солей и различных питательных веществ. Основной физиологический фактор - поддерживать осмотическое давление между кровью и тканевыми жидкостями.
Осмотическое давление крови равно 7,7 – 8,1 атм.
Онкотическое давление.
Часть осмотического давления крови, обусловленного присутствием ВМС, в основном, белками, называется онкотическим и составляет 0,04 атм.
Уравнение Доннана, выводы из него.
Значение эффекта Доннана
Уравнение Доннана учитывает распределение электролита между клетками и омывающей их жидкостью ( мембранное равновесие),
что оказывает большое значение на жизнедеятельность клетки, на величину биопотенциалов и величину осмотического давления.
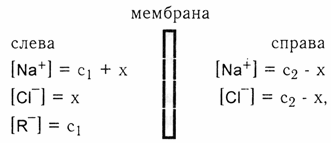
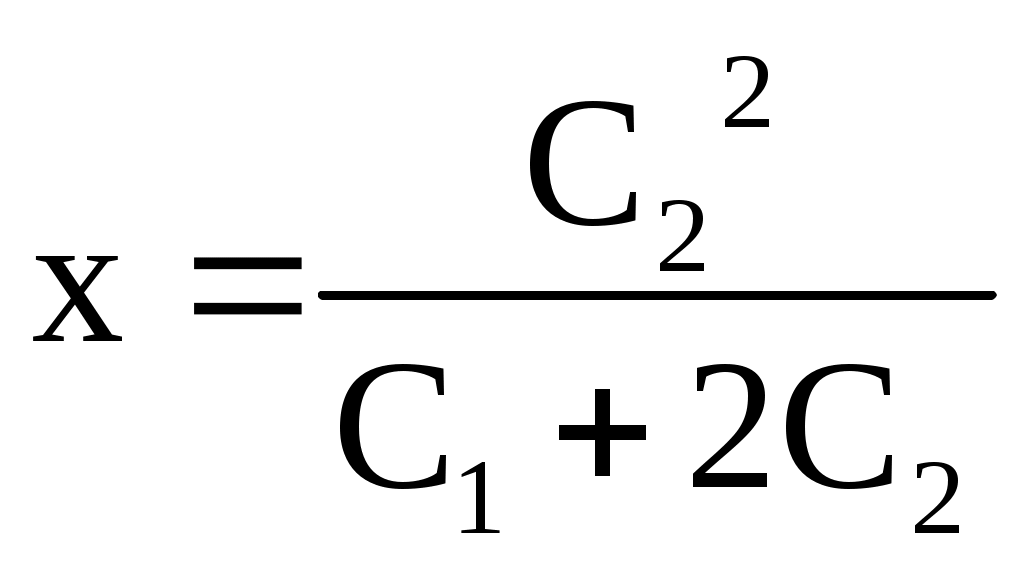
1. С2<<С1 – концентрация белка намного выше, чем соли, х<<1, то есть низкомолекулярный электролит NaCl практически не переходит через мембрану.
2. С2>>С1 – концентрация соли намного выше, чем белка
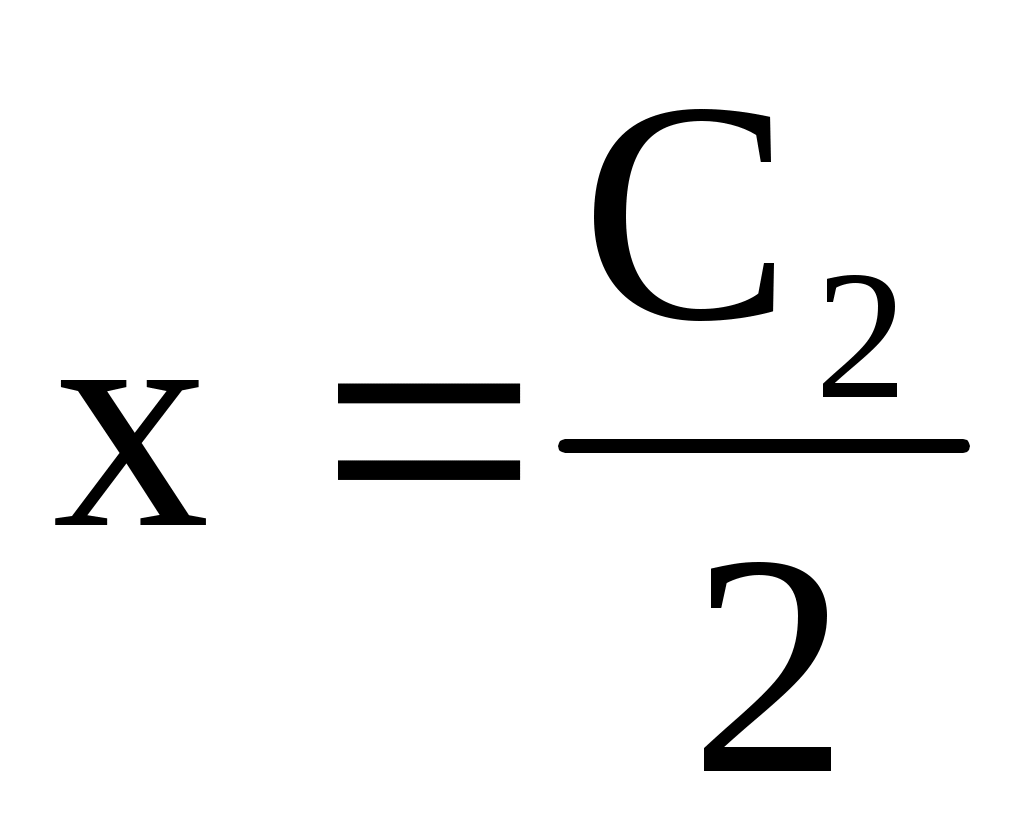
-концентрация NaCl в равновесных растворах одинакова.
3.При С2=С1 внутрь клетки переместится 1/3 ионов электролита, находящихся снаружи.
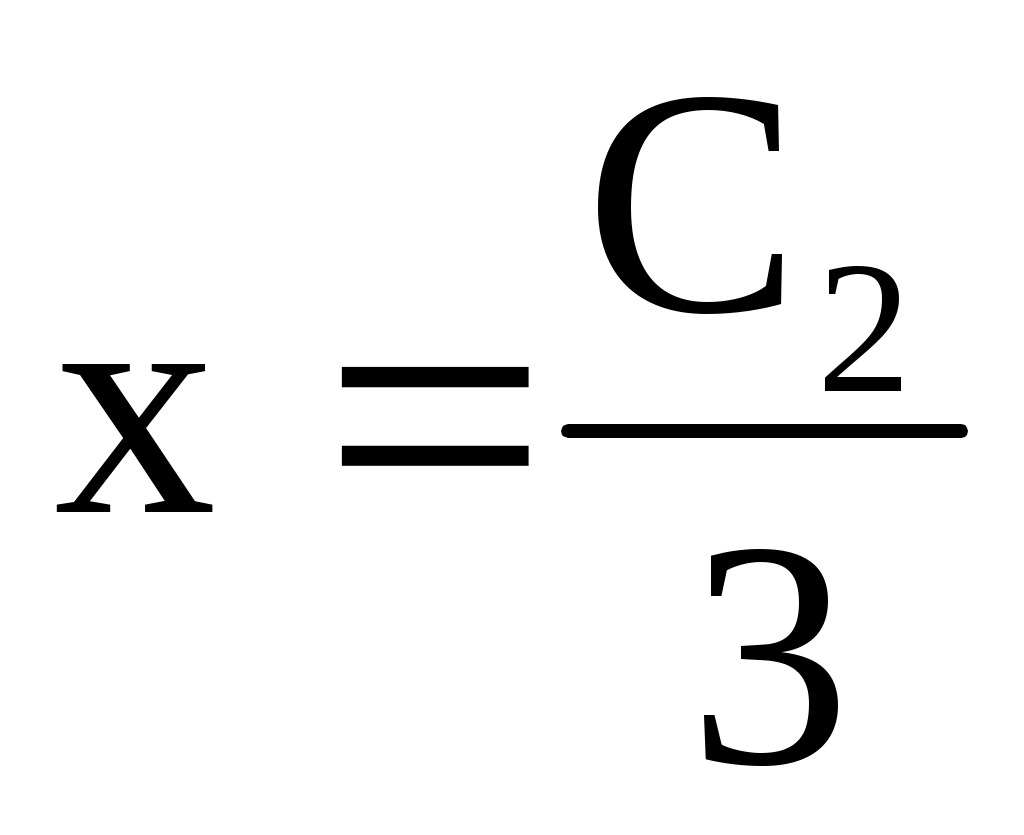
Вязкость растворов ВМС
Вязкость жидкостей - сопротивляемость жидкости ее движению под действием внешних сил.
Причина - внутреннее трение в жидкостях, обусловленное силами сцепления между молекулами.
Для жидкости, текущей под действием внешней силы по трубке или по капилляру. возникающая сила F вязкого сопротивления жидкости равна по величине и обратна по направлению внешней силе.
Абсолютная
Ньютон установил, что сила трения между двумя параллельными слоями жидкости, движущимися с различными скоростями, зависит от ее природ площади соприкосновения слоев, градиента скорости
Относительная
Относительная вязкость- отношение вязкости раствора к вязкости
р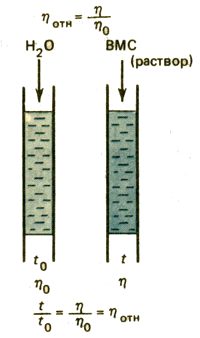 астворителя астворителя
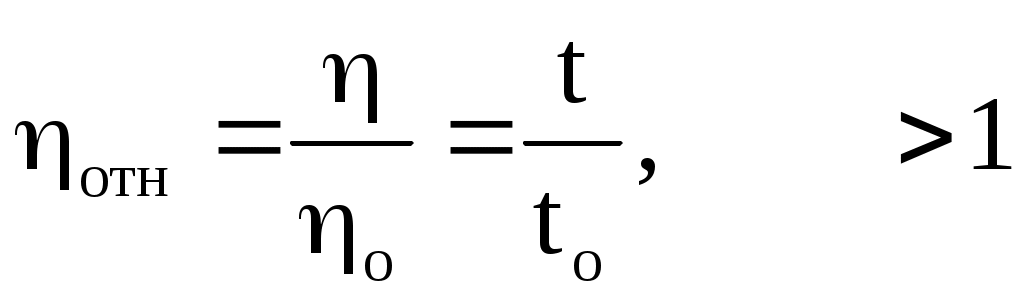
Относительная вязкость крови в норме
4,2-6 ед. при патологи смещается до 2-3 ед. (анемии), или до 15-20 (полицитемии).
Удельная
Удельная вязкость отражает возрастание относительной вязкости по сравнению с единицей и учитывает зависимость от концентрации:
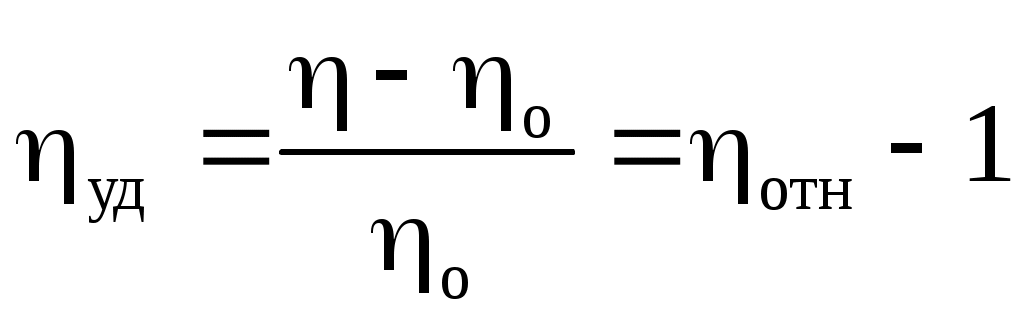
Удельная вязкость также связана с молярной массой полимера по уравнению Штаудингера:
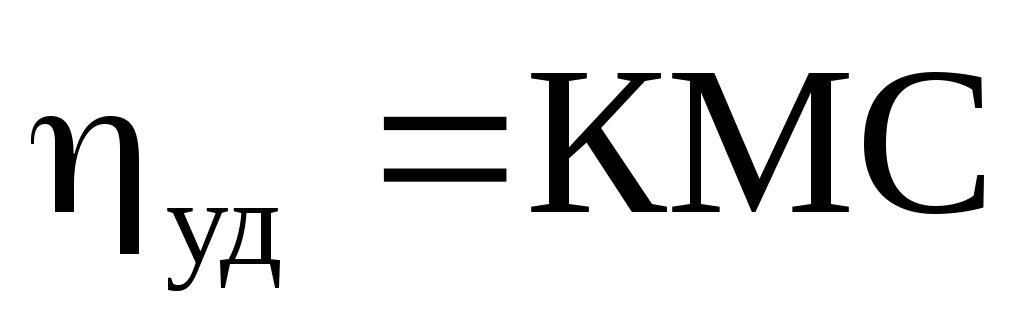
Приведенная
Приведенная вязкость раствора полимера не должна зависеть от концентрации, однако у большинства из них она возрастает с увеличением концентрации в результате взаимодействия макромолекул
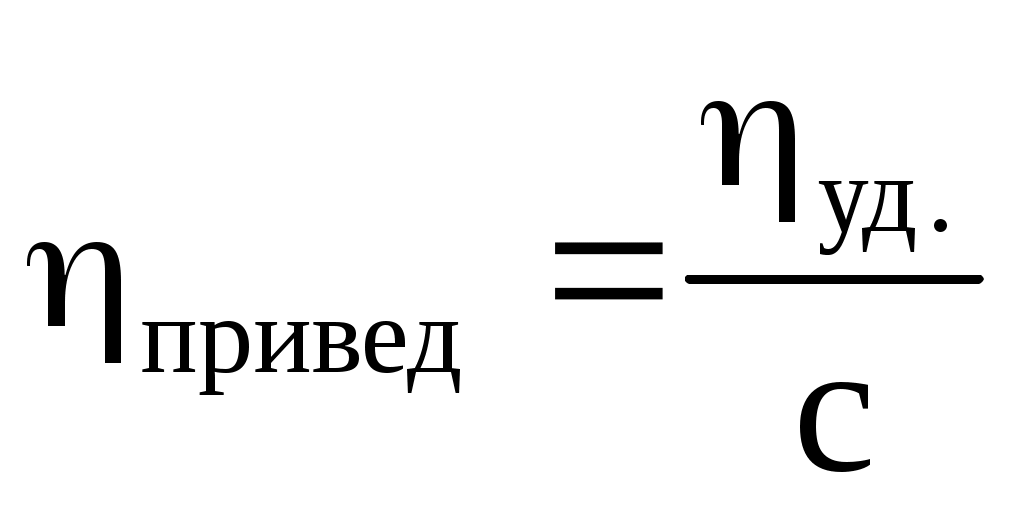
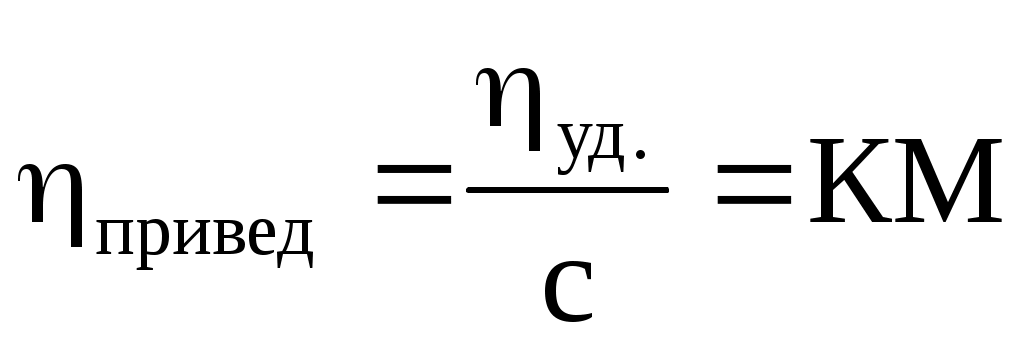
Характеристическая
Поскольку приведенная вязкость зависит от концентрации ВМС, приходится вводить еще одну величину – [η] (собственную или характеристическую вязкость), которую получают путем экстраполяции на нулевую концентрацию:
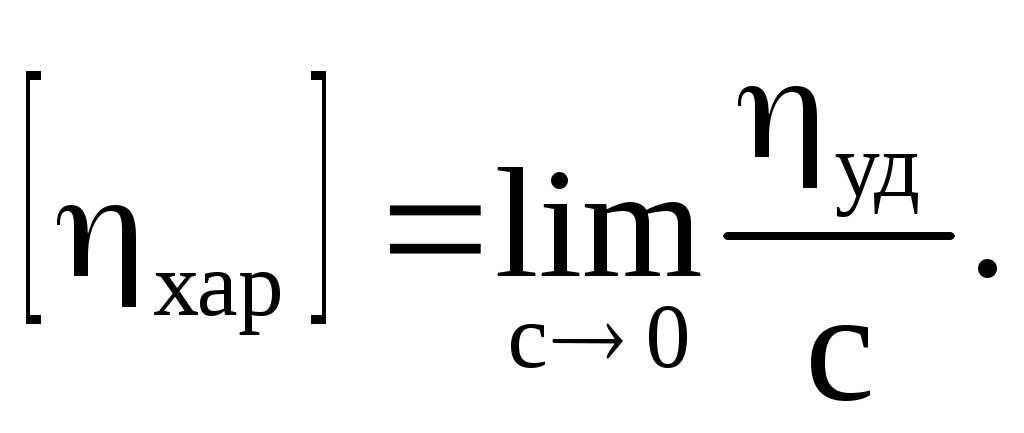
Штаудингер установил зависимость характеристической вязкости вязкости раствора от молекулярной массы полимера
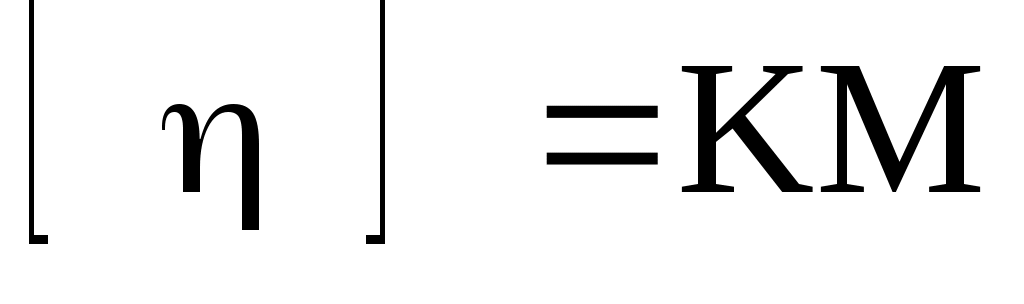
К - постоянная для всего полимергомологического ряда,
определяемая криоскопически в растворах низших его членов.
Дальнейшие исследования показали, что уравнение
Штаудингера описывает лишь предельный случай, выполняющийся в отсутствие взаимодействия между макромолекулами и при их предельном выпрямлении.
Уравнение Марка-Куна-Хаувинка
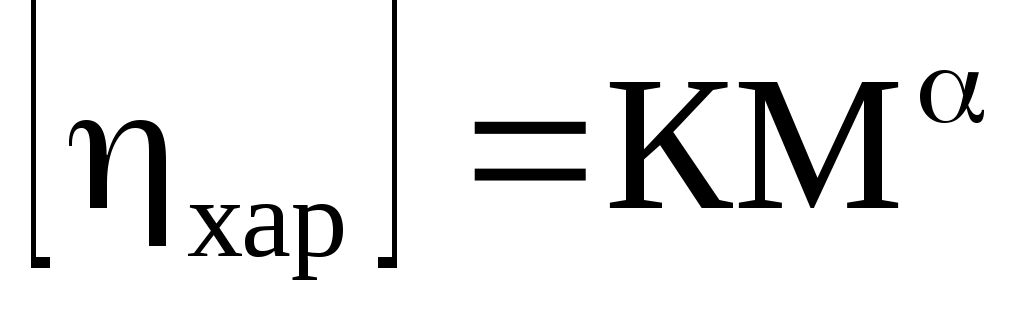
Учитывает взаимодействие макромолекул и изменения константы К (экспериментально определяемой для макромолекул разной длины)
Величина α зависит от формы макромолекул ( 0.5< α <1).
В общем случае, с увеличением жесткости макромолекул величина α приближается к 1.
Для жестких (палочки) полимеров α=1, приведенная вязкость перестает зависеть от формы макромолекул,и уравнение переходит в уравнение Штаудингера.
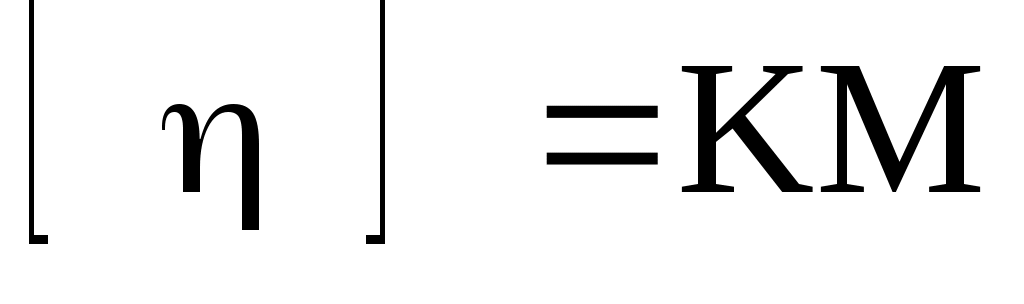
В заключение следует сказать, что вязкость растворов ВМС, как разбавленных, так и концентрированных, зависит от градиента скорости, т.к. длинные макромолекулы, находящиеся в растворе, распределяются и уменьшают гидродинамическое сопротивление потоку.
В концентрированных растворах макромолекулы могут взаимодействовать между собой, образуя ассоциаты, пространственные сетки, мешающие течению потока.
Применение ВМС
1)коллоидная защита
Защитным действием по отношению к коллоидным растворам в воде обладают белки, полисахариды, пектиновые вещества. Механизм защитного действия сводится к адсорбции ВМС на поверхности частиц.
2)лекарственные препараты
Протаргол, колларгол являются примером практического использования защитного действия полимеров. Они представляют собой гидрозоли серебра, защищенные белками.
3) флокуляция
Флокуляиты – добавление ВМС в небольших количествах недостаточных для защиты, снижает устойчивость золя. В результате коллоидные частицы образуют легкоосаждаемые хлопья – флоккулы.
Флокуляция широко используется при очистке природных и сточных вод, в пищевой промышленности, осветлении вина (полиакриламид).
ГЕЛИ
Гель – связанодисперсная система, содержащая сплошную пространственную сетку из частиц дисперсной фазы, в ячейках которой заключён растворитель.
Другое определение звучит так: гели - однородные коллоидальные студни, не имеющие видимой микроскопической структуры, содержащие большие количества воды или другой жидкости и обнаруживающие, несмотря на это, свойства твердых тел.
Процесс гелеобразования - превращение жидкой коллоидной системы в твердообразную, причем дисперсная фаза и дисперсионная среда не разделяются.
Гель может обладать двумя типами происхождения – он может образоваться из коллоидного раствора в результате потери последним текучести либо при ограниченном набухании раствора ВМС.
Набухание - процесс проникновения растворителя в полимерное вещество, сопровождаемый увеличением объема и массы.
В русскоязычной литературе иногда используется также термин «студень», подразумевающий гель, образовавшийся именно из молекул гидрофильных ВМС (например, белков). Студень следует рассматривать как частный случай геля.
Вещества, способные образовывать макромолекулярную структуру гелей, называются гелеобразователями. К ним относятся как неорганические (диоксид кремния, оксид алюминия), так и органические вещества и их смеси (поливиниловый спирт, полиакриламид, желатина, агар-агар, пектиновые вещества и др.). В качестве низкомолекулярной дисперсионной среды — наполнителя геля — выступают вода, низшие моно- и олигоспирты, углеводороды. Гели с водной дисперсионной средой называются гидрогелями, со спиртовой — алкогелями, с углеводородной — органогелями (общее название «лиогели»).
Гели образуются при коагуляции и последующей коалесценции золей, понижении температуры, концентрировании мицеллярных растворов мыл или выделении новой дисперсной фазы из пересыщенных растворов.
Удалением из лиогелей жидкой среды можно получить тонкопористые тела (аэрогели или ксерогели), в которых дисперсная фаза превращается в прочные пористые структуры. Таковы алюмогель и силикагель, получаемые высушиванием гидрогелей гидроксида алюминия и кремниевых кислот.
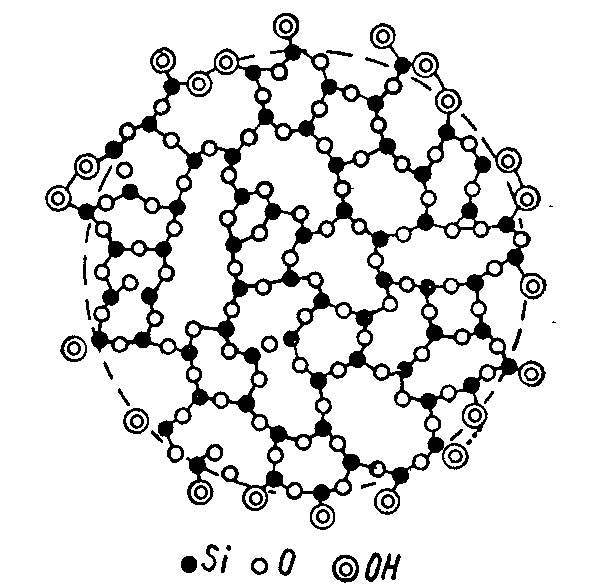
Пространственная структура силикагеля.

Поделочные камни, имеющие гелевую структуру.
Гели в принципе можно разделить на 2 типа – эластичные и хрупкие.
Хрупкие гели образуются коллоидными частицами SiO2, TiO2, SnO2, Fe2O3, V2O5 и имеют сильнопористую структуру с множеством узких жестких капилляров диаметром около 20-40 Å. При впитывании жидкости объем их практически не изменяется.
Эластичные гели (студни) образуются цепными молекулами желатина, агар-агара, каучука и поглощают только те жидкости, которые сходны с ними по своему химическому составу или в которых вещество студня может существовать виде жидкого раствора. Поглощение жидкости эластичным студнем сопровождается сильным увеличением объема.
Различия гелей и студней:
Гель
|
Студень
|
Образуется желатинированием золей
|
Образуется застудневанием ВМС или частичным набуханием ксерогеля.
|
Частичная потеря заряда гранулы, уменьшение дзетта-потенциала.
|
Частичная потеря гидратной оболочки
|
Гетерогенная система
|
Гомогенная система
|
Система не обратима к высушиванию. При потере жидкости сохраняется форма и объём, гель становится хрупким и пористым, легко поглощает любой растворитель.
|
Система обратима к высушиванию. При потере жидкости сохраняется упругость и эластичность, растворители поглощаются избирательно.
| |
 Скачать 2.59 Mb.
Скачать 2.59 Mb.