МОДЕЛЬ АТОМА. Модели строения атома
 Скачать 114 Kb. Скачать 114 Kb.
|
|
1.Модели строения атома. Модель атома по Бору. Постулаты Бора. Квантовые числа n, l, m, s. Количество и разновидность электронных орбиталей. Модели строения атома В начале XIX века Д. Дальтон возродил атомистическую теорию, опираясь на известные к тому времени основополагающие законы химии (постоянства состава, кратных отношений и эквивалентов). Были проведены первые эксперименты по изучению строения вещества. Однако, несмотря на сделанные открытия (атомы одного и того же элементы обладают одними и теми же свойствами, а атомы других элементов – иными свойствами, введено понятие атомной массы), атом считали неделимым. После получения экспериментальных доказательств (конец XIX начало XX века) сложности строения атома (фотоэффект, катодные и рентгеновские лучи, радиоактивность) было установлено, что атом состоит из отрицательно и положительно заряженных частиц, которые взаимодействуют между собой. Эти открытия дали толчок к созданию первых моделей строения атома. Одна из перых моделей была предложена Дж. Томсоном (1904): атом представлялся как «море положительного электричества» с колеблющимися в нем электронами. 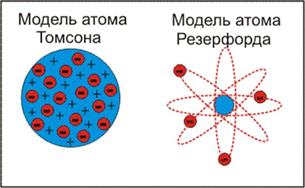 После опытов с α-частицами, в 1911г. Резерфорд предложил так называемую планетарную модель строения атома, похожую на строение солнечной системы. Согласно планеетарной модели, в центре атома находится очень маленькое ядро с зарядом Zе, размеры которого приблизительно в 1000000 раз меньше размеров самого атома. Ядро заключает в себе практически всю массу атома и имеет положительный заряд. Вокруг ядра по орбитам движутся электроны, число которых определяется зарядом ядра. Внешняя траектория движения электронов определяет внешние размеры атома. Диаметр атома составляет 10-8 см, в то время, как диаметр ядра много меньше -10-12 см. ... 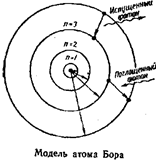 \ \Опыты по изучению атомных спектров показали несовершенство планетарной модели строения атома, поскольку эта модель противоречит линейчатой структуре атомных спектров. На основании модели Резерфорда, учении Энштейна о световых квантах и квантовой теории излучения планка Нильс Бор (1913) сформулировал постулаты, в которых заключается теория строения атома : электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным орбитам (стационарным), двигаясь по такой орбите он не излучает электромагнитной энергии, излучение (поглощение или испускание кванта электромагнитной энергии) происходит при переходе (скачкообразном) электрона с одной орбиты на другую. Накопленный экспериментальный материал, характеризующий строение атома, показал, что свойства электронов, а также других микрообъектов не могут быть описаны на основе представлений классической механики. Микрочастицы подчиняются законам квантовой механики, которая стала основой для создания современной модели строения атома. Главные тезисы квантовой механики: — энергия испускается и поглощается телами отдельными порциями – квантами, следовательно, энергия частиц изменяется скачкообразно; — электроны и другие микрочастицы имеют двойственную природу – проявляет свойства и частицы, и волны (корпускулярно-волновой дуализм); — квантовая механика отрицает наличие определенных орбит у микрочастиц (для движущихся электронов невозможно определить точное положение, т.к. они движутся в пространстве вблизи ядра, можно лишь определить вероятность нахождения электрона в различных частях пространства). Пространство вблизи ядра, в котором достаточно велика вероятность нахождения электрона (90%), называется орбиталью. Постулаты Бора — основные допущения, сформулированные Нильсом Бором в 1913 году для объяснения закономерности линейчатого спектра атома водорода и водородоподобных ионов (формула Бальмера-Ридберга) и квантового характера испускания и поглощения света. Бор исходил из планетарной модели атома Резерфорда. Первый постулат Бора: атомная система может находиться только в особых стационарных, либо квантовых, состояниях, каждому из которых соответствует некоторая энергия En; в стационарном состоянии атом не излучает энергию. Этот постулат является противоречием классической механике, согласно которой энергия движущихся электронов может быть любой. Также он является противоречием и электродинамике Максвелла, т.к. предполагает возможность ускоренного движения электронов не излучая электромагнитных волн. Второй постулат Бора: излучение света случается в процессе перехода атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равняется разности энергий стационарных состояний: Таким образом, можно вычислить частоту излучения: Поглощая свет, атом переходит из стационарного состояния с меньшим количеством энергии в стационарное состояние с большим количеством энергии. Квантовые числа: Состояние электрона в атоме можно описать с помощью четырех квантовых чисел. n – главное квантовое число. Характеризует общий запас энергии электрона в атоме и номер энергетического уровня. n приобретает целочисленные значения от 1 до ∞. Наименьшей энергией электрон обладает при n=1; с увеличением n – энергия возрастает. Состояние атома, когда его электроны находятся на таких энергетических уровнях, что их суммарная энергия минимальна, называется основным. Состояния с более высокими значениями называются возбужденными. Энергетические уровни обозначаются арабскими цифрами в соответствии со значением n. Электроны можно расположить по семи уровням, поэтому, реально n существует от 1 до 7. Главное квантовое число определяет размеры электронного облака и определяет средний радиус нахождения электрона в атоме. l – орбитальное квантовое число. Характеризует запас энергии электронов в подуровне и форму орбитали (табл. 1). Принимает целочисленные значения от 0 до n-1. l зависит от n. Если n=1,то l=0, что говорит о том, что на 1-м уровне 1-н подуровень. s – спиновое квантовое число. Характеризует собственное вращение электрона вокруг оси. Принимает значения -1/2(↓) и +1/2 (↑). Два электрона на одной орбитали обладают антипараллельными спинами. Орбитали: Название «орбиталь» отражает геометрическое представление о движении электрона в атоме; такое особое название отражает тот факт, что движение электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку. Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы (n = 1,2,3, … ∞) и определяет общую энергию электрона на данной орбитали (энергетический уровень) : Энергия для n = ∞ соответствует энергии одноэлектронной ионизации для данного энергетического уровня. Орбитальное квантовое число (называемое также азимутальным или дополнительным квантовым числом) определяет момент импульса электрона и может принимать целые значения от 0 до n - 1 (l = 0,1, …, n - 1). Момент импульса при этом задается соотношением Магнитное квантовое число ml определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от -l до l, включая 0 (ml = -l … 0 … l): В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число - соответствующей буквой (см. таблицу ниже) и магнитное квантовое число - выражением в нижеем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy, 4fz(x2-y2). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают. 2. Растворы электролитов. Электролитическая диссоциация. Степень диссоциации. Сильные и слабые электролиты (привести примеры). Электролити́ческая диссоциа́ция — это процесс распада молекул на ионы при растворении или плавлении. Молекулы электролитов при растворении в воде в той или иной степени распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Например: NaCl =Na+ + Cl– Самопроизвольный распад электролита в растворе на ионы называется электролитической диссоциацией. Положительно заряженные ионы принято называть катионами, отрицательно заряженные – анионами. Степень диссоциации равна отношению числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N). Степень электролитической диссоциации зависит от природы растворенного вещества и растворителя, от концентрации и температуры раствора. При разбавлении и повышении температуры раствора степень диссоциации увеличивается. По величине степени диссоциации электролиты делятся на сильные, средние и слабые: у сильных электролитов α ≥ 30%, у слабых α ≤ 3%. Электролиты средней силы занимают промежуточное положение, например, для 0,1 н растворов H3PO4 α=27%, H2SO3 α=20%, HF α=8%. Вода является очень слабым электролитом (α=2∙10-7%), поэтому чистая вода не проводит электрический ток. |
