Тесты по Химии с ответами. Химия тесты с ответами. По правилу Клечковского заполнение подуровней происходит в последовательности
 Скачать 63.21 Kb. Скачать 63.21 Kb.
|
|
Атом состоит из ядра и … в+ электронной оболочки. в- протонной оболочки. в- молекулярной оболочки. в- нейтронной оболочки. По правилу Клечковского заполнение подуровней происходит в последовательности П1 2s П2 2p П3 3s П4 3p П5 4s П6 3d Главное квантовое число «n» характеризует… в- вращение электрона вокруг собственной оси и собственный магнитный момент движения электрона. в- ориентацию атомной орбитали в пространстве и ее магнитный момент. в+ энергию электронного слоя (уровня), размер и плотность атомных орбиталей. в- форму атомной орбитали и орбитальный момент движения электрона. Орбитальное квантовое число «l» характеризует… в- вращение электрона вокруг собственной оси и собственный магнитный момент движения электрона. в- ориентацию атомной орбитали в пространстве и ее орбитальный магнитный момент. в- энергию электронного слоя (уровня), размер и плотность атомных орбиталей. в+ форму атомной орбитали и механический момент электрона. Магнитное квантовое число «ml» характеризует … в- вращение электрона вокруг собственной оси в+ ориентацию атомной орбитали в пространстве в- энергию электронного слоя (уровня), размер и плотность атомных орбиталей. в- форму атомной орбитали Спиновое квантовое число «mS» характеризует … в+ вращение электрона вокруг собственной оси в- ориентацию атомной орбитали в пространстве в- энергию электронного слоя (уровня), размер и плотность атомных орбиталей. в- форму атомной орбитали Принцип Паули … в+ в атоме не может быть двух электронов, обладающих одинаковым набором всех квантовых чисел. в- суммарное спиновое число электронов на подуровне должно быть наибольшим. в- электроны заполняют орбитали по возрастанию суммы главного и орбитального квантовых чисел (n + l); при равных суммах заполняется подуровень с меньшим значением главного квантового числа. в- наибольшей устойчивостью обладают подуровни, заполненные полностью или наполовину. Принцип Гунда… в- в атоме не может быть двух электронов, обладающих одинаковым набором всех квантовых чисел. в+ суммарное спиновое число электронов на подуровне должно быть наибольшим. в- электроны заполняют орбитали по возрастанию суммы главного и орбитального квантовых чисел (n + l); при равных суммах заполняется подуровень с меньшим значением главного квантового числа. в- наибольшей устойчивостью обладают орбитали, заполненные полностью или наполовину Орбитальное квантовое число принимает значения… в- от –l через 0 до +l. в+ от 0 до (n – 1). в- +1/2 и -1/2. в- 0, 1, 2, 3, ….¥. в- 1, 2, 3, ….¥. Магнитное квантовое число принимает значения… в+ от –l через 0 до +l. в- от 0 до (n – 1). в- +1/2 и -1/2. в- 0, 1, 2, 3, ….¥. в- 1, 2, 3, ….¥. Спиновое квантовое число принимает значения… в- от –l через 0 до +l. в- от 0 до (n – 1). в+ +1/2 и -1/2. в- 0, 1, 2, 3, ….¥. в- 1, 2, 3, ….¥. Электронная формула атома железа (порядковый номер 26) … в- 1s2 2s2 2p6 3s2 3p6 3d5 4s2 в- 1s2 2s2 2p6 3s2 3p6 4s2 3d5 4p1 в- 1s2 2s2 2p6 3s2 3p6 4s1 3d6 4p1 в+ 1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p0 Соответствие между обозначением подуровня и числом атомных орбиталей на нем: С1 подуровень d О1 число атомных орбиталей 5 С2 подуровень f О2 число атомных орбиталей 7 С3 подуровень s О3 число атомных орбиталей 1 С4 подуровень p О4 число атомных орбиталей 3 О5 число атомных орбиталей 2 О6 число атомных орбиталей 4 Могут существовать электронные конфигурации:
в+ p4 в- d14 в+ f6 Периоды в периодической системе элементов расположены … в+ горизонтально. в- вертикально. в- диагонально. в- отсутствуют. Группы в периодической системе элементов расположены … в- горизонтально. в+ вертикально. в- диагонально. в- отсутствуют. В периодической системе элементов имеются периоды : в+ большие. в+ малые. в- средние. в- укороченные. Группы в периодической системе делятся на … в- большие и малые подгруппы. в- длинные и короткие подгруппы. в+ главные и побочные подгруппы. в- большие и побочные подгруппы. Усиление металлических свойств происходит в паре…
в- кальций – скандий Номер периода в периодической системе… в- показывает сумму главного и орбитального квантового чисел. в- соответствует числу электронов во внешнем слое электронной оболочки. в- равен числу электронов на внешнем и предпоследнем слоях. в+ равен числу электронных уровней, заполняемых электронами в атоме. Номер группы для элементов, расположенных в главных подгруппах, равен… в+ сумме s- и p-электронов внешнего слоя. в- сумме электронов, находящихся на s-орбиталях внешнего слоя и d-орбиталях предпоследнего слоя. в- числу заполненных s- и p-орбиталей внешнего слоя. в- сумме заполненных электронами орбиталей внешнего и предпоследнего электронного слоев. Физическим обоснованием формулировки периодического закона «Свойства элементов повторяются периодически при увеличении зарядов ядер их атомов» является… в- возрастание атомной массы элементов. в- увеличение радиуса атомов химических элементов, находящихся в одной подгруппе. в+ периодическое повторение строения электронных оболочек атомов. в- ослабление металлических свойств и усиление неметаллических для элементов одного периода Одна из современных формулировок периодического закона Д.И.Менделеева: «Свойства элементов и их соединений находятся в периодической зависимости….» в- от величины атомных масс элементов. в- от строения электронной оболочки атомов. в+ от величины зарядов ядер их атомов. в- от суммы числа протонов и нейтронов в атоме. Металлические свойства элементов главных подгрупп по группе сверху вниз … в- ослабевают. в- не изменяются. в+ усиливаются. в- изменяются на неметаллические. Типичные металлы находятся в … в+ начале каждого периода. в- в конце каждого периода. в- в середине каждого периода. в- в верху каждого периода. Свойства элементов по периоду изменяются … в+ от металлических через амфотерные к неметаллическим. в- от амфотерных через металлические к неметаллическим. в- от неметаллических через амфотерные к металлическим. в- от неметаллических через металлические к амфотерным. Наибольший радиус атома среди перечисленных элементов имеет: в- азот. в+ литий. в- фтор. в- бериллий. Радиус атома для элементов главных подгрупп по группе сверху вниз в- убывает. в+ возрастает. в- не изменяется. в- изменяется периодически. Элементы расположены в порядке возрастания их радиуса… в- сера, натрий, калий, хлор. в+ хлор, сера, натрий, калий, в- калий, натрий, хлор, сера. в- калий, натрий, сера, хлор. Гидроксиды, способные проявлять как кислотные, так и основные свойства, называются… в+ амфотерными в- двойными в- несолеобразующими в- безразличными В ряду Mg(OH)2 " Ca(OH)2 " Sr(OH)2 сила оснований… в- изменяется периодически в- не изменяется в+ возрастает в- уменьшается Кислотные свойства оксидов элементов в высшей степени окисления в главной подгруппе с увеличением порядкового номера… в- зависят от условий реакции в- не изменяются в- возрастают в+ уменьшается Энергией ионизации атома называется энергия… в- выделяемая при присоединении электрона к атому в- поглощаемая при присоединении электрона к атому в+ которую необходимо затратить для отрыва электрона от атома в- которую необходимо затратить для разложения атома Сродством к электрону называется энергия,… в+ выделяемая при присоединении электрона к атому в- поглощаемая при присоединении электрона к атому в- которую необходимо затратить для отрыва электрона от атома в- которую необходимо затратить для разложения атома Наибольшей электроотрицательностью среди перечисленных элементов обладает… в- калий в+ хлор в- сера в- натрий Элементы расположены по возрастанию энергии ионизации в паре… в- фтор и литий в- хлор и натрий в+ кислород и фтор в- азот и мышьяк В периоде с увеличением порядкового номера электроотрицательность элементов… в+ увеличивается в- не изменяется в- изменяется периодически в- уменьшается В ряду химических элементов N " O " F электроотрицательность… в- убывает в- не изменяется в- изменяется периодически в+ возрастает Азот N2 в реакции N2 + 3H2 " 2NH3 является… в+ окислителем в- восстановителем в- соединителем в- заместителем Элементы расположены в порядке возрастания электроотрицательности в ряду… в- сера, натрий, калий, хлор в- натрий, сера, калий, хлор в- калий, натрий, хлор, сера в+ калий, натрий, сера, хлор С кислотами и щелочами взаимодействует оксид… в- лития в+ алюминия в- магния в- бора Среди галогенов наиболее сильным окислителем является… в+ фтор в- хлор в- бром в- йод В ряду HF – HCl – HBr – HI сила кислот… в- не изменяется в- изменяется неоднозначно в+ возрастает в- уменьшается Окислением называется процесс, в котором… в+ атом или ион отдает электроны в- атом или ион принимает электроны в- атом или ион присоединяет к себе другие атомы или ионы в- молекула или ион обменивается с другими молекулами или ионами своими составными частями Ионная связь осуществляется в молекуле… в- O2 в- H2O в- Li2 в+ NaCl Ковалентная неполярная связь осуществляется в молекуле… в+ H2 в- H2S в- Na2 в- KCl Ковалентная полярная связь осуществляется в молекуле… в- CaCl2 в- O2 в- Li2 в+ HCl Характеристики химической связи: в- энергия ионизации в- сродство к электрону в+ длина связи в+ энергия связи Валентность – это… в- число неспаренных электронов в атоме в- число электронов на внешнем электронном слое атома в+ число химических связей, которые образует атом в- формальный заряд атома в молекуле Атом углерода в молекуле CH4 имеет гибридизацию… в- sp в- s2p в- sp2 в+ sp3 Атом бериллия в молекуле BeCl2 имеет гибридизацию… в+ sp в- s2p в- sp2 в- sp3 Тетраэдрическое строение молекулы имеет… в+ CH4 в- BeCl2 в- BF3 в- HCl Ионная связь образуется между элементами… в- P и O в+ K и Cl в- H и C в- C и O Валентность атома по обменному механизму равна…
в- 1 в+ 2 в- 3 в- 4 Наиболее короткой является связь… в- K – Cl в- K – Br в- K – I в+ K – F Валентный угол равен 120˚ в молекуле … в- CCl 4 в- LiCl в+ BCl 3 в- MgCl 2 Донором является частица, предоставляющая… в- электрон в- пару свободных орбиталей в- свободную орбиталь в+ электронную пару Соответствие формулы соединения и вида химической связи: С1 KCl О1 ионная С2 H2 О2 ковалентная неполярная С3 HCl О3 ковалентная полярная С4 Zn О4 металлическая Наиболее прочная связь между элементами в молекуле, формула которой… в- H2S в- H2Se в+ H2O в- H2Te Энтальпией образования вещества называется тепловой эффект… в- реакции образования этого вещества в- образования сложного вещества из простых веществ в+ образования 1 моль сложного вещества из простых веществ, устойчивых при стандартных условиях в- образования сложного вещества из простых веществ, устойчивых при обычных условиях Реакции, протекающие с выделением теплоты, называются… в- эпизодическими в- эндотермическими в+ экзотермическими в- эзотерическими Термодинамическими функциями являются: в+ H – энтальпия. в+ S- энтропия. в+ U – внутренняя энергия. в- V – объем. в- p – давление. 1-й закон термодинамики выражается уравнением… в- DHОБР = -DHРАЗЛ. в+ Q = DU + АВНЕШ. в- DG = DH - TDS. в- H = U – pV. Самопроизвольное протекание процесса в неизолированной изобарно-изотермической системе сопровождается… в- возрастанием энтропии. в- увеличением энергии Гиббса. в+ уменьшением энергии Гиббса. в- неизменностью энергии Гиббса. в- совершением работы против внешних сил. Экзотермической является реакция… в- BaCO3(Т) = BaO(Т) + CO2(Г); DH = 258,7 кДж. в- CaCO3(Т) = CaO(Т) + CO2(Г); DH > 0. в+ 2Ca(Т) + O2(Г) = 2CaO(Т); DH = -645,6 кДж. в- MgCO3(Т) = MgO(Т) + CO2(Г); DH = 101,6 кДж. Тепловой эффект реакции зависит от … в- конечного и начального состояний системы и зависит от пути процесса. в+ конечного и начального состояний системы и не зависит от пути проведения процесса. в- конечного и начального состояний системы и условий проведения процесса. в- условий проведения процесса и не зависит от начального и конечного состояний системы. Энтропия при протекании реакции 4NH3(Г) + 3O2(Г) = 2N2(Г) + 6H2O(Г) … в+ увеличивается. в- уменьшается. в- не изменяется. в- зависит от условий проведения реакции. Тепловой эффект реакции …. соответствует теплоте образования уксусной кислоты CH3COOH в- CH4 + CO2 = CH3COOH. в+ 2C + 2H2 + O2 = CH3COOH. в- C + O2 + CH4 = CH3COOH. в- 2CH3COH + O2 = 2CH3COOH. в- CH3COONa + HCl = CH3COOH + NaCl. В реакции H2(Г) + Cl2(Г) = 2HCl(Г) выделяется 92,31 кДж. Энтальпия образования HCl равна … в- 92,31 кДж/моль. в- -92,31 кДж/моль. в- 46,155 кДж/моль. в+ -46,155 кДж/моль. Изменение энергии Гиббса при протекании химической реакции вычисляется по уравнению…
Самопроизвольное протекание процесса в изолированной системе, в соответствии со 2-м законом термодинамики, сопровождается… в+ возрастанием энтропии в- уменьшением энтропии в- увеличением энтальпии в- неизменностью внутренней энергии в- неизменностью энергии Гиббса Реакция, протекающая в прямом направлении с уменьшением энтропии… в- CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г); DG = 170,63 кДж. в- Fe2O3(Т) + 3H2(Г) D 2Fe(Т) + 3H2О(Г), DG = 55,28 кДж. в- 4NH3(Г) + 5O2(Г) D 4NO(Г) + 6H2О(Г), DG = -959,81 кДж. в+ H2(Г) + CO2(Г) D CO(Г) + H2O(Ж), DG < 0. Энтропия является функцией состояния и ее изменение равно… в- сумме энтропий исходных веществ и конечных продуктов. в- разности между суммой энтропий начальных веществ и суммой энтропий продуктов реакции. в+ разности между суммой энтропий конечных веществ и суммой энтропий начальных веществ. в- определяется способом проведения процесса. При получении 2 моль этанола, согласно термохимическому уравнению C2H4(Г) + H2O (Ж) D C2H5OH(Ж), DH0 = –44 кДж, выделяется … кДж теплоты. в+ 88 в- 66 в- 44 в- 22 Средняя скорость гомогенной реакции выражается формулой… в- в+ в- в- Измельчение твердого вещества скорость химической реакции… в- уменьшает. в+ увеличивает. в- не изменяет. в- замедляет. Энергия активации обозначена на энергетической диаграмме цифрой … 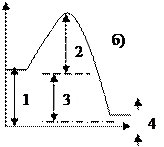 в- 1. в+ 2. в-3. в- 4. Соответствие между уравнениями реакций и формулами скорости С1 A + B = D О1 С2 2A + B = D О2 С3 2A + 2B = 2D О3 С4 A2B = 2А + В О4 О5 Математическая зависимость скорости реакции от температуры описывается уравнением… в- в- в- в+ Катализатор скорость химической реакции… в- не изменяет. в+ увеличивает. в- уменьшает. в- замедляет. в- периодически влияет. Катализатор изменяет скорость реакции, потому что… в- удаляет продукты реакции. в+ взаимодействует с реагирующими веществами, изменяя энергию активации. в- изменяет температурный коэффициент реакции. в- смещает положение равновесия в сторону прямой реакции. Выражение для скорости в- A + B = C. в+ 2A + B = C. в- A + 2B = C. в- 2A + 2B = 2C. в- A2B = C + D. Константа скорости химической реакции равна скорости химической реакции при ... в- стандартной температуре в+ стандартных концентрациях реагирующих веществ в- стандартных давлении и температуре в- стандартном изменении энергии Гиббса Температурный коэффициент показывает… в+ во сколько раз изменяется скорость реакции при повышении температуры на 100. в- во сколько раз изменяется концентрация при повышении температуры на 100. в- во сколько раз увеличивается время протекании реакции при повышении температуры на 100. в- на сколько градусов изменяется температура при протекании реакции. Соответствие между понятиями и их математическими выражениями С1 Закон действующих масс О1 С2 Правило Вант-Гоффа О2 С3 Уравнение Аррениуса О3 С4 Скорость химической реакции О4 О5 Константа скорости реакции в+ температуры в- концентрации продуктов реакции в- давления в- концентрации исходных веществ в- присутствия катализаторов Скорость химической реакции зависит от: в+ температуры. в- цвета вещества. в+ катализатора. в- формы реактора. в+ природы вещества. Скорость обратной химической реакции CaCO3(Т) D CaO(Т) + CO2(Г) описывается уравнением… в- в- в- в+ в- Закон действующих масс наиболее строго соблюдается для реакций… в- гетерогенных в- последовательных в- параллельных в+ гомогенных |
