белки.ферменты.витамины. белки. ферменты. витамины. Модуль 1 Статическая биохимия
 Скачать 405.78 Kb. Скачать 405.78 Kb.
|
|
Модуль №1 «Статическая биохимия» 4. Приведите примеры модифицированных аминокислот. Какую роль в организме они выполняют? К настоящему времени известно более 400 непротеиногенных аминокислот. Многие из них можно рассматривать как модифицированные белковые аминокислоты. При этом наиболее обычными вариациями являются: – удлинение или сокращение углеродной цепи (добавление или удаление СН2- или СН3-фрагментов); – гидрирование и дегидрирование; – гидроксилирование; – аминирование. Фитохимическую классификацию непротеиногенных аминокислот обычно связывают со структурой «исходных» протеиногенных аминокислот. При этом различают: – нейтральные алифатические аминокислоты; – серосодержащие аминокислоты; – ароматические аминокислоты; – гетероциклические аминокислоты; – дикарбоновые аминокислоты и амиды; – щелочные (основные) аминокислоты; – иминокислоты. Непосредственно в синтезе белков организма человека принимают участие только 20 аминокислот. Однако в некоторых белках имеются нестандартные модифицированный аминокислоты – производственные одной из этих 20 аминокислот. Например, в молекуле коллагена (фибриллярного белка межклеточного матрикса) присутствуют гидроксипроизводные лизина и пролина – 5-гидроксилизин и 4-гидроксипролин. Модификация аминокислотных остатков осуществляется уже в составе белков, т.е только после окончания синтеза. 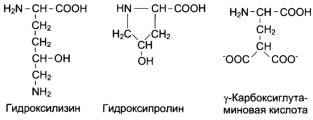 ( Модифицированные кислоты, найденные в составе белков.) Введение дополнительных функциональных групп в структуру аминокислот придает белкам свойства, необходимые для выполнения ими специфических функций. Так, γ-карбоксиглутаминовая кислота входит в состав белков, участвующих в свёртывании крови, и две близко лежащие карбоксильные группы в их структуре необходимы для связывания белковых факторов с ионами Ca2+. Нарушение карбоксилирования глутамата приводит к снижению свёртываемости крови. 26. Механизм действия ферментов. Опишите гипотезы, объясняющие механизм действия ферментов. В общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы: 1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.  Схематичное представление теории Фишера 2. Теория Кошланда (модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.  Конкурентное ингибирование. Нарисуйте графики Михаэлиса–Ментен и Лайнуивера–Берка для конкурентного ингибирования. Лекарственные препараты как конкурентные ингибиторы. Под термином "ингибирование ферментативной активности" понимают снижение каталитической 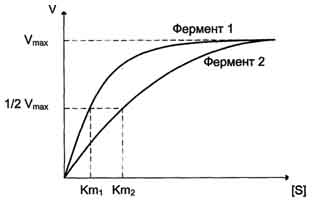 Рис. 2-20. Влияние различных концентраций субстрата на скорость реакции, катализируемой ферментами 1 и 2. активности в присутствии определённых веществ - ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Следует отметить, что все денатурирующие агенты также вызывают уменьшение скорости любой ферментативной реакции, вследствие неспецифической денатурации белковой молекулы, поэтому денатурирующие агенты к ингибитррам не относят. Ингибиторы вызывают большой интерес для выяснения механизмов ферментативного катализа, помогают установить роль отдельных ферментов в метаболических путях организма. В основе действия многих лекарственных препаратов и ядов лежит ингибирование активности ферментов, поэтому знание механизмов этого процесса крайне важно для молекулярной фармакологии и токсикологии. Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные. А. Обратимое ингибирование Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными. 1. Конкурентное ингибирование К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется (рис. 2-21). 102 Для конкурентного типа ингибирования справедливы следующие уравнения: Е + S ⇔ ES → E + P, E + I ⇔ EI. Классический пример конкурентного ингибирования - ингибирование сукцинатдегидрогеназ-ной реакции малоновой кислотой (рис. 2-22). Малоновая кислота - структурный аналог сукцината (наличие двух карбоксильных групп) и может также взаимодействовать с активным центром сукци-нат дегидрогеназы. Однако отщепление двух атомов водорода от малоновой кислоты невозможно; следовательно, скорость реакции снижается. Кинетические зависимости Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора 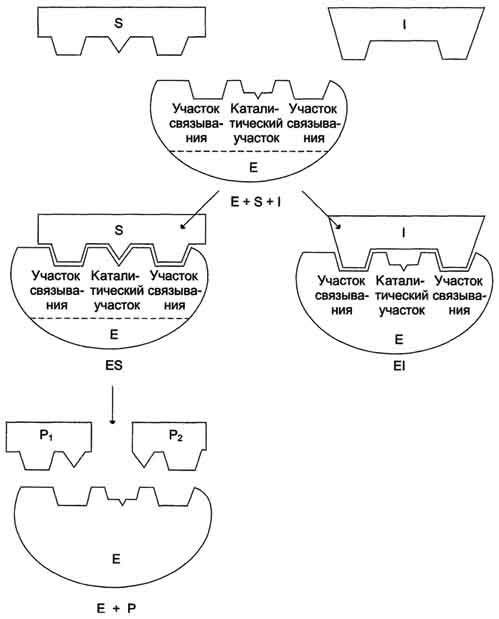 Рис. 2-21. Схема конкурентного ингибирования активности фермента. 103 необходима большая концентрация субстрата для достижения 1/2 Vmax. Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью 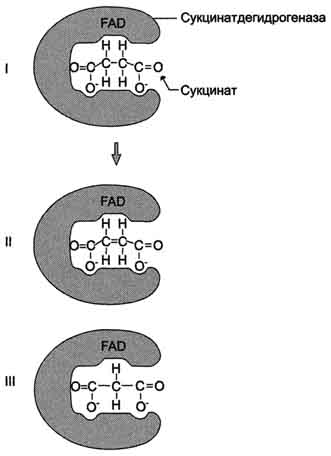 Рис. 2-22. Пример конкурентного ингибирования сукцинат-дегидрогеназы малоновой кислотой. I - сукцинат связывается с активным центром фермента сукцинатдегидрогеназы; II - в ходе ферментативной реакции происходит отщепление двух атомов водорода от сукцината и присоединение их к ко-ферменту FAD. В результате образуется фумарат, который высвобождается из активного центра сукцинатдегидрогеназы; ill - малоновая кислота - структурный аналог сукцината, она также связывается с активным центром сукцинатдегидрогеназы. При этом химическая реакция не идёт. исчезает, потому что активные центры всех молекул фермента будут находиться преимущественно в комплексе с субстратом. Лекарственные препараты как конкурентные ингибиторы Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования. Например, четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катадизирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту. При добавлении ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Эффективные антихолинэстеразные препараты - прозерин, эндрофоний и др. (рис. 2-23). Антиметаболиты как лекарственные препараты В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Эти соединения, будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, с одной стороны, и, с другой - могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов. Аномальные продукты не обладают функциональной активностью; в результате наблюдают снижение скорости определённых метаболических путей. В качестве лекарственных препаратов используют следующие антиметаболиты: сульфаниламидные препараты (аналоги парааминобензойной кислоты), применяемые для лечения инфекционных заболеваний (см. раздел 9), аналоги нуклеотидов для лечения онкологических заболеваний (см. раздел 10). 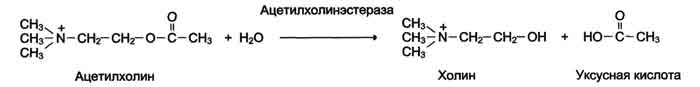 Схема 2. Неконкурентное ингибирование Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра (рис. 2-24). Неконкурентные ингибиторы не являются структурными аналогами субстрата. Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции. Кинетические зависимости Кинетическая зависимость неконкурентного ингибирования представлена на рис. 2-25. Этот тип ингибирования характеризуется снижением Vmax ферментативной реакции и уменьшением сродства субстрата к ферменту, т.е. увеличением Кm. Б. Необратимое ингибирование Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению (рис. 2-26). При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента. 1. Специфические и неспецифические ингибиторы Использование необратимых ингибиторов представляет большой интерес для выяснения 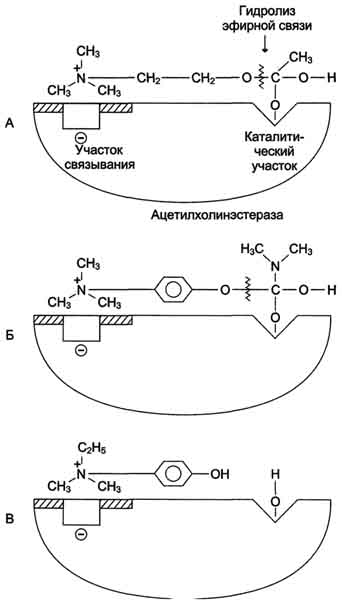 Рис. 2-23. Схема активного центра ацетилхолинэстеразы. А - присоединение ацетилхолина в активном центре фермента. Стрелкой указано место гидролиза эфирной связи в молекуле ацетилхолина; Б - присоединение конкурентного ингибитора - прозерина в активном центре фермента. Указано место гидролиза прозерина, однако реакция идёт намного медленнее, чем с ацетилхолином; В - присоединение конкурентного ингибитора в активном центре фермента - эндрофония. Эндрофоний связывается в активном центре ацетилхолинэстеразы, препятствуя присоединению ацетилхолина. механизма действия ферментов. С этой целью применяют вещества, блокирующие определённые группы активного центра ферментов. Такие ингибиторы называют специфическими. Ряд соединений легко вступает в реакции с определенными 105 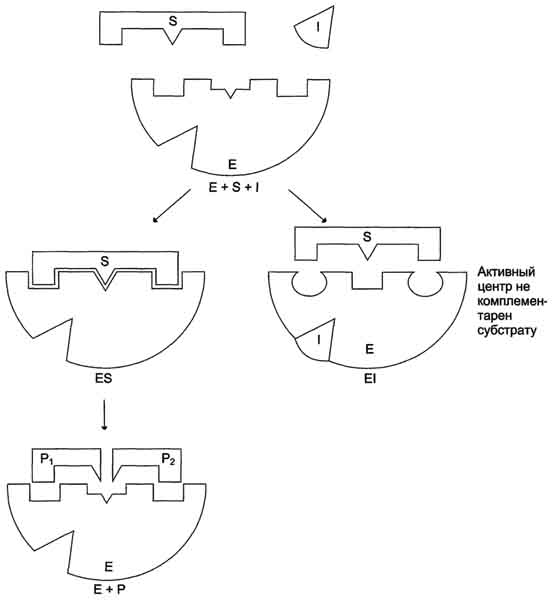 Рис. 2-24. Схема неконкурентного ингибирования активности фермента. химическими группами. Если эти группы участвуют в катализе, то происходит полная инактивация фермента. Роль гидроксильных групп серина в механизме катализа исследуют с помощью фторфосфатов, например диизопропилфторфосфата. Дии-зопропилфторфосфат (ДФФ) специфически реагирует лишь с одним из многих остатков серина в активном центре фермента. Остаток Сер, способный реагировать с ДФФ, имеет идентичное или очень сходное аминокислотное окружение (табл. 2-2). Высокая реакционная способность этого остатка по сравнению с другими остатками Сер обусловлена аминокислотными остатками, также входящими в активный центр ферментов. ДФФ относят к специфическим необратимым ингибиторам "сериновых" ферментов, так как он образует ковалентную связь с гидроксильной группой серина, находящегося в активном центре и играющего ключевую роль в процессе катализа (рис. 2-27). Ацетат йода, п-хлормеркурибензоат легко вступают в реакции с SH-группами остатков цистеина белков (рис. 2-28). Эти ингибиторы не относят к специфичным, так как они. 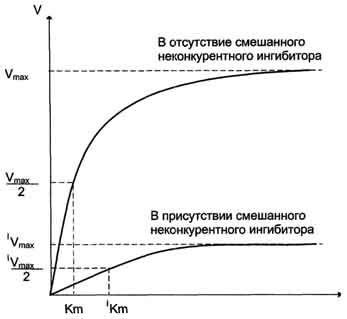 Рис. 2-25. Влияние неконкурентного ингибитора на скорость ферментативной реакции в зависимости от концентрации субстрата. Vmax - максимальная скорость реакции в отсутствие ингибитора; 'Vmax - максимальная скорость реакции в присутствии ингибитора; Кm - константа Михаэлиса в отсутствие ингибитора; 'Кm - константа Михаэлиса в присутствии ингибитора. 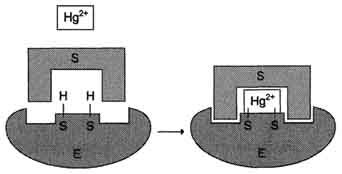 Рис. 2-26. Механизм действия ионов ртути как необратимого ингибитора. Ионы ртути в малых концентрациях блокируют сульфгидрильные группы активного центра, что приводит к снижению скорости ферментативной реакции. 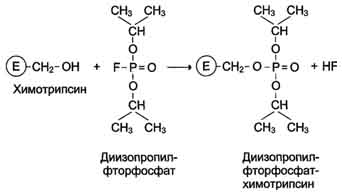 Рис. 2-27. Ингибирование активности химотрипсина с помощью диизопропилфторфосфата. Таблица 2-2. Исследование последовательности аминокислотных остатков вокруг реакционно-способного остатка се-рина, взаимодействующего с ДФФ
реагируют с любыми свободными SH-группами белков и называются неспецифическими ингибиторами. Если SH-группы принимают участие непосредственно в катализе, то с помощью этих ингибиторов представляется возможным выявление роли SH-групп фермента в катализе. 60. Кофактором каких ферментов является флавинмононуклеотид? Приведите структурную формулу кофермента, напишите 2 уравнения реакций с его участием В состав рибофлавина входит флавин – изоаллоксазиновое кольцо с заместителями (азотистое основание) и спирт рибитол. 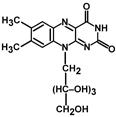 Строение витамина В2 Коферментные формы витамина дополнительно содержат либо только фосфорную кислоту – флавинмононуклеотид (ФМН), либо фосфорную кислоту, дополнительно связанную с АМФ – флавинадениндинуклеотид. 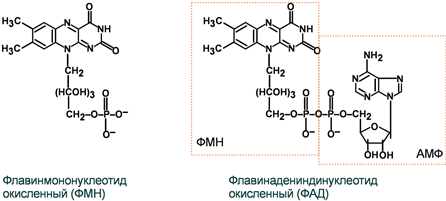 Строение окисленных форм ФАД и ФМН Метаболизм В кишечнике рибофлавин освобождается из состава пищевых ФМН и ФАД, и диффундирует в кровь. В слизистой кишечника и других тканях вновь образуется ФМН и ФАД. Биохимические функции Кофермент оксидоредуктаз – обеспечивает перенос 2 атомов водорода в окислительно-восстановительных реакциях. 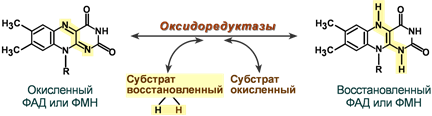 Механизм участия флавинового кофермента в биохимической реакции Витамин содержат: 1. Дегидрогеназы энергетического обмена – пируватдегидрогеназа (окисление пировиноградной кислоты), α-кетоглутаратдегидрогеназа и сукцинатдегидрогеназа (цикл трикарбоновых кислот), ацил-SКоА-дегидрогеназа (окисление жирных кислот), митохондриальная α-глицеролфосфатдегидрогеназа (челночная система).  Пример дегидрогеназной реакции с участием ФАД 2. Оксидазы, окисляющие субстраты с участием молекулярного кислорода. Например, прямое окислительное дезаминирование аминокислот или обезвреживание биогенных аминов (гистамин, ГАМК). 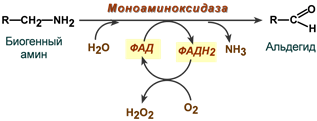 Пример оксидазной реакции с участием ФАД (обезвреживание биогенных аминов) 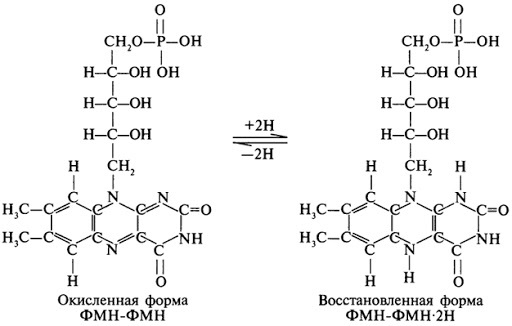 92. Перечислите витамины являющиеся гидрофобными антиоксидантами. Укажите химическое, клиническое и буквенное название данных витаминов, их роль в обмене веществ. Опишите признаки гиповитаминозов. Витамин А Химическое название: транс-9,13-Диметил-7-(1,1,5-триметилциклогексен-5-ил-6)-нонатетраен-7,9,11,13-ол Клиническое название: Ретинол Буквенное название: А Витамин А участвует в окислительно-восстановительных процессах, регуляции синтеза белков, способствует нормальному обмену веществ, функции клеточных и субклеточных мембран, играет важную роль в формировании костей и зубов, а также жировых отложений; необходим для роста новых клеток, замедляет процесс старения. Издавна известно благотворное влияние витамина А на зрение: еще в древности вареная печень - один из основных источников витамина А - использовалась как средство от ночной слепоты. Он имеет огромное значение для фоторецепции, обеспечивает нормальную деятельность зрительного анализатора, участвует в синтезе зрительного пигмента сетчатки и восприятии глазом света. Витамин А необходим для нормального функционирования иммунной системы и является неотъемлемой частью процесса борьбы с инфекцией. Применение ретинола повышает барьерную функцию слизистых оболочек, увеличивает фагоцитарную активность лейкоцитов и других факторов неспецифического иммунитета. Витамин А защищает от простуд, гриппа и инфекций дыхательных путей, пищеварительного тракта, мочевых путей. Наличие в крови витамина А является одним из главных факторов, ответственных за то, что дети в более развитых странах гораздо легче переносят такие инфекционные заболевания как корь, ветряная оспа, тогда как в странах с низким уровнем жизни намного выше смертность от этих 'безобидных' вирусных инфекций. Обеспеченность витамином А продлевает жизнь даже больным СПИДом. Ретинол необходим для поддержания и восстановления эпителиальных тканей, из которых состоят кожа и слизистые покровы. Не зря практически во всех современных косметических средствах содержатся ретиноиды - его синтетические аналоги. Действительно, витамин А применяется при лечении практически всех заболеваний кожи (акне, прыщи, псориаз и т.д.). При повреждениях кожи (раны, солнечные ожоги) витамин А ускоряет процессы заживления, а также стимулирует синтез коллагена, улучшает качество вновь образующейся ткани и снижает опасность инфекций. Ввиду своей тесной связи со слизистыми оболочками и эпителиальными клетками витамин А благотворно влияет на функционирование легких, а также является стоящим дополнением при лечении некоторых болезней желудочно-кишечного тракта (язвы, колиты). Ретинол необходим для нормального эмбрионального развития, питания зародыша и уменьшения риска таких осложнений беременности, как малый вес новорожденного. Витамин А принимает участие в синтезе стероидных гормонов (включая прогестерон), сперматогенезе, является антагонистом тироксина - гормона щитовидной железы. Как витамин А, так и b-каротин, будучи мощными антиоксидантами, являются средствами профилактики и лечения раковых заболеваний, в частности, препятствуя повторному появлению опухоли после операций. 'И витамин А, и b-каротин защищают мембраны клеток мозг от разрушительного действия свободных радикалов, при этом b-каротин нейтрализует самые опасные виды свободных радикалов: радикалы полиненасыщенных кислот и радикалы кислорода.' Антиоксидантное действие b-каротина играет важную роль в предотвращении заболеваний сердца и артерий, он обладает защитным действием у больных стенокардией, а также повышает содержание в крови 'полезного' холестерина (ЛПВП). Лютеин и зеаксентин - главные каротиноиды, защищающие наши глаза: они способствуют предупреждению катаракты, а также снижают риск дегенерации желтого пятна (важнейшего органа зрения), которая в каждом третье м случае является причиной слепоты. Еще один каротиноид - ликопин (содержится в остовном в помидорах) защищает от атеросклероза, предотвращая окисление и накопление на стенках артерий холестерина низкой плотности. Кроме того, это самый 'сильный' каротиноид в отношении защиты от рака, особенно рака молочной железы, эндометрия и простаты. Симптомы гиповитаминоза Дефицит витамина А определяется как содержание ретинола в сыворотке крови ниже 0,35 мкмоль/л. Однако, даже при уровне в плазме 0,70-1,22 мкмоль/л может наблюдаться значительное снижение содержания витамина А в печени, где он накапливается. Уровень витамина А в плазме начинает снижаться тогда, когда его концентрация в печени падает до 0,7 мкмоль/г ткани. При передозировке витамина А могут наблюдаться боли в животе; задержки менструаций; увеличение печени и селезенки; желудочно-кишечные расстройства; выпадение волос; зуд; суставные боли; тошнота; рвота; мелкие трещины на губах и в уголках рта. При хроническом гипервитаминозе А наблюдается: сухость и пигментация кожи, выпадение волос, ломкость ногтей, боли в области суставов и костей, диффузное утолщение костей, увеличение печени и селезенки, диспепсические явления. Витамин Е Химическое название: Токоферол Буквенное название: Е Витамин Е является уникальным веществом, обладающим способностью омолаживать организм, замедляя процессы старения. Именно поэтому его называют витамином молодости и красоты. Эффект замедления старения достигается за счет мощной активизации процессов тканевого дыхания, в ходе которых клетки хорошо снабжаются кислородом и из них удаляются продукты распада. Также витамин Е уменьшает свертываемость крови, профилактируя избыточное тромбообразование, а значит, улучшая микроциркуляцию и не допуская кровяного застоя в различных органах и тканях. Снижение свертывающей активности крови приводит к тому, что она лучше течет по сосудам, не закупоривая их. Кроме того, витамин Е делает стенки кровеносных сосудов гладкими, вследствие чего на них не откладываются холестериновые бляшки, за счет чего профилактируется атеросклероз. Улучшение свойств крови и состояния сосудов, а также профилактика атеросклероза в совокупности обеспечивают предотвращение сердечно-сосудистой недостаточности при регулярном употреблении витамина Е. Витамин Е улучшает функционирование иммунной системы, за счет чего предупреждаются инфекционно-воспалительные заболевания любых органов. В сочетании с витамином А предохраняет легкие от негативного воздействия загрязненного воздуха. Также витамин Е улучшает тонус и работоспособность мышц, купирует судороги и ускоряет заживление различных ран и ожогов. При применении витамина Е раны заживают с меньшими рубцами или вовсе без таковых. Отдельно необходимо сказать о том, что витамин Е улучшает половую функцию у мужчин и женщин, благоприятно действуя на выработку гормонов и состояние репродуктивных органов. Например, у женщин токоферол улучшает кровоснабжение матки и яичников, а также способствует выработке необходимого количества прогестерона и формированию плаценты во время беременности. У женщин витамин Е облегчает течение предменструального и климактерического синдрома, а также способствует полному излечению фиброзных образований молочной железы. У мужчин витамин Е улучшает качество спермы за счет нормализации функционирования половых желез. Кроме того, токоферол значительно улучшает потенцию. У всех людей вне зависимости от пола витамин Е снижает давление, расширяет и укрепляет стенки сосудов, профилактирует катаракту и анемию, а также поддерживает нормальное функционирование нервной системы. При недостаточном поступлении витамина Е в организм человека развивается его дефицит, называемый гиповитаминозом. Гиповитаминоз приводит к нарушению функционирования различных органов и систем, что проявляется следующими симптомами: Нарушение тканевого дыхания; Мышечная слабость; Гипотония мышц; Ухудшение потенции у мужчин; Высокий риск выкидыша, замирания беременности или самопроизвольного аборта у женщин; Ранний токсикоз беременности; Анемия вследствие гемолиза (разрушения) эритроцитов; Снижение уровня рефлексов (гипорефлексия); Атаксия (нарушение координации движений); Дизартрия (нарушение членораздельности речи с невозможностью нормального произношения слов и звуков); Сниженная чувствительность; Дистрофия сетчатки глаза; Гепатонекроз (отмирание клеток печени); Нефротический синдром; Бесплодие; Повышение активности креатинфосфокиназы и аланинаминотрансферазы в крови. При биохимическом исследовании плазмы крови у пациента Д., 48 лет, было выявлено снижение содержания альбуминов. Укажите возможные причины данного изменения. Альбумины – наиболее гомогенная фракция белков крови. Основная функция – связывание воды, что обеспечивает коллоидно-осмотическое (онкотическое) давление в крови. Альбумины транспортируют ионы магния, кальция, билирубин, свободные ЖК, стероидные гормоны, такие лекарственные соединения как антибиотики, барбитураты, сердечные гликозиды. Снижение содержание альбуминов наблюдается при повышении проницаемости сосудов клубочка нефрона (нефротический синдром) и заболеваниях печени. 41.К ферменту присоединились несколько остатков фосфорной кислоты. К каким функциональным группам радикалов аминокислот данного фермента можно их присоединить и какими связями? Как это отразится на активности фермента? Фосфорилирования - дефосфорилирования: Эти процессы катализируется специальными ферментами (протеинкиназами), которые присоединяют остаток фосфорной кислоты от АТФ к гидроксигруппам серина, треонина, тирозина в молекуле фермента, что приводит к активации или снижению активности фермента. Остаток фосфорной кислоты устраняется из молекулы фермента с помощью других ферментов – протеинфосфатаз. В клетке беско- нечно протекает цикл фосфорилирования-дефосфорилирования белков, который и обеспечивает изменение скорости метаболических процессов. 58.У больного с хронической почечной недостаточностью, несмотря на сбалансированную диету, отмечалось размягчение костей, повышенная их хрупкость (остеомаляция). Почему повреждение почек приводит к деминерализации? Не связано ли это с недостаточностью какого-либо витамина? Будет ли меняться картина заболевания при назначении витаминного препарата? В почках протекает процесс гидроксилирования в первом положении 1,25-диоксихолекальциферола – одного из активных метаболитов витамина D (кальциферола). Этот метаболит участвует в гомеостатической регуляции обмена кальция и остеогенеза. А именно: регулирует процессы всасывания Са и Р в почечных канальцах, резорбции костной ткани и реабсорбции Са и Р в почечных канальцах. При наличии постоянно действующих факторов недостаточности витамина Д и, следовательно, повышенной активности паратгормона и щелочной фосфатазы, идет интенсивный процесс деминерализании костей, сопровождающийся симптомами нарушения костеобразования ("четки", в местах сочленения ребра с реберными хрящами, "браслеты" на руках), и изменение состава костей (истончение костей черепа, искривление конечностей, позвоночника). При этом неуклонно продолжает снижаться содержание кальция и фосфора в крови, которое в тяжелых случаях достигает соответственно 1,0 и 0,6-3,2 мг%. Недостаточность витамина у взрослых развивается относительно редко и чаще всего обусловлена беременностью, особенно если женщина длительное время была лишена солнечного света и потребляла преимущественно высокоуглеводистую пищу, несбалансированную по соотношению кальция и фосфора. Недостаток витамина Д может возникнуть и у пожилых людей, исключивших из употребления продукты животного происхождения (молоко, творог, рыба и т.д.) При назначение витаминного препарата Д и сбалансированном питании клиническая картина будет меняться в лучшую сторону и признаки остеомаляции |
