обмен белков. Обмен простых белков
 Скачать 135.55 Kb. Скачать 135.55 Kb.
|
|
Лекция 4 Тема: Обмен простых белков План Факторы, влияющие на метаболизм белков. Азотистый баланс 2. Переваривание белков 3. Гниение аминокислот в кишечнике 4. Судьба всосавшихся аминокислот Обмен веществ или метаболизм – это превращение соединений, которое происходит в живых организмах и лежит в основе их жизнедеятельности. Значение обмена заключается: - в восстановлении постоянно теряемых организмом веществ (вода, минеральные соединения) и распадающихся органических веществ, входящих в состав тканей и тканевых жидкостей; - в обеспечении организма энергией, необходимой для движения, секреции, экскреции, образования ряда соединений и т.д. Метаболические (обменные) пути разделяют на два этапа: катаболические и анаболические. Катаболические пути – это процессы распада, деградации. При этом крупные органические молекулы разрушаются, обычно в окислительных реакциях, до простых компонентов, метаболитов. В результате таких процессов выделяется свободная химическая энергия, которая используется и преобразуется в другие формы энергии – механическую, электрическую, тепловую. Анаболические пути – это процессы синтеза. При этом из относительно простых метаболитов образуются сложные органические компоненты клетки. Здесь происходит затрата химической энергии. Корнберг пишет, что в то время как катаболические пути имеют совершенно определенные исходные вещества, но не имеют однозначно установленных конечных продуктов, анаболические пути, начинаясь от неопределенных рубежей, ведут к ясно различимым конечным продуктам. Катаболические и анаболические пути очень редко повторяют друг друга в деталях, т.е. при распаде, например, аминокислот, образуются продукты, которые не являются исходными в синтезе этой аминокислоты. Подчеркнем, что продукты катаболизма являются субстратами анаболических реакций. В процессах катаболизма вырабатывается энергия, а в процессах анаболизма она пот-ребляется. Наконец, процессы катаболизма в основном окислительные, а анаболизма – восстановительные. Катаболические и анаболические пути связывают между собой центральные пути обмена. В этот центральный метаболический котел (пул) поступает ограниченное число небольших органических молекул. Так, при распаде углеводов образуются триозофосфаты и пировиноградная кислота; при разрушении жиров – ацетил-КоА, пропионил-КоА и глицерин, при распаде белков – ацетил-КоА, оксалоацетат, α-кетоглутарат, фумарат и сукцинат. Факторы, влияющие на метаболизм белков. Азотистый баланс. В организме все белки подвергаются постоянному распаду и синтезу. Имеющаяся в здоровом организме стабильность химического состава является следствием равновесия между катаболизмом и анаболизмом. На эти процессы существенное влияние оказывают нервно-гормональные сдвиги, химическая природа веществ и внутриклеточная локализация соединений. Динамическое состояние белков организма подтверждено методом меченых атомов. Из этих данных следует, что в организме происходит постоянное смешивание эндогенных белковых молекул и аминокислот с молекулами белка и их производными, поступившими с пищей. В растущем организме скорость синтеза белков преобладает над его распадом. Во взрослом состоянии между этими процессами устанавливается динамическое равновесие. При тяжелых болезнях, голодании в организме скорости катаболизма преобладают над скоростями анаболизма. Однако даже в условиях длительного голодания синтез белков не прекращается. Обмен белков тесно связан с метаболизмом углеводов, липидов и нуклеиновых кислот. Все это свидетельствует о том, что в организме не может быть обособленного эндогенного и экзогенного обмена веществ. Обмен белков в организме регулируется и направляется центральной нервной системой. Это касается и эндокринной системы. Установлено, что после введения адренокортикотропного гормона (АКТГ), гормонов коры надпочечников и щитовидной железы в организме усиливается распад тканевых белков. В то же время соматотропный гормон (СТГ), андрогены и эстрогены, инсулин стимулируют анаболические реакции и способствуют синтезу белка. Обмен белков интенсивен в детском возрасте, при активной мышечной работе, беременности и лактации. На характер белкового обмена существенное влияние оказывает качественный и количественный состав белка пищи. Если в пище отсутствует или находится в недостаточном количестве хотя бы одна аминокислота, то синтез белка ограничивается или недостающая аминокислота извлекается из тканевых белков тела. Это естественно нарушает строго запрограммированный ход метаболизма белков. Показана тесная взаимосвязь белкового обмена с обеспеченностью организма витаминами В1, В2, В6, РР и др. Азотистый баланс. Для оценки состояния обмена белков весьма точным критерием является определение азотистого баланса. Исторически этот вопрос представляет большой интерес, он интенсивно разрабатывался отечественными учеными. Было показано, что даже при безбелковой диете азотистые соединения, тем не менее, выводятся с калом и мочой, т.е. распад белков тканей происходит постоянно. Подсчитано, что через 10 дней безбелкового питания, но достаточном в отношении калорий, человек выделяет в сут-ки 53 мг/кг веса азота. Для человека весом 70кг это составляет 3,71г азота или 23,2г белка. В 100г белка содержится 16г азота, следовательно, 1г азота соответствует 6,25г белка. 23,2г белка, постоянно распадающегося в организме, Рубнер назвал «коэффициентом изнашивания». Однако, как оказалось впоследствии, этого количества белка недостаточно для нормального функционирования организма. Действительно, было установлено, что азотистое равновесие в организме человека устанавливается при потреблении в сутки 35г белка. Это количество белка было названо «физиологическим минимумом». Исходя из таких исследований, стали считать, что для нормального функционирования всех систем человеку достаточно потреблять ежесуточно 30- 45г белка. Однако затем было выяснено, что при длительном нахождении людей или животных на таком рационе белка, у них развивались эндокринные и генетические нарушения. Так возникло клинически важное представление об азотис-том балансе. Если из организма за сутки выводится меньше азота, чем было введено его с пищей, то это положительный азотистый баланс. При этом синтетические процессы превалируют над процессами катаболизма белков органов и тканей. Положительный азотис-тый баланс характерен для растущих организмов и для периода беременности. В том случае, если количество азота принятого с пищей оказывается меньше выводимого с калом и мочой, то говорят об отрицательном азотистом балансе. Здесь усиливаются процессы распада белков органов и тканей. Подобное состояние встречается при голодании, белковой недостаточности разной степени, тяжелых заболеваниях, инфекциях, в пожилом возрасте и т.д. При азотистом равновесии имеется полное соответствие между количеством азота получаемого с пищей и количеством его, теряемого с мочой. Такое состояние характерно для здорового взрослого человека и животных, находящихся на полноценной диете с нормальным суточным содержанием белка. Представления об азотистом балансе позволили разработать суточные нормы белка в питании, которые необходимы для сохранения здоровья и обеспечения высокой работоспособности человека. Установлено, что суточное потребление белка ребенком в возрасте 1-3 года должно составлять не менее 55г, в возрасте 4-6 лет – 72г, 7-9 лет – 89г, 10-13 лет – 100г, а в возрасте 13-15 лет – 106г. Что касается взрослого человека, который затрачивает каждые сутки 2500 ккал, то он должен потреблять не менее 100г белка, а в жарком климате – 120г. При тяжелом немеханизированном труде на каждые 500 ккал расхода энергии в пищевой рацион следует включать дополнительно 10г белка. Суточные потребности в белке резко возрастают при беременности и лактации, а также при многих патологических состояниях: ожоги, травмы, нефриты, тяжелые инфекционные заболевания, авитаминозы и др. Если для углеводов и жиров в организме могут образовываться запасы, то белки не депонируются в прямом смысле этого слова. Однако белки плазмы крови, растворимые белки печени и мышц могут рассматриваться как резервные белки. Нормальный ход обмена белка в организме зависит не только от количества белка, принимаемого с пищей, но и от его качественного состава. Белок должен быть полноценен качественно. В этом случае говорят о биологической ценности белка, которая, в первую очередь, определяется степенью его усвоения. Чем лучше усваивается белок, тем меньше его надо для удовлетворения пот-ребностей организма. В белке важно соотношение аминокислот, например, на 100г белка должно приходиться 1г лизина, 1г триптофана, 1г метионина. Если метионина будет 0,5г, то усвояемость белка составит лишь 50%. Из животных белков наиболее ценными являются белки молока, мяса и куриного яйца, а из растительных – белок картофеля. Кроме того, биологическая ценность белка будет тем выше, чем ближе его аминокислотный состав к составу белков данного организма, чем больше он содержит незаменимых аминокислот и чем легче белок переваривается в соках желудочно-кишечного тракта. А.А.Покровским рассчитана суточная потребность человека в незаменимых аминокислотах. Потребность взрослого человека в триптофане составляет 1г, в треонине – 2-3г, в лизине – 3-5г, в метионине – 2,4г, в фенилаланине – 2-4г, в валине – 4г, в лейцине – 4,6г, в изолейцине – 3-4г. Переваривание белков. В растительных тканях полная пот-ребность в белковых соединениях может быть удовлетворена за счет синтеза. У животных и человека часть белка синтезируется в организме, а другая часть должна обязательно поступать с пищей. Средние величины содержания белка в основных пищевых продуктах приведены в таблице 14. Таблица 14 – Содержание белка в некоторых пищевых продуктах
Из этой таблицы следует, что содержание белка в животных продуктах существенно выше, чем в растительных. Кроме того, биологическая ценность белка животных продуктов также выше, т.к. в них содержатся все незаменимые аминокислоты, причем, в оптимальных соотношениях. У млекопитающих и человека расщепление белка начинается в желудке. Оно происходит под влиянием пепсина. Этот фермент выделяется главными клетками слизистой желудка в неактивной форме, в виде пепсиногена. Профермент же под влиянием всегда присутствующих малых количеств пепсина и свободной соляной кислоты превращается в активный пепсин. Процесс носит название автокаталитического. Из желудочного сока выделен еще один протеолитический фермент гастриксин с аналогичным спектром действия. Пепсин разрывает пептидную связь, образованную аминогруппами ароматических и кислых аминокислот. Образовавшиеся полипептиды подвергаются в кишечнике действию нескольких протеолитических ферментов. Некоторые из них выделяются через проток поджелудочной железы в виде неактивных предшественников: трипсиногена, химотрипсиногена, прокарбоксипептидаз и проэластазы. Так, трипсиноген (249 аминокислот) под влиянием энтеропептидазы (выделяется стенкой кишечника), малых количеств трипсина или ионов кальция, превращается в активный трипсин. При этом от N-конца трипсиногена отщепляется гексапептид. Трипсин максимально активен при рН 7,0 и расщепляет пептидные связи, в которых участвуют карбоксильные группы аргинина или лизина. Это эндопептидаза. Химотрипсиноген также представляет собой одну полипептидную цепь, в которой обнаружено 5 дисульфидных мостиков. Образование химотрипсина катализируется трипсином и протекает в 3 стадии. Вначале полипептидная цепь расщепляется между 15 и 16 остатками аминокислот и образуется π-химотрипсин, он активен, но неустойчив. Затем от одного из фрагментов под влиянием трипсина отщепляются остатки 14 и 15 (серин и аргинин) – образуется σ-химотрипсин. Наконец, в последней стадии от фермента отщепляется дипептид (148 и 149 остатки – треонин и аспарагин). При этом образуется активный α-химотрипсин, состоящий их трех полипептидных цепей, удерживаемых пятью дисульфидными связями. Химотрипсин гидролизует пептидные связи, образованные карбоксильными группами триптофана, фенилаланина или тирозина, в меньшей степени – лейцина и метионина. Это также эндопептидаза. Затем пептиды подвергаются в кишечнике действию карбоксипептидаз А и В. Это экзопептидазы, они гидролизуют только концевые пептидные связи. Карбоксипептидаза А гидролизует все СООН-концевые связи, за исключением, если они образованы лизином или аргинином или когда предпоследней аминокислотой является пролин. Карбоксипептидаза В атакует только СООН-концевые остатки лизина или аргинина. Секрецию ферментов поджелудочной кислоты (трипсиногена, химотрипсиногена и прокарбоксипептидазы) стимулирует гормон холецистокинин, продукцию которого, в свою очередь вызывают аминокислоты, поступившие в двенадцатиперстную кишку. Под влиянием еще одной эндопептидазы - эластазы расщепляются пептидные связи, образованные главным образом глицином, аланином и серином (рис.55). Энтеропептидаза   Трипсиноген Трипсин Трипсиноген Трипсин     Аутокатализ 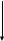 Проэластаза Химотрипсиноген Прокарбоксипептидаза Проэластаза Химотрипсиноген Прокарбоксипептидаза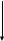 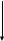 Эластаза Химотрипсин Карбоксипептидаза Рисунок 55 – Активация протеиназ в кишечнике Стенка кишечника секретирует лейцинаминопептидазу – экзопептидазу, гидролизующую NH2-концевые пептидные связи. Аналогичным образом действует аланинаминопептидаза, которая более специфична и гидролизует пептидные связи, в образовании которых участвует N-концевой аланин. Завершают процесс переваривания пептидов, с образованием свободных аминокислот, дипептидазы. Их известно несколько: глицил-глицин-дипептидаза, пролиназа, пролидаза. Суммируем представленные выше данные в виде весьма удобной таблицы 15. Таблица 15 – Протеолитические ферменты желудочно-кишечного тракта
Итак, в результате распада белков пищи (рис.56) образуются свободные аминокислоты, которые всасываются эпителиальными клетками тонкого кишечника. Эволюционно-детерминированный, биологический смысл переваривания пищевых белков в желудочно-кишечном тракте состоит в том, чтобы путем последовательного действия протеолитических ферментов лишить белки пищи видовой и тканевой специфичности. Второе значение переваривания пищевых белков состоит в том, чтобы придать продуктам распада белка способность всасываться в кровь через стенку кишечника. Примерно 95-97% белков пищи всасывается в виде свободных аминокислот. 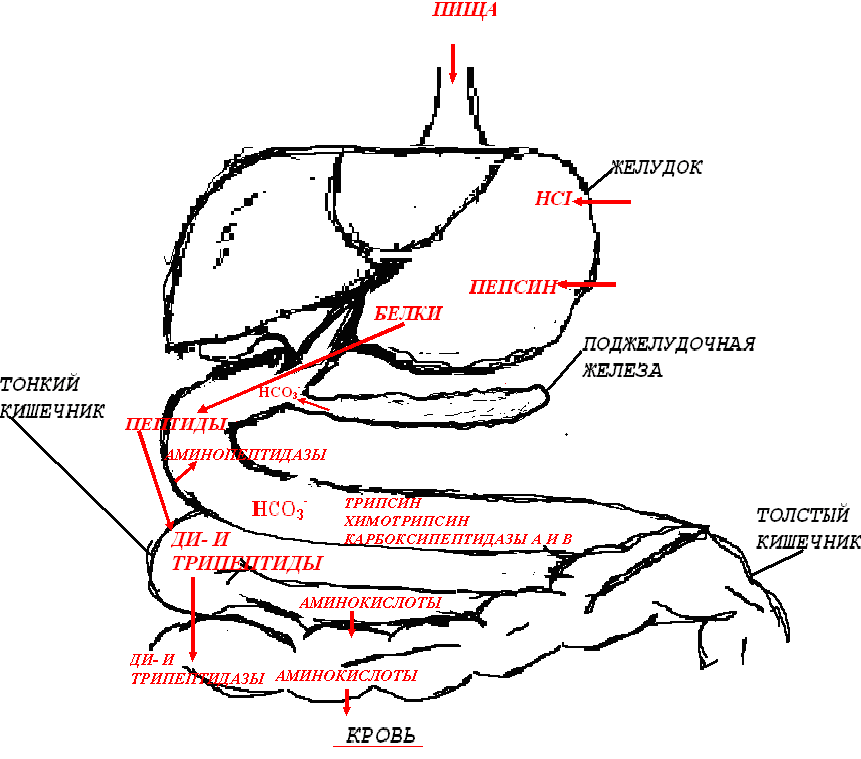 Рисунок 56 – Схема последовательной деградации пищевых белков в желудочно-кишечном тракте Тонкие механизмы всасывания аминокислот в кишечнике изучены недостаточно. Имеются сведения о всасывании небольшой части мелких пептидов. Однако где они гидролизуются – на клеточной поверхности или внутри клеток кишечника до сих пор окончательно не установлено. Что касается аминокислот, то энергия для их транспорта может поставляться биохимическими реакциями (направляемый метаболизмом транспорт) или они могут всасываться активно, благодаря работе Na+, К+- насоса, в частности за счет энергии движения ионов натрия. На всасывание аминокислот влияют многие факторы. Так, чем больше объем пиши, тем слабее всасываются аминокислоты. Алкоголь тормозит всасывание аминокислот. Для хорошего всасывания необходимо оптимальное соотношение аминокислот. При отсутствии метионина, остальные аминокислоты не всасываются, недостаток или отсутствие гистидина тормозит всасывание 10 аминокислот. Гниение аминокислот в кишечнике. Часть не расщепившихся белков, не всосавшиеся аминокислоты подвергаются в толс-том кишечнике гниению. Кал на 30% состоит из микроорганизмов, ферменты которых способствуют катаболизму аминокислот и образованию 4 видов газов: метана, сероводорода, аммиака и углекис-лого газа. В результате гниения, с одной стороны, образуются некоторые витамины (К, В12), значение которых обычно невелико, а с другой стороны – ядовитые вещества. Подсчитано, что у человека за сутки вырабатывается и выделяется с калом такое количество токсических веществ, которое способно вызвать гибель 5-6 кроликов. При гниении, например, серосодержащей аминокислоты цистеина образуется сильно ядовитое вещество метилмеркаптан (СН3 – SH); в норме он распадается на метан и сероводород. Приведем схему гниения цистеина в толстом кишечнике: 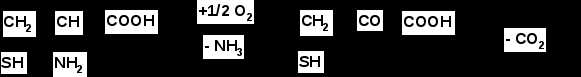 цистеин тиопируват 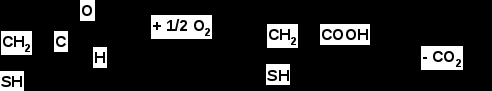 тиоуксусный тиоуксусная альдегид кислота метилмеркаптан метан сероводород При гниении в кишечнике тирозина образуются фенол и крезол, а триптофана – скатол и индол (рис.57). 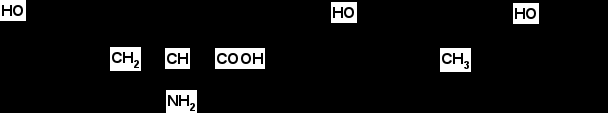 тирозин крезол фенол  триптофан скатол индол триптофан скатол индол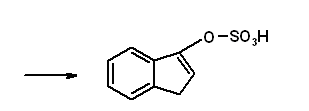 животный индикан Рисунок 57 – Распад ароматических аминокислот в кишечнике Токсические вещества обусловливают запах кала и вместе с ним удаляются из организма. Однако часть их всасывается в кровь, доносится током крови до печени и там обезвреживается. Детоксикация веществ в печени обычно включает две фазы. В первой – метаболит подвергается окислению, восстановлению или гидролизу, благодаря чему у него возникают дополнительные функциональные группы: NH2, SH, СООН, ОН и др. Для второй фазы характерны реакции конъюгации – к функциональным группам присоединяются глюкуроновая кислота, серная кислота, глицин, глутамин или ацетильный остаток: 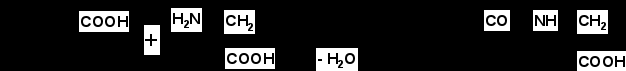 бензойная кислота глицин гиппуровая кмслота В результате этих модификаций вещество становится менее токсичным, более растворимым в воде и легче выводится из организма. Чаще всего в процессе детоксикации ядовитых веществ в печени принимают участие 3́-фосфоаденозин-5́-фосфосульфат (ФАФС) и уридиндифосфоглюкуроновая кислота (УДФГК): 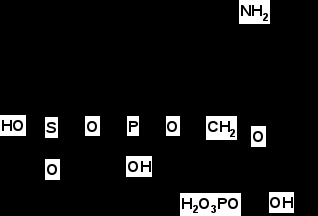 ФАФС 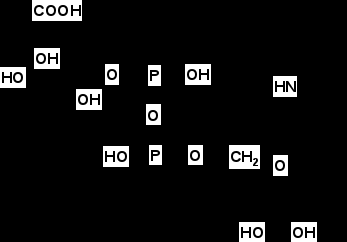 УДФГК Конечным продуктом детоксикации индола является животный индикан. В норме, в крови содержание его составляет 0,25-0,8 мг/л. Оно резко возрастает в крови и моче при задержке пищи в кишечнике, например при завороте кишок, и значит при сильном развитии в нем гнилостных процессов. Всегда при пище богатой белками концентрация индикана в крови возрастает, а при углеводном питании и голодании уменьшается. Изменение содержания индикана в моче служит одним из диагностических тестов на состояние процесса пищеварения в организме человека. Судьба всосавшихся аминокислот. Аминокислоты, которые всосались из кишечника, попадают в кровь и доносятся до всех органов и тканей. Здесь они используются по различным направлениям, в первую очередь, для синтеза белка (рис.58). В конечном счете из 20 аминокислот десять превращаются в ацетил-КоА (аланин, глицин, серии, цистеин, треонин, тирозин, фенилаланин, лизин, триптофан, лейцин), пять – в α-кетоглутарат (аргинин, гистидин, глутаминовая кислота, глутамин и пролин), три – в сукцинил-КоА (метионин, изолейцин, валин) и две – в оксалоацетат и фумарат, как части фенилаланина и тирозина. Иными словами, происходит унификация катаболизма, когда из множества соединений, в частности аминокислот, образуется всего несколько, причем, достаточно простых.  Углеводы Углеводы Липиды Липиды  Холин Холин Креатин КреатинПептиды (глутатион, ансерин,   карнозин) карнозин)  Другие аминокислоты Другие аминокислоты Порфирины (гем, гемоглобин, Порфирины (гем, гемоглобин,    Аминокислоты  цитохромы) цитохромы)Белки (ферменты, гормоны, антитела)      Никотинамид - НАД Никотинамид - НАДГормоны (окситоцин, вазопрессин, катехоламины, тироксин) Биогенные амины Меланины  α- Кетокислоты CO2 + H2O α- Кетокислоты CO2 + H2OПурины, пиримидины Аммиак Мочевина Рисунок 58 – Пути использования аминокислот после всасывания в кишечнике Перенос аминокислот как через внешнюю клеточную мембрану, так и через внутриклеточные мембраны осуществляет, видимо, специальная транспортная система. Механизм ее изучен недостаточно. Считают, что особую роль в транспорте аминокислот играет фермент γ-глутамилтрансфераза (рис.59). 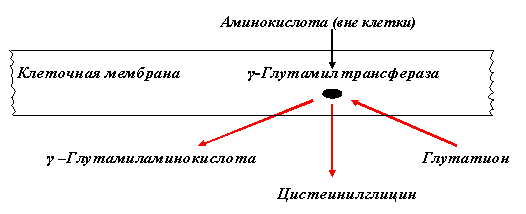 Рисунок 59 – Схема первой реакции γ-глутамильного цикла Этот фермент переносит γ-глутамильную группу от глутатиона (чаще всего) на транспортируемую аминокислоту. Комп-лекс γ-глутамиламинокислота транспортируется через биомембрану и внутри клетки распадается на свободную аминокислоту и пироглутаминовую кислоту. Таким путем удается транспортировать значительные количества аминокислот из почечных канальцев, через слизистую кишечника и др. |
