лр 2. Определение молярной массы эквивалента металла
 Скачать 108.5 Kb. Скачать 108.5 Kb.
|
|
МИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии отчет по лабораторной работе №2 по дисциплине «Химия» Тема: Определение молярной массы эквивалента металла Студент гр. 1204 ____________________ Манулис В.Ю. Преподаватель ____________________ Васильев Б. В Санкт-Петербург 2021 Цель работы: Основные теоретические положения Эквивалент – реальная или условная частица вещества X, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода H+, а в данной окислительно-восстановительной реакции эквивалентна одному электрону. Молярная масса эквивалента – Его молярная масса, умноженная на фактор эквивалентности Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции. Формула: n(экв1) = n(экв2) Расчет молярной массы эквивалента: Оксиды состоят из элемента и кислорода. Если предположить, что в реакциях обмена элемент замещается на водород, то эквивалентное число z для оксида равно произведению числа атомов элемента и валентности элемента, образующего оксид. zоксида= n(элемента) *|C.O.(элемента)| Основания имеют в своем составе гидроксогруппу ОН–, способную соединяться с одним ионом водорода: ОН– + Н+ = Н2О. Кислоты имеют в своем составе активный водород, способный замещаться в реакциях нейтрализации, следовательно, эквивалентное число z для кислоты равно числу катионов водорода в ее составе, или ее основности. zкислоты= n(Н+) = основности Соли имеют в своем составе металл и кислотный остаток. Каждая соль может быть получена реакцией нейтрализации, в которой ион металла замещает ионы водорода. Следовательно, эквивалентное число z для соли равно произведению числа атомов металла в ее составе и степени окисления металла. zсоли= n(Ме) · |С.О.(Ме)| Схема установки: 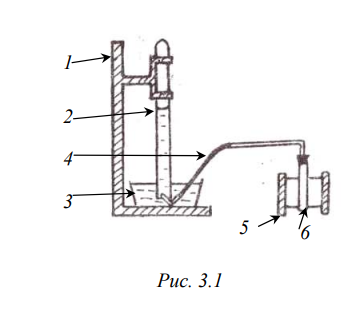 1 штатив для эвдиометра 2 эвдиометр 3 кристаллизатор 4 газоотводная трубка 5 штатив для пробирки 6 пробирка Протокол наблюдений Лабораторная работа № 2 «Определение молярной массы эквивалента металла» Обработка результатов 1. Приведите объем выделившегося водорода к нормальным условиям (н. у.): 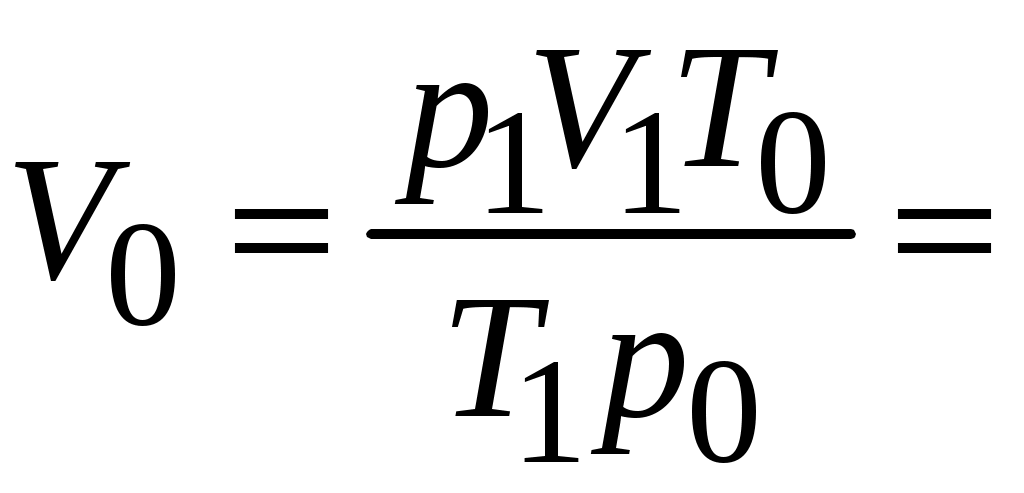 2. Рассчитайте молярную массу эквивалента металла, используя закон эквивалентов: 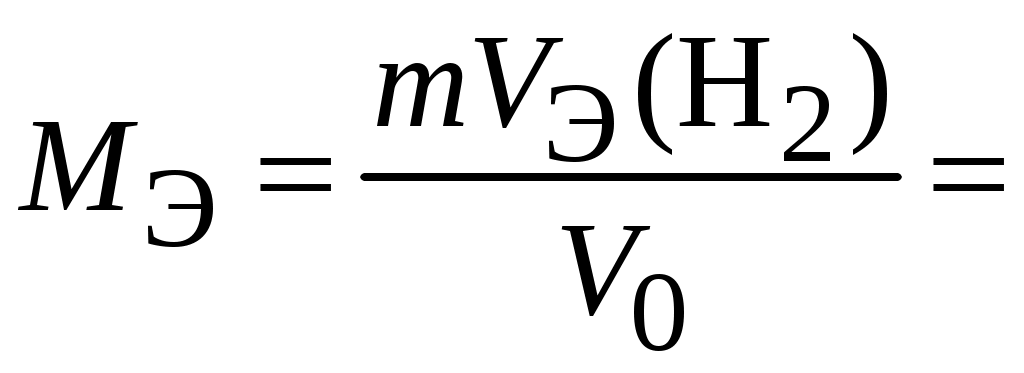 3. Определите молярную массу атомов металла Мат = zМЭ = z=1: Мат1 = z=2: Мат2 = z=3: Мат3 = Неизвестный металл – __________, так как … 4. Вычислите абсолютную и относительную погрешности определения молярной массы эквивалента металла: абсолютная: относительная: 5. Приведите уравнение окислительно-восстановительной реакции Выводы: |
