Химическая технология. Ответ Каталитическая конверсия углеводородов (паровая, парокислородная и пароуглекислотная) представляет собой технологическую комбинацию следующих химических реакций (тепловой эффект
 Скачать 0.84 Mb. Скачать 0.84 Mb.
|
|
Контрольная № 2 1. Производство водорода из метана и воды. Физико-химические основы процесса Ответ: Каталитическая конверсия углеводородов (паровая, парокислородная и паро-углекислотная) представляет собой технологическую комбинацию следующих химических реакций (тепловой эффект H298,16 кДж/моль). СН4 + Н2О → CO + 3H2 + 20,5 кДж/моль СН4 + 2Н2О → CO2 + 4H2 + 163,7 кДж/моль СН4 + CO2 → 2CO + 2H2 + 248,3 кДж/моль CO + 3H2O → CO + H2 - 41,16 кДж/моль C + O2 → CO2 – 393,56 кДж/моль СН4 + O2 → CO2 + 2Н2О – 802,61 кДж/моль CO2 + C → 2CO + 172,5 кДж/моль СН4 2Н2 + C + 74,94 кДж/моль H2O + C → CO + H2 + 131,46 кДж/моль Процесс конверсии протекает на никелевом катализаторе. Выход Н2 на моль израсходованного в процессе пара наибольший для СН4 и снижается с увеличением содержания углерода в молекуле углеводорода. Равновесная концентрация конвертированного газа прямо пропорциональна температуре, давлению процесса и соотношению пар : углеводород в исходной конвертируемой смеси. Процесс можно проводить в одну стадию. Однако в ряде случаев его целесообразнее вести в две стадии (две ступени). Первая стадия процесса парового риформинга протекает в трубах, заполненных катализатором, с подводом тепла извне через стенку трубы. Во второй ступени протекает остаточная конверсия метана кислородом по реакции: СН4 + 0,5O2 → CO + 2Н2 Для смещения равновесия реакции конверсии метана вправо, т. е. в сторону получения водорода, применяется избыток водяного пара по сравнению со стехиометрическим соотношением. Кроме того, избыток пара предотвращает выделение элементарного углерода (сажи) и уменьшает процентное содержание метана в конвертированном газе. Как видно из уравнения, полную конверсию метана можно осуществить в одну стадию с образованием водорода и двуокиси углерода. При низкотемпературной конверсии в продуктах реакции остается значительное количество метана. При повышенных температурах газ содержит в большом количестве окись углерода. И в том и в другом случае для смещения равновесия реакции конверсии метана вправо требуется значительный избыток пара. Расход пара уменьшается при проведении конверсии метана в две стадии. Поэтому в промышленных условиях целесообразно процесс получения водорода конверсией метана с водяным паром проводить в две стадии (конверсия метана и конверсия окиси углерода). При высокой температуре происходит термическое разложение метана и его гомологов с выделением углерода. Выделяющийся углерод оседает на катализаторе, происходит так называемое зауглероживание катализатора, в результате чего снижается его активность и происходит преждевременное его разрушение. Увеличивается сопротивление конвертора, а главное - снижается его производительность. Для предотвращения выделения углерода, кроме избытка пара, требуется, чтобы парогазовая смесь находилась в соприкосновении с поверхностью катализатора ничтожно малое время, недостаточное для воспламенения смеси. Это условие соблюдается, если скорость нагретой газовой смеси до ее поступления на катализатор больше скорости распространения пламени и исключена возможность обратного проникновения пламени с раскаленного катализатора в смесительное и надкатализаторное пространство. Используемые для описания химических превращений в трубчатой печи и шахтном реакторе уравнения (1) – (3) являются итоговыми уравнениями реакций, которые фактически отражают баланс химических элементов до и после превращений. Детальный же механизм процесса может быть очень сложным. Например, реакцию метана с водяным паром на поверхности никелевого катализатора можно представить следующей совокупностью стадий: 1. СН4 + Z→ ZCН2 + Н2 , 2. ZCН2 + Н2О →ZCНOH + Н2 , 3. ZCНOH→ ZCO + Н2 , 4. ZCO → Z + CO , 5. Z + Н2О →ZO + Н2 (равновесная стадия), 6. ZО + CО→ Z + СО2 (равновесная стадия). Здесь Z – активный центр на поверхности катализатора. Для описания процесса конверсии метана итоговыми уравнениями, связывающими исходные вещества СН4 и Н2О и продукты Н2, СО, и СО2 , достаточно написать 2 линейно независимых уравнения реакций, например, уравнения (1) и (2). Любое другое уравнение, связывающее эти вещества, можно будет получить из первых двух. Уравнение (2) описывает конверсию СО в аппаратах 5 и 6. Конверсия природною газа может быть осуществлена либо термическим разложением метана СН4 → С+2Н2 – 18,1 ккал (1) либо каталитическим окислением метана водяным паром, кислородом и двуокисью углерода: СН4 + 0,5О2 → CO + 2H2 + 8,5 ккал (2) СН4 + H2O CO + 3H2 – 49,3 ккал(3) СН4 + CO2 2CO + 2H2 – 59,1 ккал(4) СО + H2O CO2 + H2 + 9,8 ккал(5) Выбор окислителей и их возможные сочетания определяются назначением процесса и технологической схемой дальнейшей переработки полученного газа. Реакции (1) - (2) практически необратимы. Реакции (3) - (5) являются обратимыми, т. е. в зависимости от условий, в которых они осуществляются, могут проходить как слева направо, так и справа налево. Вследствие обратимости реакции прямой процесс невозможно осуществить до конца. В самом деле, в обратимых реакциях, например в реакции (3), оба процесса - прямой (взаимодействие метана с водяным паром) и обратный (взаимодействие окиси углерода с водородом) - протекают одновременно. При достаточно высоких температурах и концентрациях метана в газовой смеси скорость прямой реакции гораздо больше, чем скорость обратного процесса. Постепенно скорости прямого и обратного процессов выравниваются и наступает химическое равновесие, при котором в смеси присутствуют как исходные вещества, так и продукты реакции. Равновесный состав газа для обычно применяемых в промышленности исходных газовых смесей и интервале температур 827 - 1027°С приведен в табл.1). С изменением температуры, давления и состава исходной смеси равновесный состав газа также изменяется. При повышении температуры увеличиваются скорости обеих реакций (прямой и обратной), но увеличиваются они в разной степени. В случае реакций, протекающих с поглощением тепла (эндотермических реакций), например реакции (3), скорость прямой реакции возрастает гораздо больше, чем скорость обратной реакции. В результате этого равновесие сдвигается вправо, т. е. в сторону уменьшения содержания метана в конвертированном газе. В случае же реакций, протекающих с выделением тепла (экзотермических реакций), например реакции (5), равновесие сдвигается влево, т. е. степень конверсии окиси углерода снижается. Таблица 1. Равновесный состав газа в процессе конверсии метана для обычно применяемых в промышленности исходных газовых смесей при абсолютном давлении 1 ат
Изменение давления влияет на равновесный состав газа только тогда, когда в результате реакции изменяется объем газа (при постоянном давлении), т. е. когда общее число молей (объемов) исходных веществ отличается от числа молей (объемов) продуктов реакции. Равновесный состав газа для реакций, протекающий без изменения объема, например, реакции (5), не зависит от давления. Реакция (3) протекает с увеличением объема: из двух объемов исходной смеси получается четыре объема конвертированного газа, поэтому при повышении давления равновесие смещается влево, т. е. степень конверсии метана снижается. Например, для исходной смеси состава СН4 : H2O = 1 : 2 при 827°С и давлениях 10, 20 и 40 атм содержание метана в конвертированном газе составляет соответственно 5, 10 и 16%. Для того чтобы остаточное содержание метана в конвертированном газе не увеличивалось при повышении давления, необходимо одновременно повысить температуру. Так, например, чтобы получить при указанном составе исходной смеси газ с остаточным содержанием метана 0.5% при абсолютном давлении 10 атм, нужно повысить температуру до 960°С, а при 20 атм - до 1060°С. Несмотря на это, проведение процесса конверсии при умеренном давлении (20 - 30 атм) экономически целесообразно, так как в данном случае уменьшается расход энергии на сжатие конвертированного газа, а также снижаются капитальные затраты на сооружение конверсионной установки. При увеличении концентрации реагирующих веществ происходит также увеличение концентрации образующихся веществ. Для рассматриваемой реакции (3) повышение содержания водяных паров в исходной смеси приведет к смещению равновесия вправо, т. е. к увеличению содержания СО и водорода и уменьшению содержания метана в конвертированном газе. Увеличение количества добавляемого водяного пара особенно важно, когда конверсия метана осуществляется при повышенном давлении. Например, применяя исходную смесь СН4 : H2O = 1 : 4 при давлении 10 атм, можно получить конвертированный газ, содержащий 0,5% метана, при 850°С, т.е. на 110°С ниже, чем при составе исходной смеси 1 : 2. Скорость реакции взаимодействия метана с водяным паром, т. е. количество метана, прореагировавшего в единицу времени, в отсутствие катализатора очень мала. Так, при нагревании смеси метана с водяным паром до 700°С и соотношении СН4: H2O = 1 : 2 в течение 3 ч только 3% метана превращается в водород. Для получения газа, содержащего 0,5% метана, требуется повысить температуру до 1400°С. В производственных условиях конверсия метана должна протекать в течение долей секунды, что достигается путем применения катализаторов. Равновесие реакции конверсии метана водяным паром, как реакции эндотермической, с ростом температуры смещается в сторону образования СО и Н2, а с ростом давления в обратную сторону, т. е. в сторону образования метана. Однако для заданного давления и температуры превращение метана возрастает с ростом содержания пара в исходной газовой смеси (рис. 6). На этом рисунке одновременно видно, как с ростом температуры падает полнота конверсии СО водяным паром – реакции экзотермической. И хотя давление оказывает отрицательное воздействие на превращение метана, наблюдается постоянный рост используемого давления в промышленных процессах паровой конверсии метана. Проведение процесса при повышенных давлениях снижает расходы на компрессию полученного синтез-газа, затраты на изготовление аппаратуры, улучшает условия теплопередачи. Развитие этого процесса ограничивается в основном прочностью металла реакционных труб, работающих в жестких условиях высоких температур. Равновесные соотношения при конверсии метана показывают, что для заданного превращения метана при постоянном соотношении водяной пар : углерод повышение давления в процессе означает повышение температуры риформинга, повышение температуры газов, выходящих из трубчатых печей, и повышение температуры стенок реакционных труб. Наиболее обоснованное и практически оправданное уравнение скорости реакции конверсии метана для атмосферного давления дал Темкин и его ученики. Энергия активации процесса паровой конверсии составляет 129,79 кДж/моль для температурной области 800 - 900°С на никелевой фольге и 100,48 кДж/моль для этой же области температур на никелевом катализаторе, нанесенном на пористом носителе. Кинетические данные используют для расчета аппаратов конверсии, в частности для расчета температур на входе в реактор и выходе из него. В качестве катализаторов конверсии используют никель, нанесенный на пористый носитель. Содержание никеля в катализаторе может колебаться в широких пределах - от 4 до 35% (масс.). Наиболее стабильными катализаторами для широкого диапазона температур конверсии и работы в экстремальных условиях являются катализаторы, носители для которых не содержат SiО2, главной их основой является -Аl2О3 (корунд). В качестве активаторов в них могут содержаться оксиды кальция, титана, магния, хрома. Внутренняя поверхность таких катализаторов колеблется от 5 до 50 м2/г. Восстановление нанесенного NiO до металлического никеля происходит в загруженном конверторе водородом или метаном. Для конверсии легких фракций нефти (нафты) используют щелочные калийсодержащие катализаторы. Использование таких катализаторов дает возможность проводить конверсию нафты при низких соотношениях пар : углерод (3: 1) без выделения сажи. Катализаторами называются такие вещества, которые увеличивают скорость химических реакций. Применение катализатора не вызывает сдвига химического равновесия в ту или иную сторону. Как установлено многочисленными исследованиями лучшим для процесса конверсии метана является никелевый катализатор. В свежем катализаторе никель находится в виде окислов. Катализатором же ускоряющим реакции конверсии метана, является металлический никель. Поэтом, перед началом процесса конверсии катализатор необходимо восстановить газом, содержащим водород NiO + H2 = Ni + H2O. Катализатор восстанавливается водородом полностью при температуре 300 - 400°С в течение 2 - 4 ч. При отсутствии водорода катализатор можно также восстановить рабочей смесью (метан и водяной пар или метан, водяной пар и кислород) при 750 - 850°С. Если никель находится не в виде окислов, а в виде их соединении с окисью алюминия (шпинели), то для его восстановления требуется более высокая температура (800 - 900°С). В этом случае процесс восстановления протекает медленнее. Никель-алюминиевая шпинель (голубовато-зеленоватого цвета) образуется при нагревании катализатора до температуры выше 600°С в среде, не содержащей восстановителей (Н2 и СО). Эффективность работы катализатора определяется остаточным содержанием метана в конвертированном газе при определенном количестве подаваемого исходного газа. Нагрузка на катализатор характеризуется объемной скоростью.Объемной скоростью называется количество кубометров исходного газа (сухого), проходящего через 1 м3 катализатора в час. Объемная скорость выражается в ч-1. В промышленных условиях катализатор конверсии метана работает в интервале объемных скоростей 250 - 400 ч-1 при 600 - 1000°С. Активность никелевого катализатора может снижаться вследствие присутствия в газе соединений серы: Н2S, CS2 и COS. Вещества, снижающие активность катализатора, называются каталитическими ядами. Процесс отравления катализатора Н2S протекает по схеме Ni + H2S → NiS + H2. Образовавшийся сернистый никель уже не способен ускорять реакцию конверсии метана, в связи с чем активность катализатора снижается. Проведенными исследованиями установлено значительное влияние температуры на отравление катализатора соединениями серы. Показано, что при температуре, равной 600°С, наличие даже небольших количеств соединений серы в газе (5 мг/м3 серы) приводит к необратимому отравлению и полной потере активности катализатора. С повышением температуры отравляемость катализатора этими соединениями уменьшается. Так, при температуре 700 - 800°С отравление катализатора происходит в значительно меньшей степени и активность его может быть восстановлена в процессе конверсии метана, не содержащего соединений серы. При 850°С и содержании в газе 5 - 7 мг/м3 серы заметного отравления катализатора не наблюдается. Конверсия метана может сопровождаться выделением свободного углерода (сажи), что затрудняет проведение процесса. Реакция (1) образования сажи протекает параллельно с основными реакциями в случае недостатка окислителей - водяного пара и кислорода. При этом углерод отлагается не только на поверхности, но и внутри гранул катализатора, что приводит к уменьшению активности и механическому разрушению катализатора и к увеличению гидравлического сопротивления аппарата потоку газа. В отсутствие катализатора образование углерода по реакции (1) начинается при нагревании метана до температуры 800°С, а на восстановленном никелевом катализаторе эта реакция протекает с заметной скоростью уже при 400°С. Воспламенение в объеме (без катализатора) смеси метана с водяным паром и кислородом, применяемой в процессе конверсии природного газа, всегда сопровождается образованием углерода вследствие частичного разложения метана при температуре около 1100°С, развиваемой в пламени. На никелевом катализаторе при достаточном количестве окислителей выделения свободного углерода не происходит. Из сказанного следует, что на нагретый катализатор нельзя подавать природный газ, не смешав его предварительно с водяным паром и кислородом. В промышленности большое количество водорода получают из метана, добавляя к нему при высокой температуре перегретый водяной пар: 1) CH4 + H2O = CO + 3 H2 2) CO + H2O = CO2 + H2 В сумме этот процесс можно записать уравнением: CH4 + 2 H2O = 4 H2 + CO2 Смесь газов охлаждают и промывают водой под давлением. При этом СО2 растворяется, а малорастворимый в воде водород идет на промышленные нужды. Производство водорода методом паровой каталитической конверсии углеводородов Назначение установки - производство водорода, потребность в котором возрастает из года в год в связи с постоянным углублением процессов переработки нефти, повышением требований к качеству получаемых топлив и смазочных материалов, а также в связи с необходимостью обессеривания энергетического топлива. В качестве сырья для получения водорода методом паровой каталитической конверсии легких углеводородов могут быть использованы природные и заводские (сухие и жирные) газы, а также прямогонные бензины. Этот наиболее распространенный метод производства водорода включает три стадии: подготовку сырья к конверсии, собственно конверсию и удаление из продуктов оксидов углерода. Применяемая в настоящее время технология peгламентирует некоторые требования к качеству сырья, в частности по содержанию в нем соединений серы (в газах до 100 мг/м3, в бензинах до 0,3 мг/кг), отравляющих как никелевый катализатор паровой конверсии углеводородов, так и цинкмедный катализатор низкотемпературной конверсии оксида углерода. Присутствие в сырье непредельных углеводородов вызывает образование углеродистых отложений на катализаторе паровой конверсии углеводородов. В промышленности получают технический водород с содержанием водорода 95 - 98 % (об.). Производство технического водорода меньшей концентрации приводит к его повышенному расходу на установке гидрокрекинга, а большей концентрации - требует значительных затрат и экономически нерентабельно. Паровую конверсию углеводородов следует вести, избегая осаждения углерода на катализаторе, способствующего его разрушению и увеличению гидравлического сопротивления в реакторе. Для предотвращения этого процесса следует поддерживать некий минимальный расход водяного пара в процессе паровой конверсии углеводородов. Теоретически этот расход не должен быть ниже 2:1. Однако для улучшения теплопередачи на практике подают до 4 - 5 м3 пара на конверсию 1 м3 метана. В заводской практике для доочистки сырья для водородных установок нашли применение три типа процессов: очистка моноэтаноламином от сероводорода, одностадийное поглощение соединений серы поглотителем на основе оксида цинка (в случае присутствия лишь термически нестойких соединений серы) и двухступенчатая схема извлечения соединений серы, включающая деструктивное гидрирование сернистых соединений с последующим поглощением сероводорода на оксиде цинка. Современные установки по производству водорода обладают мощностью от 300 тыс. м3 до 3 млн. м9 водорода в сутки; для них характерны рабочие давления в интервале 2 - 3 МПа. 2. Схема получения полиэтилена под высоким давлением Ответ: Полиэтилен -(СН2-СН2)n- представляет собой карбоцепной термопластичный кристаллический полимер белого цвета. Макромолекулы полиэтилена имеют линейное строение с небольшим количеством боковых ответвлений. Свойства полиэтилена зависят от способа полимеризации. Сырьем в производстве полиэтилена служит этилен высокой чистоты 99,8 %. Известны две химические концепции получения полиэтилена; радикальная полимеризация этилена в газовой фазе; координационно-ионая полимеризация этилена в растворе бензина. На их основании разработаны две технологические концепции: производство полиэтилена высокого давления; производство полиэтилена низкого давления. Получение полиэтилена высокого давления проводят радикальной полимеризацией этилена в газовой фазе при температуре 180–300 °С и давлении 150–300 МПа. Процесс идет в присутствии инициаторов – молекулярного кислорода (0,003 % об.) или пероксида ди-трет-бутила. Реакция протекает через образование промежуточного пероксидного соединения с последующим гомолитическим распадом: 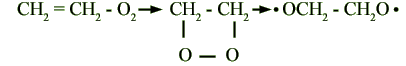 Образующиеся радикалы инициируют реакцию полимеризации этилена: nСН2 = СН2 Конверсия этилена в полиэтилен и свойства полученного полимера зависят от температуры, давления, концентрации инициатора и времени проведения полимеризации. Технологическая схема производства полиэтилена высокого давления представлена на рис. 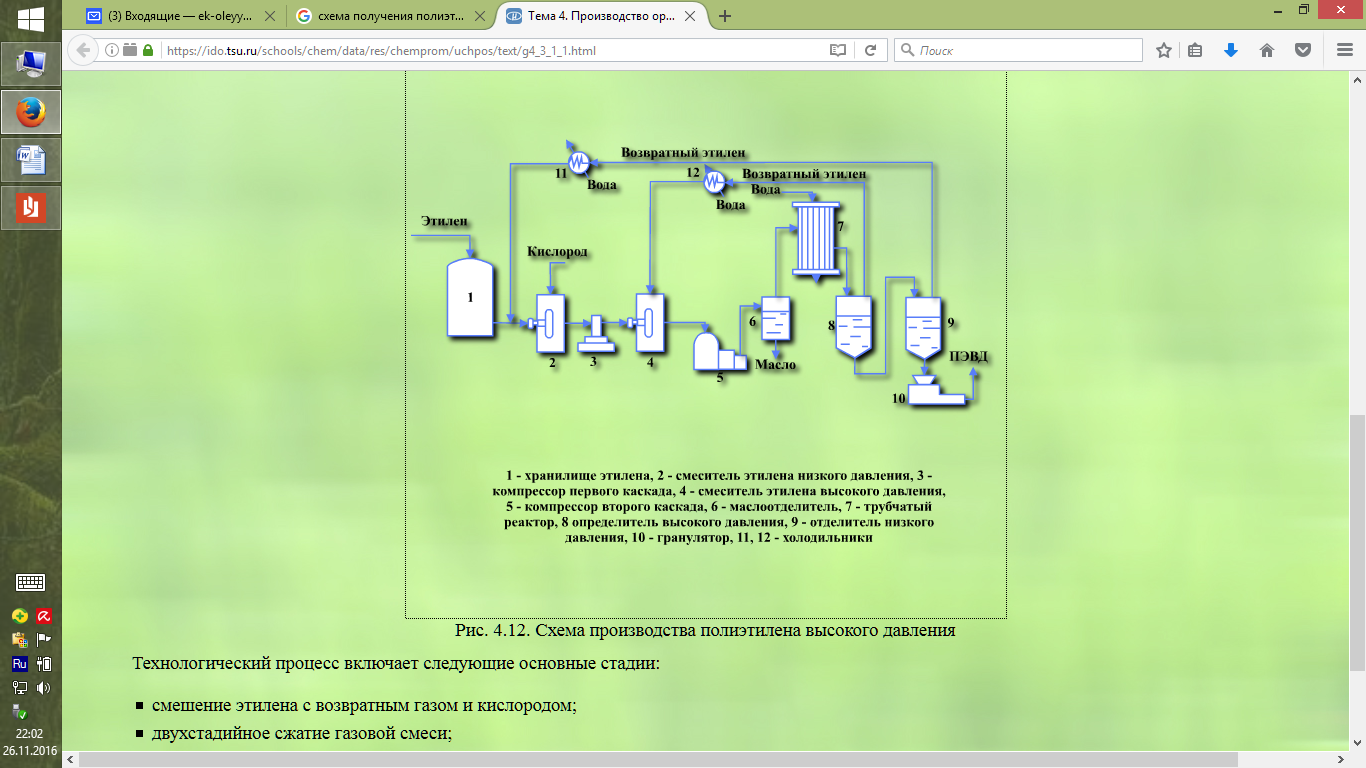 Технологический процесс включает следующие основные стадии: смешение этилена с возвратным газом и кислородом; двухстадийное сжатие газовой смеси; полимеризация этилена; разделение полимера и непрореагировавшего этилена; грануляция полимера. Современные установки по производству полиэтилена высокого давления имеют мощность 150 тыс. т в год. Выход полимера составляет 95–98 %.  Решение: Окисление аммиака является первой стадией получения азотной кислоты из аммиака. По этому методу аммиака окисляется кислородом воздуха в присутствии платинового катализатора при 800-9000С до оксидов азота. Затем, полученный оксид азота окисляется до диоксида азота, а последний поглощается водой с образованием азотной кислоты. Схематично процесс можно изобразить следующим уравнением 4NН3 + 5О2 = 4NО + 6Н2О 2NО + О2 = 2NО2 2NО2 + Н2О = 2НNО3 + NО Для материальных расчетов можно в первом приближении записать суммарное уравнение этих трех стадий в виде NН3 + 2О2 = НNО3 + Н2О Мол. масса NН3 – 17, НNО3 – 63. Необходимое количество аммиака для получения 1 т НNО3 с учетом степени окисления, степени контактирования, степени абсорбции и с учетом того, что 3 % аммиака превращается в азот, составит 1000 * 17/63 / 1 / 0.98 *1,03/0,97 = 292,4 кг Объем аммиака составит 292,4 * 22.4/17 = 385,3 м3 Расход воздуха (м3/ч), требуемый для окисления (в составе аммиачно- воздушной смеси) будет равен 385,3·(100 – 13,7)/ 13,7= 2427,1 м3, где 13,7 – содержание аммиака в смеси (% об.), т. е. (8.5/17) * 100/(8.5/17 + 91.5/29) = 13,7 Составляем таблицу материального баланса:
Невязка баланса составляет 6,2 %. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
