глава 11. Полициклические ароматические углеводороды и их производные
 Скачать 0.86 Mb. Скачать 0.86 Mb.
|
|
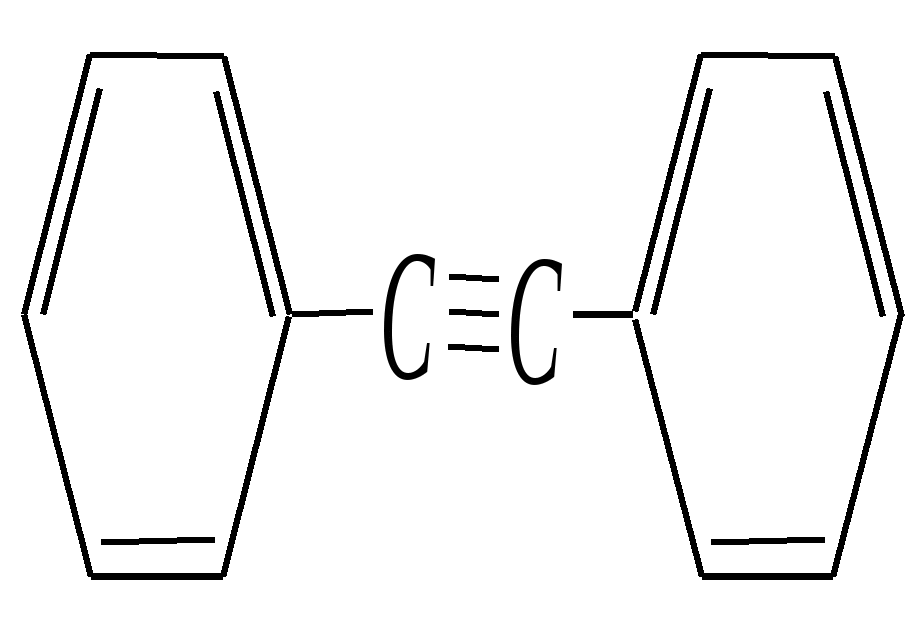
Глава 11. полициклические ароматические углеводороды и их производные Полициклические соединения содержат несколько бензольных колец. Их молекулы могут содержать как изолированные, так и конденсированные друг с другом циклы. К соединениям с изолированными бензольными кольцами относят дифенил (бифенил), стильбены, толан, полиарилметаны и их производные:
Наличие изолированного бензольного кольца в молекулах этих соединений во многом определяет их строение и важнейшие свойства. К соединениям с конденсированными бензольными кольцами относят, например, нафталин, антрацен, фенантрен и их производные:
Эти углеводородные системы обладают большей специфичностью в химическом поведении, чем молекулы с изолированными циклами, они также являются структурной основой для многих природных и биологически важных веществ. Поэтому в данной главе будут рассмотрены соединения с конденсированными бензольными кольцами. 11.1. классификация углеводородов с конденсированными циклами В зависимости от расположения нескольких циклов относительно друг друга полициклические углеводороды можно разделить на три группы: линейные (или линейные ацены), ангулярные (или ангулярные фены) и перициклические. К представителям линейных аценов относятся нафталин и антрацен (см. выше). К представителям ангулярных фенов относится фенантрен (см. выше). Примерами перициклических углеводородов могут служить пирен, коронен, овален:
11.2. нафталин Нафталин — конденсированная система, состоящая из двух бензольных колец. Эти кольца имеют два общих атома углерода:  , или , или  , или , или  Нафталин широко применяется для производства фталевого ангидрида, нафтолов, нафтиламинов и других производных, используемых в производстве красителей, а также в производстве лекарственных препаратов и дубильных веществ. Используется и в качестве инсектицида. 11.2.1. строение, изомерия, номенклатура Все атомы углерода молекулы нафталина расположены в одной плоскости, атомные орбитали, участвующие в образовании -связей, находятся в гибридизации, близкой к sp2, а негибридные pz-орбитали образуют единую бициклическую сопряжённую систему. Поэтому молекулу нафталина можно представить в виде трёх граничных структур:  Из них следует, что связи а, b, c и dобладают разным -характером. Так, для связей а, c и dэто  Это подтверждается и квантово-химическими расчётами: связьb имеет больший -характер (0.725 ) по сравнению с другими углерод-углеродными связями. Длины углерод-углеродных связей в молекуле нафталина также неодинаковы. Экспериментально установлено, что длина связи b составляет 0.138 нм, а других углерод-углеродных связей — 0.141 0.142 нм. Каждый из шестичленных циклов в молекуле нафталина (один из двух) обладает ароматичностью, так как представляет собой 6--электронную циклическую сопряжённую систему. Оставшиеся четыре атома углерода можно представить диеновой системой, соединённой с бензольным кольцом:  Следовательно, нафталин обладает ароматичностью. Однако его ароматичность ниже ароматичности бензола, поскольку электронная плотность распределена неравномерно. В отличие от молекулы бензола атомы углерода в нафталине неодинаковы. Ниже приведена общепринятая нумерация в нафталиновой системе и обозначения атомов углерода при помощи греческих букв с учётом имеющихся плоскостей симметрии:  Другими словами, для монозамещённых нафталинов возможны - и -изомеры:   -замещённый нафталин -замещённый нафталин Положение заместителей в дизамещённых нафталинах может быть обозначено как цифровыми локантами, так и в некоторых случаях приставками орто-, мета-, пара-, пери-, амфи-:
Всего же возможно для дизамещённых нафталинов 10 структурных изомеров в случае одинаковых заместителей и 14 — в случае разных. Примеры названий:   1,5-динитронафталин 6-нитронафталин-2-сульфокислота, или амфи-нитронафталинсульфокислота Углеводородные радикалы, образованные от нафталина, носят название нафтилы: 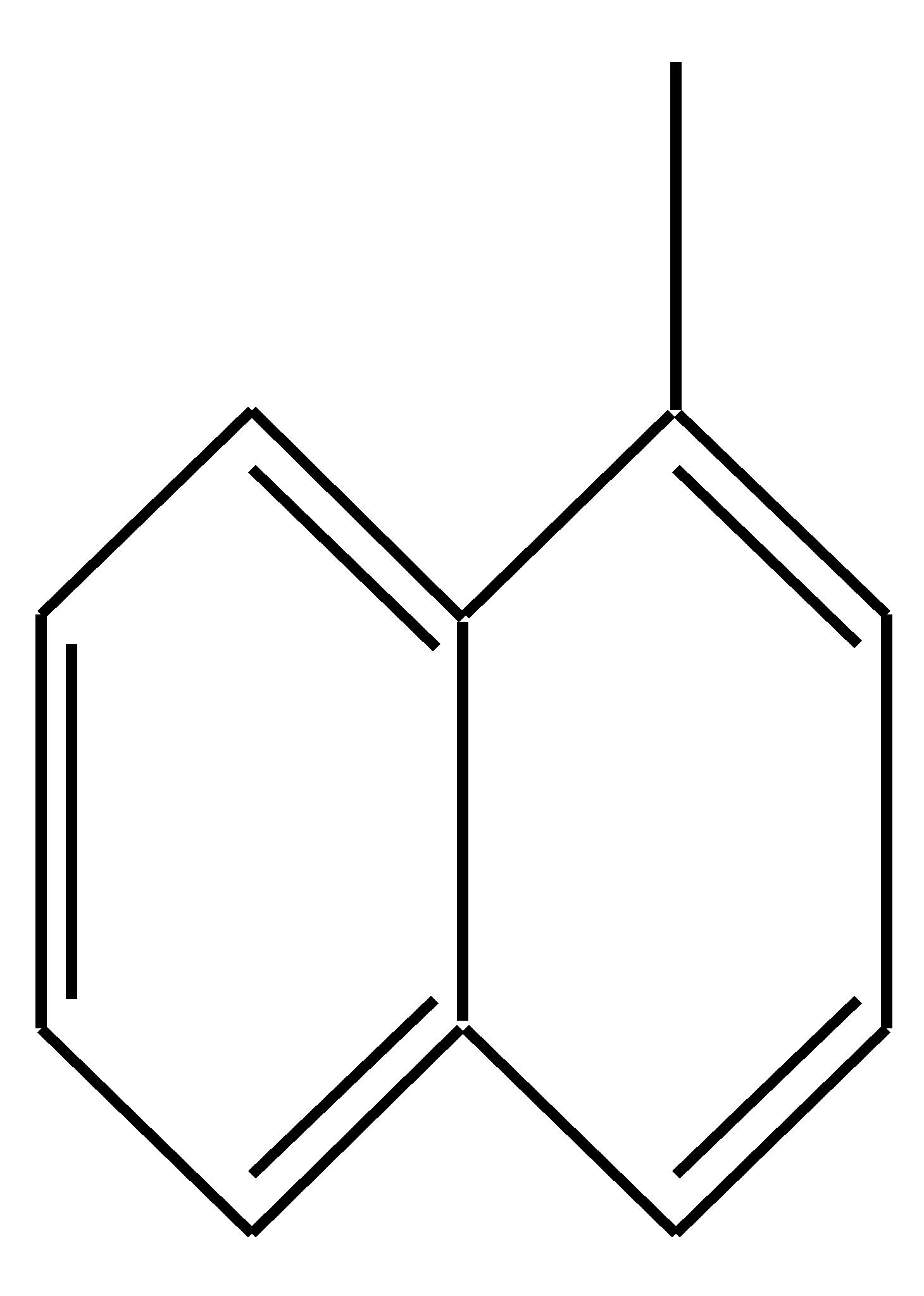  -нафтил -нафтил 11.2.2. свойства Нафталин — бесцветное кристаллическое вещество, летучее, с характерным запахом. Температура плавления 353 К, температура кипения 491 К. Аналогично углеводородам ряда бензола нафталин незначительно растворим в воде, но хорошо — в неполярных и малополярных органических растворителях. Химические свойства нафталина должны определяться, с одной стороны, наличием ароматической системы, а с другой стороны — способностью к взаимодействиям, связанным с присутствием диенового фрагмента. 11.2.2.1. Электрофильное замещение РеакцииSE для нафталина протекают легче, чем для бензола. Это объясняется: 1) неравномерностью распределения -электронной плотности, а значит, большей скоростью образования -комплекса; 2) сохранением ароматичности системы на стадии образования -комплекса, что не требует затрат на преодоление энергии делокализации ароматического кольца. Направление электрофильного замещения — преимущественно в -положение. Это можно объяснить сравнением устойчивости -комплексов, представив нафталиновую систему чередующимися -связями и учитывая повышенный -характер связи С1–С2: 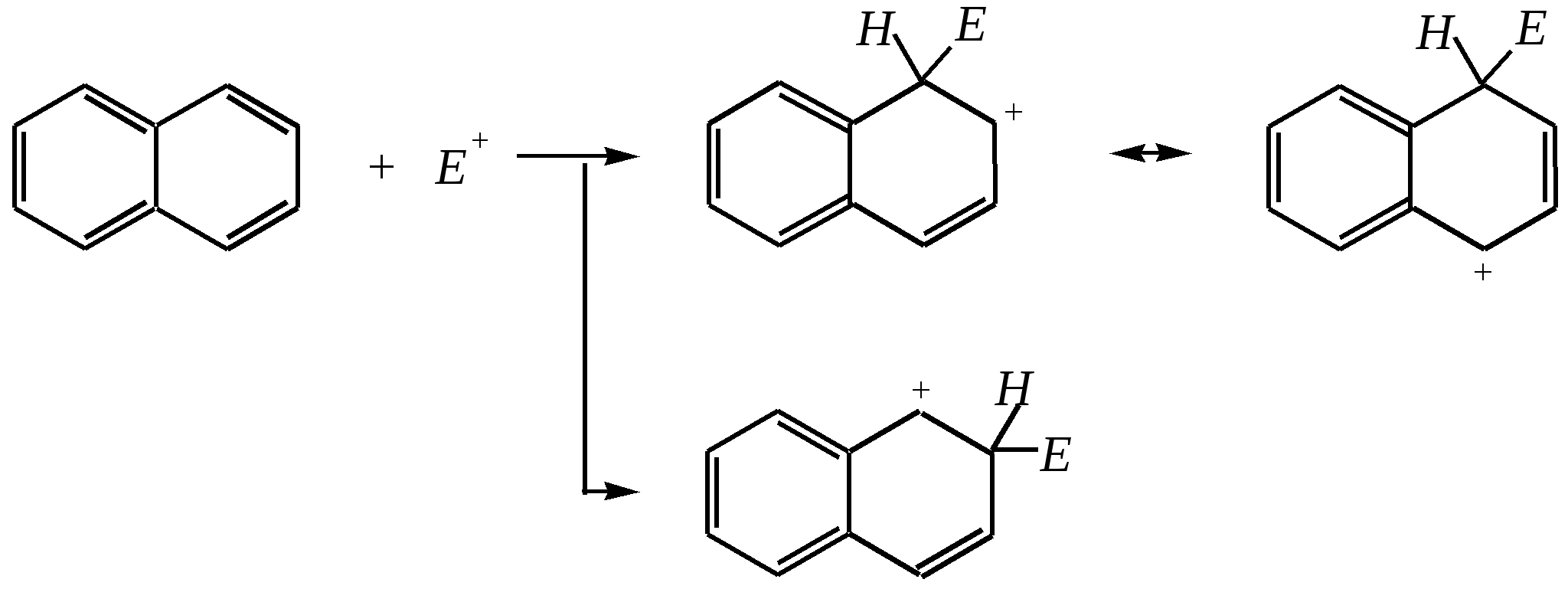 Так как связь С9–С10 имеет низкий -характер, то полного сопряжения между кольцами нет или, другими словами, -электронная проводимость между кольцами невелика. Поэтому граничные структуры представлены без учёта участия второго кольца в делокализации положительного заряда. Типичными примерами SE-реакций здесь являются нитрование, сульфирование и хлорирование. Нитрование смесью концентрированных азотной и серной кислот протекает легко и в избытке реагента при 320 К приводит к смеси 1,5- и 1,8-динитронафталинов:  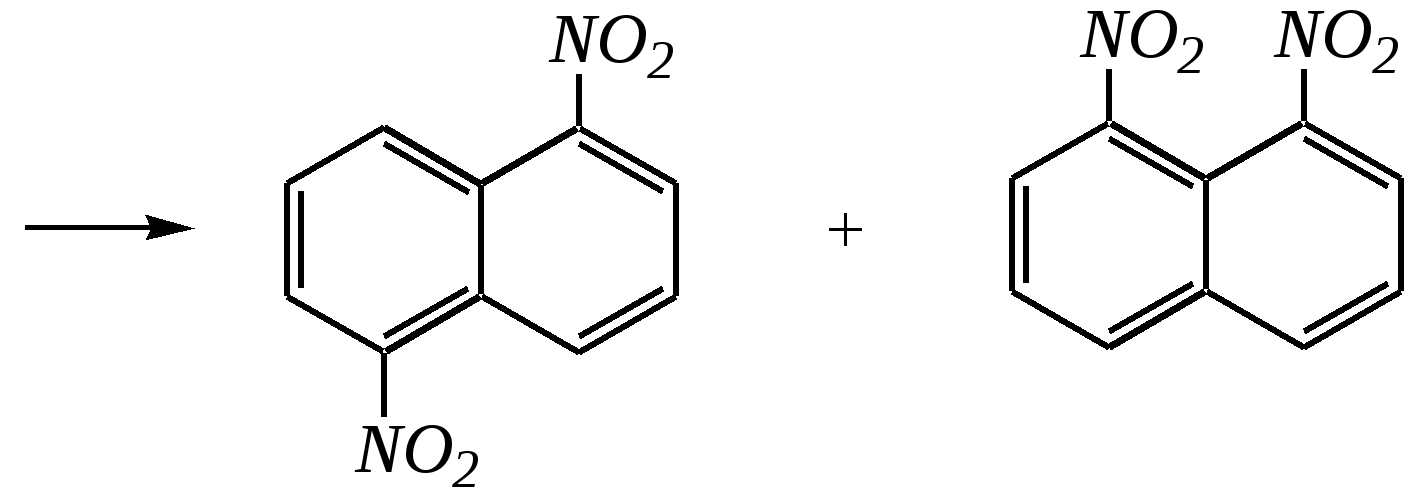 1,5-динитронафталин 1,8-динитронафталин То есть как первая, так и вторая нитрогруппы вводятся в одно из -положений. Но реакция введения второй нитрогруппы осуществляется в другое, незамещённое, кольцо. Причина же лёгкого введения второй нитрогруппы в молекулу нафталина заключается прежде всего в слабой -электронной проводимости между кольцами, и поэтому акцепторное влияние нитрогруппы на величину -электронной плотности в незамещённом кольце мононитронафталина незначительно. Это и приводит к образованию динитропроизводных примерно в тех же условиях, что и мононитропроизводных. Сульфирование нафталина в обычных условиях, так же как и нитрование, приводит к моно- и дизамещённым производным. Однако структура молекул продуктов сульфирования здесь сильно зависит от температурного режима. (Похожее явление наблюдалось при сульфировании фенола – гл. 10.5.3.3.) -Изомер образуется при 333 К, но при температуре 433 К он перегруппировывается в термодинамически более стабильный -изомер:  Вторая сульфогруппа вводится в незамещённое кольцо. При этом из -нафталинсульфокислоты образуется в основном смесь 1,5-, 1,7- и 2,7-нафталиндисульфокислот (причём при низкой температуре преимущественно 1,5-изомер до 60—70% от теоретического), а из -изомера — смесь 1,6-, 1,7-, 2,6- и 2,7-нафталиндисульфокислот. Хотя при продолжительном нагревании в любом случае образуются только две нафталиндисульфокислоты — 2,6- и 2,7-изомеры:  Хлорирование нафталина на хлориде алюминия протекает при 383 К. При монохлорировании образуется в основном -изомер. Дальнейшее введение атомов хлора протекает неселективно как в одно, так и в оба кольца. Среди дихлорпроизводных преобладают 1,4- и 1,5-изомеры (возможно, по пространственным причинам). Но в избытке хлора продолжительное проведение реакции приводит к перхлорнафталину:  1-хлорнафталин  1,4- и 1,5-дихлорнафталины Причина такого направления протекания реакции хлорирования, в отличие от нитрования и сульфирования, в значительно меньшем акцепторном влиянии атома хлора как заместителя в ароматическом кольце, что и делает электрофильное замещение неселективным. В целом для монозамещённых нафталинов влияние заместителя распространяется, главным образом, на замещённое кольцо. Если активирующая электронодонорная группа находится у -углеродного атома, электрофил направляется, как правило, в четвёртое положение (в меньшей степени во второе). Типичным примером может служить нитрование -нафтола, причём продуктом динитрования является 2,4-динитронафтол-1:  нафтол-1 4-нитронафтол-1 2,4-динитронафтол-1 Если же электронодонорный заместитель находится у -углеродного атома, то электрофильная атака направляется в первое положение. Дезактивирующая электроноакцепторная группа направляет атаку электрофила в соседнее незамещённое кольцо, при этом, как правило, по -углеродным атомам (например, см. выше нитрование). Но условия реакции (как при сульфировании) могут оказывать влияние на её направление. 11.2.2.2. Реакции присоединения Эти реакции подтверждают диеновый характер нафталиновой системы. Важнейшими из них являются гидрирование, галогенирование и реакции диенового синтеза. Проведение реакции гидрирования возможно в разных условиях. Присоединение молекулярного водорода на хромоникелевом катализаторе приводит сначала к тетрагидропроизводному:
тетралин (1,2,3,4-тетрагидронафталин), а затем – к пергидропроизводному, но в значительно более жёстких условиях:
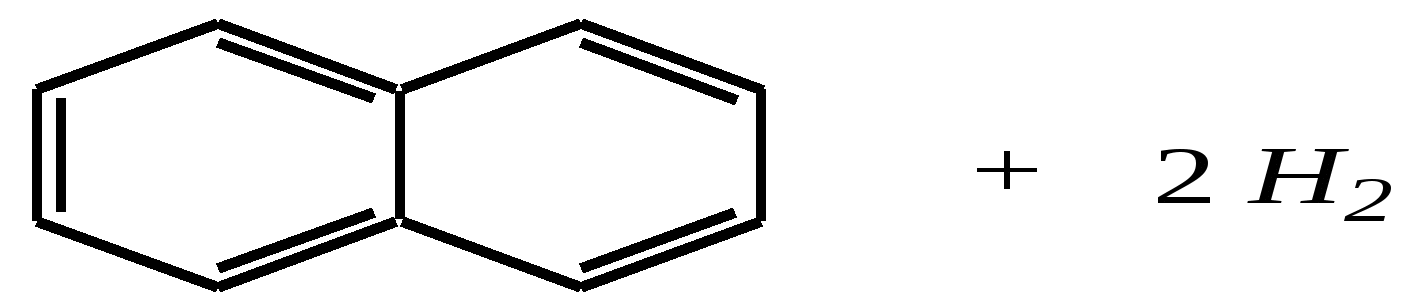
декалин (пергидронафталин) Из этих двух реакций в первой нафталин проявляет свойства диеновой системы, а во второй происходит нарушение ароматической системы кольца. Отсюда и различия в условиях протекания реакций: первая — аналогично диенам, вторая — аналогично алкилбензолам. Гидрирование атомарным водородом (водородом в момент выделения) проводят металлическим натрием в кипящих этаноле или пентаноле-1. Продукты реакций при этом могут различаться:  1,4-дигидронафталин 1,2-дигидронафталин 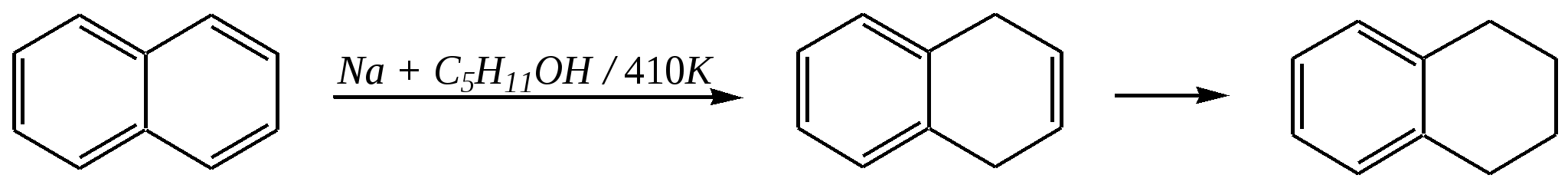 тетралин Реакции в обоих случаях начинаются как 1,4-присоединение, но в этаноле промежуточный продукт перегруппировывается в 1,2-дигидронафталин, стабилизированный --сопряжением, а в пентаноле-1, при более высокой температуре, реакция протекает дальше до образования продукта полного гидрирования диенового фрагмента. Восстановление по Бёрчу (гл. 9.5.1.2, 9.5.2.2) селективно приводит к 1,4-дигидронафталину:  Галогенирование также начинается как реакция 1,4-присоединения, но затем наблюдается отщепление молекулы галогеноводорода, так как продукт реакции элиминирования оказывается более стабилен по причине того же --сопряжения:  В реакции диенового синтеза (гл. 4.3.3) нафталин является типичным диеном, а в качестве диенофила может быть, например, дицианоацетилен:  11.2.2.3. Окисление Энергичное окисление кислородом на ванадиевом катализаторе приводит к разрушению одного кольца и образованию фталевого ангидрида: 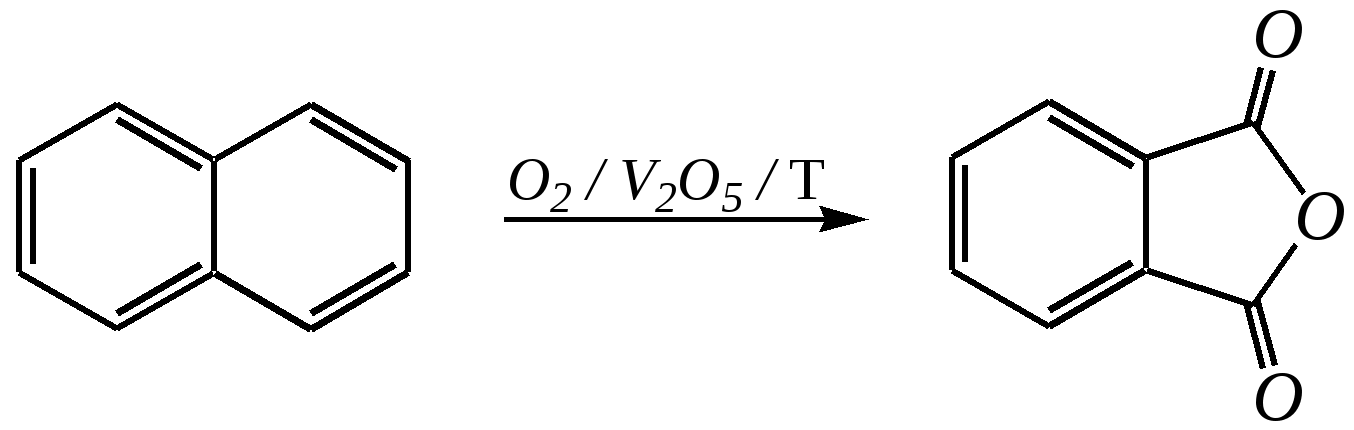 Эта реакция для монозамещённых нафталинов протекает по кольцу, имеющему бóльшую -электронную плотность. Так, например, в молекуле -аминонафталина разрушается замещённое кольцо, содержащее электронодонор:  А в молекуле -нитронафталина, наоборот, разрушается незамещённое кольцо, так как заместитель понижает электронную плотность, что препятствует реакции окисления:  Мягкое окисление нафталина и его производных также возможно. Причём нафталины окисляются легче, чем гомологи бензола, и эта реакция приводит обычно к образованию нафтохинонов: 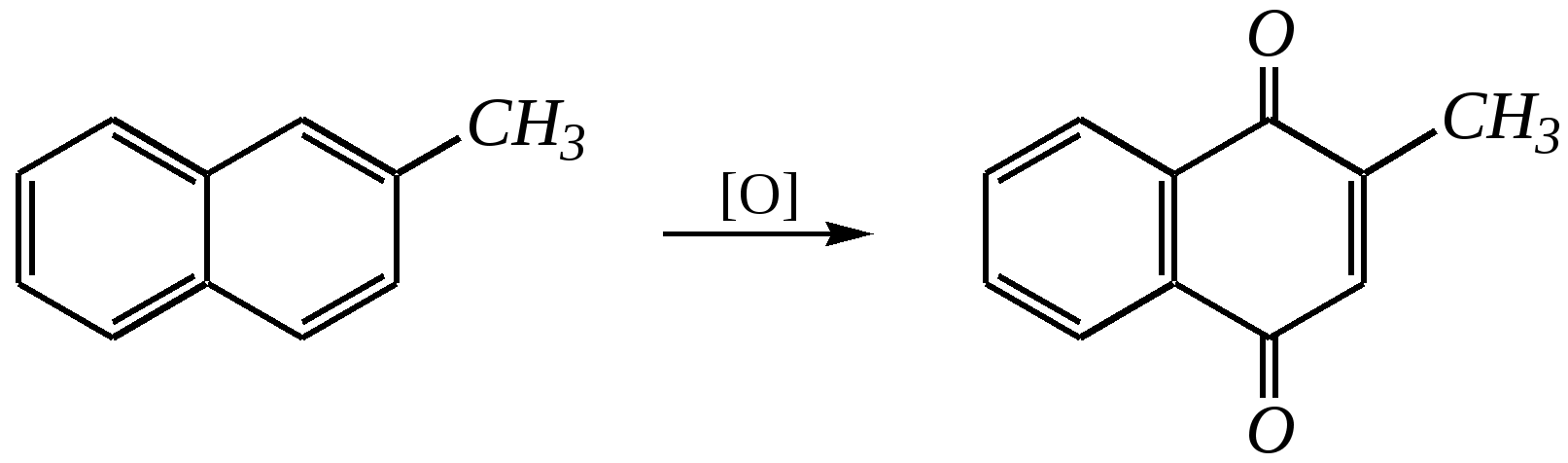 2-метилнафтохинон-1,4 11.2.3. способы получения Главным источником нафталина, так же как и бензола, является каменноугольная смола. Кроме того, существуют и синтетические способы получения, как самого нафталина, так и его производных.

 1-метилнафталин
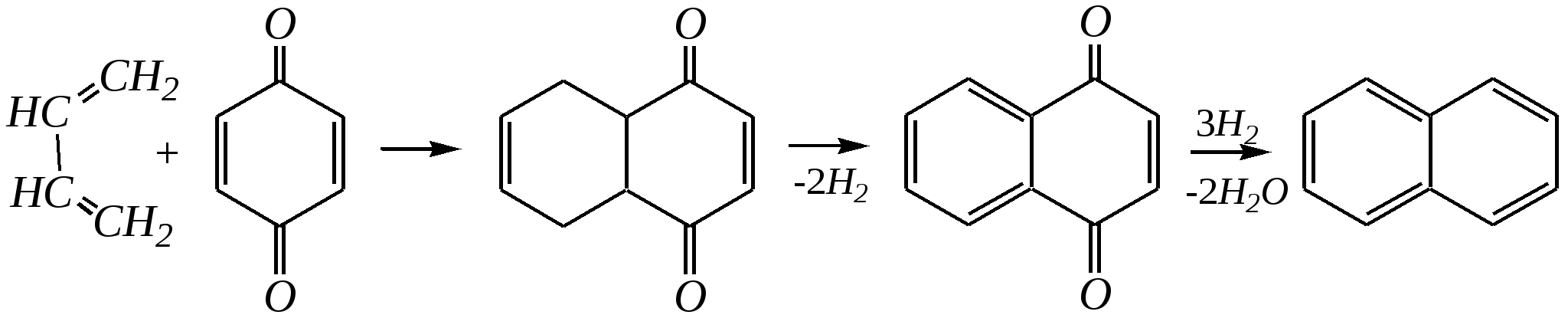 11.2.4. важнейшие представители Нафтолы (нафтол-1 и нафтол-2) — бесцветные кристаллы со слабым фенольным запахом, хорошо растворимые в этаноле, диэтиловом эфире, хлороформе, бензоле, плохо в воде.  нафтол-1, нафтол-2, или -нафтол или -нафтол По химическим свойствам типичные фенолы. С водными растворами щелочей образуют растворимые в воде соли. Подобно фенолам обладают дезинфицирующими свойствами. Однако в медицине нашёл применение лишь -нафтол, его применяют для лечения кишечных заболеваний. Получают -нафтол из 2-нафталинсульфокислоты щелочным плавлением при температуре 570—610 К. Применяются нафтолы также в производстве красителей. п-Нафтохинон (нафтохинон-1,4) — кристаллы жёлтого цвета с температурой плавления 401 К, хорошо растворимые в полярных органических растворителях, плохо в воде. По химическим свойствам аналогичен п-бензохинону. Сильный окислитель, легко восстанавливается до соответствующего гидрохинона. Сам является продуктом окисления нафталина триоксидом хрома в уксусной кислоте. Является промежуточным продуктом в синтезе антрахиноновых красителей, катализатор в синтезе синтетического каучука, ингибитор коррозии. Используется в производстве синтетического волокна — лавсана (полиэтилентерефталата) и в синтезе красителей. Витамины К — группа производных п-нафтохинона, стимулирующих свёртывание крови. Витамины К1 и К2 содержатся в зелёных травах, листьях, овощах и представляют собой вязкую жёлтую жидкость, нерастворимую в воде. 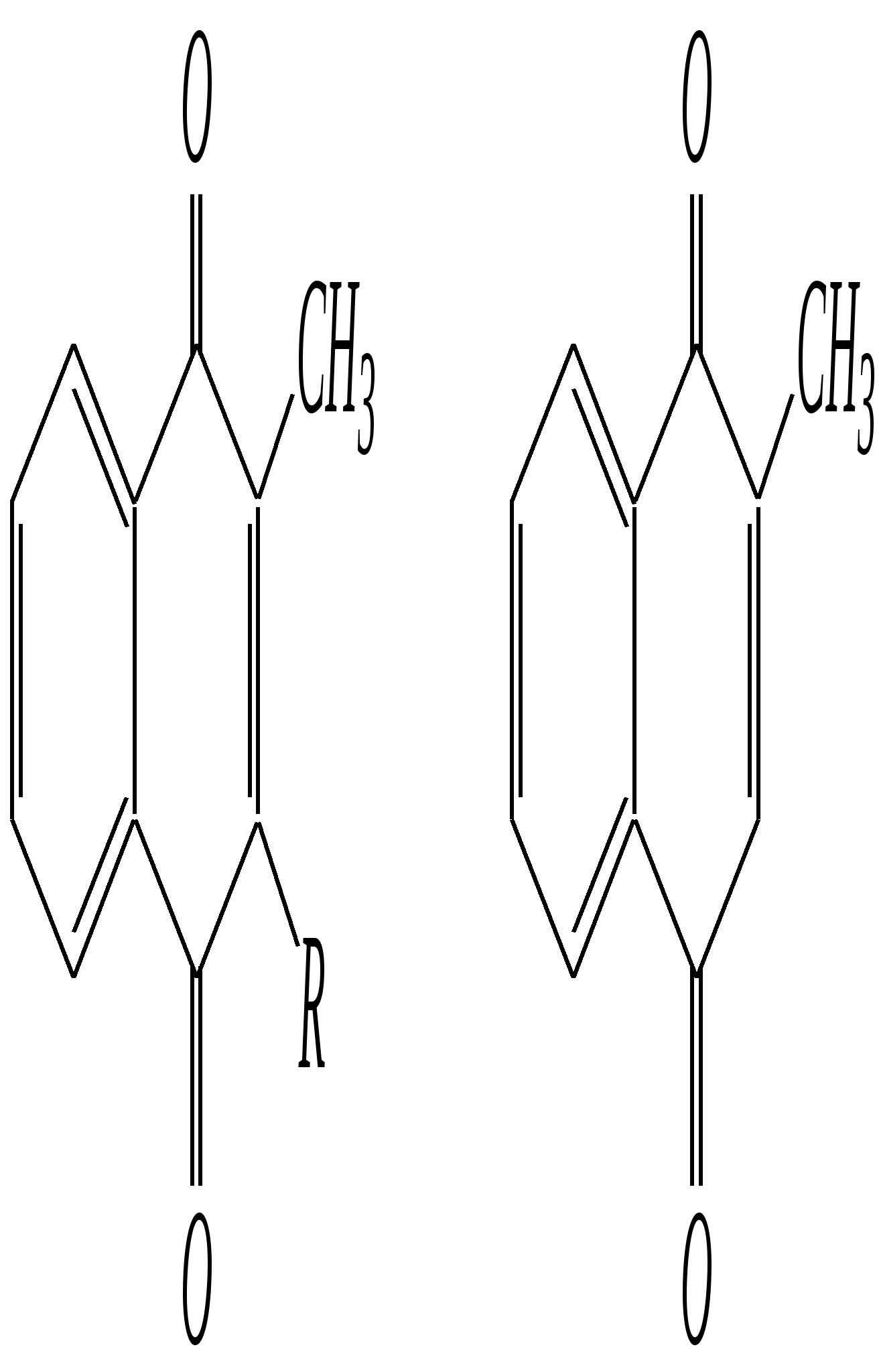 витамины К1 и К2 витамин К3 Витамин К3 синтетический продукт, представляет собой лимонно-жёлтые кристаллы, плохо растворимые в воде. 11.3. антрацен Молекулу антрацена можно представить как конденсированную систему из трёх бензольных колец:  или или  11.3.1. строение, изомерия, номенклатура Так же, как и в случае нафталина, все атомы углерода молекулы антрацена расположены в одной плоскости, атомные орбитали, участвующие в образовании -связей, находятся в гибридизации, близкой к sp2. Негибридные pz-орбитали образуют единую трициклическую сопряжённую систему. Поэтому молекулу антрацена можно представить в виде четырёх граничных структур: 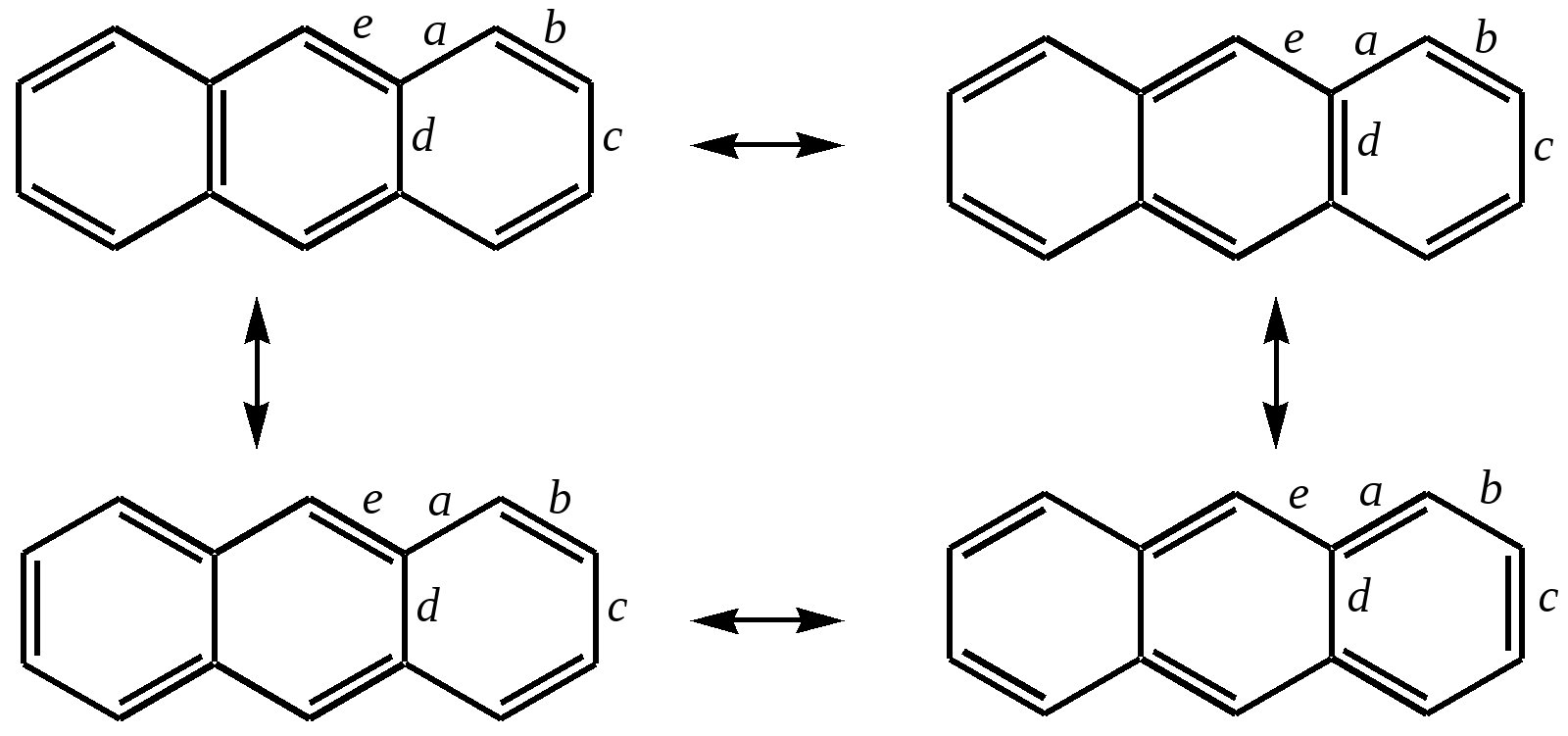 При этом, если выделить пять разных типов углерод-углеродных связей, можно заметить их неравнозначность, т.е. связи а, b, c, dи e обладают разным -характером. Так, для связей а, c и dэто  Это согласуется с длинами углерод-углеродных связей в молекуле антрацена. Длина связи b составляет 0.137 нм, связи e0.140 нм, а других углерод-углеродных связей — 0.141 0.144 нм. Каждый из трёх шестичленных циклов в молекуле антрацена (только один из трёх) обладает ароматичностью, так как представляет собой 6--электронную циклическую сопряжённую систему. Остальные углеродные фрагменты можно представить диеновыми системами, соединёнными с бензольным кольцом:  Антрацен обладает ароматичностью. Однако его ароматичность ниже ароматичности бензола и нафталина, так как ароматичность любой полициклической системы может быть оценена долей в ней ароматических циклов. В антрацене из трёх циклов, имеющихся в молекуле, только один может быть ароматическим (а в двух других можно выделить лишь диеновые системы). В сравниваемом нафталине ароматическим является один цикл из двух. В результате такого сравнения и сравнения с бензолом получается ряд уменьшения ароматичности: 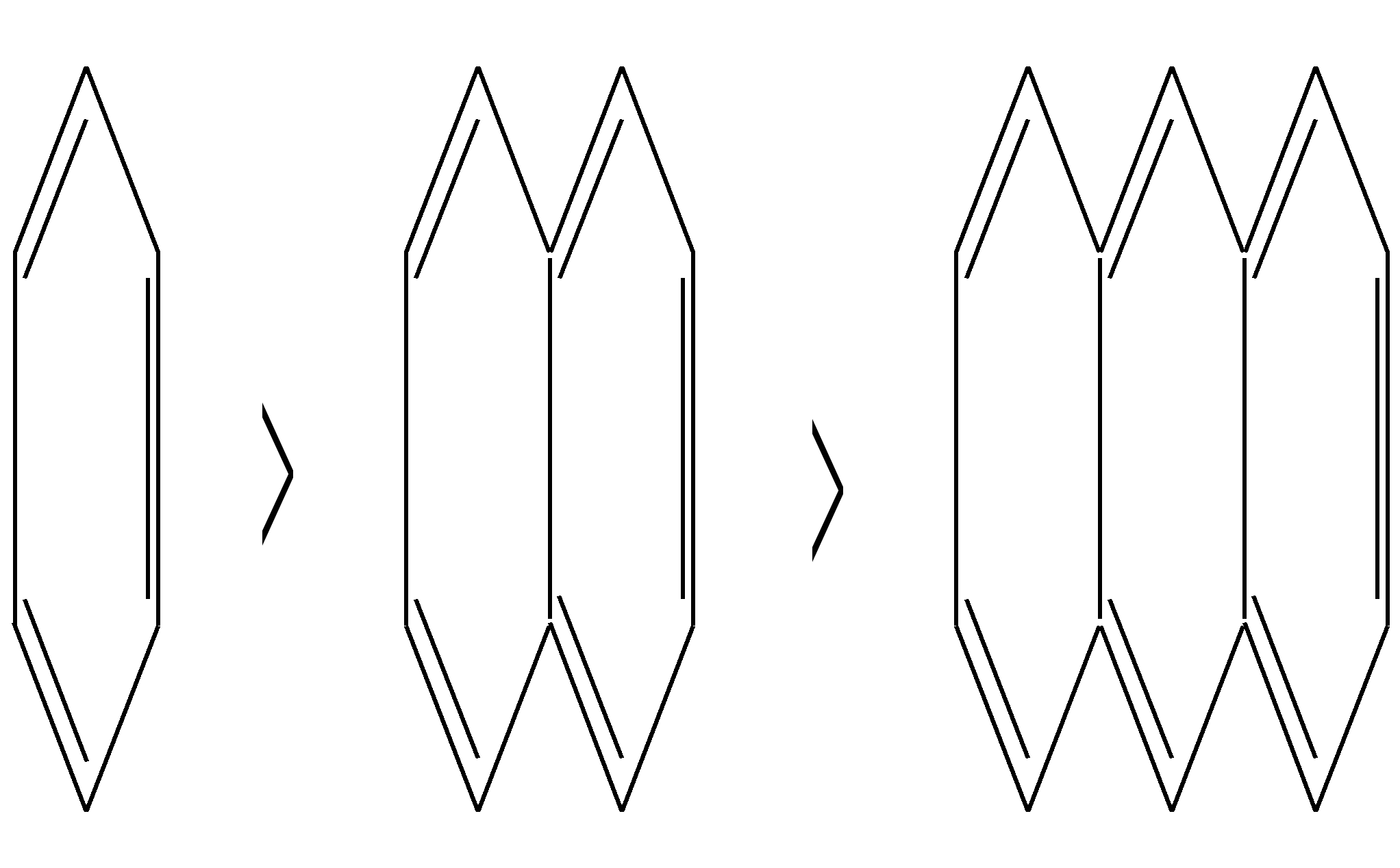 Приведём общепринятую нумерацию атомов углерода в антраценовой системе:  Положения 9 и 10 иногда называют мезоположениями. В отличие от нафталина, для антрацена возможно уже три изомерных монопроизводных: по 1, 2 и 9 углеродным атомам соответственно:    11.3.2. свойства Антрацен — бесцветное кристаллическое вещество с температурой плавления 490 К и температурой кипения 624 К. Аналогично углеводородам ряда бензола и нафталина он нерастворим в воде, но растворяется в органических растворителях. Для растворов характерна фиолетовая флуоресценция. Химические свойства антрацена определяются наличием ароматической и диеновой систем. При этом, как следует из электронного строения молекулы, диеновый характер антрацена должен быть выражен ещё сильнее, чем у нафталина. В целом взаимодействие с электрофилами протекает легко, но во многих случаях сначала получаются продукты присоединения по 9-му и 10-му положениям. При нагревании эти вещества превращаются в замещённые антрацены. Так, бромирование антрацена протекает легко:   9,10-дибром-9,10-дигидроантрацен 9-бромантрацен Электрофильная атака в центральное кольцо оказывается значительно выгоднее, чем по любому периферийному кольцу. Это связано как со стабильностью образующегося -комплекса, в котором делокализация заряда происходит с участием двух бензольных колец  , ,так и с формально большей ароматичностью -комплекса и продукта присоединения 9,10-дибром-9,10-дигидроантрацена по сравнению с самим антраценом, так как в этих трициклических частицах присутствуют два бензольных кольца. При сульфировании антрацена при повышенных температурах можно получить 1- и 2-замещённые сульфокислоты, однако первичным продуктом будет 9-антраценсульфокислота:  9-антраценсульфокислота  1-антраценсульфокислота 2-антраценсульфокислота Продукты моносульфирования могут легко дальше превращаться в дисульфокислоты (аналогично нафталину), давая, главным образом, смесь 1,5- и 1,8-дизамещённых антраценов, а при нагревании 2,6- и 2,7-антрацендисульфокислот. Антрацен легко нитруется азотной кислотой в обычных условиях, образуя единственный продукт мононитрования 9-нитроантрацен: 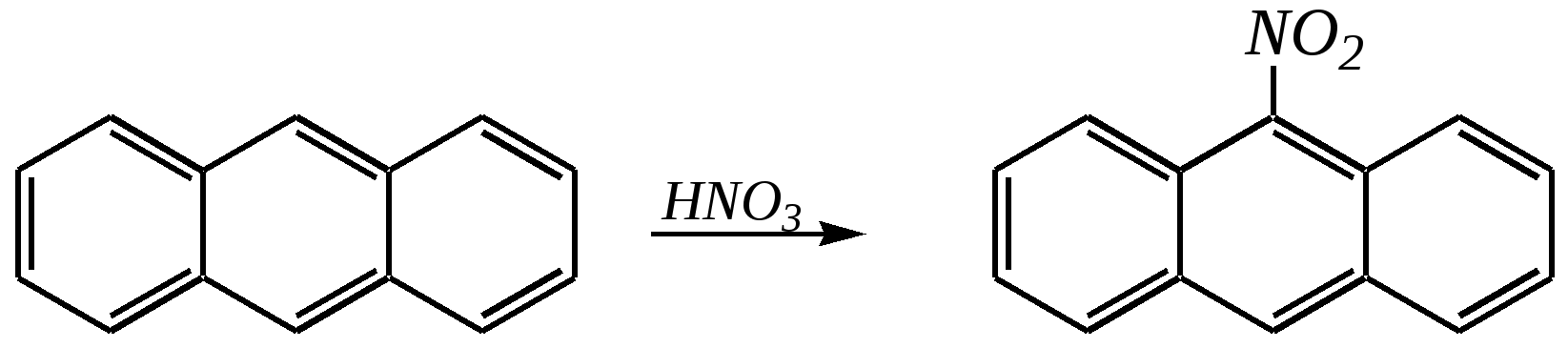 9-нитроантрацен К типичным реакциям присоединения относятся реакция диенового синтеза (реакция Дильса–Альдера)  малеиновый ангидрид и реакция фотодимеризации антрацена   Гидрирование антрацена в мягких условиях приводит к образованию 9,10-дигидроантрацена, что также объясняется высокой устойчивостью системы, содержащей два бензольных кольца:  Продукт исчерпывающего гидрирования (пергидроантрацен) можно получить, проводя реакцию в жёстких условиях с применением металлических катализаторов.Окисление по 9-му и 10-му атомам также протекает легко с участием разных окислителей, например, K2Cr2O7 в сернокислой среде, концентрированной HNO3 , кислорода при освещении и других:  антрахинон-9,10 При использовании кислорода реакция протекает через образование нестабильного фотооксида. Стабильный фотооксид удаётся получить только для некоторых 9,10-замещённых антраценов, например:  9,10-дифенилантрацен 9,10-дифенилантраценпероксид-9,10 11.3.3. способы получения Основным источником получения антрацена, как и нафталина, и бензола, является каменноугольная смола. Синтетические способы существуют, хотя они часто сложны и многостадийны. Так, например, антрацен может быть получен из нафталина и ацетилена (а значит, и из бензола и ацетилена — гл. 11.2.3): 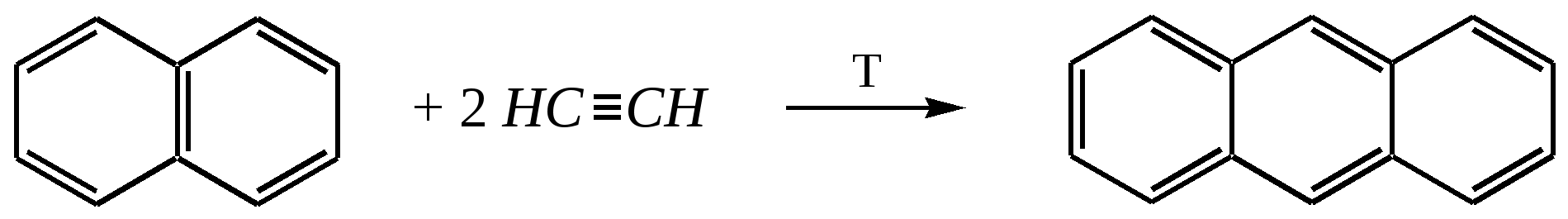 или из бензола и фталевого ангидрида:   антрахинон-9,10 антрацен Антрацен и его гомологи могут быть получены и в реакциях алкилирования по Фриделю–Крафтсу. Для этого используются бензол, его гомологи и их галогенпроизводные. Например:  9,10-дигидроантрацен 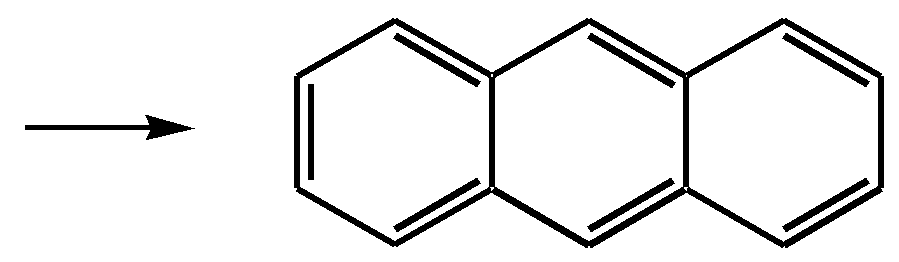 Используются также способы восстановления антрахинона-9,10 (аналогично в вышеприведённой схеме) и другие способы. 11.3.4. важнейшие представители Антрахинон-9,10 — светло-жёлтое кристаллическое вещество с температурой плавления 559 К. Получают из бензола и фталевого ангидрида (см. выше). Используют для синтеза красителей (ализарина, индантренового синего и др.). Эмодины — производные антрахинона, являющиеся действующими веществами препаратов алоэ, ревеня, крушины и др., часто использующихся в качестве слабительных средств. Они содержатся как в свободном виде, так и в виде эфиров и гликозидов. Представителем является 1,8-дигидрокси-3,6-диметилантрахинон-9,10 (обнаружен в крушине): 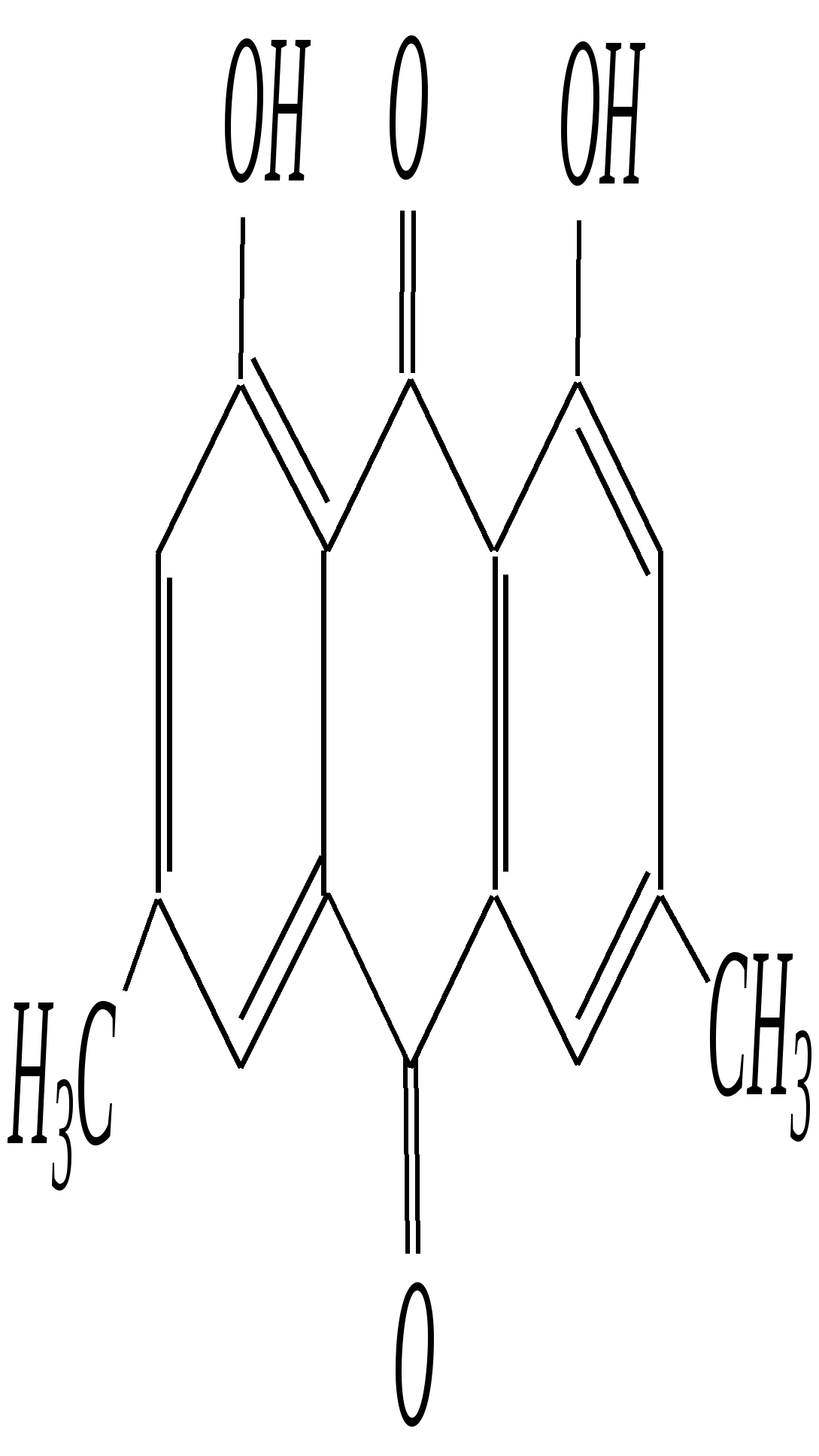 Кроме того, в медицинской практике широко используются антибиотики антрациклинового ряда, структура которых содержит фрагмент антрахинона. 11.4. фенантрен Фенантрен так же, как и антрацен, является трициклической системой, но относится к ангулярным фенам в соответствии с классификацией по взаимному расположению циклов относительно друг друга:  или или  11.4.1. строение, изомерия, номенклатура Молекула фенантрена плоская. Атомные орбитали, участвующие в образовании -связей, находятся в гибридизации, близкой к sp2. Негибридные pz-орбитали образуют единую трициклическую сопряжённую систему, которой соответствуют пять граничных структур:  При этом можно выделить девять разных типов углерод-углеродных связей. Связи а—i обладают разным -характером. Так, для связей а, c, e и fэто  В молекуле фенантрена можно выделить два из трёх шестичленных циклов, обладающих ароматичностью и представляющих собой 6--электронные циклические сопряжённые системы. Остальные два атома углерода — это этиленовый фрагмент, сопряжённый с бензольными кольцами: 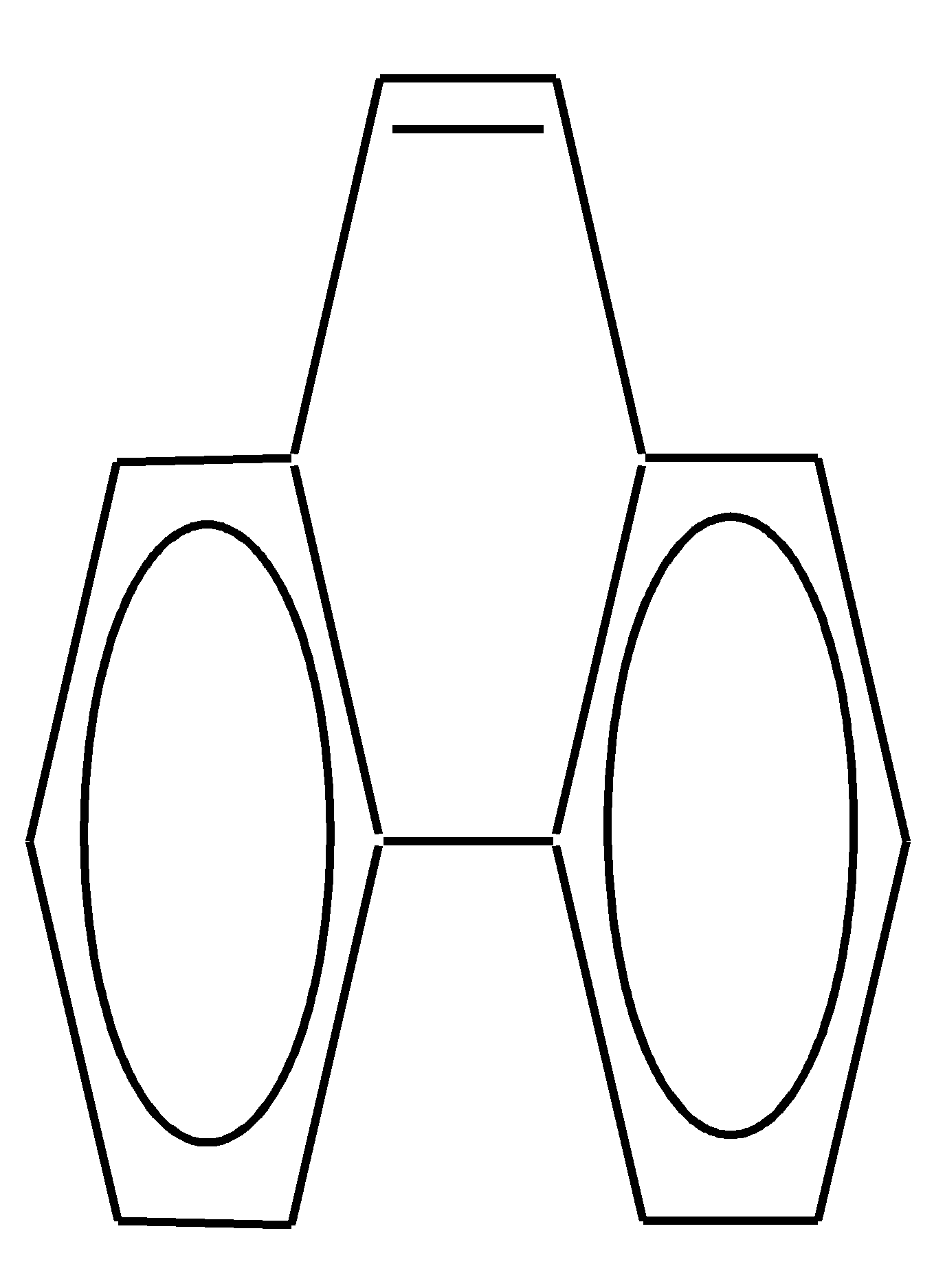 Ароматичность фенантрена выше ароматичности антрацена и нафталина, но ниже ароматичности бензола, так как здесь два цикла из трёх обладают ароматичностью (гл. 11.3.1). Поэтому ряд уменьшения ароматичности рассматриваемых в этой главе ароматических систем будет следующим:  Приведём общепринятую нумерацию атомов углерода в фенантреновой системе: 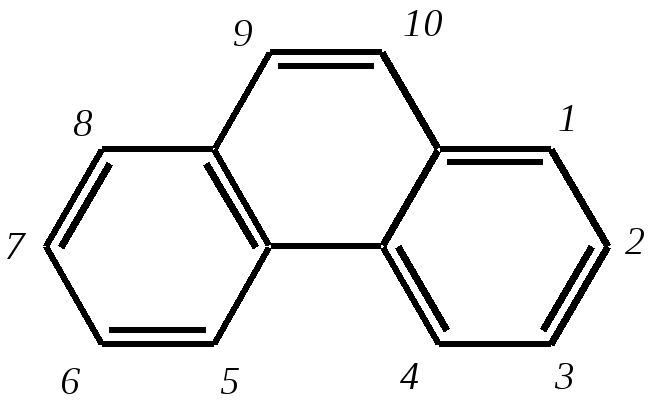 Фенантрен является структурным изомером антрацена. Но число изомерных монозамещённых производных для него будет уже пять. 11.4.2. свойства Фенантрен — бесцветное кристаллическое вещество с температурой плавления 373 К и температурой кипения 613 К. Вообще гомологи фенантрена имеют более низкую температуру плавления и обладают лучшей растворимостью, чем соответствующие антраценовые углеводороды. Химические свойства фенантрена определяются наличием ароматической системы и, в отличие от антрацена, этиленового фрагмента. Поэтому молекула должна проявлять высокую реакционную способность по отношению к электрофилам. Преимущественно это присоединение по связи С9—С10 с последующим отщеплением и образованием продукта формального замещения. Так, бромирование в присутствии кислот Льюиса приводит к образованию 9-бромфенантрена:  9-бромфенантрен Нитрование азотной кислотой в мягких условиях протекает крайне неселективно, но с большей долей 9-нитрофенантрена среди продуктов нитрования. Другими продуктами этой реакции являются 1-, 2-, 3-, 4-нитрофенантрены и 9,10-динитрофенантрен. Окисление и восстановление фенантрена протекает довольно легко, как и антрацена, и исключительно по 9-му и 10-му атомам:
Однако гидрирование атомарным водородом (металлическим натрием в спирте) требует использования более высококипящего пентанола-1. Пергидрофенантрен (аналогично пергидроантрацену) можно получить, проводя реакцию в жёстких условиях.Фенантренхинон-9,10 используется для синтеза красителей. 11.4.3. способы получения Кроме извлечения из каменноугольной смолы, используются и синтетические методы получения фенантрена и его замещённых. Это дегидрирование производных дифенилэтана:
или метод Хеуорса с использованием нафталина:    11.5. физиологическое действие полициклических углеводородов Канцерогенное действие полициклических ароматических углеводородов с конденсированными кольцами проявляется при дозах на 1—2 порядка более низких, чем дозы общетоксического действия, и имеет длительный латентный период. Наиболее сильными канцерогенами являются 1,2-бензопирен (бенз[а]пирен), обнаруженный в табачном дыме, и метилхолантрен, который может образовываться из холестерина.  пирен 1,2-бензопирен метилхолантрен (3,4-бензопирен, бенз[a]пирен) Метаболизм большинства полициклических углеводородов приводит к образованию фенолов, однако для этой группы веществ обнаружен и уникальный путь — окисление до хинонов. Исследования путей метаболизма бенз[а]пирена показали, что он образует значительное число продуктов окисления. В первую очередь это 4,5-, 7,8- и 9,10-дигидродиолы. Однако кроме них обнаружены также 3- и 9-гидроксипроизводные и 1,6-, 3,6- и 6,12-хиноны. Образование всех этих продуктов идёт через эпоксисоединения, причём показано, что 4,5-эпоксисоединение наиболее устойчиво. Предполагается, что именно эти «окисленные» формы бенз[а]пирена, особенно содержащие атомы кислорода в положениях 4, 5, 11 и 12, и являются сильными канцерогенами. Производные фенантрена, прежде всего гидрированные, входят в структуру важных природных соединений — это стероиды (гл. 8.7). вопросы и упражнения
|