витамины. При ферментации Е. ashbyii наблюдаются более или менее близкие закономерности в изменении биохимических показателей культуральной жидкости
 Скачать 235.08 Kb. Скачать 235.08 Kb.
|
|
Продуцентами витамина являются бактерии (Brevibacterium ammoniagenes, Micrococcus glutamaticus), дрожжи (Candida guilliermondii, Candida flaveri), микроскопические (Ashbya gossypii, Eremothecium ashbyii) и плесневые грибы (Aspergillus niger). Промышленное получение рибофлавина осуществляется химическим синтезом, микробиологическим и комбинированным. При этом синтезированная микроорганизмами рибоза химически трВ клетках E. ashbyii он встречается в виде флавинадениндинуклеотида и свободного витамина, расположенного в виде желтых кристаллов в вакуолях. Для выращивания Е. ashbyii пригодны глубинный и поверхностный методы. В качестве источников азотного питания используется молочная сыворотка, семена бобовых растений, рыбная мука, кукурузный экстракт, соевая мука и казеин. Из углеводов — глюкоза, сахароза. Очень перспективным и экономически выгодным является применение в качестве основного компонента питательной среды барды пшеничной муки (отходы спиртового брожения). Состав питательной среды и количественные отношения ингредиентов зависят от культуры. При ферментации Е. ashbyii наблюдаются более или менее близкие закономерности в изменении биохимических показателей культуральной жидкости. В течение 30—40 ч почти полностью расходуются углеводы, после чего отмечается интенсивный синтез и накопление в культуральной жидкости рибофлавина. Накопление рибофлавина в питательной среде совпадает по времени с началом автолиза культуры. В первые сутки ферментации резко падает pH, но начиная со вторых суток медленно поднимается. Весь процесс продолжается в течение 3—5 суток, при температуре 28—30°. Для нормального хода синтеза рибофлавина необходима хорошая аэрация. На биосинтез рибофлавина угнетающее действие оказывают ионы железа, поэтому их концентрация в среде должна быть тщательно подобрана. В глубинной культуре Е. ashbyii в течение первых двух суток содержание рибофлавина примерно одинаково в мицелии и культуральной жидкости. Начиная с третьих суток преобладающее его количество находится в культуральной жидкости, а содержание в мицелии резко падае B12Биосинтез витамина B12 осуществляется специальными культурами, к числу которых могут быть отнесены актиномицеты (Act. olivaceus, Act. griseus, Act. aureofaciens, Act. fradiae), а также бактерии (Вас. megatherium, Lactobacillus casei, Clostridium tetanomorphicum, пропионовокислые бактерии). Наибольшее промышленное значение имеют Act. olivaceus и Propionobacterium shermanii. Единственный способ получения витамина В12 в настоящее время – микробиологический синтез. Его продуцентами являются прокариоты и, прежде всего, пропионовые бактерии, которые и в естественных условиях образуют этот витамин. Выделено 14 видов пропионовокислых бактерий, продуцирующих витамин В12. Мутанты Propionibacterium shermanii и Pseudomonas denitrificans продуцируют в жидкой среде до 58 – 59 мг/л цианкобаламина. Технология получения. Для получения высокоочищенных препаратов витамина В12 пропионовокислые бактерии культивируют периодическим способом без доступа кислорода на средах, содержащих глюкозу, казеиновый гидролизат, витамины, неорганические соли, хлорид кобальта. Уровень рН ферментационной среды поддерживают около 7,0 добавлением NH4OH; продолжительность ферментации 6 суток; через 3 суток в среду добавляют 5,6-диметилбензимидазол. Добавление в среду предшественника 5,6-диметилбензимидазола по окончании первой ростовой фазы (5 – 6 суток) стимулирует быстрый (18 – 24 ч) синтез витамина с выходом последнего до 30 мг/л. Цианкобаламин накапливается в клетках бактерий, поэтому операции по выделению витамина заключаются в следующем: сепарирование клеток, экстрагирование водой при рН 4,5 – 5,0 и температуре 85 – 90 оС, в присутствии стабилизатора (0,25 % раствор натрия нитрита), Экстракция протекает в течение часа, после чего водный раствор охлаждают, нейтрализуют раствором едкого натрия, добавляют коагулянты белка – хлорид железа трехвалентного и алюминия сульфат с последующим фильтрованием. Фильтрат упаривают и дополнительно очищают, используя методы ионного обмена и хроматографии, после чего проводят кристаллизацию витамина при 3 – 4 оС из в одноацетонового раствора. 3)Аскорбиновая кислота, или витамин С - это противоцинготный витамин, имеющийся у всех высших растений и животных; толькг человек и микробы не синтезируют ее, но людям она неотложно необходима, а микробы не нуждаются в ней. И, тем не менее, определенные виды уксуснокислых бактерий причастны к биосинтезу полупродукта этой кислоты - L-сорбозы. Таким образом, весь процесс получения аскорбиновой кислоты является смешанным, то есть химико-ферментативным. Биологическая стадия процесса катализируется мембраносвязанной полиолдегидрогеназой, а последняя (химическая) включает последовательно следующие этапы: конденсация сорбозы с диаде-тоном и получение диацетон - L-сорбозы, окисление диацетон --L-сорбозы до диацетон-2-кето-Ь-гулоновой кислоты, подвергаемой затем гидролизу с получением 2-кето-1,-гулоновой кислоты; последнюю подвергают энолизации с последующей трас формацией в L-аскорбиновую кислоту. Ферментацию G.oxydans проводят на средах, содержащих сорбит (20%), кукурузный или дрожжевой экстракт, при интенсивной аэрации (8-10 г О2/л/ч). Выход L-сорбозы может достичь 98% за одни-двое суток. При достижении культурой log-фазы можно дополнительно внести в среду сорбит, доводя его концентрацию до 25%. Также установлено, что G.oxydans может окислять и более высокие концентрации полиспирта (30-50%), создаваемые на последних стадиях процесса. Это происходит благодаря полиолде-гидрогеназы, содержащейся в клеточной биомассе. Ферментацию бактерий проводят в периодическом или непрерывном режиме. Принципиально доказана возможность получения L-сорбозы из сорбита с помощью иммобилизованных клеток в ПААГ. Получение витамина D2. Витамин D – это группа родственных соединений, в основе которых находится эргостерин, который обнаружен в клеточных мембранах эукариот. Содержание эргостерина в дрожжевых клетках колеблется в пределах 0,2 – 11 %. Кроме дрожжей продуцентами эрогостерина могут быть мицелиальные грибы – аспергиллы и пенициллы, в которых содержится 1,2 – 2,2 % эргостерина. Трансформация эргостерина в витамин D2(кальциферол) происходит под влиянием ультрафиолетового облучения. При этом разрывается связь в кольце (позиции 9,10) и образуется двойная связь в боковой цепочке (позиции 22, 23). Технология получения. В качестве продуцентов эргостерина микробиологическим способом используют культуры дрожжей, которые получают на средах, обеспечивающих полноценное развитие клеток. Основная среда содержит источник углерода и пониженное количество азота (высокое значение C/N), обогащается ацетатом (активатором биосинтеза стеринов). Культивирование дрожжей проводят при температуре, близкой к оптимальной для конкретного штамма, и выраженной аэрации. Спустя 3 – 4 суток, в зависимости от ростовых характеристик и биосинтетической активности культуры, клетки сепарируют и подвергают вакуум-высушиванию. Затем сухие дрожжи облучают ультрафиолетовыми лучами – УФЛ (длина волны 280 – 300 нм) в течение оптимального по продолжительности времени. Облучение дрожжей можно проводить до сепарирования клеток в тонком слое 5 % суспензии, учитывая малую проникающую способность УФЛ. Облученные сухие дрожжи применяют в животноводстве; в промышленности их выпускают под названием «кормовые гидролизные дрожжи, обогащенные витамином D2». В таком препарате содержится не менее 46 % сырого белка, незаменимые аминокислоты (лизин, метионин, триптофан) и 5000 ME витамина D2 в 1 г. В случае получения кристаллического витамина D2 клетки продуцента гидролизуют соляной кислотой при 110 оС, затем температуру снижают до 75 – 78 оС и добавляют этанол. Спиртовой экстракт упаривают до 70 %-го содержания сухих веществ. Полученный «липидный концентрат» обрабатывают раствором едкого натрия. Эргостерин кристаллизуется из неомыленнной фракции концентрата при 0 оС. Его очищают повторной перекристаллизацией. Кристаллы высушивают, растворяют в серном эфире, облучают УФЛ, эфир отгоняют, раствор витамина D2 концентрируют и кристаллизуют. Микробиологический синтез каротиноидов. Наиболее перспективными продуцентами для биосинтеза каротиноидов являются бактерии, дрожжи (чаще всего на практике применяют дрожжи рода Candida, которые хотя и синтезируют небольшое количество каротиноидов, но отличаются высокой скоростью роста и способностью хорошо утилизировать разнообразные источники сырья) и мицелиальные грибы. Более часто на практике применяют зигомицеты Blakeslea trispora и Choanephora conjuncta. Спаривающиеся (+) и (-) особи этих видов при совместном культивировании могут образовывать 3 – 4 г каротина на 1 л среды. Питательные среды для развития микроорганизмов-продуцентов достаточно сложны по составу, они включают в себя источники углерода, азота, витаминов, микроэлементов, специальных стимуляторов (гидрол, кукурузно-соевая мука, растительные масла, керосин, -ионон или изопреновые димеры и т.п.). Вследствие того, что в клетках микроорганизмов образуются активные комплексы гидролитических ферментов, они способны утилизировать в качестве источников углерода различные субстраты – гидролизаты растительных отходов, мелассу, низкомолекулярные спирты и т.п. В качестве источника азота в питательную среду добавляют дрожжевой или кукурузный экстракт, соли аммония; при этом соотношение углерода к азоту должно составлять 320-400. Также кроме источников углерода и азота в питательную среду добавляют фосфор, калий, магний, цинк, железо, марганец, витамины группы В, токоферол. Стимуляторы каротинообразования целесообразно вносить в культуральные среды в конце тропофазы, то есть когда продуцент переходит в продуктивную фазу (идиофазу). Вначале штаммы микроорганизмов-продуцентов выращивают раздельно, а затем – совместно при 26 С (т.к. при более высокой температуре уменьшается выход целевого продукта процесса и ухудшается его качество) и усиленной аэрации (т.к. для окисления углеродных субстратов необходим кислород) с последующим переносом в основной ферментер. Условия культивирования сохраняют прежними. В процессе выращивания вначале наблюдается интенсивный рост микроорганизмов и незначительный синтез каротиноидов. Усиленный синтез каротиноидов отмечается в начале стационарной фазы развития микроорганизмов. Длительность ферментации – 6 – 7 дней. По окончании стадии ферментации, каротиноиды извлекают ацетоном (или каким-либо другим полярным растворителем), переводят в неполярный растворитель. В случаях извлечения белково-каротиноидных комплексов, то применяют поверхностно-активные вещества в концентрации 1 – 2 %. В целях очистки и более тонкого разделения гомологов можно прибегнуть к методам хроматографии или к смене растворителей. Промышленное получение гиббереллинов осуществляют при культивировании грибов, относящихся к аскомицетам, в частности Gibberella fujikuri (в конидиальной стадии — Fusarium moniliforme). Выделяют гиббереллины из фильтрата КЖ. Получение гиббереллинов с помощью F. moniliforme рассматривается как типичный двухфазный процесс микробиологического синтеза, при котором вначале происходит интенсивное накопление биомассы, а затем образование продукта. Главным условием, обеспечивающим высокую продуктивность культуры, следует считать истощение источников азота в среде при сохранении высокого уровня соединений углерода. Характерная особенность процесса биосинтеза гиббереллинов — низкое значение рН среды (3,0–4,5), при котором происходит их образование. При культивировании продуцента в глубинных условиях в качестве источника азота положительный эффект оказывают виннокислая соль аммония (0,7 %) и особенно соевая мука (3 %); из других соединений — сахароза или глюкоза (4–6 %). На средах, содержащих названные компоненты, концентрация гиббереллинов достигает 200 мг/л. Технологическим решением для обеспечения избытка углерода может быть выращивание продуцента на полноценной среде, а затем перенос биомассы на несбалансированную по составу среду с лимитом по азоту. Возможно также дробное добавление источника углерода по ходу культивирования, при этом его концентрация не должна превышать 1–4 %. Кроме углеводов в качестве источника углерода предложены различные жиры и масла, которые можно использовать при проведении одностадийного процесса. При лимите среды по азоту иногда наблюдается увеличение биомассы мицелия, что связано с синтезом и накоплением в мицелии полисахаридов и жиров. Режим аэрации, перемешивание и другие детали технологического процесса зависят от оборудования и особенностей продуцента. При ферментации гиббереллины (преобладают 3, 4, 7) секретируются в культуральную среду. Перед выделением продукта необходимо отделить мицелий фильтрованием или центрифугированием. Из раствора продукт можно выделить: адсорбцией активным углем, хемосорбцией ионитами или экстракцией. С помощью микроорганизмов в настоящее время можно получать некоторые алкалоиды — вещества растительного происхождения, являющиеся сложными гетероциклическими азотистыми основаниями и обладающие чрезвычайно высокой физиологической активностью; они оказывают сильное действие на животный организм. Многие из них являются ядами. Большинство алкалоидов парализуют и угнетают нервную систему, к примеру кокаин, кураре, морфин, атропин. Некоторые из них продуцируют микроорганизмы. В лабораторных условиях с помощью микроорганизмов получают алкалоиды спорыньи — эргоалкалоиды. Спорынья распространена на ряде злаков, вызывая их заболевание; рожки спорыньи можно увидеть на каждом поле при созревании злаков. Рожки собирают вручную, обрабатывают химическим путем. Такой способ получения эргоалкалоидов трудоемок и не всегда может удовлетворять потребность медицины . в данном алкалоиде. Некоторые культуры грибов при выращивании на искусственных питательных средах могут синтезировать эргоалкалоиды. Большой интерес представляют алкалоиды типа атропина. В зерне пшеницы и других злаков, хранившихся при неблагоприятных условиях, образуются токсические вещества. В таком зерне были найдены алкалоиды атропиновой группы, которые продуцируются развивающимися в зерне бактериями. Из культур этих бактерий были получены вещества типа атропина. Ферменты Из всех вышеперечисленных источников ферментов наибольшее практическое значение имеют микроорганизмы - продуценты ферментов. Их широкое использование обусловлено, прежде всего, их доступностью, возможностью организовать более эффективное промышленное производство на относительно дешевом сырье и управление, процессом биосинтеза, используя, различные продуценты ферментных препаратов. Использование микроорганизмов значительно расширило круг получаемых ферментных препаратов сразличным спектром действия. Только с их помощью удалось получить такие ферменты, как целлюлазы и глюкозоизомеразы. В качестве продуцентов ферментов могут использоваться различные микроорганизмы. Для получения амилолитических и протеолитических ферментных препаратов в промышленности наиболее часто используют различные штаммы гриба рода Aspergillusи бактерий Bacillus. У бактерий короче цикл развития, на их основе легче получать мутанты. Из схемы ясно, что экстракт из поверхностной культуры или фильтрат культуральной жидкости является исходным материалом для получения препаратов ферментов различной степени очистки. На первом этапе выделения отходом процесса является нерастворимая часть культуры – биошрот, содержащий нерастворимые включения среды и биомассу продуцента. Далее в зависимости от свойств выделяемого фермента и сопутствующего ему балласта схема очистки и получения ферментного препарата может включать различные приемы и методы, такие, как концентрирование, диализ, осаждение органическими растворителями, солями, гель-фильтрование, афинная хроматография, иммобилизация, сушка термолабильных материалов и т. д. Поэтому рассмотрим этапы получения ферментных препаратов. 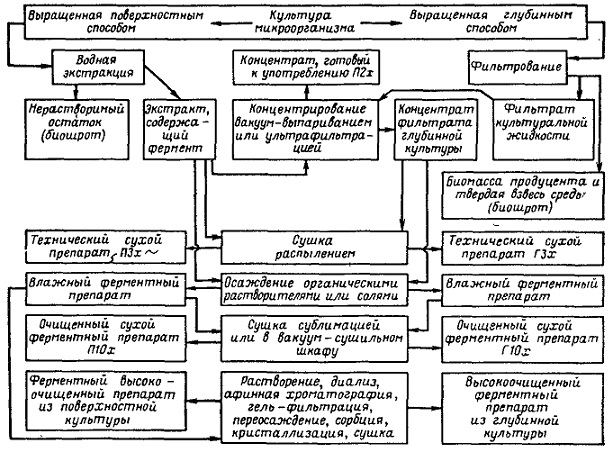 По объему производства ферменты занимают третье место после аминокислот и антибиотиков. Из нескольких тысяч известных в настоя щее время ферментов наиболее широко в промышленности используются различные гидролазы, которые можно разделить на четыре основные группы ферментных препаратов. 1. Амилолитические ферментные препараты.К этой группе препаратов относятся α- и β-амилазы и глюкоамилаза. Их используют для гидролиза крахмала и гликогена. В процессе гидролиза сначала образуются более простые полисахариды - декстрины, а в последующем - глюкоза. При этом α-амилаза гидролизует без определенного порядка α-1,4-глюкозидные связи с образованием декстринов, мальтозы и глюкозы, β-амилаза отщепляет остатки мальтозы, а глюкоамилаза - остатки глюкозы от концевых частей молекул полисахарида. Наиболее широкое применение эти препараты нашли в пищевой промышленности (производство патоки и глюкозы). 2. Протеолитические ферментные препараты.Эта группа ферментов относится к гидролазам. Они обладают такой важной особенностью, как высокоселективное воздействие на некоторые пептидные связи белковых молекул и пептидов. Например, пепсин способствует гидролизу пептидных связей с остатками ароматических аминокислот, трипсин катализирует гидролиз пептид-ной связи между остатками аминокислот аргинина и лизина. Ферментов, входящих в этот класс, очень много. Их классифицируют, в основном, по способности проявлять максимум ферментативной активности в определенной области рН раствора. Кислые протеазы проявляют максимум активности в интер-вале рН раствора от 1,5 до 3,0, нейтральные - 6,5-7,5, щелочные - от 8,0 и выше. Протеазы нашли свое применение в различных отраслях народного хозяйства: в пищевой и легкой промышленности (предварительная обработка свежего сырого мяса и шкур, животных в кожевенной промышленности), в химической промышленности при получении синтетических моющих средств с добавками протеолитических ферментных препаратов, в здравоохранении при лечении некоторых воспалительных процессов, ожогов, тромбозов, 3. Пектолитические ферментные препараты.Пектолитические ферментные препараты используются для расщепле ния пектиновых веществ, содержащихся в стеблях растений (льна), в различных корнеплодах, фруктах. К ним относятся пектин, пектиновые кислоты и протопектин. Пектиновая кислота - это полимер галактурононой кислоты. Пектин - это полностью или частично этерифицированная метиловым спиртом пектиновая кислота. Протопектин представляет собой комплекс с целлюлозой и белковыми веществами. Строение комплекса пока полностью не установлено. Пектиновые вещества имеют молекулярную массу от 20000 до 200000. Все пектиназы делятся на две группы - гидролазы и трансэлиминазы. Первые катализируют процесс отщепления метоксильных групп (пектинэстераза) или обеспечивают разрыв α-1,4-гликозидных связей (полигалактуроназы). Вторые осуществляют негидролитическое расщепление пектиновых веществ с образованием двойных связей (пектинтрансэлиминазы). Препараты нашли свое применение в легкой промышленности при вымачивании льна, в пищевой промышленности (осветление вин, консервирование фруктовых соков). 4. Целлюлолитические ферментные препараты.Целлюлолитические ферментные препараты используются при обработке целлюлозы. Сама целлюлоза или клетчатка представляет собой полисахарид общей формулы (С6Н10О5)n и содержится в клеточных стенках растений. При степени полимеризации n=10 образует кристаллическую решетку. Нитевидные молекулы, взаимодействуя между собой, образуют прочные структуры - фибриллы. В объеме таких фибрилл существуют упорядоченные кристаллические участки, где молекулы рас положены параллельно друг другу и связаны водородными связями, сущеcтвуют также участки с неупорядоченной структурой - аморфные. Микроорганизмы способны синтезировать целый комплекс целлюло-литических ферментов, которые последовательно катализируют процесс гидролиза целлюлозы до глюкозы. В ферментном комплексе различают три группы ферментных препаратов: Ci-фактор, Сx-фермент и целлюбиазу. Целлюлолитические ферментные препараты нашли применение в целлюлозно-бумажной промышленности, медицинской промышленности (получении лекарственных веществ - стероидов из растений), в пищевой про мышленности (при производстве растительных масел) и в сельском хозяйстве (в качестве добавок к кормам жвачных животных). Продуцентами аминокислот в биосинтезе наиболее часто служат бактерии, относящиеся к родам Corynebacterium, Brevibacterium, Escherishia. Субстратом при производстве аминокислот является углеводное сырье (меласса, гидролизаты крахмала и целлюлозы), этанол, уксусная или другие органические кислоты, а также углеводороды. В качестве источника азота используют соли аммония, нитраты, а также аминокислоты. У микробиологического синтеза есть свои преимущест ва и свои недостатки. С одной стороны, в нем мало стадий и требуется от носительно простая и универсальная аппаратура. С другой стороны, живые организмы, с которыми приходится работать, очень чувствительны к ма лейшему изменению условий, а концентрация целевого продукта получа ется низкой, что ведет к увеличению размеров аппаратуры.
У ряда микроорганизмов хорошо изучены пути синтеза всех двадцати аминокислот. Исходным материалом для синтеза служат простые промежуточные продукты обмена (пируват, 2-оксоглутарат, оксалоацетат или фумарат, эритрозо-4-фосфат, рибозо-5-фосфат и АТР). При синтезе большинства аминокислот аминогруппа вводится только на последнем этапе путем трансаминирования. Некоторые аминокислоты образуются в результате ряда превращений других аминокислот, и в этих случаях трансаминирования не требуется. Аминокислоты можно подразделить на группы, исходя из путей их синтеза (рис. 7.17). Синтез различных аминокислот включает разное число этапов, катализируемых ферментами. Примечателен тот факт, что аминокислоты, которые человек должен получать в готовом виде, синтезируются особенно длинным путем. 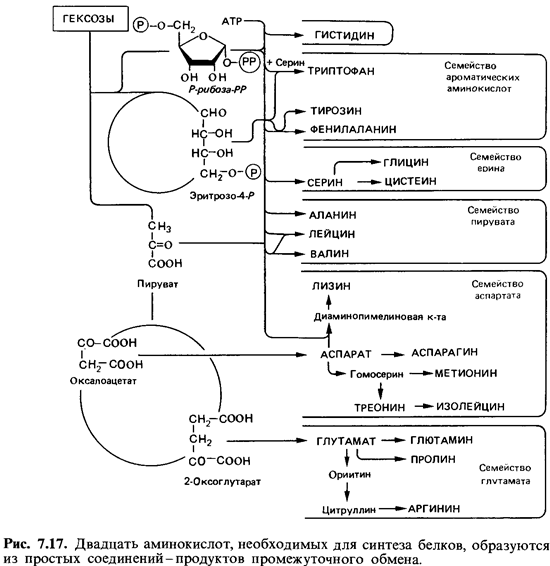 |
