Краткосрочный план урока
№12 СШ ФИО учителя:Молдагалиева А. А.
Дата: 23.12.2022 г Класс: 7 «Б», «В»
Количество присутствующих: отсутствующих:
|
Раздел долгосрочного плана: 7.2 В Воздух. Реакция горения
|
Тема урока
|
Процесс горения.
Практическая работа №2/Демонстрация
«Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде»
|
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу)
|
7.3.1.4 -знать условия горения вещества и продукты реакции горения
7.3.1.5 -приводить примеры легковоспламеняющихся, горючих и негорючих веществ
7.3.1.6 -понимать, что вещества лучше горят в чистом кислороде, чем на воздухе
7.3.1.7 - знать, что при горении металлов и неметаллов образуются оксиды
|
Цели урока
|
- знать условия горения веществ и продукты горения веществ
-приводить примеры лековоспламеняющихся, горючих и негорючих веществ
- понимать, что вещества лучше горят в чистом кислороде
- знать, что при горении металлов и неметаллов образуются оксиды
- знать способ определения кислорода тлеющей лучинкой
-исследовать реакции горения серы, фосфора и железа в воздухе и кислороде
- записывать словесные уравнения реакций горения серы, фосфора, железа
- уметь проводить наблюдения во время эксперимента, делать выводы
|
Критерии оценивания
|
Учащиеся:
называют условия горения вещества и продукты реакции горения
приводят примеры легковоспламеняющихся, горючих и негорючих веществ
объясняют, почему вещества лучше горят в чистом кислороде, чем на воздухе
понимают, что при горении металлов и неметаллов образуются оксиды
называют способ определения кислорода тлеющей лучинкой
правильно записывают словесные уравнения реакций горения серы, фосфора и железа
записывают свои наблюдения в тетради, оформляют результаты в виде таблицы, делают выводы по работе
|
Языковые цели
|
Предметная лексика и терминология:
Горение, продукты горения, оксиды, легковоспламеняющиеся вещества, кислород, перманганат калия, тлеющая лучинка, температура воспламенения, сера, фосфор, железо, индикатор.
Серия полезных фраз для диалога/письма:
Условием горения веществ является …
Вещества горят в кислороде с образованием …
Вещества лучше горят в………., чем в воздухе.
При выполнении опытов нужно соблюдать……
Мы обнаружили/ увидели/заметили/пронаблюдали, что…
|
Привитие ценностей
Ценности
«Мәңгіліқ ел»
|
Труд и творчество:
Умение организовывать свою работу, активно участвовать в процессе обучения; проявлять уважение к труду.
Сотрудничество:
стремиться к сотрудничеству через работу в группе; достижению лучшего результата; развитию умений анализировать, делать выводы.
Образование в течение всей жизни (мотивация для обучения, ответственность за свое обучение)
Открытость: способность воспринимать чужое мнение и выражать свою точку зрения
|
Межпредметные связи
|
Естествознание (химические явления)
Физика (виды энергии, физические явления)
|
Предварительные знания
|
Естествознание -5 класс. Правила техники безопасности при проведении исследований.
Естествознание – 5 класс. Виды энергии.
Температура и тепловая энергия. Физические и химические изменения, вызванные нагреванием. Горение.
Химия - 7 класс. Воздух. Состав воздуха.
|
Ход урока
Этапы урока
|
Запланированная деятельность на уроке
|
Ресурсы
|
Начало урока
10 мин
Середина урока
11-35 мин
|
Приветствие. Проверка подготовленности учащихся к уроку. Организация внимания учащихся. Пожелание успеха.
Деление учащиеся на группы (24 ученика в классе)
Деление класса на 4 группы по 6 человек.
Деление класса на группы по принципу 1 лидер + 5 учеников (случайный выбор).
МЕТОД: Учитель выбирает 4 лидеров из числа сильных учеников. Лидеры выходят к доске. У учителя есть набор карточек в количестве 20 шт, среди которых имеется 5 единиц, 5 двоек, 5 троек, 5 четверок. Карточки учителем раздаются учащимся в произвольном порядке. Лидерам присваивается номер группы (1,2,3 или 4). Ученики в зависимости от своего номера на карточке распределяются в соответствующие группы.
Актуализация знаний. Постановка целей урока.
Давайте все посмотрим на картинки, изображенные на слайде.

Какой химический процесс объединяет эти картинки? (ответы обучающихся).
Какое ключевое слово заложено в картинках? (горение)
Как вы думаете, что является темой нашего урока?
Значит цель нашего урока ….
( Определение темы и постановка целей урока совместно с учащимися)
Учащиеся формулируют и записывают тему урока в тетрадях.
Беседа по вопросам:
1)Что вы уже знаете о горении?
2)Без какого вещества горение невозможно?
3)В состав какой природной смеси входит кислород?
4)Сколько по объему содержится кислорода в воздухе?
5)Какие еще газы присутствуют в воздухе, помимо кислорода? Перечислите их.
6)Как можно получить кислород из других веществ? (учащиеся затрудняются ответить на этот вопрос, т.к не хватает знаний)
Ф.О. Устные комментарии.
Чтобы ответить на этот вопрос, проведем эксперимент.
Изучение нового материала
Учащиеся в группах выполняют практическую работу.
Практическая работа № 2 «Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде»
(Видео демонстрации)
Цель
-понимать, что вещества лучше горят в чистом кислороде, чем на воздухе
- знать, что при горении металлов и неметаллов образуются оксиды
-записывать словесные уравнения реакций горения серы, фосфора и железа
-знать условия горения веществ и продукты горения
-записывать наблюдения, оформлять таблицу результатов, делать выводы
Уровень мыслительных навыков Знания. Понимание. Применение.
Критерий оценивания учащиеся
устанавливают, что вещества лучше горят в чистом кислороде, чем на воздухе
определяют, что при горении металлов и неметаллов образуются оксиды
правильно записывают словесные уравнения реакций горения серы, фосфора и железа
называют условия горения вещества и продукты реакции горения
правильно оформляют результаты в виде таблицы, делают выводы по работе
Задание
Практическая работа № 2 «Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде»
Ход работы:
Учащиеся по группам выполняют практическую работу. Повторяют правила ТБ.
Видео демонстрация «Получение кислорода»
Собрать прибор, как показано на рисунке стр.24.
В пробирку насыпьте примерно на ¼ объема перманганата калия и у отверствия положите рыхлый комочек ваты.
Закройте пробирку пробкой с газоотводной трубкой и проверьте на герметичность.
Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил до дна стакана для собирания кислорода.
Начните нагревать пробирку. Проверьте наличие кислорода в стакане с помощью тлеющей лучинки и накройте стакан стеклом.
Видео демонстрация «Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде»
Взаимодействие кислорода с простыми веществами.
Горение серы.
Возьмите в ложечку для сжигания небольшое количество порошка серы и поместите в пламя спиртовки, понаблюдайте за цветом горения серы в воздухе. Пока сера горит, внесите ее в колбу с кислородом и сравните цвет горения. После сжигания серы в сосуд прилейте немного дисстилированой воды, встряхните его и исслейде раствор индикатором.
Горение фосфора.
Положите в лабораторную ложечку кусочек красного фосфора и подержите в пламени спиртовки до его возгорания. Понаблюдайте горение фосфор в воздухе. Горящий фосфор внесите в колбу с кислородом и сравните цвет горения фосфора. После сжигания в сосуд прилейте немного дистиллированной воды, встряхните его и исследуйте раствор индикатором.
Горение железа.
На дно стеклянной банки(500 мл) насыпьте сухого песка, наполните ее кислородом и накройте стеклянной пластинкой. Тонкую железную проволку тщательно очистите шкуркой от оксидов. Прикрутите к стеклянной палочке для получения спирали. На один конец прикрепите корковую пробку, а на другой насадите небольшую лучинку, зажгите на спиртовке, когда она хорошо разгорится, внесите спираль в сосуд с кислородом. Что вы наблюдаете?
После видео демонстраций ученики в группе должны обсудить увиденное, сравнить горение серы, фосфора и железа в кислороде и на воздухе и заполнить таблицу в тетрадях для практических работ, сделать выводы.
Таблица результатов:
№
|
Опыт
|
Наблюдение
(на воздухе)
|
Наблюдения
(в кислороде)
|
Уравнение реакции
|
1
|
Горение серы
|
|
|
|
2
|
Горение фосфора
|
|
|
|
3
|
Горение железа
|
|
|
|
Дескриптор обучающиеся
правильно называют условия горения веществ и продукты реакции горения
правильно записывают словесные уравнения реакций горения серы, фосфора и железа
правильно оформляют результаты в виде таблицы, делают выводы по работе
определяют различие в горении веществ на воздухе и в чистом кислороде
Беседа по вопросам:
1)В чем вещества горят лучше?
2)Объяснить, почему.
3)Что является продуктом всех увиденных реакций горения?
4)Каким пламенем горит сера в кислороде?
5)Какой продукт образуется при горении фосфора в кислороде?
6)При каких условиях проходили все реакции горения?
Ф.О. Устные комментарии.
Физкультминутка «Танцующий ежик»
А теперь давайте познакомимся с процессом горения подробнее.
Используем стратегию «Мудрые совы»
У учащихся в группе лежит лист с вопросами и заданиями, на которые они сообща должны ответить устно или письменно (рядом с вопросами и заданиями стоят знаки У или П).
Учащиеся в тетрадях выполняют только письменные задания, остальные устно проговаривают в группе.
Цель:
-знать, какие реакции относятся к реакциям горения, какими признаками они сопровождаются
-записывать общую схему и конкретные примеры горения простых веществ в кислороде в словесном виде
-объяснять понятие «медленное окисление», приводить примеры
-сравнивать горение веществ на воздухе и в чистом кислороде
-определять условия возникновения и прекращения горения
-приводить примеры легковоспламеняющихся, горючих и негорючих веществ
Уровень мыслительных действий Знания. Понимание. Применение
Критерий оценивания учащиеся
знает определение реакций горения, признаки реакций
записывает общую схему и конкретные примеры горения простых веществ в кислороде в словесном виде
объясняет понятие «медленное окисление», приводит примеры
сравнивает горение веществ на воздухе и в чистом кислороде, находит сходства и отличие
определяет условия возникновения и прекращения горения
приводит примеры легковоспламеняющихся, горючих и негорючих веществ
Уровень мыслительных навыков Знания. Понимание. Применение. Навыки высокого порядка.
Задание для групп:
1)Какие реакции относятся к реакциям горения? У
2)Какие признаки реакций наблюдаются при этом? У
3)Запишите общую схему взаимодействия простых веществ с кислородом. П
4)Что образуется при горении простых веществ? Показать на примере горения меди и алюминия. П
5)Объясните понятие «медленное окисление», приведите по 2 примера. У
6)Сравните процессы горения веществ на воздухе и в кислороде. В чем сходства и отличия? П
Ответ представьте в виде диаграммы Венна (для сильных)
Сходство
7)Используя схему 5 на стр 58 в учебнике, определите, каковы условия возникновения и прекращения горения? У
8)Какие вы знаете горючие, легковоспламеняющиеся и негорючие вещества? Приведите по 2 примера на каждый случай. П
9)Даны вещества: бензин, уголь, вода, природный газ, песок, сера, углекислый газ, глина, торф, нефть, керосин.
Распределите вещества на группы:
А) негорючие
Б) горючие
В) легковоспламеняющиеся
Предложите способ, как можно одним из перечисленных веществ остановить горение другого вещества. П , У
Учащиеся совместно находят ответы на вопросы и выполняют письменные задания. Более сильные ученики, помогают более слабым учащимся выполнять задания, если что-то не понятно, объясняют.
Учитель наблюдает за группами, в случае необходимости направляет и помогает учащимся.
Дескриптор обучающийся
знает определение реакций горения, признаки реакций
записывает общую схему и конкретные примеры горения меди и алюминия в кислороде в словесном виде
объясняет понятие «медленное окисление», приводит два примера
сравнивает горение веществ на воздухе и в чистом кислороде, находит сходства и отличие, представляет ответ в виде диаграммы Венна
определяет условия возникновения и прекращения горения
приводит примеры легковоспламеняющихся, горючих и негорючих веществ
распределяет вещества на горючие, негорючие, легковоспламеняющиеся, предлагает способ, как можно одним из перечисленных веществ остановить горение другого вещества
Прием обратной связи«Шкатулка вопросов»
Учащимся из каждой группы предлагается взять из шкатулки бумажку с вопросом и ответить на него. Вопросы представлены из предыдущего задания. Если ученик затрудняется ответить, ему помогают другие учащиеся его группы или класса.
Ф.О. Учитель в процессе ответов учащихся употребляет следующие слова и фразы: «Молодец», «Умничка», «Ты хорошо ответил», «У кого другое мнение?», «Попробуй сам исправить свой ответ, подумай».
|
Набор карточек в количестве 20 шт, среди которых имеется 5 единиц, 5 двоек, 5 троек, 5 четверок
Слайд
Компьютер
Интерактивная доска
Видео опыты:
Получение
кислорода из перманганата калия
Горение серы
Горение фосфора
Горение железа
(взяты из интернета)
Таблица результатов
(в качестве образца)
Тетради для практических работ
Видеоролик
Листы с вопросами и заданиями
Материалы
учебника
« Химия 7 класс» § 9,
стр. 55-58
Диаграмма Венна
(в качестве образца)
Рабочие тетради
Шкатулка с бумажками, на которых заранее написаны вопросы из предыдущего задания
|
В воздухе
Отличия
В кислороде
Отличия
|
|
|
Конец урока
2 мин
|
Рефлексия
Заполнение группой рефлексивной мишени
(оценивается по баллам 1,2,3,4,5). Мишени вывешиваются на доску и учитель видит результаты.
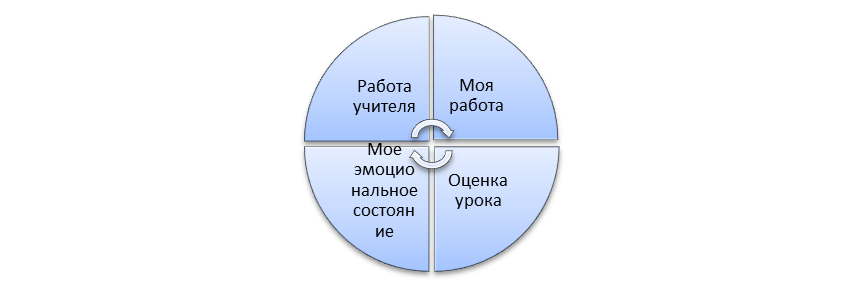
|
Рефлексивные
мишени (на группу)
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися?
|
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися?
|
Здоровье и соблюдение техники безопасности
|
-поддержка слабых (ученик – ученик, ученик - учитель)
- мотивация сильных (задания повышенной сложности, возможность помогать в обучении более слабым ученикам)
-по уровню заданий (дифференцированные задания согласно таксономии Блума, на знание, понимание, применение, навыки высокого порядка)
-по источнику получения знаний (учебник, видео, картинки, учитель, собственный опыт учащегося)
|
Устные комментарии во время беседы по вопросам (на этапе актуализации, на этапе выполнения практической работы)
Письменные комментарии к практической работе.
|
Обсуждение ПТБ при работе с нагревательными приборами
Физкультминутка
| |
 Скачать 384.72 Kb.
Скачать 384.72 Kb.