Прогностическое значение компонентов полиорганной недостаточности. Прогностическое значение компонентов полиорганной недостаточност. Прогностическое значение компонентов полиорганной недостаточности в оценке исходов острейшего и острого периодов тяжёлого ишемического инсульта
 Скачать 53.09 Kb. Скачать 53.09 Kb.
|
|
Прогностическое значение компонентов полиорганной недостаточности в оценке исходов острейшего и острого периодов тяжёлого ишемического инсульта. Силкин В. В.1, 2, Ершов В. И. 1, 2 1 Оренбургский государственный медицинский университет, Оренбург, Россия 2 Университетский научно-клинический центр неврологии, нейрореаниматологии и нейрохирургии, Оренбург, Россия Тяжёлый ишемический инсульт (ИИ) остаётся значительной медико-социальной проблемой в России и мире, являясь одной из лидирующих причин смертности, а также основной причиной стойкой утраты трудоспособности среди взрослого населения [1]. Данные показатели удалось в значительной степени снизить с развитием первичной профилактики и лечения ИИ, в особенности методов реперфузии, однако, социальные последствия тяжёлого ИИ остаются значительными [2, 3]. ИИ является осложнением заболеваний сердечно-сосудистой системы, при тяжёлом течении наиболее часто – церебрального атеросклероза (атеротромботический подтип, АП) и фибрилляции предсердий (кардиоэмболический подтип, КП). Тяжёлый ИИ клинически проявляется развитием выраженного неврологического дефицита, церебральных осложнений, в том числе отёка и дислокации головного мозга, окклюзионной гидроцефалии, геморрагической трансформации, судорожного синдрома, и экстрацеребральных осложнений, в том числе инфекционных респираторных осложнений, кардиальных осложнений, венозных тромбоэмболических осложнений, инфекции мочевыделительной системы, сепсиса [2]. Развитие осложнений обуславливает отклонение базовых физиологических показателей и формирование недостаточности отдельных систем органов, что определяет тяжесть состояния пациентов с тяжёлым ИИ. Недостаточность двух и более систем органов определяется как полиорганная недостаточность (ПОН) [4] и служит неблагоприятным фактором клинического течения и исхода при ИИ. Тяжесть клинического течения, необходимость мониторинга и коррекции витальных функций определяют необходимость лечения данной группы пациентов в специализированных блоках и отделениях реанимации и интенсивной терапии сосудистых центров, что отражено в клинических рекомендациях, действующих порядке и стандартах оказания медицинской помощи пациентам с ИИ. Важным компонентом интенсивной терапии являются объективная оценка степени тяжести и прогнозирование клинического течения и исхода у отдельно взятого пациента. С данной целью применяются разработанные шкалы оценки тяжести при критических состояниях APACHE-II, SAPS-II, шкала динамической оценки органной недостаточности SOFA. При этом, прогностические факторы клинического течения и исхода при тяжёлом ИИ и, в частности, прогностическое значение ПОН остаются недостаточно изученными. Цель: определение прогностической значимости факторов ПОН в клиническом течении и исходах тяжёлого ИИ. Материалы и методы. В исследование включено 110 пациентов (48 мужчин, 62 женщины) с тяжёлым ИИ, поступивших в блок реанимации и интенсивной терапии неврологического отделения для больных с острым нарушением мозгового кровообращения ГАУЗ «ГКБ им. Н. И. Пирогова» г. Оренбурга. Всем пациентам при поступлении определена тяжесть ИИ по шкале National Institute of Health Stroke Score (NIHSS), выполнена мультиспиральная компьютерная томография (МСКТ) головного мозга, определён патогенетический подтип ИИ согласно критериям Trial of 10172 in Acute Stroke treatment (TOAST). Критерии включения: установленный диагноз ИИ, возраст 18 – 85 лет, госпитализация в течение 24 ч от начала заболевания, оценка по шкале NIHSS при поступлении ≥14 баллов, атеротромботический или кардиоэмболический подтипы ИИ. Критерии невключения: тяжёлая сопутствующая патология, неуточнённых патогенетический подтип. Всем пациентам производились диагностические и лечебные мероприятия согласно порядку и стандартам оказания медицинской помощи пациентам с острым нарушением мозгового кровообращения. Для оценки прогностической значимости проанализированы следующие категории параметров: паспортные данные (возраст, пол, время от начала до госпитализации), предшествующий коморбидный статус, данные неврологического осмотра и нейровизуализации, развитие осложнений ИИ, развитие органной недостаточности. Оценка предшествующей сопутствующей патологии включала наличие диагностированной патологии, данные эхокардиоскопии с оценкой фракции выброса (ФВ). Характеристика ИИ включала первичный или повторный ИИ, бассейн левой, правой средней мозговой артерии (ЛСМА, ПСМА) или вертебробазилярной системы (ВБС), подтип ИИ, оценку тяжести ИИ по NIHSS, оценку уровня сознания по шкале ком Глазго (ШКГ), наличие судорожного синдрома, данные МСКТ головного мозга. Оценка органной недостаточности производилась на 1, 3, 5, 7 и 10 сутки госпитализации в соответствии с критериями Sequential Organ Failure Assessment (SOFA). Оценивались факт наличия и степень тяжести церебральной недостаточности (оценка ШКГ <15 баллов), дыхательной недостаточности (ИО <400 или необходимость респираторной поддержки), сердечнососудистой (СрАД <70 мм рт. ст. или необходимость вазопрессорной поддержки), почечной (критерии острого повреждения почек), коагуляторной (тромбоцитопения <150*109/л), печёночной недостаточностей (общий билирубин >20 мкмоль/л). Также производилась оценка по шкале APACHE-II при поступлении. Конечной точкой исследования принят исход госпитализации в категориях выживания и летального исхода. Обработка данных производилась с использованием программы Statistica 10.0 (StatSoft, США). Количественные показатели представлены в виде медианы и квартильного размаха (Me [Q1; Q3]), категориальные в виде процентов от количества в соответствующей группе. Для оценки достоверности различий количественных показателей между группами применялся U-критерий Манна-Уитни, для категориальных показателей применялся критерий Хи-квадрат Пирсона. Рассчитано отношение шансов и 95% доверительный интервал (ОШ, ДИ 95%) для определения предикторной значимости показателей. Принят уровень статистической достоверности при p<0,05. Результаты. Возраст пациентов исследуемой группы составил 74 [67; 79] года. 37 пациентов (33,64%) поступили в период до 4,5 ч от начала заболевания, при этом ТЛТ была проведена 17 (15,45%) пациентам. Большинство пациентов были с первичным ИИ (64,55%), распределение по патогенетическим подтипам оказалось равномерным (АП и КП по 50%), по локализации очага превалировали пациенты с поражением каротидного бассейна: 51 пациент (46,36%) с локализацией в бассейне ЛСМА, 40 (36,36%) в бассейне ПСМА, 19 (17,27%) в ВБС. По результатам госпитализации выжили 50 (45,45%) пациентов, летальный исход наблюдался у 60 (54,55%) пациентов. Не наблюдалось различий между выжившими и умершими пациентами по возрасту, полу и времени госпитализации от начала заболевания. При анализе сопутствующей патологии оказались ассоциированы c летальным исходом ИБС (ОШ 2,67 (1,05; 6,79), p=0,037) и ожирение II-III степени (4,61 (1,19; 17,85), p=0,025), также у пациентов с летальным исходом наблюдалась более низкая ФВ (p=0,009). ПИКС, фибрилляция предсердий, хроническая болезнь почек, сахарный диабет 2 типа и гликемия при поступлении не были ассоциированы с вероятностью летального исхода в период госпитализации. Оценка по ШКГ при поступлении оказалась достоверно ниже в группе пациентов с летальным исходом (здесь и далее – в группе выживших 14 [13; 15] и в группе с летальным исходом 13 [11; 14] баллов, p=0,001), при этом достоверных различий при оценке по NIHSS не наблюдалось (17 [16; 20] и 19 [17; 21] баллов, p=0,282). Были ассоциированы с неблагоприятным исходом обширный очаг ИИ по данным МСКТ при поступлении (8 (16%) и 20 (33,33%) пациентов, ОШ 2,63 (1,03; 6,7), p=0,041) и кардиоэмболический подтип ИИ (19 (38%) и 36 (60%) пациентов, ОШ 2,45 (1,12; 5,33), p=0,023), а проведение ТЛТ оказалось ассоциировано со снижением летальности (13 (26%) и 4 (6,67%) пациента, ОШ 0,2 (0,06; 0,68), p=0,009). Развитие первичного или повторного ИИ, а также локализация не были ассоциированы с исходом. Также в группе пациентов с летальным исходом оценка по шкале APACHE-II была достоверно выше (9 [8; 11] и 12 [9; 15] баллов, p<0,001). Анализ церебральной недостаточности в исследуемой группе показал, что низкая оценка по ШКГ является предиктором неблагоприятного исхода с 1 по 10 сутки, причём наибольшую прогностическую ценность она имеет на 3 и 5 сутки (p<0,001). На 1 сутки (диаграмма 1) по частоте в обеих группах превалировало поверхностное оглушение – 21 пациент (42%) в группе выживших и 30 пациентов (50%) в группе с летальным исходом. Среди выживших значительно меньше, чем в группе с летальным исходом, было пациентов с сопоре (3 пациента (6%) и 10 пациентов (16,7%) соответственно) и коме I степени (1 пациент (2%) и 3 пациента (5%) соответственно), пациенты в коме II степени на 1 сутки были только в группе с летальным исходом (ОШ 0,72 (ДИ 95% 0,57; 0,90), p=0,003). В группе выживших на 3 сутки (диаграмма 2) были 3 пациента (6%) в сопоре, 3 (6%) в коме I степени и 1 (2%) в коме II степени, в то время как в группе пациентов с неблагоприятным исходом соответствующие степени угнетения сознания были у 9 (15%), 5 (8,33%) и 8 (13,33%) пациентов. Доли пациентов в поверхностном оглушении в группах были сопоставимы: 21 (42%) среди выживших и 15 (25%) у пациентов с неблагоприятным исходом, соответственно; аналогично, в глубоком оглушении были 12 (24%) выживших пациентов и 16 (26,67%) с летальным исходом, соответственно. Пациентов в ясном сознании было значительно больше в группе выживших – 10 пациентов (20%) и 2 пациента (2,33%). Оценка по ШКГ была достоверно ассоциирована с летальностью: ОШ 0,74 (ДИ 95% 0,62; 0,88), p <0,001. Летальность на 3 сутки составила 8,33% для группы с неблагоприятным исходом. На 5 сутки (диаграмма 3) в группе выживших в ясном сознании были 12 пациентов (24%), 18 (36%) в поверхностном оглушении и 11 (22%) в глубоком оглушении. В группе пациентов с неблагоприятным исходом данные показатели были ниже: 2 (3,33%), 8 (13,33%) и 9 пациентов (15%), соответственно. Среди выживших в сопоре были 5 (10%) пациентов, в коме I степени 4 (8%); в группе пациентов с летальным исходом 11 (18,33%) пациентов были в сопоре, 5 (8,33%) в коме I степени, 5 (8,33%) в коме II степени и 6 (10%) – в коме III степени. Оценка по ШКГ на 5 сутки также оставалась ассоциирована с летальностью: 0,68 (0,57; 0,83), p <0,001. Кумулятивная летальность на 5 сутки составила 23,33% от всех пациентов с летальным исходом. На 7 сутки 7 (14%) выживших пациентов были в сопоре и 2 (4%) – в коме I степени, среди пациентов с летальным исходом 10 (16,67%) в сопоре и по 3 (5%) в коме I, II и III степени, в сумме 9 (15%) пациентов. На 10 сутки среди выживших пациентов 3 (6%) были в сопоре, в коме не было ни одного, в отличие от группы пациентов с летальным исходом.  Диаграмма 1. Структура церебральной недостаточности и летальность, 1 сутки. 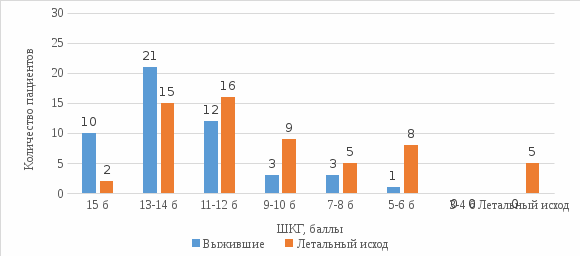 Диаграмма 2. Структура церебральной недостаточности и летальность, 3 сутки.  Диаграмма 3. Структура церебральной недостаточности и летальность, 5 сутки. При сравнительном анализе структуры дыхательной недостаточности и респираторной поддержки в обеих группах показано, что необходимость респираторной поддержки вне зависимости от механизма развития дыхательной недостаточности (паренхиматозной на фоне респираторной патологии или вентиляционной на фоне церебральной недостаточности) ассоциирована с летальным исходом уже на 1 сутки – ОШ 3,92 (ДИ 95% 1,02; 15,00), p=0,043. При этом на 1 сутки были заинтубированы 3 пациента (6%) в группе выживших (из которых 2 по показанию развития судорожного синдрома и были экстубированы в тот же день) и 12 (20%) в группе с летальным исходом. Наибольшей частоты развитие дыхательной недостаточности достигло на 5 сутки (диаграмма 4), когда в группе выживших пациентов были заинтубированы 8 (16%), 2 пациентам (4%) была наложена трахеостома, и только 3 (6%) были экстубированы. Среди пациентов с летальным исходом на 5 сутки были заинтубированы 24 (40%), 4 (6,67%) наложена трахеостома, а 3 (5%) также были экстубированы. Дыхательная недостаточность и проведение инвазивной ИВЛ на 5 сутки оказались значительным предиктором неблагоприятного исхода в период госпитализации – ОШ 5,45 (ДИ 95% 2,16; 13,80), p <0,001. На 10 сутки в группе выживших оставались заинтубированными только 2 пациента (4%), 5 (10%) были с трахеостомой и 8 (16%) были экстубированы. В группе пациентов с летальным исходом заинтубированы были 9 пациентов (15%), 5 пациентам (8,33%) была наложена трахеостома, экстубированы были только 3 (5%).  Диаграмма 4. Сравнительная структура респираторной поддержки и летальность, 5 сутки. Сердечно-сосудистая недостаточность достигала максимальной выраженности с 3 по 7 сутки (диаграмма 5). До 5 суток необходимость вазопрессорной поддержки возникала только у пациентов в группе с неблагоприятным исходом. На 5 сутки сердечно-сосудистая недостаточность развилась у 3 пациентов (6%) в группе выживших и у 11 (18,33%) в группе с летальным исходом, наблюдалась ассоциация с летальным исходом – ОШ 3,51 (ДИ 95% 1,02; 12,15), p=0,044. На 7 сутки вазопрессорная поддержка требовалась только 1 пациенту (2%) в группе выживших и 6 (10%) пациентам в группе с летальным исходом. На 10 сутки вазопрессорная поддержка требовалась только пациентам в группе с летальным исходом. 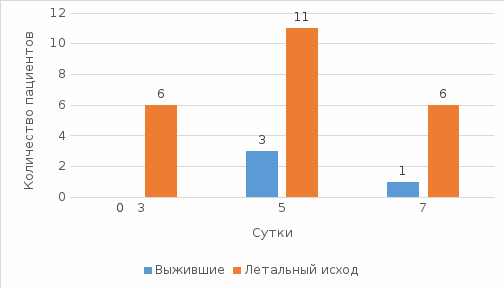 Диаграмма 5. Сравнительная динамика применения вазопрессорной поддержки, 3 – 7 сутки. Недостаточность других органных систем наблюдалась значительно реже. Острое повреждение почек было зафиксировано только у 5 пациентов (2 на 5 сутки, 2 на 7 сутки, 1 – на 10 сутки), все пациенты были в группе с летальным исходом. Острая тромбоцитопения также наблюдалась у незначительного количества пациентов с летальным исходом. Острой печёночной недостаточности в исследуемой группе не наблюдалось. При многовариантном логит-регрессионном анализе ассоциации церебральной (ШКГ), дыхательной (респираторная поддержка) и сердечно-сосудистой (вазопрессорная поддержка) недостаточности на 5 сутки, прогностическую значимость сохраняет низкая оценка по ШКГ (p=0,011). Обсуждение. Несмотря на очевидность неблагоприятного влияния полиорганной недостаточности на исход тяжёлого ИИ, важным является уточнение степени влияния недостаточности различных органных систем и их сочетаний. Поиск прогностических факторов и определение их значимости ранее проводились неоднократно [5 – 12]. Полученные нами данные о неблагоприятном прогностическом влиянии низкой оценки по ШКГ при поступлении, обширного очага ИИ по данным МСКТ, кардиоэмболического подтипа ИИ и более высокой оценке по APACHE-II согласуются с данными литературы [5, 8 – 9, 11]. Отсутствие влияния на исход возраста и оценки по NIHSS при поступлении, вероятно, объясняются включением в исследуемую выборку только пациентов с тяжёлым ИИ, а также исключением пациентов с неуточнённым подтипом ИИ. Значительно меньше представлено в литературе данных о динамической оценке органной недостаточности при тяжёлом ИИ и её прогностическом значении [11]. Нами показано, что церебральная, дыхательная и сердечно-сосудистая недостаточность достигают максимальной выраженности на 3 – 5 сутки. В этот же период они имеют наибольшую прогностическую значимость. Однако, в дальнейшем требуется комплексная динамическая оценка недостаточности систем органов в структуре полиорганной недостаточности при тяжёлом ИИ, и определение прогностической значимости этой оценки. Кроме того, остаётся неясным влияние различных локализаций и патогенетических подтипов на ранний исход в данной группе пациентов. Данный вопрос требует дальнейшего исследования. Заключение. Таким образом, прогностическими факторами неблагоприятного раннего исхода тяжёлого ИИ являются низкая оценка по ШКГ при поступлении, обширный очаг ИИ по данным МСКТ, кардиоэмболический подтип ИИ и более высокая оценка по APACHE-II при поступлении, более низкая оценка по ШКГ на 3 и 5 сутки (наиболее значимый предиктор), необходимость респираторной или вазопрессорной поддержки на 5 сутки. Требуется дальнейшее изучение прогностической значимости комплексной оценки полиорганной недостаточности при тяжёлым ИИ, а также оценки с учётом различных патогенетических подтипов и локализаций. Список литературы. Мачинский, П. А. Сравнительная характеристика показателей заболеваемости ишемическим и геморрагическим инсультом в России / П. А. Мачинский, Н. А. Плотникова, В. Е. Ульянкин, А. Г. Рыбаков, Д. А.Макеев // Известия высших учебных заведений. Поволжский регион. Медицинские науки. – 2019. – № 2 (50). – С. 112 – 132. Smith M, Reddy U, Robba C, Sharma D, Citerio G. Acute ischaemic stroke: challenges for the intensivist. Intensive Care Med. 2019 Sep;45(9):1177-1189. doi: 10.1007/s00134-019-05705-y. Epub 2019 Jul 25. PMID: 31346678. Emberson J, Lees KR, Lyden P, et al.; Stroke Thrombolysis Trialists' Collaborative Group. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials. Lancet. 2014 Nov 29;384(9958):1929-35. doi: 10.1016/S0140-6736(14)60584-5. Epub 2014 Aug 5. PMID: 25106063; PMCID: PMC4441266. Сепсис в начале ХXI века. Классификация, клинико-диагностическая концепция и лечение. Патологоанатомическая диагностика: Практическое руководство / Под ред. В. С. Савельева, Б. Р. Гельфанда. — М.: Литтерра, 2006. — 176 с. — (Серия «Практические руководства»). Gattringer T, Posekany A, Niederkorn K, et al; Austrian Stroke Unit Registry Collaborators. Predicting Early Mortality of Acute Ischemic Stroke. Stroke. 2019 Feb;50(2):349-356. doi: 10.1161/STROKEAHA.118.022863. PMID: 30580732. Ершов, В. И. Клинико-прогностические аспекты нарушений водно-электролитного гомеостаза в острейшем периоде ишемического инсульта / В. И. Ершов, Л. А. Айжанова, А. Н. Чирков, А. М. Назаров, А. П. Гончар-Зайкин // Вестник интенсивной терапии. – 2017. – № 4. – С. 53-57. Шайтанова, Т. Ю. Нейропептид S100-B: диагностика злокачественного течения инфаркта мозга / Т. Ю. Шайтанова, В. А. Саскин, Э. В. Недашковский // Вестник анестезиологии и реаниматологии. – 2015. – Т. 12. № 3. – С. 48-55. Bautista AF, Lenhardt R, Yang D, et al. Early Prediction of Prognosis in Elderly Acute Stroke Patients. Crit Care Explor. 2019;1(4):e0007. Published 2019 Apr 29. doi:10.1097/CCE.0000000000000007 Corso G, Bottacchi E, Tosi P, et al. Outcome Predictors in First-Ever Ischemic Stroke Patients: A Population-Based Study. Int Sch Res Notices. 2014;2014:904647. Published 2014 Dec 25. doi:10.1155/2014/904647 Battey TW, Karki M, Singhal AB, et al. Brain edema predicts outcome after nonlacunar ischemic stroke. Stroke. 2014 Dec;45(12):3643-8. doi: 10.1161/STROKEAHA.114.006884. Epub 2014 Oct 21. PMID: 25336512; PMCID: PMC4295905. Qin W, Zhang X, Yang L, Li Y, Yang S, Li X, Hu W. Predictive value of the sequential organ failure assessment (SOFA) score for prognosis in patients with severe acute ischemic stroke: a retrospective study. J Int Med Res. 2020 Aug;48(8):300060520950103. doi: 10.1177/0300060520950103. PMID: 32865055; PMCID: PMC7469749. Grabska K, Gromadzka G, Członkowska A. Infections and ischemic stroke outcome. Neurol Res Int. 2011;2011:691348. doi:10.1155/2011/691348 |
