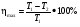|
|
Физика справочник формул. Справочник формул размеры молекул V Sd толщина слоя, где d диаметр молекулы Vкапли 1 мм3 (молекула)
                                                      Физика Физика
Справочник формул
РАЗМЕРЫ МОЛЕКУЛ
V = Sd – толщина слоя, где
d – диаметр молекулы
Vкапли = 1 мм3
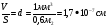 (молекула) (молекула)
10-8 см (атома)
ЧИСЛО МОЛЕКУЛ
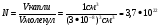
МАССА МОЛЕКУЛЫ ВОДЫ
 , ,
где N – число молекул.
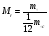 - относительная молекулярная масса - относительная молекулярная масса
Количество вещества и постоянная Авогадро
Один моль – это кол-во в-ва, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
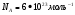
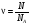 - кол-во в-ва - кол-во в-ва
МОЛЯРНАЯ МАССА
Молярной массой М в-ва называют в-во, взятое в кол-ве одного моля.
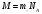 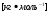 молярная масса молярная масса
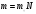 . . 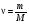 - кол-во в-ва. - кол-во в-ва.
 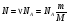 - число молекул - число молекул
МАССА В-ВА, СОДЕРЖАЩЕГОСЯ В ЛЮБОМ КОЛ-ВЕ В-ВА
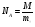  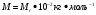
БРОУНОВСКОЕ ДВИЖЕНИЕ
Броуновское движение – это тепловое движение взвешенных в жидкости (или газе) частиц.
Причина Броуновского движения закл-ся в том, что удары молекул жидкости о частицу не компенсируют друг друга, хаотичное, беспорядочное движение самой жидкости.
ВЗАИМОДЕЙСТВИЕ МОЛЕКУЛ
На расстояниях, превышающих 2-3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила притяжения сначала увеличивается, а затем начинает убывать и убывает до нуля, когда расстояние между двумя молекулами становится равным сумме радиусов молекул.
ИДЕАЛЬНЫЙ ГАЗ
Ид. газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. В нем:
Отсутствуют силы межмолекулярного взаимодействия;
Взаимодействие молекул происходит только при их соударении и является упругим;
Молекулы идеального газа не имеют объема, представляют собой материальные точки.
Давление (ид. газа) создается ударами молекул о стенки сосуда 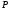 n,
где n – концентрация молекул.
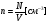 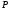
 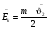
СРЕДНЕЕ ЗНАЧЕНИЕ КВАДРАТА СКОРОСТИ МОЛЕКУЛ
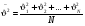 средн.значен. кв. скорости средн.значен. кв. скорости
где N – число молекул в газе.
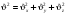 квадрат модуля любого вектора квадрат модуля любого вектора
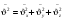 среднее значение среднее значение 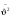
 сред. значен. квадр. проекций скорости сред. значен. квадр. проекций скорости
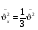 средн. квадрат проекции скорости средн. квадрат проекции скорости
ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗА
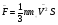 ; ;  ; ;
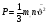 - основн. уравнен. МКТ газов. - основн. уравнен. МКТ газов.
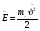 ; ; 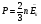 . .
Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекул.
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ
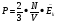
АБСОЛЮТНАЯ ТЕМПЕРАТУРА

T , где Т – абсолютная температура
 = kТ ,где k- коэф. пропорциональности = kТ ,где k- коэф. пропорциональности
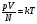
Предельн. тем-ру, при котор. давление идеал. газа обращается в нуль при пост. объеме или объем ид. газа стремится к нулю при неизменном давлении, называют абсолютным нулем температуры
ПОСТОЯННАЯ БОЛЬЦМАНА
 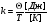 постоянная Больцмана постоянная Больцмана
Постоянная Больцмана связывает температуру  в энергетических единицах с температурой Т в кельвинах. в энергетических единицах с температурой Т в кельвинах.
T = t+273
ТЕМПЕРАТУРА
МЕРА СРЕДНЕЙ КИНЕТИЧЕСКОЙ ЭНЕРГИИ МОЛЕКУЛ.
Абсолютная температура есть мера средней кинетической энергии движения молекул.
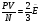 и и 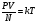 ; ; 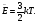
p = nkT, где n – концентрация молекул [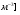
В равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
СРЕДНЯЯ СКОРОСТЬ ТЕПЛОВОГО ДВИЖЕНИЯ МОЛЕКУЛ
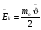 ; ; 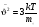 , где , где 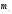 - масса молекул тела - масса молекул тела
 - средняя квадратичная скорость - средняя квадратичная скорость
УРАВНЕНИЯ СОСТОЯНИЯ ИДЕАЛ. ГАЗА
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало.
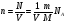 , где , где
NA – постоянная Авогадро
m – масса газа
М – его молярная масса
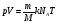
Произведение постоянной Больцмана k и постоянной Авогадро NA называют универсальной (молярной) газовой постоянной и обозначают буквой R.
R = 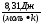
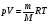 - уравнение Менделеева-Клапейрона - уравнение Менделеева-Клапейрона
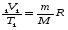 и и 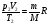
начальное состояние газа конечное состояние
 - уравнение Клапейрона. - уравнение Клапейрона.
ГАЗОВЫЕ ЗАКОНЫ
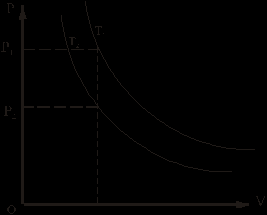
1. Изотермический процесс («изос» - от греч. равный)
Закон Бойля-Мариотта
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
PV = const при T = const
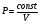 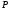
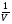 
I
II
Графиком является изотерма (гипербола)
Т1>T2, т.к. R1>R2
R1V1 = R2V2
2. Изобарный процесс («барос» - вес, тяжесть)
закон Гей- Люссака
Процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным
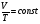 при P=const при P=const
V = T const; V
T; 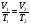 . .
V P1
V1 P2
V2
O T
Графиком является изобара (прямая)
V1>V2 , P1
В области низких температур все изобары идеального газа сходятся в точке Т=0. Но это не означает, что объем реального газа действительно обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния (PV=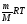 ) не применимо. ) не применимо.
3. Изохорный процесс («хорема» - вместимость) -
(закон Шарля)
Процесс изменения термодинамической системы при постоянном объеме называют изохорным.
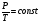 при V=const; P при V=const; P
T
P V1
P1 V2
P2
O T
Графиком является изохора (прямая)
P2V1
В соответствии с уравнением p=const . T
все изохоры начинаются в точке Т=0. Значит, давление идеального газа при абсолютном нуле равно нулю.
НАСЫЩЕННЫЙ ПАР
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром.
Давление пара Р0, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
ЗАВИСИМОСТЬ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА ОТ ТЕМПЕРАТУРЫ
Р С
В
А
О Т
С ростом t давление растет.
Давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры.
АВ – рост давления, увеличение температуры.
Ро=nkT; P
n, Po
T.
BC - жидкость испарилась и превратилась в пар.
Давление насыщенного пара растет не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул (плотности) пара.
ВЛАЖНОСТЬ ВОЗДУХА
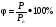 - влажность воздуха - влажность воздуха
где р - порциальное давление водяного пара,
ро – давление насыщенного пара при той же температуре.
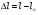 - абсолютное удлинение - абсолютное удлинение
Ɛ = 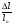  - относительное удлинение, - относительное удлинение,
где lo – начальная длина
l - конечная длина стержня
МЕХАНИЧЕСКИЕ СВОЙСТВА ТВЕРДЫХ ТЕЛ
Ϭ (сигма) – механическое напряжение.
F=kx,
где k – коэф. жесткости
x = Δ l – абсолютное удлинение
Ϭ = 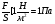  - механическое напряжение - механическое напряжение
Ϭ =E/ Ɛ/ - закон Гука,
где Е – коэф. упругости или модуль Юнга
Ɛ – относительное удлинение.
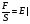 Ɛ Ɛ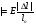 ; ; 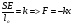


E = 
ВНУТРЕННЯЯ ЭНЕРГИЯ
U - внутренняя энергия [Дж]
U = 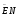 ; ; 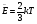 ; ; 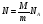 ; ; 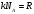 ; ;
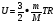 - значен. внутр. энергии ид. газа - значен. внутр. энергии ид. газа
Т
U; U = 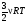 . .
ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ
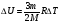 ; U ; U
m; U
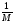 ; ; 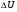
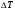 . .
РАБОТА В ТЕРМОДИНАМИКЕ
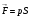  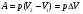
При расширении газа работаA'>0, а при сжатии А'<0.
Работа внешней силы при расширении газа<0, т.е. А>0,а при сжатии А>0.
 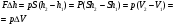
p
p
V2-V1
V1 V2 V
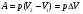
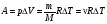

КОЛИЧЕСТВО ТЕПЛОТЫ
1.Нагревание и охлаждение
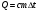 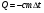
Q- количество теплоты [Дж]
c- удельная теплоемкость вещества 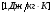
m-масса тела [кг]
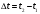 -средняя температура -средняя температура
При нагреванииQ>0
При охлажденииQ<0
2.Плавление и кристаллизация
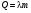 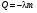 , ,
где λ – уд. теплота плавления [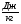 ] ]
Кол-во теплоты, необходимое для превращения 1 кг кристаллического в-ва при температуре плавления в жидкость той же to, называют удельной теплотой плавления.
3. Парообразование и конденсация
Q = rm; Q = rm
r, L – уд. парообразование [Дж/кг]
Количество теплоты, необходимое для превращения при постоянной температуре 1 кг жидкости в пар называют удельной теплотой преобразования.
При парообразовании Q>0
При конденсации Q<0
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Закон превращения и сохранения энергии, распространенный на тепловые явления, носит название первого закона термодинамики.
U = A+Q – первый закон термодинамики
A = A ; Q = ΔU = A
1. Изохорный процесс
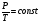 ; V=const, ΔV=0. ; V=const, ΔV=0.
A=PΔV=0; ΔU=Q; ΔT>0; ΔU>0 увеличивается
2. Изотермический процесс
T = const ΔT = 0
ΔU=0; Q= - A ; Q = A
3. Изобарный процесс
P = const; ΔU = Q+A; Q = ΔU = A'
4. Адиабатный процесс
Процесс, протекающий в системе (теплоизолированной), которая не обменивается теплом с окружающими телами.
Q = 0 ; ΔU = A.
Q1 + Q2 + Q3 + … = 0 – уравнение теплового баланса
где Q1, Q2, Q3, … - кол-ва теплоты, полученные или отданные телами.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Второй закон термодинамики указывает направление возможных энергетических превращений и тем самым выражает необратимость процессов в природе.
Принципы действия тепловых двигателей
Температуру Т1 называют температурой нагревателя.
Температуру Т2 называют температурой холодильника
A' =|Q1|-|Q2|, где
Q1 – кол-во тепла, полученное от нагревателя, а
Q2 – кол-во теплоты отданное холодильнику.
Коэф. полезного действия теплового двигателя называют отношение работы А', совершаемой двигателем, к количеству теплоты, полученному от нагревателя:
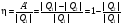 . .
Так как у всех двигателей некоторое количество теплоты передается холодильнику, то < 1.
Максимальное значение КПД тепловых двигателей.
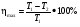
Реальная тепловая машина, работающая с нагревателем, имеющим температуру Т1, и холодильником с температурой Т2, не может иметь КПД, превышающий КПД идеальной тепловой машины.
Закон сохранения электрического заряда.
При электризации тел выполняется закон сохранения электрического заряда. Этот закон справедлив для замкнутой системы. В замкнутой системе алгебраическая сумма зарядов всех частиц остается неизменной. Если заряды частиц обозначить через q1, q2 и т.д., то
q1 + q2 + q3 + … + qn = const.
Основной закон электростатики – закон КУЛОНА
Если расстояние между телами во много раз больше их размеров, то ни форма, ни размеры заряженных тел существенно не влияют на взаимодействия между ними. В таком случае эти тела можно рассматривать как точечные.
Сила взаимодействия заряженных тел зависит от свойств среды между заряженными телами.
Сила взаимодействия двух точечных неподвижных заряженных тел в вакууме прямо пропорциональна произведению модулей заряда и обратно пропорциональна квадрату расстояния между ними. Эту силу называют кулоновской.
|
|
|
 Скачать 2.6 Mb.
Скачать 2.6 Mb.


















































 Физика
Физика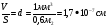 (молекула)
(молекула)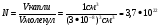
 ,
,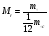 - относительная молекулярная масса
- относительная молекулярная масса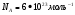
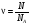 - кол-во в-ва
- кол-во в-ва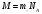
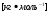 молярная масса
молярная масса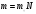 .
. 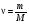 - кол-во в-ва.
- кол-во в-ва.
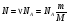 - число молекул
- число молекул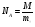

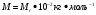
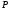

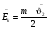
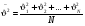 средн.значен. кв. скорости
средн.значен. кв. скорости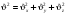 квадрат модуля любого вектора
квадрат модуля любого вектора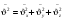 среднее значение
среднее значение 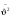
 сред. значен. квадр. проекций скорости
сред. значен. квадр. проекций скорости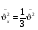 средн. квадрат проекции скорости
средн. квадрат проекции скорости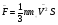 ;
;  ;
;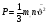 - основн. уравнен. МКТ газов.
- основн. уравнен. МКТ газов.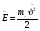 ;
; 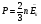 .
.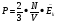

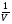

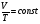 при P=const
при P=const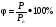 - влажность воздуха
- влажность воздуха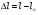 - абсолютное удлинение
- абсолютное удлинение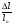
 - относительное удлинение,
- относительное удлинение,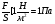
 - механическое напряжение
- механическое напряжение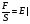 Ɛ
Ɛ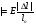 ;
; 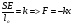



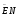 ;
; 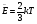 ;
; 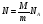 ;
; 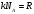 ;
;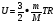 - значен. внутр. энергии ид. газа
- значен. внутр. энергии ид. газа
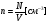
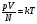

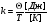 постоянная Больцмана
постоянная Больцмана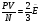 и
и 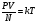 ;
; 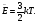
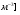
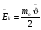 ;
; 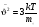 , где
, где 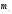 - масса молекул тела
- масса молекул тела - средняя квадратичная скорость
- средняя квадратичная скорость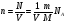 , где
, где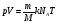
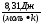
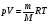 - уравнение Менделеева-Клапейрона
- уравнение Менделеева-Клапейрона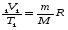 и
и 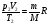
 - уравнение Клапейрона.
- уравнение Клапейрона.
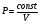
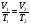 .
.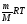 ) не применимо.
) не применимо.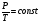 при V=const; P
при V=const; P 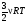 .
.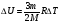 ; U
; U 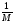 ;
; 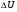
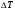 .
.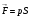
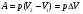

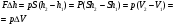
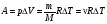
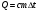
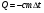
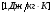
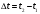 -средняя температура
-средняя температура 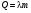
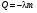 ,
,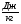 ]
]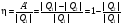 .
.