Лекция 9 Антимикробные химиопрепараты и антибиотики. Тема Антимикробные химиопрепараты. Иммунопрофилактика иммунотерапия инфекционных заболеваний. Иммунобиологические и антимикробные препараты. Лекция9
 Скачать 2.47 Mb. Скачать 2.47 Mb.
|
|
Тема Антимикробные химиопрепараты. Иммунопрофилактика иммунотерапия инфекционных заболеваний. «Иммунобиологические и антимикробные препараты». Лекция9 Антимикробные химиопрепараты и антибиотики: понятие; классификация по источнику, способам получения, химической структуре, спектру, механизму и типу действия. Химиотерапия-Лечение инфекционных, паразитарных или иных заболеваний с помощью химиотерапевтических средств Химиотерапевтическими препаратаы- лекарственные средства, которые в организме больного избирательно подавляют размножение возбудителей инфекций и инвазий или угнетают пролиферацию опухолевых клеток. Термин «антибиотик» был предложен С. Ваксманом в 1942 г. и обозначал продукты микроорганизмов, которые в малых концентрациях убивают или задерживают размножение других микроорганизмов Антимикробными препаратами - вещества природного происхождения, избирательно подавляющие жизнедеятельность микроорганизмов По происхождению (продуценту) антибиотики подразделяются на 3 группы: Антибиотики, образуемые грибами и лишайниками. Так, из культуральной жидкости Penicillium notatum первоначально был выделен пенициллин Cephalosporium acremonium - цефалоспорин, Aspergillus fumigatus - фумигаллин, Penicillium urticae - гризеофульвин, Trichothecium roseum - трихотецин. Лишайники продуцируют усниновую кислоту, обладающую сильным антибиотическим действием. К натриевой соли усниновой кислоты особенно чувствительны дифтерийные палочки. Антибиотики, образуемые актиномицетами. Актиномицеты, особенно представители рода стрептомицетов , продуцируют большое количество антибиотиков: Streptomyces greseus - стрептомицин, Str. fradiae - неомицин, Str. canamyceticus - канамицин, Micromonospora purpurea - гентамицин, Str. aureofaciens - хлортетрациклин, Str. venezuelae - хлорамфеникол, Str. erythreus - эритромицин, Str. fradiae - тилозин, Str. bevoris - леворин, Str. spheroides - новобиоцин, Str. mediterranei - рифамицин, Str. neursei - нистатин. Многие из этих антибиотиков обладают широким спектром действия. Антибиотики, выделенные из бактерий. Группа антибиотиков бактериального происхождения менее обширна и имеет меньшее практическое значение, так как их эффективность значительно ниже, чем у антибиотиков, синтезируемых грибами или актиномицетами. Бактерии-продуценты антибиотиков синтезируют грамицидин, колицин, пиоцианин, субтилин, полимиксин и другие антимикробные вещества  По способу получения антибиотики бывают: природные – продуцируемые различными микроорганизмами: Эти антибиотики получают биологическим синтезом с последующей очисткой от балластных примесей. Например, природными антибиотиками являются пенициллин, стрептомицин. Основными продуцентами природных антибиотиков являются бактерии, актиномицеты, плесневые грибы. полусинтетические – путем биосинтеза получают природный антибиотик, а затем его химически модифицируют; Полусинтетическими антибиотиками являются, например, метициллин и оксациллин. синтетические – антибиотики изначально получают химическим синтезом. Примером синтетических антибиотиков являются фторхинолоновые препараты; левомицетин По типу действия антибиотики делятся на: микробактерицидные (бактерицидные, фунгицидные)– приводящие к гибели бактерии(возбудителей инфекционных заболеваний) микробактериостатические (бактериостатические, фунгистатические) – ингибирующие рост и размножение бактерий, что в итоге приводит к их гибели. Антибиотики по спектру действия : Препараты узкого спектра действия активны в отношении только небольшого количества грамположительных или грамотрицательных бактерий. Препараты широкого спектра действия активны против большого количества как грамположительных, так и грамотрицательных бактерий. Эффективные антибиотики должны отвечать следующим требованиям: - в низкой концентрации обладать микробоцидным или микробостатическим действием; - быть безвредным для макроорганизма и не снижать свою активность в тканях организма; - подавлять рост или размножение микробов, не нарушая физиологического состояния макроорганизма. По объекту воздействия выделяют следующие группы антимикробных препаратов: -антибактериальные препараты; -противотуберкулезные препараты; - противогрибковые препараты; - противопротозойные препараты; - противовирусные препараты. По молекулярной структуре : таблица   По химическому составу: ароматические соединения (левомицетин) аминогликозиды (стрептомицин) макролиды (эритромицин) полипептиды (полимиксин) В-лактамазные (пенициллины , цефалоспорины) По механизму антимикробного действия антибиотики подразделяются на: ингибиторы синтеза клеточной стенки (Бета-лактамы Гликопептиды) - клеточная стенка бактерий – идеальная мишень для высокоизбирательного антибактериального эффекта, т. к. ее структурная основа - пептидогликан уникальна для прокариот и отсутствует у эукариотных клеток; - антипептидогликановые антибиотики действуют бактерицидно, вызывая лизис бактерий, исключение составляют хламидии, микоплазмы; - β-лактамные антибиотики связываются с транспептидазами, препятствуя, тем самым, завершению синтеза пептидогликанового каркаса; - гликопептиды, циклосерин подавляют образование гликопептидных субъединиц и их полимеризацию в гликопептидные цепи. ингибиторы синтеза белка на рибосомах (Аминогликозиды Тетрациклины Хлорамфеникол Линкозамиды Макролиды Фузидиевая кислота) - по ряду признаков белоксинтезирующий аппарат прокариот отличается от рибосом эукариотических клеток. Бактериальные рибосомы состоят из меньших по размеру субъединиц (30s и 50s, что в сумме составляет 70s), у эукариот - 40s и 60s, что в сумме составляет 80s, более мелких РНК. Известно несколько точек приложения таких препаратов – это блокаторы 30s субъединиц рибосом (т. е. прерывают процесс до начала синтеза); - блокаторы 50s субъединиц рибосом (обрывает процесс удлинения пептидных цепей); - инактиваторы фермента транслоказы, что обрывает процесс удлинения пептидных цепей. ингибиторы синтеза нуклеиновых кислот: Ингибиторы синтеза предшественников нуклеиновых кислот (сульфаниламиды, триметоприм) Ингибиторы репликации ДНК (хинолоны, нитроимидазолы, нитрофураны) Ингибиторы РНК-полимеразы (рифамицины) - существует три способа: 1) блокада синтеза предшественников пуринпиримидиновых оснований (сульфаниламиды, триметоприм), 2) подавление репликации ДНК (хинолоны, нитроимидазолы, нитрофураны), 3) инактивация РНК-полимераз, что блокирует транскрипцию, т. е. синтез матричных РНК. ингибиторы функции цитоплазматической мембраны: - полимиксины действуют как катионные детергенты, т. е. повреждают фосфолипидный матрикс клеточных мембран (т. к. мембраны бактерий и эукариот имеют много общего). Менее избирательны, следовательно, менее токсичны (сейчас не применяются); - полиеновые антибиотики повреждают эргостерол ЦПМ грибов, что приводит к их гибели, т. е. применяют в лечении грибковых инфекций. 2. Механизмы действия антимикробных химиопрепаратов. Расписан в 1 вопросе 3. Резистентность микроорганизмов антимикробным химиопрепаратам, ее механизмы. Основные механизмы резистентности микробов к антибиотикам: - способность к синтезу ферментов, инактивирующих антибактериальный препарат; - модификация бактериальных структур, с которыми взаимодействует антибиотик.  Различают следующие виды резистентности микроорганизмов: 1. Естественная резистентность (первичная резистентность, природная устойчивость) - отсутствие «мишеней». Например, микоплазмы не имеют пептидогликана в составе клеточной стенки, поэтому не чувствительны к бета-лактамным антибиотикам. 2. Приобретенная резистентность: - первично приобретенная резистентность - резистентность бактериального штамма к химиотерапевтическому препарату без предварительного контакта с антибиотиком; - вторично приобретенная резистентность – резистентность микроба,развивающаяся после контакта с химиотерапевтическим препаратом Антибиотикорезистентность – это устойчивость микробов к антимикробным препаратам. Пути преодоления резистентности к антимикробным химиопрепаратам. Пути борьбы с антибиотикоустойчивыми бактериями: Систематическое получение новых препаратов Смена а/б для лечения Комбинирование препаратов Определение чувствительности микроба к а/б и использование только эффективных Запрет на использование а/б в пищевой промышленности Запрещение самолечения Назначение строго по показаниям Начало лечения с ударных доз Методы определения чувствительности бактерий к антимикробным химиопрепаратам. Чувствительные – штаммы, рост которых прекращается при использовании доз препарата в терапевтических концентрациях. Умеренночувствительные – штаммы, для угнетения которых требуются максимальные дозы препарата. Устойчивые – штаммы, для подавления роста которых требуются дозы препарата токсичные для организма. Устойчивость не развивается при следующих условиях: - АБ должен проникнуть в клетку - Аб д. вступить во взаимодействие с мишенью и подавить функцию мишени - АБ должен при этом сохранить при этом свою структуру методы определения чувствительности микроорганизмов к антибактериальным препаратам. Метод серийных разведений в жидких средах. В жидкие среды с серийными разведениями антибиотиков вносят исследуемую культуру, инкубируют посевы 10-18 часов при 37°С, и учитывают результаты визуально или нефелометрически. - Иногда в среду добавляют глюкозу и индикатор, что позволяет учитывать результаты по изменению окраски среды. Этот метод позволяет установить минимальную ингибирующую концентрацию (МИК) или минимальную подавляющую концентрацию (МПК) препарата для конкретного возбудителя. Исследование можно выполнять в различных объемах питательной среды - от 1 до 10 мл; в качестве питательной среды обычно используют МПБ или любую другую среду, соответствующую питательным потребностям возбудителя. В пробирках с питательной средой готовят серию двойных разведений антимикробного препарата. В качестве контроля используют пробирку с питательной средой без антибиотика. В каждую пробирку (с антибиотиком и контрольную) вносят суспензию бактерий с концентрацией 106 микробных клеток/мл. Пробирки инкубируют 10-18 часов при 37°С (или до появления бактериального роста в контрольной пробирке). По истечении указанного срока учитывают результаты. МПК соответствует наибольшему разведению препарата, тормозящему рост тест-культуры Метод серийных разведений в плотных средах. Метод аналогичен предыдущей процедуре, но проводится на плотных питательных средах. При использовании этого метода готовят серийные разведения антимикробного препарата, затем вносят каждое разведение в пробирки, содержащие охлажденную агаровую среду. Содержимое пробирки после перемешивания быстро переносят в чашки Петри либо пробирки “скашивают” до застывания агара. Затем агар засевают исследуемой культурой (петлей или специальным дозатором). Посевы инкубируют 18-20 часов при 37°С. После инкубирования посевов определяют МИК по отсутствию роста на чашках или в пробирках, содержащих наименьшие концентрации препарата. Диффузионные методы. Эти методы менее чувствительны, чем методы стандартных разведений, но проще по выполнению. На практике их применяют чаще. Эти методы позволяют определять чувствительность бактерий к нескольким антибиотикам одновременно. Классический метод. В чашки Петри вносят тонкий слой (4-5 мм) плотной питательной среды. После застывания на поверхность агара наносят микробную взвесь (105 клеток/мл) и равномерно распределяют по поверхности агара. Излишки суспензии удаляют, а чашки подсушивают в термостате. Затем в агаре пробивают лунки и в каждую вносят по 0,1 мл раствора исследуемого антибиотика, после чего чашки помещают в термостат. После инкубирования в оптимальных условиях измеряют диаметр зоны подавления роста вокруг лунки для каждого препарата Метод дисков (диско-диффузионный метод). Для определения чувствительности бактерий с помощью этого метода на агар высевают исследуемую культуру (суспензия, содержащая 109 клеток/мл). После этого на поверхность агара промещают диски из фильтровальной бумаги, пропитанные антибиотиками. Для этого используют коммерческие диски, содержащие определенные концентрации антибиотиков. Посевы инкубируют при 37°С в течение времени, необходимого для роста конкретного возбудителя. Вокруг дисков в зависимости от активности и концентрации антибиотика образуются разной величины зоны задержки роста исследуемого микроба . Зоны задержки роста культур измеряют с помощью линейки. Полученные размеры зон сравнивают с величинами зон задержки роста, указанными в инструкции, после чего микроорганизмы относят к той или иной группе (чувствительным, умеренно чувствительным или резистентным). Е-тест представляет собой модификацию метода дисков. В этом тесте вместо дисков используется полоска, содержащая разные концентрации антибиотика на разных участках. Каждая зона полоски имеет соответствующую маркировку. Полоска помещается на поверхность агара с бактериальной культурой. Зона задержки роста культуры в этом тесте также имеет эллипсовидную форму. Минимальной ингибирующей концентрации антибиотика соответствует тот участок полоски, где ее пересекает зона задержки роста исследуемой культуры Принципы эмпирической и рациональной антимикробной химиотерапии инфекционных заболеваний. ПРИНЦИПЫ РАЦИОНАЛЬНОЙ АНТИБИОТИКОТЕРАПИИ Микробиологический принцип (определение антибиотикочувствительности) Фармакологический принцип (выбор наиболее активного и менее токсичного антибиотика, дозы препарата, интервалов и метода введения) Клинический принцип (общее состояние больного, возраст, пол , сопутствующие заболевания) Эпидемиологический принцип (подбор АБ исходя из расространенности устойчивых штаммов и др.) Фармацевтический принцип (срок годности, условия хранения препарата) Побочное действие антимикробных химиопрепаратов и антибиотиков на нормальную микрофлору макроорганизма. Осложнениями и побочными действиями антимикробной терапии являются: 1. Осложнения со стороны макроорганизма: - токсическое действие препаратов; - дисбиоз (дисбактериоз); - отрицательное воздействие на иммунную систему; - эндотоксический шок (терапевтический); - аллергические реакции. 2. Побочные действия на микроорганизмы: - формирование атипичных и персистирующих форм микробов; - формирование антибиотикозависимости и антибиотикоустойчивости. Токсическое действие препаратов на макроорганизм. Чаще всего токсические реакции проявляются при длительном применении антибиотиков, особенно у детей, беременных женщин, пациентов с нарушенными функциями печени и почек. Среди токсических реакций отмечаются поражения паренхимы печени (тетрациклины), поражения почек (амфотерицин В, линкомицин, аминогликозиды), поражения органов кроветворения (левомицетин). Токсическое действие антибиотиков проявляется в виде нейротоксических, ототоксических, нефротоксических, общетоксических, тератогенных реакций. Дисбактериозы (дисбиозы) возникают в результате воздействия антибиотиков (особенно широкого спектра действия) на нормальную микрофлору организма. Чаще поражается микрофлора желудочно-кишечного тракта. В результате этого нарушаются функции органов и систем, возникает авитаминоз, развивается вторичная инфекция. 419 Иммунодепрессивные эффекты возникают в результате воздействия антибиотиков на органы и клетки иммунной системы. Эндотоксический шок развивается при лечении инфекций, вызванных грамотрицательными бактериями. При введении антибиотиков наступает гибель возбудителя и высвобождается большое количество эндотоксина. Клинически эндотоксический шок проявляется кратковременным ухудшением состояния больного (падение давления, слабость). Аллергические реакции на антибиотики клинически проявляются анафилаксией, сывороточноподобным синдромом, лекарственной лихорадкой, эритемами. Анафилаксия – острая реакция, развивающаяся в течение 5-30 минут после применения антибиотика. Для нее характерны диффузная эритема, кожный зуд, бронхоспазм, отек гортани, гипотензия, аритмия и другие симптомы. Наиболее частой причиной развития анафилаксии является пенициллин. Сывороточноподобный синдром вызывают β-лактамы, сульфаниламиды и стрептомицин. Этот синдром обычно развивается на 7-21 сутки от начала применения антибиотика. Если пациент получал антибиотик ранее, первые проявления могут возникнуть через несколько часов. Клинические проявления - лихорадка, крапивница, артралгия, лимфоаденопатия. Сывороточноподобный синдром часто разрешается самостоятельно после отмены антибиотика. Лекарственная лихорадка может быть единственным проявлением аллергии, ее чаще всего вызывают β-лактамы, сульфаниламиды, стрептомицин, ванкомицин, хлорамфеникол. Как правило, лекарственная лихорадка развивается на 6-8 сутки от начала терапии и почти всегда разрешается спустя 48-72 часа после отмены антибиотика. Нередко лекарственная лихорадка сопровождается эозинофилией, лейкоцитозом, ускорением СОЭ, тромбоцитопенией, зудящими высыпаниями. Многоформная экссудативная эритема характеризуется развитием полиморфных эритематозных высыпаний, нередко спустя 10-14 дней после начала применения антибиотика. Сыпь, обычно симметричная, локализуется на дистальных участках конечностей, реже имеет распространенный характер, представлена множественными округлыми папулами (реже пузырьками), которые образуют кольцевидные высыпания. Вакцины. Понятие, современная классификация вакцин: живые, инактивированные, анатоксины, субклеточные, субвирионные (из протективных антигенов), рекомбинантные, дивергентные, трансгенные. Достоинства и недостатки различных типов вакцин. Вакцина – это медицинский или ветеринарный препарат, предназначенный для создания иммунитета к инфекционным болезням. Вакцина изготавливается из ослабленных или убитых микроорганизмов, продуктов их жизнедеятельности или из их антигенов, полученных генно-инженерным или химическим путем  Субъединичные вакцины. — Представляют собой отдельные антигены возбудителей, извлеченные из бактерий и вирусов химическими (спирт, кислота и др.) или физическими методами (дезинтеграция ультразвуком), максимально очищенные, но мало иммуногенные. Химические (субклеточныеисубвирионные) вакцины. компонентные или субклеточные (бактериальные) субъединичные или субвирионные (вирусные). ► К субк леточны м вакцинам относятся. менингококковые и пневмококковые вакцины, приготовленные из полисахаридных антигенов капсул; ► к субвирионны м - гриппозная на основе. гемагглютитина и нейраминидазы. Дивергентные вакцины. В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Рекомбинантные вакцины - относятся к новому поколению иммунных препаратов, произведенных посредством встраивания антигена вируса в геном дрожжевых клеток. Трансгенные вакцины- препараты созданные на основе трансгенных растений путем интеграции гена в ядерную хромосому  Преимущества и недостатки Живые вакцины Преимущеста высокая прочность и длительность создаваемого ими иммунитета возможность выбора разных путей введения в организм человека (не только путем подкожного введения, но и накожного, перорального, интраназального) Недостатки Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма.  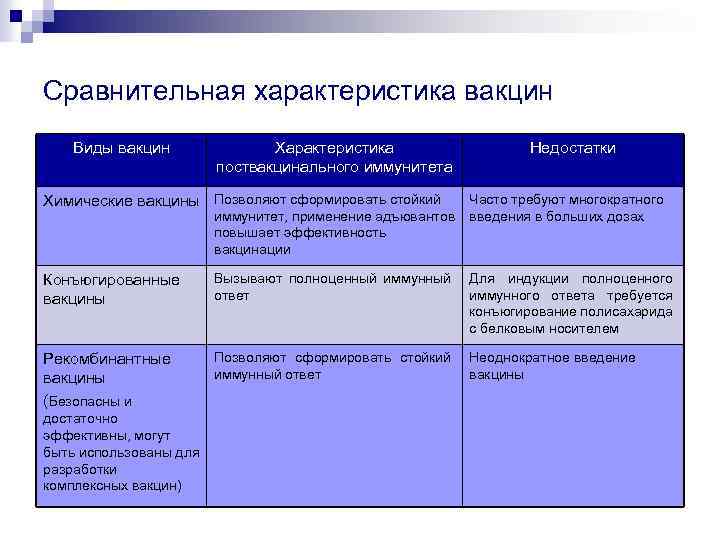 Адъюва́нт — соединение или комплекс веществ, используемое для усиления иммунного ответа при введении одновременно с иммуногеном. Анатоксины достоинства- выработка иммунитета против нескольких инфекций Недостатки анатоксинов — индуцируют только антитоксический иммунитет, что не исключает возможности возникновения локализованных болезней у привитого, а также носительство им возбудителей данного заболевания. Трансгенные- Преимущества: Меньше побочных эффектов, так как не содержат микроорганизмов Вызывают узкоспецифический иммуитет Возможно комплектование по иммуногенным свойствам Недостатки возможность проявления мутаций , развитие аллегрических реакций, Анатоксины, их получение и практическое применение  Применяют против столбняка , дизентерии, газовой гангрене , ботулизма ,стафилококковой инфекции Способы изготовления и введения вакцин. Адъюванты.    Штаммы выращивают на жидких питательных средах (гидролизаты казеина и др белково –углеродные среды)   Сыворотки антитоксические и антимикробные, гомологичные и гетерологичные, их получение, очистка, титрование и применение.  Для получения гомологичных нечужеродных иммунных сывороток используют сыворотки переболевших людей (коревая, паротитная, оспенная сыворотки) или специально иммунизированных людей-доноров (противостолбнячная, противоботулини-ческая и другие сыворотки) либо СЫВОРОТКИ из плацентарной, а также абортной крови, содержащие антитела к ряду возбудителей инфекционных болезней вследствие вакци¬нации или перенесенного заболевания. Естественно, что гомологичные сыворотки предпочтительнее гетерологичных. Поскольку нативные иммунные сыворотки содержат в своем составе ненужные балластные белки, например альбумин, из этих сывороток выделяют и подвергают очистке и концентрированию специфические белки — иммуноглобулины. Для очистки и концентрирования иммуног-лобулинов используют различные физико-химические методы: осаждение спиртом или ацетоном на холоде, обработка ферментами, аффинная хроматография, ультрафильтрация. Титрование антитоксических сывороток может производиться тремя методами: по Району, Эрлиху и Ремеру: Метод Района. Осуществляется с помощью реакции флоккуляции по известному анатоксину или токсину, одну Lf которых нейтратизует одна единица антитоксина. Первичная, или инициальная, реакция флоккуляции наступает при соответствии количества антигенных единиц анатоксина количеству антитоксинов в исследуемой сыворотке. Исходя Из результатов первичной реакций флоккуляции и ведут расчет антитоксических единиц в 1 мл испытуемой сыворотки. Однако метод Района является только ориентировочным. Метод Эрлиха. Перед титрованием сывороток определяют условную смертельную (опытную) дозу токсина. За опытную дозу токсина (Lt) принимается то его количество, которое в смеси с 1 ME стандартной сыворотки вызывает гибель 50% взятых в опыт животных. На втором этапе титрования к различным разведениям испытуемой сыворотки добавляют опытную дозу токсина, смесь выдерживают 45 мин и вводят животным. По получаемым результатам производят раечет титра испытуемой антитоксической сыворотки. Метод Ремера. Титрование также осуществляется в два этапа, но данный метод является более экономичным, так как опыт проводится на одном животном. Предварительно определяется опытная некротическая доза токсина — Ln (Limes necrosis) введением внутрикожно морской свинке различного количества токсина со стандартной сывороткой. За некротическую дозу токсина принимается то его наименьшее количество, которое при внутрикожном введении морской свинке в смеси с 1/50 ME стандартной антитоксической сыворотки вызывает на месте введения некроз на 4—5-й день. Затем различные объемы испытуемой сыворотки в смеси с оттитро ванной некротической дозой токсина вводят внутрикожно морской свинке и по результатам производят расчет титра сыворотки. По методу Ремера титруется противодифтерийная сыворотка. Сывороточные препараты делятся: Гетерологичные (полученные из крови животных) Гомологичные (полученные из крови человека) Гетерологичные: Иммунизация животных Высокая концентрация антител Неограниченный подбор продуцентов Высокая иммуногенность (чужеродность) - особое внимание при использовании Гомологичные: Не иммуногенны Из донорской или плацентарной крови Концентрация АТ не велика. При этом могут содержать другие АТ. Антибактериальные сыворотки: Иммунизируют лошадей, ослов. Малоэффективны. Противосибиреязвенная Противочумная Противолептоспирозная Противогриппозная Антитоксические: Иммунизируют лошадей. Эффективны. Противодифтерийная Противостолбнячная Противогангренозная Противоботулиническая Проивостафилококковая Вводят по Безредке 12. Иммуноглобулины нормального и направленного действия, их приготовление и применение. Это высокоочищенные концентрированные гамма-глобулины людей и животных. 2 вида: Нормальные (получают из донорской, абортивной, плацентарной крови) Противокоревой Полиомиелитный Против коклюша 2. Направленного действия (получают из иммунных сывороток людей-доноров и животных) Против бешенства Против оспы Против столбняка Побочные эффекты при серотерапии и их профилактика. Работы А. М. Безредко. Побочные эффекты серотерапии: развитие аллергических реакций (анафилактический шок, сывороточная болезнь, феномен Артюса). Гомологичные сыворотки вводят сразу в полной дозе, гетерологичные – по методу Безредки. Вначале внутрикожно вводят 0,1 мл разведенной (1:100) нормальной лошадиной сыворотки и наблюдают за реакцией в течение 20 мин. Проба считается положительной, если диаметр папулы достигает 1 см. и более. При отрицательном результате пробы подкожно вводят 0,1 мл неразведенной сыворотки, и если в течении 30 мин реакция отсутствует, внутримышечно вводят остальное количество препарата. Артюса феномен (N. M. Arthus, 1862—1945, французский иммунолог) — местная гиперергическая воспалительная реакция с некрозом тканей, вызываемая преципитацией комплекса аллерген + антитело в сосудистой стенке и тканях Сывороточная болезнь — аллергическая реакция на гетерологичные сыворотки или ЛС, характеризующаяся лихорадкой, артралгиями, высыпаниями на коже и лимфаденопатией, проявляющаяся через 5–12 сут после применения аллергена. Анафилакти́ческий шок (от др.-греч. ἀνά- «против-» и φύλαξις «защита») — аллергическая реакция немедленного типа, состояние резко повышенной чувствительности организма, развивающееся при повторном введении аллергена.  Аллергены, их приготовление и применение. Принцип аллергологической диагностики инфекционных заболеваний. Для диагностики и лечения аллергических заболеваний из экзогенных А. готовят препараты, которые также получили название «аллергены». Общий принцип их приготовления: Из сложных по составу продуктов готовят водно-солевые экстракты. Экстрагирующей жидкостью обычно служит раствор хлористого натрия, стабилизированный фосфатным буфером с рН = 7,0 — 7,2 с добавлением 0,4% раствора фенола. А. из простых хим. веществ готовят, разводя их в различных растворителях. Полученные экстракты освобождают от взвешенных частиц фильтрованием или центрифугированием. Далее фильтрат или надосадочную жидкость стерилизуют фильтрованием через фильтр Зейтца. Полученный таким образом фильтрат (аллерген) проверяют на стерильность, безвредность и специфичность. Для проверки на стерильность вносят по 0,5 мл экстракта на различные питательные среды и следят за посевами 8 дней. Стерильный экстракт разливают в инсулиновые флаконы и снова проверяют его на стерильность. Следующий этап — проверка на безвредность, для чего экстракт вводят белым мышам. Если мыши остаются живыми в течение 4 дней, А. считается безвредным. Специфичность проверяют на здоровых и чувствительных к данному А. людях. У здоровых лиц А. должен давать отрицательную кожную пробу, а у больных — положительную Основной принцип специфической диагностики аллергических заболеваний - выявление причинно-значимого аллергена, для чего проводят тесты in vivo и определяют аллерген-специфические IgE антитела или сенсибилизированные лимфоциты и продукты специфического взаимодействия антигенов и антител.  Бактериофаги. Практическое применение в микробиологии и медицине, достоинства и недостатки, конкретные примеры.  Используют в биотехнологии и генной инженерии для получения рекомбинантной ДНК и штаммов микроорганизмов с практическими полезными характеристиками и свойсвтами Фагодиагностика. Бактериофаги используются при диагностике сибирской язвы, брюшного тифа, дизентерии и других инфекционных заболеваний. Фагопрофилактика – это предупреждение бактериальных инфекций путем применения бактериофагов. В профилактических целях бактериофаг используется в тех случаях, когда возбудитель известен. Ф Фаготерапия – это способ лечения некоторых бактериальных инфекций (брюшного тифа, дизентерии, холеры и др.) специфическими бактериофагами  Контроль, хранение и применение иммунобиологических препаратов.  Иммунобиологическими называют препараты(вакцина) которые оказы-вают влияние на иммунную систему, действуют через иммунную систему или принцип действия которых основан на иммунологиче-ских реакциях. Благодаря этим свойствам иммунобиологические препараты применяют для профилактики, лечения и диагностики инфекционных и тех неинфекционных болезней, в генезе которых играет роль иммунная система. Побочное действие иммунобиологических препаратов: местные и общие реакции, их проявления и меры предупреждения. ХЗ Виды побочных действий вакцин: иммунофармакологическое действие вакцин , вакцинальный инфекционный процесс , образование антител к непротективным антигенам вакцин, аллергия ( частый побочный эффект, вызываемый как антигенами вакцины , так и различными примесями и добавками ) , иммуномодулирующее действие вакцин , иммунодефицитные состояния ( чаще транзиторные иммунодефицитные состояния) , психогенное действие вакционации. |
