Вариант 7. Тема строение атома
 Скачать 0.61 Mb. Скачать 0.61 Mb.
|
|
Вариант 7 ТЕМА 1. СТРОЕНИЕ АТОМА 1.1.7, 1.2.7, 1.3.7, 1.4.7, 1.12 ТЕМА 2. ХИМИЧЕСКАЯ СВЯЗЬ 2.1.7, 2.2.7, 2.3.7, 2.4.7, 2.12 ТЕМА 3-4. ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ 3.1.7., 3.2.7, 3.6.7, 3.32.7, 3.10 Химическая кинетика 4.1.8, 4.3.8, 4.4.8 ,4.5.8.,4.12 ТЕМА 5. РАСТВОРЫ. ДИСПЕРСНЫЕ СИСТЕМЫ 5.1.7, 5.2.7, 5.3.7, 5.4.7, 5.5.7 ТЕМА 6. ОСНОВЫ ЭЛЕКТРОХИМИИ 6.1.7, 6.2.7, 6.3.7, 6.4.7, 6.5.7 ТЕМА 1. СТРОЕНИЕ АТОМА 1.1.7, 1.2.7, 1.3.7, 1.4.7, 1.12 1.1.Дано значение одного из четырех квантовых чисел. Составьте таблицу значений четырех квантовых чисел: n, ln, me,ms. Приведите характеристику каждого квантового числа и его возможные значения. l = 0 Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .) Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов). Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz. Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы: ↑ и ↑. Для l= 0 в таблицу проставляем все возможные значения остальных квантовых чисел.
1.2. Для элемента напишите распределение электронов в нормальном и возбужденном состоянии. Укажите валентные электроны. Определите число протонов и нейтронов у данного атома. 42Mo Распределение электронов для атома Mo в нормальном состоянии напишем согласно правилу Клечковского, то есть с учетом энергии каждого уровня и подуровня: 42 Mo молибден 1s 22s 22p 63s 23p64s 23d104p65s14d5. Для проявления возбужденного состояния нарисуем электронную формулу валентного слоя: 4d 5s       Поскольку в нормальном состоянии у атома Мо имеется все электроны распарены, то возбужденное сотсояние совпадает с валентным. Протон (р) - это частица, имеющая массу 1,67.10-27 кг и положительный заряд. Нейтрон (n) - незаряженная частица, обладающая массой 1,67.10-27 кг. Число протонов в ядре характеризует его заряд (z) и принадлежность атома данному химическому элементу, соответствует порядковому номеру элемента. Его пишут слева внизу у символа элемента. Сумму протонов (z) и нейтронов (n), содержащихся в ядре атома, называют массовым числом (А), А = z + n. Массовое число обычно пишут слева вверху у символа элемента. Следовательно, у атома свинца 96 42Mo имеется 42 протона и 54 нейтронов. 1.3. Напишите распределение электронов для 73Ta 83Bi. Определите, к каким периоду, группе, семейству они относятся, укажите их валентные электроны. Объясните, в чем сходство и различие элементов с учетом следующих параметров: возможные степени окисления, радиус атома, энергия ионизации, относительная электроотрицательность, восстановительная и окислительная способности. 73Ta 83Bi Напишем распределение электронов: 73Ta тантал 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 83Bi висмут 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 Выпишем отдельно валентные электроны: для 83Bi это 6p3, для тантала 73Ta - 5d3. Поскольку у Вi последним заполняется p-подуровень, этот элемент относится к p-семейству. У тантала идет заполнение d-подуровня, следовательно, это d элемент. Валентный слой Bi содержит 3 электрона, представим его графически: П 6р    6s   ри возбуждении степени окисления −3, +1, +2, +3, +4, +5 6d 6p 6s       У тантала 5d 6s ↑ ↓    П 6p  6s  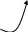 6d ри возбуждении происходит распаривание 6s электронов и переход на 6p подуровень. С    тепени окисления будут 0; +3; +5. Эти элементы относятся к металлам, являются восстановителями, склонны к образованию соединений с ковалентной связью. При нормальных условиях тантал малоактивен, на воздухе окисляется лишь при температуре свыше 280 °C, покрываясь защитной плёнкой Ta2O5; с галогенами реагирует при температуре свыше 250 °C. При нагревании реагирует с С, В, Si, P, Se, Те, Н2О, СО, СО2, NO, HCl, H2S. Химически чистый тантал исключительно устойчив к действию жидких щелочных металлов, большинства неорганических и органических кислот, а также многих других агрессивных сред (за исключением расплавленных щелочей). В отношении химической устойчивости к реагентам, тантал подобен стеклу. Тантал нерастворим в кислотах и их смесях, его не растворяет даже царская водка. Растворим только в смеси плавиковой и азотной кислот. Реакция с плавиковой кислотой идет только с пылью металла и сопровождается взрывом. Очень устойчив к воздействию серной кислоты любой концентрации и температуры, устойчив в обескислороженных расплавленных щелочных металлах и перегретых парах их (литий, натрий, калий, рубидий, цезий). При комнатной температуре в среде сухого воздуха не окисляется, но в среде влажного воздуха покрывается тонкой плёнкой оксида. Нагрев до температуры плавления приводит к окислению висмута, которое заметно интенсифицируется при 500 °C. При достижении температуры выше 1000 °C сгорает с образованием оксида Bi2O При нагревании с концентрированной серной кислотой растворяется с образованием BiH(SO4)2, тогда как с разбавленной серной кислотой растворяется с образованием сульфата висмута: Взаимодействие висмута с фтором, хлором, бромом и йодом сопровождается образованием различных галогенидов: С металлами способен образовывать интерметаллиды — висмутиды 1.4. Объясните, что характеризуют и как изменяются радиус атома, энергия ионизации, восстановительная способность, сродство к электрону, электроотрицательность а) по периоду слева направо (табл. 1.5); б) по группе сверху вниз (табл. 1.6). а) 38Sr - 53I, б) 24Cr - 74W. а) В периодах 38Sr - 53I атомные радиусы по мере увеличения заряда ядра, в общем, уменьшаются, так как при одинаковом числе электронных слоев возрастает заряд ядра, а следовательно, притяжение им электронов. По периоду 38Sr - 53I энергия ионизации немонотонно возрастает. В периодах 38Sr - 53I сродство к электрону и окислительные свойства элементов возрастают, в группах уменьшаются. В периодах наблюдается общая тенденция роста величины электроотрицательности. В пределах каждой подгруппы элементов, как правило, радиусы атомов увеличиваются сверху вниз, так как возрастает число электронных уровней. Б) В пределах каждой подгруппы 24Cr - 74W элементов, как правило, радиусы атомов увеличиваются сверху вниз, так как возрастает число электронных уровней. Сродство к электрону и окислительные свойства элементов возрастают, в группах 24Cr - 74W . Величина электроотрицательности падает. В пределах одной группы с увеличением порядкового номера энергия ионизации обычно убывает, что связано с увеличением расстояния внешнего электронного уровня от ядра. 1.12. Природный хлор содержит два изотопа: 35Cl и 37Cl. Относительная атомная масса хлора равна 35,45. Определите молярную долю каждого изотопа хлора. 35x + 37y = 35,45 x+y=1 y=1-x 35x + 37(1-x) = 35.45 37x-35x=37-35,45 2x=1.55 x=0,775 y=1-0.775=0,225 Ответ: т. е. изотопов 3517Cl в газе 77,5%, 3517Cl в газе 22,5%. ТЕМА 2. ХИМИЧЕСКАЯ СВЯЗЬ 2.1. Напишите электронную формулу атома I указанного элемента в устойчивых степенях окисления. Приведите примеры соединений элемента в этих степенях окисления. Для хрома характерны следующие степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII). Электронные формулы иода в этих степенях окисления следующие: I(0) йод 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 I(I) йод 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 I(II) йод 1s 22s 22p 63s 23p64s 23d104p65s24d105p3 I(V) йод 1s 22s 22p 63s 23p64s 23d104p65s24d105p0 I(VII) йод 1s 22s 22p 63s 23p64s 23d104p65s04d105p0 Нулевая степень окисления иода проявляется в простом веществе. Степень окисления +1 иод имеет в солях типа CaI2 и др. Примером соединения иода в степени окисления +2 может служить иодноватистая кислота (HIO). Степень окисления +5 в иодноватой HIO3, +6 в иодной HIO4 кислоте. 2.2. С позиций метода ВС покажите образование предложенной Молекулы BeBr2. Какие орбитали соединяющихся атомов участвуют в образовании связей? Сколько σ- и π-связей содержит молекула? Какова пространственная структура молекулы? Каков тип гибридизации центрального атома в указанном соединении (если есть)? Отметьте полярность связей и полярность молекулы в целом. О 2s пределяем тип гибридизации центрального атома. Для этого выписываем валентные электроны центрального атома 4Be.   З 2p  атем электроны переводим в возбужденное состояние 2s  Отмечаем, что у Be имеются две внешние орбитали: s и р. Далее "подводим" валентные электроны 35Br. 4р       4s Для образования устойчивой молекулы в центральном атоме происходит процесс гибридизации валентных орбиталей, который показан на рис.. 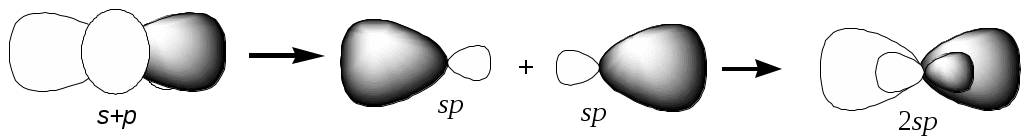 Таким образом по аналогии: s + p = 2sp. Гибридные орбитали центрального атома – это заряженные поля и, отталкиваясь, они располагаются под определенным углом (валентный угол), чтобы образовалась устойчивая молекула: при гибридизации типа sp валентный угол составляет 180 о. В молекуле BeBr2 реализуется sp-гибридизация, и валентный угол составляет 180 о. Чтобы изобразить молекулу в целом, остается показать перекрывание полученных гибридных орбиталей центрального атома с валентными орбиталями боковых атомов. В случае рассматриваемой молекулы BeBr2 боковым атомом является 53I. Так как это р-элемент, то его валентные наружные электроны имеют орбиталь в виде гантели. В случае, если это будет s-элемент, то форма орбитали в виде шара. "Подводя" валентные орбитали йода к гибридным орбиталям бериллия, получаем схему молекулы BeBr2 (рис. 2.4). Br Be Br  В случае BeBr2 в молекуле две ковалентные связи σ-типа. В случае молекулы BeBr2 более электроотрицательным элементом является бром (2,96), Be(1,57). Поэтому связь Be–Br является полярной. Однако в целом молекула неполярна, так как при наличии двух диполей оттягивание электронов идет в обе стороны одинаково, и дипольные моменты взаимно компенсируются. Рассматриваемая молекула BeBr2 имеет линейную форму. 2.3. Используя значения относительной электроотрицательности атомов BeO, MgO, CaO, SrO, расположите указанные соединения в порядке возрастания ионности связи. К какому из соединяющихся атомов смещено электронное облако и почему? Р е ш е н и е О степени ионности связи можно судить на основе разности относительных электроотрицательностей атомов: ОЭО: O - 3,5; Be – 1,47; Mg -1,23; Ca - 1,04; Sr - 0,99. Связь: BeO MgO CaO SrO ∆ОЭО: 2,03 2,27 2,46 2,51 Следовательно, в порядке возрастания ионности связей указанные молекулы можно расположить в ряд: BeO – MgO – CaO - SrO; электронная плотность при образовании химической связи смещается к более электроотрицательному атому. Поэтому в BeO электронная плотность смещена к O; в MgO - к O; в CaO - к O; в SrO - к O. 2.4. В указанном комплексном соединении [Co(NH3)5Cl]Cl2 отметьте комплексообразователь, лиганды, внутреннюю и внешнюю сферы; определите степень окисления комплексообразователя и координационное число. Напишите уравнение диссоциации комплекса, приведите выражение константы нестойкости (Кнест). Назовите это соединение.
В соответствии с правилами ИЮПАК соединение называется пентаамминохлоркобальта (III) хлорид. 2.12. Определите степени окисления элементов в следующих соединениях: Ca 2+Cr4+ O-24, Sr 2+(Cl+ O-2)2, F- 2O 2+,Са2+ 3(Р5+ О2- 4)2, N3+ H +4N 5+O 2-3, Fe3+ 2(S6+ O2- 4)3. |