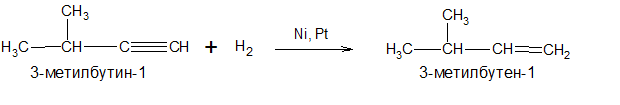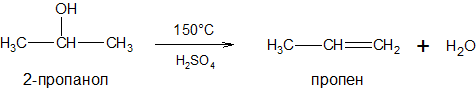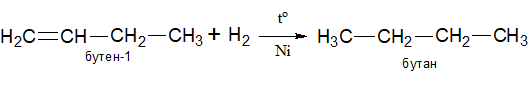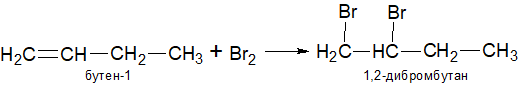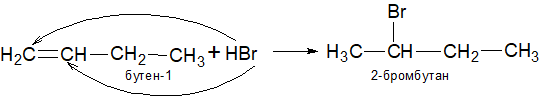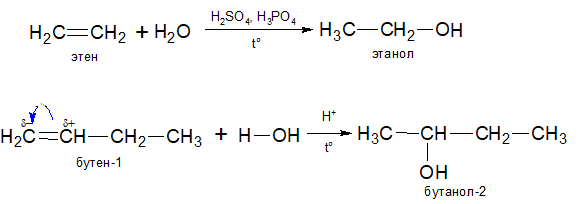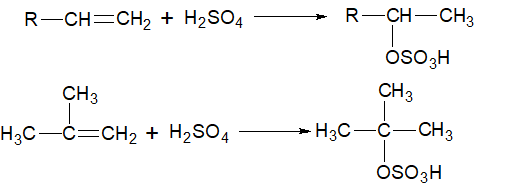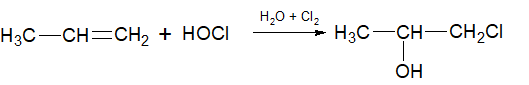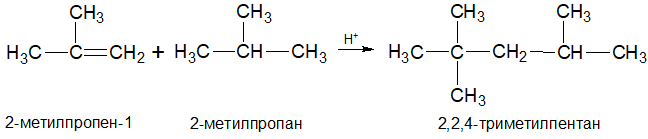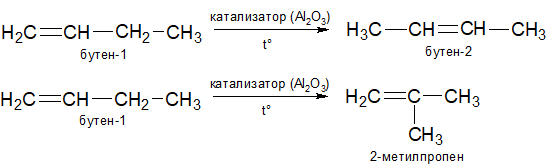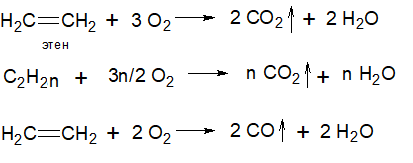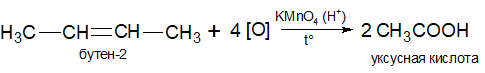|
|
Способы получения и свойства алкенов имеют существенные отличия. Термический крекинг алканов. При Т450700С разложение алканов приводит к образованию более низкомолекулярных алканов и алкенов C14H30 C7H16 C7H14 Механизм реакции свободнорадикальный. Дегидрирование алканов
Способы получения и свойства алкенов имеют существенные отличия по сравнению с алканами. Двойная связь в составе углеродной цепи алкенов очень реакционноспособна, поэтому они охотно вступают в реакции присоединения, в отличие от алканов, для которых характерны реакции замещения. Далее подробно рассмотрим способы получения, физические и химические свойства алкенов.
Физические свойства алкенов
Физические свойства алкенов, такие как температура плавления и кипения немного ниже температуры кипения соответствующих алканов.
Первые представители данного класса с C1по C4 — газообразные вещества, практически не имеющие запаха, C5-C17 – жидкости с резким запахом, более 17 атомов углерода – твердые вещества.
Растворимость. Они плохо растворимы в воде, и хорошо растворимы в органических соединениях. Их плотность меньше плотности воды.
Алкены-неполярные соединения, практически нерастворимые в воде и растворимые в органических растворителях. Они менее плотные, чем вода.
Температура плавления и кипения. Температура кипения/плавления увеличивается прямо пропорционально относительной молекулярной массы соединения. В таблице представлены некоторые физические характеристики алкенов, а на рисунке зависимость температур их кипения/плавления от числа углеродных атомов.

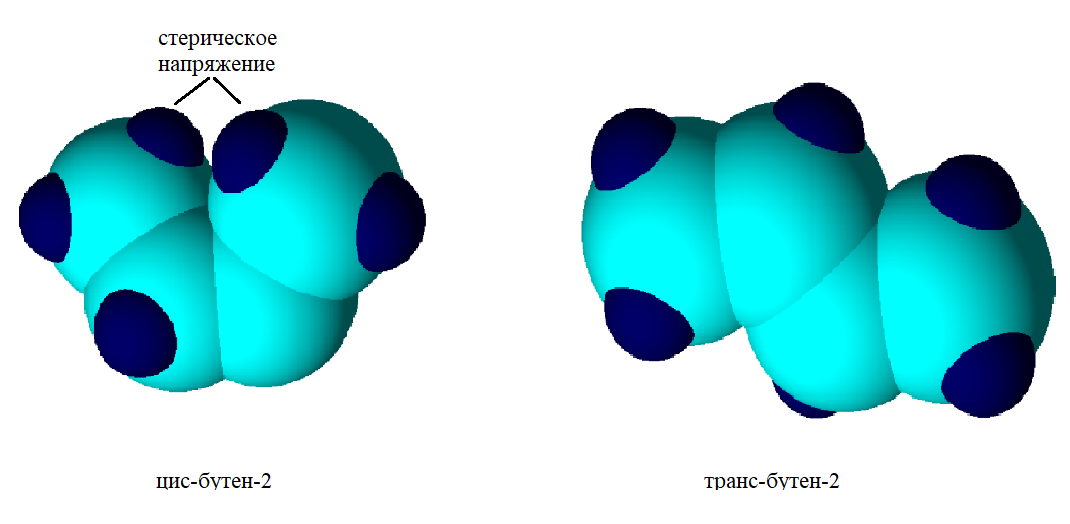
Устойчивость алкенов. В целом цис-алкен менее устойчив, чем его стерео транс-изомер. Это обусловлено нестабильностью цис-изомера вследствие влияния стерического фактора.
Получение алкенов.
Алкены получают следующими способами:
1.Термический крекинг алканов. При Т=450-700°С разложение алканов приводит к образованию более низкомолекулярных алканов и алкенов:
C14H30 = C7H16 + C7H14
Механизм реакции – свободно-радикальный.
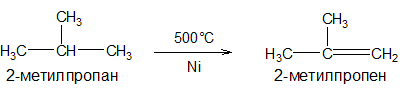
2.Дегидрирование алканов. Реакция протекает в присутствии катализаторов Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO при Т500°С:
3.Неполное гидрирование алкинов в присутствии катализатора (Ni, Pt, Pd) при T
150°С.
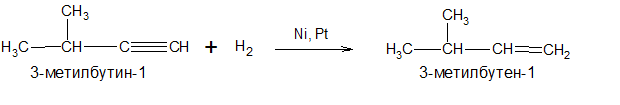
4.Реакция отщепления (элиминирование)– дегидратация, дегалогенирование, дегидрогалогенирование.
Дегидратация спиртов при Т≥ 150°С, в присутствии водоотнимающего агента — серной кислоты:
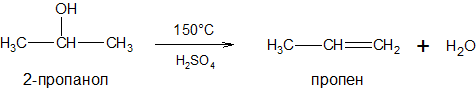
Дегидрогалогенирование моногалогеналкановпод действием спиртового раствора щелочи:
Дегалогенирование дигалогеналканов при действии активных металлов:
При протекании реакций элиминирования с участием спиртов и моногалогеналканов отщепление атома водорода происходит от менее гидрогенизированного атома углерода (т.е. того атома углерода, который соединен с наименьшим числом атомов водорода). Это правило известно, как правило Зайцева.
Химические свойства алкенов.
Химические свойства алкенов обусловлены наличием двойной связи, которая состоит из сильной сигма (σ) связи и слабой пи (π) связи. Типичные реакции алкенов протекают с разрывом этой более слабой π-связи и формированием двух σ-связей. При взаимодействии электофильного агента (E+) с алкеном образуется очень реакционноспособный карбкатион,который очень быстро присоединяет нуклеофильный агент (Nu—):
1 стадия – образование карбкатиона протекает медленно:
2 стадия – присоединение нуклеофила протекает очень быстро:
Реакции присоединения
1.Гидрирование алкенов в присутствии платинового или никелевого катализатора. Реакция является экзотермической.
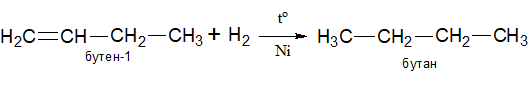
2.Галогенирование алкеновв инертном растворителе, например, четыреххлористый углерод. Алкены реагируют с галогенами с образованием дигалоалканов. Реакционная способность галогенов уменьшается в ряду: хлор > бром > йод.
Для обнаружения двойной углерод-углеродной связи используют бром. При добавлении к алкену 5% раствора брома в тетрахлорметане, последний обесцвечивается, что указывает на наличие двойной связи в молекуле.
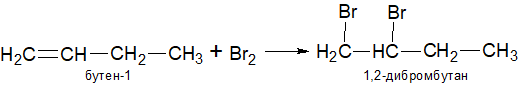
3.Гидрогалогенирование алкенов концентрированными водными растворами галогенводородов. Реакционная способность растет в ряду HI > HBr > HCl.
Симметричные алкены дают только один продукт из-за эквивалентности двух атомов углерода.
В несимметричных алкенах добавление галогенводорода происходит таким образом, что атом галогена (отрицательная часть молекулы) присоединяется к атому углерода, который соединен с меньшим количеством атомов водорода (т.е. наименее гидрогенезированный). Это правило известно как правило Марковникова (1869 г.):
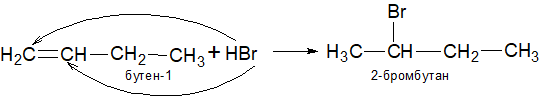
Однако в некоторых случаях присоединение галогенводорода происходит против правила Марковникова. Например, в присутствии кислорода и пероксидов проявляется пероксидный эффект:
Присоединение против правила Марковникова может также идти в случае наличия в молекуле алкена электронноакцепторных групп, например, -СООН, –СN, –CHal3 (Hal–галоген), –C(O)–R, –COOR, –NO2, –N=O, –SO3H и т.п.:
4.Гидратация алкенов в присутствии разбавленных кислот и катализатора. Например, при пропускании смеси этена и пара над фосфорной кислотой и кремнеземом под давлением 65 атм, а при 300С получают этанол.
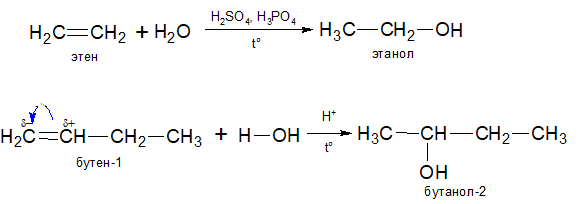
5.Сульфирование алкенов концентрированной серной кислотой протекает в соответствии с правилом Марковникова:
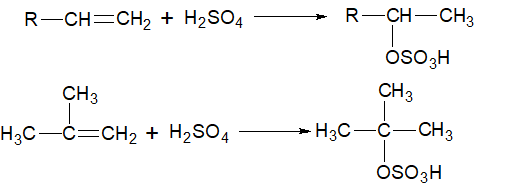
6.Гипогалогенирование алкенов происходит по правилу Марковникова:
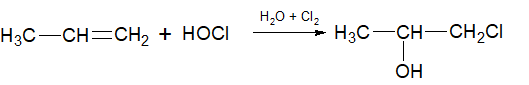
7.Алкилирование алкенов в кислой среде:
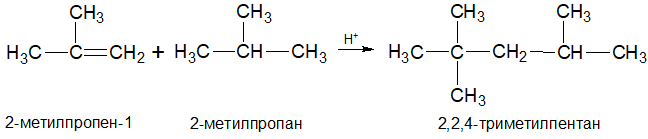
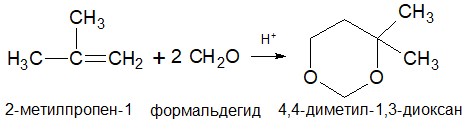
8.Присоединение альдегидов алкенами (реакция Принса):
Изомеризация алкенов
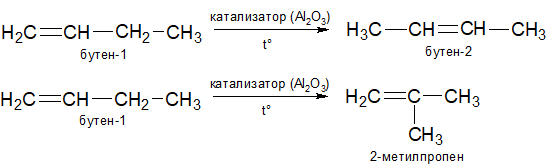
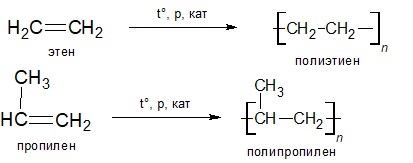
Полимеризация алкенов.
Полиприсоединение — это процесс, с помощью которого большое количество молекул одного вида объединяются (без выделения простых молекул, таких как НHal, Н2О и т.д.) для образования гигантской молекулы, называемой полимером. Алкены подвергаются полимеризации при нагревании под давлением в присутствии подходящих катализаторов. Например, при нагревании этена до 1000оС под давлением 1000 атм. в присутствии кислорода получают полиэтилен.
Реакции окисления.
Окисление алкенов происходит легко, но продукт окисления зависит от окисляющего агента. Существует множество вариантов окисления алкенов. Рассмотрим основные из них:
Горение алкенов. Алкены, как и алканы, очень горючие. Алкены горят светящим пламенем. Реакции их горения являются экзотермическими.
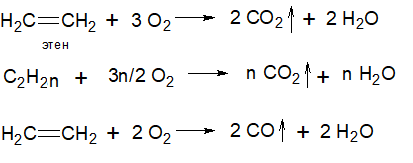
Окисление кислородом воздуха при Т=200-500оС, в присутствии серебряного катализатора или надкислотами (реакция Прилежаева) ведет к образованию эпоксидов:
Окисление алкенов под действием холодного щелочного раствора перманганата калия приводит к образованию дигидроксильных соединений (диолы или гликоли). Перманганат калия при этом обесцвечивается, поэтому реакция является качественной на присутствие кратных связей. Такая реакция носит имя Вагнера:
Окисление алкенов под действием подкисленного раствора перманганата или бихромата калия или окиси хрома (III) приводит к образованию кислоты и кетона:
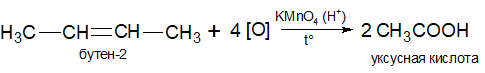
Озонирование алкенов приводит к образованию озонидов, которые далее под действием воды в присутствии восстановителя образуют альдегиды (Реакция Гарриеса). Окисление алкенов озоном с последующим разложением образовавшегося озонида водой называют озонолизом. Характер продуктов (альдегидов и кетонов), образующихся вследствие озонолиза, зависит от расположения двойной связи в материнском алкене. Поэтому такая реакция обеспечивает очень удобный способ определения положения двойной связи в любой молекуле:
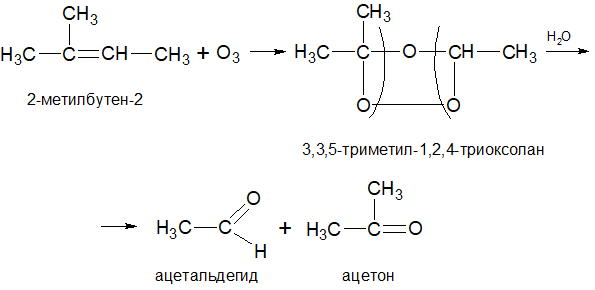
Более высокомолекулярные алкены, содержащие длинную С-С цепь, обладают алкан-подобной структурой. Вследствие этого они могут вступать в реакции замещения подобно алканам.
Где применяются представители ненасыщенных соединений -алкены? Этилен — ценное сырье для химического производства. Из него получают стирол, винилхлорид, этанол, уксусный альдегид, уксусную кислоту, и также дихлорэтан.
Полимеризацией алкенов получают различные полимеры, смазочные материалы и резиновые изделия.
В среднем мировое производство полиэтилена составляет 100 миллионов тонн в год. В промышленных объемах из пропилена получают полипропилен. Кроме того, пропилен — стартовый материал для производства окиси, изопропилового спирта, кумола, бутиральдегида, глицерина.
Бутены, главным образом, необходимы производстве полиизобутилена, метилэтилкетона, бутилкаучука, изопрена. Изобутилен — превосходное химическое сырье для производства третичного бутанола, бутилкаучука, а также изопрена. Применяется при алкилировании фенолов для изготовления сурфактантов (особые вещества, покрывающие альвеолы легких).
Сополимеры с бутенами используются в качестве изолятора и добавок для масел.
Высшие алкены используются не только в производстве полимерных материалов, но также и в производстве высших органических спиртов. |
|
|
 Скачать 219.04 Kb.
Скачать 219.04 Kb.