Вопрос 1 . Строение атома. Постулаты Бора.
Состав атома.
Атом состоит из атомного ядра и электронной оболочки.
Ядро атома состоит из протонов (p+) и нейтронов (n0). У большинства атомов водорода ядро состоит из одного протона.
Число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов).
Постулаты Бора
Квантовые постулаты Бора – предположения(утверждения), сделанные Н. Бором для того, чтобы модель строения атома Резерфорда соответствовала реальному поведению атомов водорода; Правило квантования орбит – правило, по которому электрон движется по орбитам, момент импульса которых равен целому числу постоянной Планка (с чёрточкой); главное квантовое число – целое число, равное соответствующему номеру состояния атома
Первый постулат Бора, носящий название постулата стационарных состояний, гласит: атомная система может находиться только в особых стационарных либо квантовых состояниях, каждому из которых соответствует некоторая энергия En. Когда атом находится в стационарном состоянии, электромагнитные волны атома отсутствуют.
Второй постулат Бора звучит следующим образом: если атом переходит из стационарного состояния с большей энергией En в стационарное состояние с меньшей энергией Ek, то разность этих энергий может высвободиться в виде излучения. В таком случае излучается фотон с энергией: hv = En – Ek
Вопрос 2. Волновое уравнение. Квантово-механическое объяснение строения атома.
Волновое уравнение - линейное дифференциальное уравнение в частных производных, описывающее изменение в пространстве (в общем случае, в конфигурационном пространстве) и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах..
Квантово-механическое объяснение строения атома.. В основе квантово механической теории строения атома лежит планетарная модель Э. Резерфорда, согласно которой атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов. Согласно современным представлениям, ядро атома состоит из элементарных частиц двух видов - протонов и нейтронов.
Вопрос 3.Квантовые числа, обозначения орбиталей. Заполнение электронных оболочек многоэлектронных атомов: принцип запрета Паули, правило Хунда, правила Клечковского. Закономерности заполнения электронных оболочек атомов химических элементов.
Квантовое число в квантовой механике — численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние этого объекта. Задание всех квантовых чисел однозначно и полностью характеризует состояние частицы.
Например, состояние электрона в атоме и вид описывающей его волновой функции могут быть охарактеризованы четырьмя квантовыми числами: главным (n), орбитальным (l), магнитным (m) и спиновым (ms).
Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы (n = 1,2,3, … ∞) и определяет общую энергию электрона на данной орбитали (энергетический уровень) :
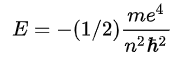
Энергия для n соответствует энергии одноэлектронной ионизации для данного энергетического уровня.
Орбитальное квантовое число (называемое также азимутальным или дополнительным квантовым числом) определяет момент импульса электрона и может принимать целые значения от 0 до n — 1 (l = 0,1, …, n — 1). Момент импульса при этом задаётся соотношением
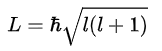
Атомные орбитали принято называть по буквенному обозначению их орбитального числа:
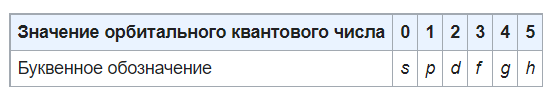
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах: s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
Магнитное квантовое число ml определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от -l до l, включая 0 (ml = -l … 0 … l):
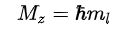
Принцип запрета Паули — это квантово-механический принцип, который гласит, что два или более идентичных фермиона (частицы с полуцелым спином) не могут одновременно находиться в одном и том же квантовом состоянии в квантовой системе. Этот принцип был сформулирован австрийским физиком Вольфгангом Паули в 1925 году для электронов, а затем распространился на все фермионы в его теореме о связи спина со статистикой в 1940 году.
Для случая электронов в атомах его можно сформулировать следующим образом: невозможно, чтобы два электрона многоэлектронного атома имели бы одинаковые значения четырёх квантовых чисел n, (главное квантовое число), l (орбитальное квант число), m (магнитное квантовое число) и ms, (квантовое число проекции спина). Например, если два электрона находятся на одной орбитали, то их значения для тройки квантовых чисел n, l, m — одинаковы, поэтому значения ms должны различаться, и, таким образом, электроны должны иметь противоположные проекции спина 1/2 и −1/2 (в единицах h).
Правило Хунда — правило квантовой химии, которое определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка: Ниже по энергии лежит тот атомный терм, для которого выполняются два условия:
Мультиплетность максимальна.
При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Правило Клечковского (также Правило n + l; также используется названия правило Маделунга или принцип Ауфбау) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Правило Клечковского гласит: Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел {\displaystyle n+l}n + l . При одинаковой сумме раньше заполняется орбиталь с меньшим значением {\displaystyle n}n .
Правило n + l предложено в 1936 г. немецким физиком Э. Маделунгом; в 1951 г. было вновь сформулировано В. М. Клечковским.
Электро́нная конфигура́ция — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
Электронная конфигурация обычно записывается для атомов в их основном состоянии. Для определения электронной конфигурации элемента существуют следующие правила:
Принцип заполнения. Согласно принципу заполнения, электроны в основном состоянии атома заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми.
Принцип запрета Паули. Согласно этому принципу, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа).
Правило Хунда. Согласно этому правилу, заполнение орбиталей одной подоболочки начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заполнение орбиталей парами электронов с противоположными спинами.
Вопрос 4. Современная формулировка периодического закона. Связь распределения элементов по периодам и группам с распределением электронов по уровням и подуровням электронной оболочки.
Современная формулировка периодического закона Д. И. Менделеева: свойства элементов и их соединений находятся в периодической зависимости от заряда ядра (порядкового номера) элемента. В классической формулировке: от атомного веса.
Положение элемента в периодической системе связано с его электронным строением:
1) Номер периода совпадает со значением главного квантового числа n внешнего уровня.
2) Каждый период начинается с s-элемента (заливка заполняется ѕ-уровнем).
3) Номер группы для элементов главных подгрупп соответствует числу электронов на внешнем уровне (т. к. максимальное число электронов на внешнем уровне = 8, число групп в системе 8).
Период - горизонтальный ряд элементов с последовательно меняющимися свойствами. 1, 2, 3 - малые периоды; 4 – 7 - большие периоды, состоящие из 2 - рядов.
Группа- вертикальный ряд, в котором друг под другом расположены сходные между собой элементы. Выделяют главные и побочные подгруппы: главные образованы элементами малых периодов и сходными с ними по свойствам элементами больших периодов; побочные подгруппы - элементами больших периодов.
Из электронной формулы атома легко определить валентные электроны и орбитали: им соответствуют подуровни с максимальным значением n и l.
Внешние, наиболее удаленные от ядра и наименее связанные с ним электроны, легко вступают во взаимодействие с другими атомами. Общее количество электронов на внешнем уровне элемента определяет максимально достижимую валентность и равно номеру группы в таблице.
Химические элементы, имеющие сходство в структуре внешнего электронного слоя, проявляют общие химические свойства.
Вопрос 5. Потенциал ионизации, сродство к электрону, электроотрицательность.
Потенциал ионизации и сродство к электрону.
Важнейшими характеристиками электронной конфигурации атома являются энергия ионизации или потенциал ионизации (ПИ) и сродство атома к электрону (СЭ). Потенциалом ионизации называют изменение энергии в процессе отрыва электрона от свободного атома при температуре О К
Асфальтены — вещества, имеющие различные фрагменты, отличающиеся друг от друга электронной неоднородностью. По-видимому, каждый участок характеризуется средними значениями потенциала ионизации и.сродства к электрону. Поэтому в такой системе создаются благоприятные условия для образования комплексов с переносом заряда, в которых один участок или одна молекула является донором, другая — акцептором
Потенциал ионизации и сродство к электрону — важные характеристики реакционной способности атомов элемента. Если атомы двух элементов сильно отличаются между собой значениями потенциалов ионизации, то у одного из них будет низкий потенциал ионизации, а у другого — высокое сродство к электрону. Такие атомы будут легко реагировать друг с другом с образованием прочной связи. Практическое использование этих характеристик ограничено тем, что они относятся к изолированным атомам, т. е. к газообразным состояниям. Если же атомы находятся не в изолированном состоянии, то принято пользоваться другой характеристикой, называемой электроотрицательностью, т. е. способностью атома притягивать к себе электроны, обобществляемые при образовании химической связи. Мерой электроотрицательности является энергия, равная арифметической сумме энергии ионизации
Эле́ктроотрица́тельность (χ) (относительная электроотрицательность) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, т.е. способность атомов притягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (p-элементов, F, O, N, Cl), а низкая — у активных металлов
6 вопрос Химическая связь как результат обобществления электронов
Химическая связь — это взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами. Современное описание химической связи проводится на основе квантовой механики.
Ионная (электровалентая) Она образуется при взаимодействии атомов, которые сильно отличаются по электроотрицательности. В этом случае происходит переход валентных электронов от атомов с меньшей электроотрицательностью к атомам, у которых она больше. В результате такого перехода возникают два противоположно заряженных иона - катион и анион, которые взаимно притягиваются друг к другу. Наиболее типичной ионной связью является связь между металлами и галогенами. Для органических соединений наиболее характерными являются ковалентная и водородная связи.
Ковалентная (неэлектровалентная) связь - основная химическая связь в органических соединениях. Этот тип связи образуется при взаимодействии атомов, электроотрицательности которых равны или отличаются незначительно. Такая связь возникает в результате обобществления валентных электронов, которые до образования связи принадлежали двум атомам.
Ковалентная полярная связь образуется между различными атомами неметаллов. При образовании ковалентной полярной связи общие электронной пары смещаются в сторону наиболее электроотрицательного элемента. Вы рассмотрели модель образования ковалентной полярной связи в молекулах сложных веществ.
σ-связь — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии», соединяющей ядра атомов.
π-связь — ковалентная связь, образующаяся перекрыванием атомных p-орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-орбиталей вдоль линии соединения атомов, пи-связи возникают при перекрывании p-орбиталей по обе стороны от линии соединения атомов.
Вопрос 7. Модели, используемые для объяснения реакционной способности элементов (метод валентных связей, метод молекулярных орбиталей) и их сущность.
Метод валентных связей - теория локализованных электронных пар. В основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними.
Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома и обладают одинаковыми энергией и формой.
Ковалентная связь: два соседних атома связаны общей электронной парой
Кратные связи: несколько общих пар
Изображение на схемах: H − H, H : H, H − C ≡ C − H 1
Валентность: количество связей атома в соединении
Метод валентных связей (координационные соединения )
Координационный ион (соединение) образуется по донорно-акцепторному механизму за счет неподеленных электронных пар лигандов (доноров) и свободных гибридных орбиталей иона комплексообразователя (акцептора).
Метод молекулярных орбиталей
При использовании метода молекулярных орбиталей считается, что каждый электрон находится в поле всех ядер. При этом связь не обязательно образована парой электронов. Например, ион Н2" состоит из двух протонов и одного электрона. Между двумя протонами действуют силы отталкивания, между каждым из протонов и электроном - силы притяжения. Химическая частица образуется лишь в том случае, если взаимное отталкивание протонов компенсируется их притяжением к электрону. Это возможно, если электрон расположен между ядрами - в области связывания. В противном случае силы отталкивания не компенсируются силами притяжения - говорят, что электрон находится в области антисвязывания, или разрыхления.
Многоэлектронная волновая функция в методе МО
Полная волновая функция молекулы должна быть антисимметрична относительно перестановок номеров электронов. Поэтому она имеет вид определителя (или линейной комбинации нескольких определителей), построенного из молекулярных спин-орбиталей и называемого определителем Слейтера.
Метод Хартри — Фока приближѐнный метод решения многоэлектронного уравнения Шредингера путѐм его сведения к одноэлектронному в предположении, что каждый электрон двигается в некотором усреднѐнном самосогласованном поле, создаваемом ядрами и всеми остальными электронами. При этом волновая функция многоэлектронной системы выбирается в виде детерминанта Слейтера.
Решение уравнений Хартри-Фока
Два основных подхода : ab initio (прямой расчет всех интегралов в заданном базисе) и полуэмпирический (параметризация матричных элементов оператора Фока на основе экспериментальных данных) Уравнения Хартри-Фока обычно решают итерационным путем: задают начальные орбитали (нулевое приближение) и строят оператор Фока. Затем решают уравнения Хартри-Фока и находят орбитали первого приближения, исходные для следующего шага итераций. Время расчета R4 . Метод ССП не подходит для описания соединений переходных металлов, процессов диссоциации и др.
Ограничения метода МО
Как правило, вблизи равновесного расположения ядер достаточно в основном состоянии применять метод МО. Если же при изменении положений ядер происходит разрыв или образование связей, то без учета электронной корреляции нельзя получить правильное описание процесса..
Основные источники ошибок
1. Отсутствие или неполный учет электронной корреляции.
2. Неполный базисный набор
3. Релятивистские эффекты
4. Отклонения от адиабатического приближения
Вопрос 8. Гибридизация. Гибридные орбитали. Кратные связи.
Гибридизация атомных орбиталей — выравнивание электронной плотности атомных орбиталей неодинакового типа, что сопровождается формированием новых, молекулярных орбиталей с одинаковыми формой и энергией.
Углеродный атом в основном состоянии характеризуется следующей электронной формулой:
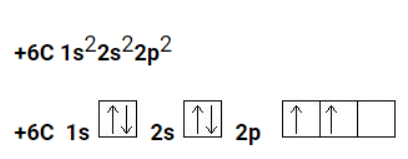
Когда атом углерода переходит в возбужденное состояние, один электрон переходит с 2s-подуровня на 2р-подуровень:
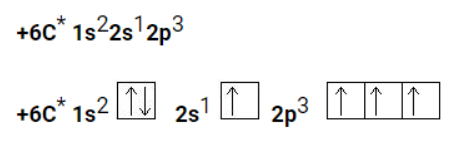
В процессе гибридизации участвуют атомные орбитали, которые характеризуются небольшой разницей в энергии. В большинстве случаев это орбитали одного энергетического уровня. Исходя из количества и типа орбиталей, принимающих участие в гибридизации, для углеродного атома возможны , и -гибридизация.
Автором концепции гибридизации валентных атомных орбиталей является американский химик Лайнус Полинг. Так ученый в 1931 г. ответил на вопрос, по какой причине при наличии у центрального атома неодинаковых (s, p, d) валентных орбиталей, сформированные им связи в многоатомных молекулах с идентичными лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Знания о гибридизации важны для построения метода валентных связей. Гибридизацию нельзя рассматривать в качестве реального физического процесса. Это удобная модель, с помощью которой объясняют электронное строение молекул, а именно, гипотетические видоизменения атомных орбиталей при формировании ковалентной химической связи, включая выравнивание длин химических связей и валентных углов в молекуле.
На основе концепции гибридизации было представлено качественное описание простых молекул. С течением времени модель была расширена и использовалась уже в случае сложных молекул. По сравнению с теорией молекулярных орбиталей концепция гибридизации не является строго количественной.
Гибридная орбиталь имеет фору знака бесконечности или несимметричной перевернутой восьмерки, вытянутой в сторону от атомного ядра. Такая форма обусловливает более сильное, чем в случае чистых атомных орбиталей, перекрывание гибридных орбиталей с орбиталями (чистых или гибридных) других атомов и приводит к образованию более прочных ковалентных связей.
sp2-гибридизация. Этот вид гибридизации происходит, когда смешиваются одна s-орбиталь и две p-орбитали. В результате происходит образование трех гибридных орбиталей, которые расположены в одной плоскости под углом 120 градусов друг к другу.
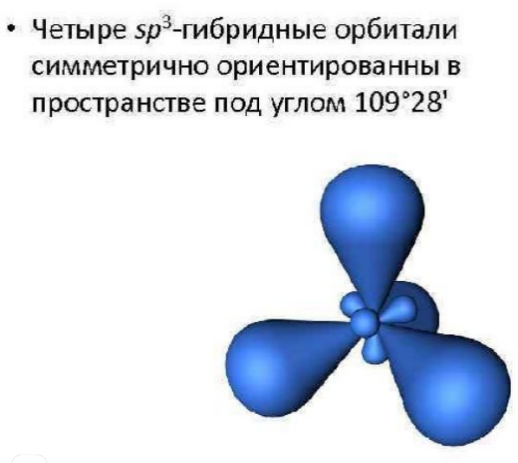
sp3-гибридизация. Этот вид гибридизации происходит, когда смешиваются одна s-орбиталь и три p-орбитали. В результате происходит образование четырех полноценных sp3-орбиталей. Эти орбитали направлены к вершине тетраэдра и располагаются друг к другу под углом 109,28 градусов.
Кратные связи — Тип химической связи, осуществляемой двумя или тремя парами электронов, общими для двух непосредственно соединённых атомов, как, например, в этилене H2C = CH2, формальдегиде H2C = О, ацетилене HC ≡ CH, синильной кислоте Н—С ≡ N (подробнее см. Двойная связь.
Кратные связи, хим. связи двухцентрового типа, к-рые в отличие от простой связи образованы более чем одной парой электронов. По числу пар электронов, образующих кратные связи, различают двойные, тройные и четверные связи. В приближении молекулярных орбиталей методов кратные связи сопоставляются с мол. орбиталями, к-рые по св-вам симметрии делят на s-, p- и d-орбитали. p-Орбитали антисимметричны относительно плоскости, проходящей через связь. В многоатомных молекулах эта плоскость является общей для всей молекулы или для мол. фрагмента, включающего эту связь. d-Орбитали антисимметричны относительно двух взаимно перпендикулярных плоскостей, проходящих через связь. При образовании кратных связей возникает, как правило, одна (или более) s-орбиталь и обязательно хотя бы одна p- или d-орбиталь. По этой причине составляющие кратных связей, определяемые p- или d-орбиталями, наз. соотв. p- или d-связями. Атомы непереходных элементов в молекулах и ионах м. б. связаны простой, двойной и тройной связями. Образование простой d-связи С—С в молекуле этана соотносят с перекрыванием двух sp3-гибридных орбиталей атомов углерода. В молекуле этилена кроме s-связи С—С присутствует одна, а в молекуле ацетилена с тройной связью - две p-связи:
9 вопрос. Скорость химической реакции. Факторы, влияющие на скорость химического процесса. Гомогенные и гетерогенные реакции. Влияние температуры на скорость химической реакции, уравнение Аррениуса, энергия активации. Правило Вант-Гоффа
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
На то, насколько быстро будет происходить химическое взаимодействие, могут повлиять следующие факторы:
концентрация веществ;
природа реагентов;
температура;
присутствие катализатора;
давление (для реакций в газовой среде).
Таким образом, изменяя определённые условия протекания химического процесса, можно повлиять на то, насколько быстро будет протекать процесс.
Концентрация реагентов -
В процессе химического взаимодействия частицы реагирующих веществ сталкиваются друг с другом. Количество таких совпадений пропорционально числу частиц веществ в объёме реагирующей смеси, а значит и пропорционально молярным концентрациям реагентов.
Природа реагентов -
Так как в процессе взаимодействия разрушаются химические связи реагирующих веществ и образуются новые связи продуктов реакции, то большую роль будет играть характер связей, участвующих в реакции соединений и строение молекул реагирующих веществ.
Площадь поверхности соприкосновения реагентов -
Такая характеристика, как площадь поверхности соприкосновения твёрдых реагентов, на протекание реакции влияет, порой, довольно значительно. Измельчение твёрдого вещества позволяет увеличить площадь поверхности соприкосновения реагентов, а значит и ускорить протекание процесса. Площадь соприкосновения растворимых веществ легко увеличивается растворением вещества.
Температура реакции -
При увеличении температуры энергия сталкивающихся частиц возрастёт, очевидно, что с ростом температуры и сам химический процесс будет ускоряться. Для количественного описания того, как температура может влиять на скорость взаимодействия веществ используют правило Вант-Гоффа. Правило Вант-Гоффа состоит в том, что при повышении температуры на 10 градусов, происходит ускорение в 2−4 раза. Математическая формула, описывающая правило Вант-Гоффа, выглядит следующим образом:

Уравне́ниеАрре́ниуса устанавливает зависимость константы скорости. химической реакции от температуры. Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать.
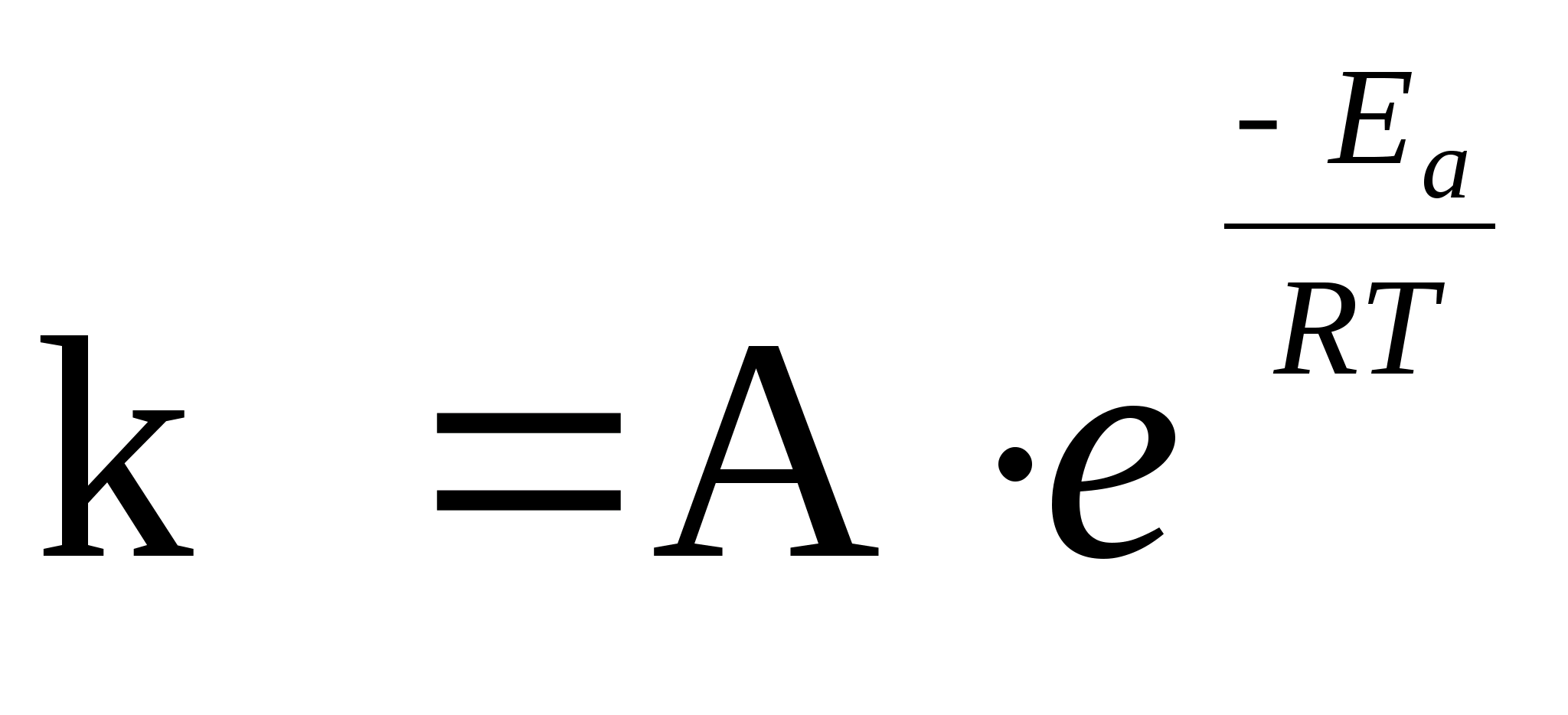
Энергия активации в химии — эмпирически определяемый параметр, характеризующий показательную зависимость константы скорости реакции от температуры[1]. Выражается в джоулях на моль.
В химической модели, известной как Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
Молекулы должны быть правильно ориентированы относительно друг друга.
При низкой (для определённой реакции) температуре большинство молекул обладают энергией меньшей, чем энергия активации, и неспособны преодолеть энергетический барьер. Однако в веществе всегда найдутся отдельные молекулы, энергия которых значительно выше средней. Даже при низких температурах большинство реакций продолжают идти. Увеличение температуры позволяет увеличить долю молекул, обладающих достаточной энергией, чтобы преодолеть энергетический барьер. Таким образом повышается скорость реакции
Вопрос 10. Термодинамика. Основные определения. Первое начало термодинамики.
Лучше смотреть в тетрадь
Химическая термодинамика
раздел химии, изучающий энергетику химических и физических превращений, направление протекания процессов в физико-химических системах, химические и фазовые превращения.
Основы химической термодинамики
В ходе химических превращений происходит разрыв одних связей между частицами и образование новых связей при формировании продуктов реакции. Разрыв и образование химических связей сопровождаются выделением или поглощением энергии в виде теплоты, света или совершения работы расширения газообразных продуктов. Закономерности превращений различных форм энергии друг в друга изучает наука, называемая термодинамикой.
Первый закон термодинамики
Химическая термодинамика представляет собой научную дисциплину, которая изучает:
- переход энергии из одной формы в другую, от одной части системы к другой;
- тепловые эффекты, сопровождающие химические и физические процессы;
- возможность и направление самопроизвольного протекания процессов
Вопрос11. Закон Гесса. Второе начало термодинамики. Свободная энергия Гиббса.
Закон Гесса. Второе начало термодинамики. Свободная энергия Гиббса.
Закон Гесса
В основе термохимических расчетов лежит закон постоянства количества теплоты, открытый русским химиком Г.И. Гессом в 1840 г.
Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от пути реакции (т.е. от числа стадий и промежуточных состояний). Согласно закону Гесса, теплота химической реакции равна разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ:
Qреакции = ΣQобр.(продуктов) — ΣQобр.(исх.веществ)
где Qобр. – теплота образования 1 моль соединения из простых веществ в стандартных условиях (Т = 298 К, p = 101,3 кПа).
Величину Qобр. = -ΔHoобр. называют стандартной молярной теплотой (энтальпией) образования вещества.
Стандартные теплоты образования простых веществ в наиболее устойчивой модификации (О2, Н2, Сграфит и т.п.) приняты равными нулю.
Закон Гесса позволяет рассчитать тепловые эффекты любых промежуточных (в том числе, гипотетических) стадий на пути превращения реагента в продукт реакции.
Второе начало термодинамики
Определяет критерий самопроизвольного протекания процесса в изолированных системах – энтропию (S)
Энтропия - это параметр характеризующий хаотичность движения частиц, является мерой молекулярного, атомного и ионного беспорядка.
Термодинамическая вероятность состояния системы (W) это число микросостояний, с помощью которых осуществляется данное макросостояние
Уравнение Больцмана
S=R*LnW
R-постоянная Больцмана
Энтропия- это мера термодинамической вероятности состояния веществ и систем.
Любая изолированная система предоставленная самой себе, изменяется в направлении состояния обладающего максимальной вероятностью.
Все процессы в изолированной системе происходят в направлении увеличения энтропии.
Изменение энтропии
ΔS = S2 –S1
если ΔS > 0, то процесс протекает в прямом направлении,
если ΔS < 0, то процесс протекает в обратном направлении.
значения стандартных энтропий приведены в таблице;
значение энтропий зависит от агрегатного состояния веществ.
В отличие от энтальпии и внутренней энергии можно определить абсолютное значение энтропии всех веществ, т.к. для энтропии есть нулевая точка отсчета.
Энтропия вещества при Т=0 К равна нулю, вероятность = 1. Данное макросостояние достигается единственным микросостоянием.
При фазовых переходах (плавление, кипение) энтропия растет скачкообразно. Если в реакции участвуют газообразные вещества, то об изменении энтропии можно судить по изменению объема газообразных веществ.
Свободная энергия Гиббса
Свободная энергия или Энергия Гиббса G – это та часть всей энергии системы, которую можно использовать для совершения максимальной работы.
Энтропийный и энтальпийный факторы обычно действуют в противоположных направлениях и общее направление реакции определяется влиянием преобладающего фактора.
В неизолированных системах критерием является ΔG –энергия Гиббса, ее рассчитывают при разных температурах.
Уравнение энергии Гиббса
ΔG = ΔHº– TΔSº
Т.к. энергия Гиббса является мерой самопроизвольности протекания процесса, то между знаком ΔG для любой реакции и ее самопроизвольным протеканием (при постоянных температуре и давлении) существуют такие зависимости:
Если ΔG отрицательно (ΔG<0), то реакция протекает самопроизвольно в прямом направлении.
Если ΔG равно нулю (ΔG=0), то реакция находится в равновесном состоянии.
Если ΔG положительно (ΔG>0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
Изменение энергии Гиббса.
Для удобства принято сравнивать значения ΔG при стандартных условиях – концентрации равны 1 моль/л, парциальное давление газообразных веществ равно 101,3 кПа, температура 298,15 К. Тогда свободную энергию обозначают через ΔGº, на основе значений которой можно вычислить изменение энергии Гиббса химической реакции:
ΔG0р-ции = Σ ΔGºпрод — Σ ΔGºисх
Величина ΔG0р-ции позволяет определить, будет ли данная реакция, находящаяся в стандартных условиях, протекать самопроизвольно в прямом или обратном направлении. Аналогично теплоте образования, энергии Гиббса образования простых веществ равны нулю.
Любая реакция при постоянных температуре и давлении протекает самопроизвольно в направлении убыли энергии Гиббса
Стандартная энергия Гиббса образования химического соединения ΔG°
это энергия Гиббса реакции образования одного моля этого соединения находящегося в стандартных условиях, из простых веществ
ΔG° простых веществ так же как ΔH°, ΔS° равны нулю
Единицы измерения ΔG° - кДж/моль
Стандартная энергия Гиббса образования химического соединения ΔG° приведена в справочниках
Вопрос 12. Химическое равновесие. Константа равновесия химической реакции. Принцип ЛеШателье.
Химическое равновесие это состояние системы, которое остается неизменным, не смотря на действие каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Для химической реакции:
2NO(г) + O2(г) → 2NO2(г)
константа химической реакции Кс есть отношение: Кс = [NO2]2/([NO]2 · [O2])
13 вопрос. Характеристика растворов. Способы выражения состава растворов. Растворимость. Законы Рауля и Вант-Гоффа.
Раствор — гомогенная физико–химическая система переменного состава, состоящая из двух или более компонентов и продуктов их взаимодействия.
По агрегатному состоянию растворы разделяют на жидкие, твердые и газообразные Наиболее значительную роль в химии и особенно в биохимии играют жидкие растворы.
Компонентами раствора являются растворитель (среда) и растворенное вещество, равномерно распределенное в растворителе в виде молекул или ионов. Под растворителем обычно понимают то вещество, которое находится в таком же агрегатном состоянии, как и раствор в целом. Если вещества, составляющие раствор, имеют одинаковое агрегатное состояние (например, спирт и вода), то растворителем называют то из веществ, которое имеется в большем количестве
Способы выражения состава растворов
Массовая доля – отношение (обычно процентное) массы растворенного вещества к массе раствора. Например, 15% (масс.) водный раствор NaCl на 100 единиц массы содержит 15 единиц массы NaCl и 85 единиц массы Н2О. .
Мольная доля – отношение химического количества растворенного вещества (или растворителя) к сумме химических количеств всех веществ, составляющих раствор. В случае раствора одного вещества в другом мольная доля растворенного вещества (N2) равна ,
Моляльность (моляльная концентрация) – отношение химического количества растворенного вещества к массе растворителя. Обычно моляльность обозначается буквой m.
Закон Руля: Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества.
Закон Вант-Гоффа: все разбавленные растворы проявляют осмотическое давление, численно равное тому газовому давлению, которое оказывало бы растворенное вещество, если бы оно находилось в газообразном состоянии и занимало бы объем, равный объему раствора
первым законом Рауля:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
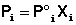
второй закон Рауля
Из первого закона Рауля следует, что понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества .
 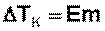
законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов |
 Скачать 0.51 Mb.
Скачать 0.51 Mb.