Вопросы №58-65. Закон разбавления Оствальда. По величинам изотонических коэффициентов электролиты можно разделить на две группы
 Скачать 93.8 Kb. Скачать 93.8 Kb.
|
|
Вопрос №58 Слабые электролиты. Степени диссоциации и константа диссоциации. Закон разбавления Оствальда. По величинам изотонических коэффициентов электролиты можно разделить на две группы сильные электролиты (i приближается к целому числу больше 1) слабые электролиты (i лишь немногим больше 1) Электролиты, степень диссоциации которых в растворах меньше единицы, называют слабыми электролитами. К ним относят воду, ряд кислот, основания р-, d- и f-элементов. Между этими двумя группами нет четкой границы, одно и то же вещество в одном растворителе проявляет свойства сильного, а в другом - слабого электролита. Например, хлорид лития и иодид натрия, имеющие ионную кристаллическую решетку, при растворении в воде ведут себя как типичные сильные электролиты, при растворении же в ацетоне или уксусной кислоте эти вещества являются слабыми электролитами со степенью диссоциации в растворах меньше единицы Слабые электролиты – это вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Степень диссоциации α<3%. К слабым электролитам относятся почти все органические кислоты (CH3COOH, C2H5COOH и др.); некоторые неорганические кислоты (H2CO3, H2SO3, H2SiO3, HCN, HNO2, H3PO4, HF, H2S и др.); почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); вода. Они плохо (или почти не проводят) электрический ток. В растворах слабых электролитов диссоциирует лишь часть молекул (или формульных единиц). Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита называется степенью диссоциации На степень электролитической диссоциации влияет ряд факторов: природа растворителя иэлектролита: сильными электролитами являются вещества с ионными и ковалентными сильно-полярными связями; хорошей ионизирующей способностью, т.е. способностью вызывать диссоциацию веществ, обладают растворители с большой диэлектрической проницаемостью, молекулы которых полярны (например, вода); температура: поскольку диссоциация — процесс эндотермический, повышение температуры повышает значение α; концентрация: при разбавлении раствора степень диссоциации возрастает, а с увеличением концентрации — уменьшается; стадия процесса диссоциации: каждая последующая стадия менее эффективна, чем предыдущая, примерно в 1000–10 000 раз; например, для фосфорной кислоты α1 > α2 > α3: В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действия масс. Константу равновесия для процесса диссоциации называют (кажущейся) константой диссоциации Кд. Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температуры, и не зависит от концентрации раствора. С повышением температуры значение константы диссоциации обычно уменьшается. В соответствии с принципом Ле Шателье подобная температурная зависимость константы диссоциации указывает на то, что процесс диссоциации является экзотермическим, т. е. суммарная теплота гидратации ионов выше энергии внутримолекулярных связей Степень диссоциации в отличие от константы диссоциации изменяется с концентрацией раствора Кд – константа диссоциации – это отношение произведения концентрации диссоциированных ионов к концентрации недиссоциированных молекул электролита 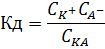 Величина константы диссоциации зависит от природы электролита и растворителя, температуры, но не зависит от концентрации электролита в растворе. Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем легче электролит диссоциирует на ионы, тем больше константа диссоциации Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: Здесь где Закон разбавления Оствальда выведен В.Оствальдом в 1888 году и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации Вопрос № 59 Слабые электролиты. Многоосновные кислоты. Ступенчатая диссоциация. Ступенчатая диссоциация Многоосновные кислоты и многокислотные основания в водных растворах диссоциируют ступенчато, т.е. вначале от молекулы отщепляется один из ионов, затем другой и т.д. Каждая такая ступень характеризуется своей константой – ступенчатой константой диссоциации (для комплексных соединений – константой нестойкости) Каждая стадия ступенчатой диссоциации многоосновной кислоты характеризуется своей константой диссоциации. H3PO4 ⇆ H+ + H2PO4– 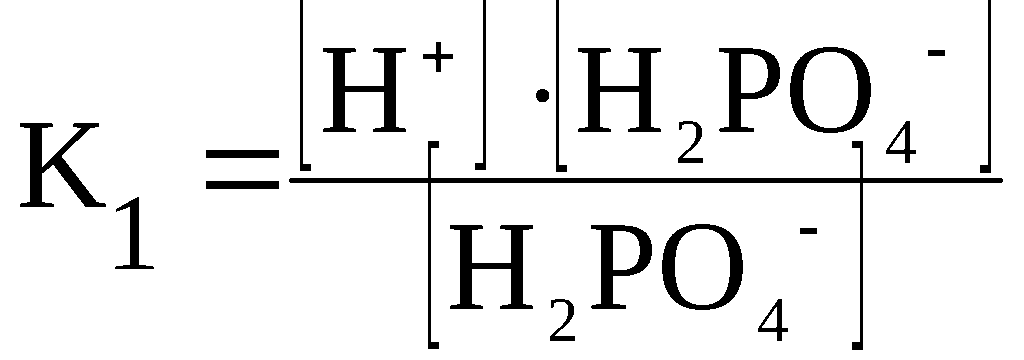 H2PO4– ⇆ H+ + HPO42– 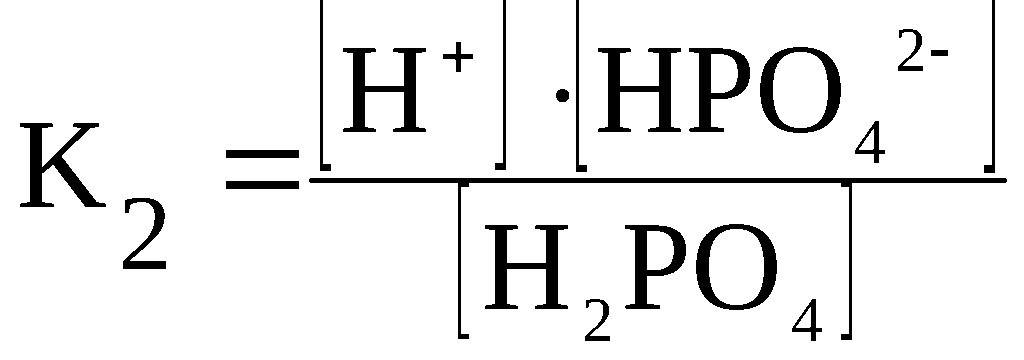 HPO42– ⇆ H+ + PO43– 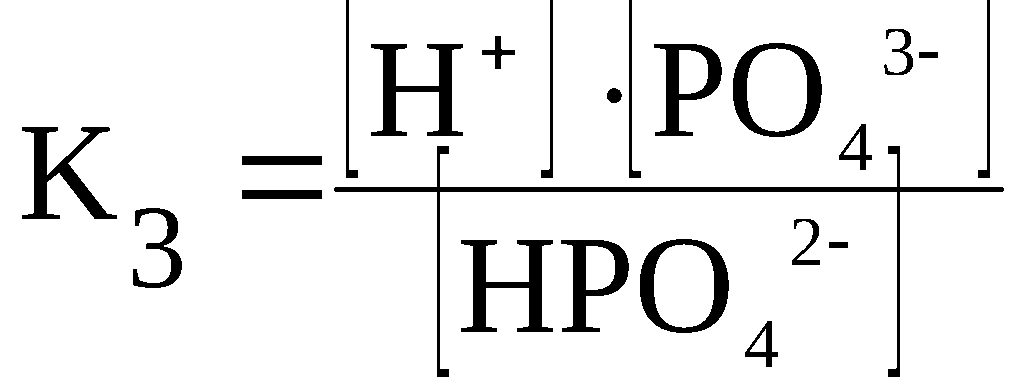 Например, серная кислота H2SO4 – сильная двухосновная кислота, диссоциирует в две ступени. I ступень: H2SO4 ↔ H+ + HSO4¯ II ступень: HSO4¯ ↔ H+ + SO42– При ступенчатой диссоциации веществ распад по первой ступени всегда происходит в гораздо большей степени, чем по второй; по второй стадии – больше, чем по третьей и т.д. Иначе говоря, соблюдается неравенство: K1 >> K2 > K3 > ... . Это объясняется тем, что энергия, необходимая для отрыва иона от нейтральной молекулы, меньше, чем от заряженной частицы. Например, отрыв иона H+ будет происходить более легко от нейтральной частицы – молекулы H3PO4, чем от отрицательно заряженного иона H2PO4–. В свою очередь, отрыв иона H+ от однозарядного иона H2PO4– требует меньшей энергии, чем от двухзарядного иона HPO4–. Кислые и основные соли также диссоциируют ступенчато, например: 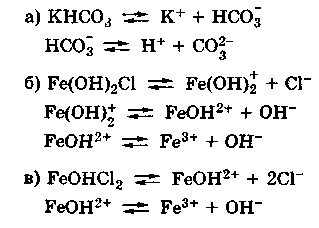 Вопросы № 60-62 Коллигативные свойства растворов. Осмос. Понижение температуры замерзания растворителя. Повышение температуры кипения растворителя. Коллигативные свойства растворов это – общие свойства, не зависящие от того, какое вещество растворено в каком растворителе. Таких свойств несколько. Криоскопия. Это – исследование понижения температуры плавления раствора (расплава) - по сравнению с температурой плавления чистого растворителя при растворении в нем некоторого вещества. Ткрист m K Ткрист(раствора) Ткрист(раствителя) mK Здесь К – криоскопическая константа для данного растворителя; m – моляльность раствора Эбулиоскопия. Это – исследование повышения температуры кипения раствора (расплава) - по сравнению с температурой кипения чистого растворителя при растворении в нем некоторого вещества Ткип m Е Ткип ( растворител я) Ткип ( раствора) mЕ Здесь Е – криоскопическая константа для данного растворителя; m – моляльность раствора Закон Рауля Это – исследование понижения давления насыщенного пара растворителя раствора - по сравнению с давлением пара над чистым растворителем при растворении в нем некоторого вещества. Относительное понижение упругости пара над раствором равно мольной доле растворенного вещества Первый закон РауляПервый закон Рауля: давление пара над раствором нелетучего вещества меньше давления пара над чистым растворителем. Это явление объясняется тем, что нелетучее растворенное вещество связывает часть молекул растворителя в виде сольватов (гидратов), тормозя процесс испарения. Математическое описание первого закона Рауля для бинарной системы зависит от того электролитом или неэлектролитом является растворенное вещество: (а) для неэлектролитов где ро — давление насыщенного пара над чистым растворителем, P — давление пара над раствором нелетучего вещества, ν (в-во) – химическое количество растворенного вещества, моль. ν (р-ль) — химическое количество растворителя, моль. Р0-Р — относительное понижение давления пара над раствором; (б) для электролитов гдеi— изотонический коэффициент (коэффициент Вант-Гоффа), характеризующий диссоциацию электролита на ионы. P — давление пара над раствором нелетучего вещества, ν (в-во) — химическое количество растворенного вещества, моль. ν (р-ль) — химическое количество растворителя, моль. Р0-Р — относительное понижение давления пара над раствором Эбулиоскопический закон РауляЭбулиоскопический закон Рауля: раствор нелетучего вещества кипит при более высокой температуре, чем чистый растворитель. Температура кипения (Ткип) — это температура, при которой давление пара над жидкостью равно атмосферному давлению Математическое описание эбулиоскопического закона: (а) для неэлектролитов: DТкип = Е·Cm, где DТкип = Tкип(р-р) - Tкип(р-ль) Сm — моляльная концентрация раствора, моль/кг Е — эбулиоскопическая константа растворителя; Е (Н2О) = 0,52. Сm= (б) для электролитов: DТкип = i·Е·Cm гдеi— изотонический коэффициент (коэффициент Вант-Гоффа), характеризующий диссоциацию электролита на ионы DТкип = Tкип(р-р) - Tкип(р-ль) Сm — моляльная концентрация раствора, моль/кг Е — эбулиоскопическая константа растворителя. Криоскопический закон РауляКриоскопический закон Рауля: раствор нелетучего вещества замерзает при более низкой температуре, чем чистый растворитель. Температура замерзания (Тзам) — это температура, при которой давление пара над жидкостью равно давлению над твердым растворителем. Математическое описание криоскопического закона: (а) для неэлектролитов: DТзам = К·Cm, К — криоскопическая константа растворителя; К (Н2О) = 1,86. Сm — моляльная концентрация раствора, моль/кг (б) для электролитов: DТзам = i·К·Cm, где DТзам = Tзам(р-ль) - Tзам(р-р), К — криоскопическая константа растворителя; Сm — моляльная концентрация раствора, моль/кг i— изотонический коэффициент (коэффициент Вант-Гоффа), характеризующий диссоциацию электролита на ионы Осмос — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества из объёма с меньшей концентрацией растворенного вещества. Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя. = TRC C — молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м³; R — универсальная газовая постоянная; T — термодинамическая температура раствора Вопрос №63 Ионные равновесия в сложных системах Сюда относится гидролиз и гидратация солей Вставьте ответы на данный вопрос начиная с 48-51 Вопросы № 64-65 Координационные соединения. Центральный ион. Координационное число и геометрия ближайшего окружения. Геометрия по методу валентных связей. Комплексные соединения или координационные соединения (частицы нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Соединения образованы центральным ионом – атом металла или неметалла; имеет обычно положительную степень окисления, хотя может иметь с.о., равную нулю, а в некоторых особых случаях и отрицательную. Центральный ион окружен лигандами – отрицательно заряженными частицами, или нейтральными молекулами. Центральный ион и лиганды связаны ковалентной – донорно-акцепторной связью, при которой донором электронной пары выступает лиганд, а акцептором – центральный ион. Отсюда и степени окисления этих частиц: донором может быть частица, имеющая не слишком прочно связанные электронные пары; акцептором может быть частица, имеющая свободные орбитали с небольшой энергией: Все лиганды образуют внутреннюю координационную сферу. Комплекс состоит из центрального атома и расположенных вокруг него лигандов. Центральный атом – акцептор электронов, как правило, d металл в неотрицательной степени окисления Лиганд – донор электронов, может быть частицей любой сложности, имеющей один или более донорных атомов Совокупность центрального атома и всех лигандов называется координационной сферой В состав лиганда должен входить атом, имеющий одну или несколько неподелённых электронных пар 1 пара – монодентатный 2 пары – бидентатный 3 пары – тридентатный Центральный атом (комплексообразователь) — атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали для образования связи. Координационное число — число атомов, непосредственно присоединенных к центральному атому (2, 4, 5, 6 и т. д.) Степень окисления — заряд, которым обладал бы атом элемента в химическом соединении, если электроны в каждой его связи сместить к более электроотрицательному атому Если внутреннюю сферу комплексного соединения образуют одинаковые лиганды, то они располагаются симметрично вокруг центрального атома. Комплексы, образованные центральными ионами, координационное число которых равно 2 имеют линейное строение (рисунок 2.2 а). Такая геометрия соответствует sp-гибридному состоянию атомных орбиталей комплексообразователя. При координационном числе комплексообразователя равном 4 комплексный ион может иметь либо квадратное строение (состояние sp2d- гибридизации орбиталей комплексообразователя), либо тетраэдрическое (sp3-гибридизация атомных орбиталей центрального иона) (рисунок 2.2 б, в). Р 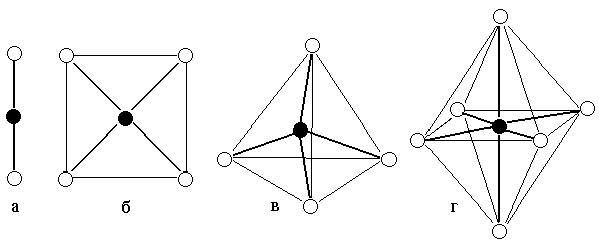 исунок 2.2 – Геометрия комплексных ионов: исунок 2.2 – Геометрия комплексных ионов:а) координационное число комплексообразователя равно 2; б) и в) координационное число комплексообразователя равно 4; г) координационное число комплексообразователя равно 6 Шестикоординированные комплексы имеют геометрию октаэдра (рисунок 2.2 г). Октаэдрическое строение комплекса соответствует sp3d2-гибридному состоянию атомных орбиталей комплексообразователя. Исследования скоростей замещения лигандов в различных соединениях позволило сделать вывод о лабильности комплексных соединений в зависимости от электронной конфигурации центрального иона: лабильные комплексы относятся к типу внешнеорбитальных комплексов (использующих внешний d-подуровень для образования связей), либо к внутриорбитальным комплексам, у которых есть по крайней мере одна свободная внутренняя d-орбиталь Для описания химической связи в координационных соединениях используют различные теоретические подходы. В основе наиболее результативных из них лежат метод валентных связей, теория кристаллического поля и метод молекулярных орбиталей. Применительно к координационным соединениям метод валентных связей утверждает, что в подобных соединениях обязательно реализуются связи, образованные по донорно-акцепторному механизму. В химии комплексных соединений такая связь называется координационной. Обычно в функции донора электронной пары при образовании координационной связи выступает лиганд, а в функции акцептора - центральный атом. |
