Белки и Углеводы. 1. 1 История изучения белка
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
Содержание
1 Белки 1.1 История изучения белка Свое название белки получили от яичного белка, который с незапамятных времен использовался человеком как составная часть пищи. Согласно описаниям Плиния Старшего, уже в Древнем Риме яичный белок применялся и как лечебное средство. Однако подлинная история белковых веществ начинается тогда, когда появляются первые сведения о свойствах белков как химических соединений (свертываемость при нагревании, разложение кислотами и крепкими щелочами и т. п.). Впервые термин белковый применительно ко всем жидкостям животного организма использовал французский физиолог Ф. Кене в 1747 г., и именно в таком толковании термин вошел в 1751 г. в «Энциклопедию» Д. Дидро и Ж. Д'Аламбера. С этого периода исследования, связанные с получением белков, приобретают систематический характер. Создание теории протеина совпало по времени с формированием представлений о функции белков в организме. В 1835 г. И.Я. Берцелиус высказал идею о важнейшей функции белка – биокаталитической. Вскоре были открыты первые протеолитические ферменты – пепсин (Т. Шванн, 1836) и трипсин (Л. Корвизар, 1856). Открытие протеаз стимулировало интерес биохимиков к физиологии пищеварения, а, следовательно, и к продуктам переваривания белков. К середине 19 в. было показано, что под действием протеолитических ферментов белки распадаются на близкие по свойствам фрагменты, получившие название пептоинов (К. Леман, 1850). Важное событие в изучении белков – выделение из белкового гидролиза аминокислоты глицина (А. Браконно, 1820). К концу 19 в. было изучено большинство аминокислот, входящих в состав белка, синтезирован аланин (А. Штреккер, 1850). В 1894 г. А. Коссель высказал идею о том, что основными структурными элементами белков являются аминокислоты. В начале 20 в. значительный вклад в изучение белка внес Э. Фишером, впервые применившим для этого методы органической химии. Путем встречного синтеза Э. Фишер доказал, что белки построены из остатков В 60-е гг. в химии белков развивалось синтетическое направление: были синтезированы инсулин и рибонуклеаза. Дальнейшее развитие получили аналитические методы: стал широко использоваться автоматический аминокислотный анализатор, созданный С. Муром и У. Стайном в 1958, существенно модифицированы хроматографические методы, до высокой степени совершенства доведен рентгеноструктурный анализ, сконструирован автоматический прибор для определения последовательности аминокислотных остатков в белке – секвенатор. Благодаря созданию прочной методологической базы стало возможным проводить широкие исследования аминокислотной последовательности белка. В эти годы была определена структура несколько сотен сравнительно небольших белков (до 300 аминокислотных остатков в одной цепи), полученных из самых различных источников как животного, так и растительного, бактериального, вирусного и другого происхождения. Среди них – протеолитические ферменты (трипсин, химотрипсин, субтилизин, карбоксипептидазы), миоглобины, геомоглобины, цитохромы, лизоцимы, иммуноглобулины, гистоны, нейротоксины, белкоавых оболочек вирусов, белково-пептидные гормоны и др. В результате были созданы предпосылки для решения актуальных проблем энзимологии, иммунологии, эндокринологии и др. областей физико-химической биологии. 1.2 Структура, свойства и функции белков Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Название протеины (от греческого proteos - первый, важнейший) отражает первостепенное значение этого класса веществ. Белкам принадлежит особая роль в воспроизводстве основных структурных элементов клетки, а также в образовании таких важнейших веществ как ферменты и гормоны. Наследственная информация сосредоточена в молекуле ДНК клеток любых живых организмов, поэтому с помощью белков реализуется генетическая информация. Без белков и ферментов ДНК не может реплицироваться, самопроизводиться. Таким образом, белки являются основой структуры и функции живых организмов. Все природные белки состоят из большого числа сравнительно простых структурных блоков – аминокислот, связанных друг с другом в полипептидные цепи. Белки представляют собой полимерные молекулы, в состав которых входит 20 различных АК. Поскольку эти АК могут объединяться в самой различной последовательности, то они могут образовывать громадное количество разнообразных белков и их изомеров. Физико-химические свойства белков определяются их высокомолекулярной природой, компактность укладки полипептидных цепей и взаимным расположением остатков аминокислот. Молекулярная масса варьируется от 5 до 1 млн., а константы седиментации – от 1 до 20 (и выше). Средний удельный объем белковых молекул –0,70-0,75 см3/г, а константы диффузии –106-108 см2/с. Максимум поглощения белков, в УФ-области спектра, обусловленный наличием ароматических аминокислот, находится вблизи 280 нм. Возбуждение электронов атома азота пептидной группы вызывает резкое увеличение поглощения при 185-240 нм. В ИК-области спектра белки поглощают за счет СО- и NH-групп при 1600 и 3100-3300 см-1. Один из первых этапов выделения белка – получение соответствующих органелл (рибосом, митохондрий, ядер, цитоплазматической мембраны) с помощью дифференциального центрифугирования. Далее белки переводят в растворимое состояние путем экстракции буферными растворами солей и детергентов, иногда – неполярными растворителями. Затем применяют фракционное осаждение неорганическими солями, этанолом, ацетоном или путем изменения pH, ионной силы. Для предотвращения денатурации работу проводят при пониженной температуре, с целью исключения протеолиза используют ингибиторы протеаз, некоторые белки стабилизируют полиолами, например, глицерином. Дальнейшую очистку проводят по схемам, специально разработанным для отдельных белков или группы гомологичных белков. Наиболее распространенные методы разделения – гель-проникающая хроматография, ионообменная и адсобрционная хроматография; эффективные методы – жидкостная хроматография высокого разрешения и аффинная хроматография. 1.3 Структура белка Молекулы белков представляют собой линейные полимеры, состоящие из 20 основных аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. 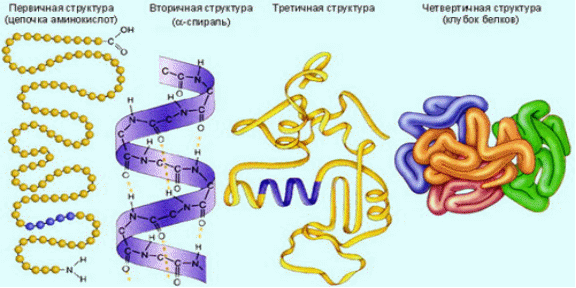 Рис. Четыре структуры белка Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Концы белка называют С- и N- концом (в зависимости от того, какая из групп концевой аминокислоты свободна (не принимает участие в образовании пептидной связи): -COOH или -NH2, соответственно). При синтезе белка на рибосоме, новые аминокислоты присоединяются к C-концу. Белки длиной от 2 до 100 аминокислотных остатков часто называют пептидами, при большей степени полимеризации - протеинами, хотя это деление весьма условно. Кроме последовательности (первичной структуры), крайне важна трехмерная структура белка. Она формируется в процессе фолдинга. Выделяют четыре уровня структуры белка: Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Четверичная структура — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. 1.4 Классификация белков Из-за относительно больших размеров белковых молекул, сложности их строения и отсутствия достаточно точных данных о структуре большинства белков еще нет рациональной химической классификации белков. Существующая классификация в значительной мере условна и построена главным образом на основании физико-химических свойств белков, источников их получения, биологической активности и других, нередко случайных, признаков. Так, по физико-химическим свойствам белки делят на фибриллярные и глобулярные, на гидрофильные (растворимые) и гидрофобные (нерастворимые) и т.п. По источнику получения белки подразделяют на животные, растительные и бактериальные; на белки мышечные, нервной ткани, кровяной сыворотки и т.п.; по биологической активности – на белки-ферменты, белки-гормоны, структурные белки, сократительные белки, антитела и т.д. Протеины представляют собой простые белки, состоящие только из остатков аминокислот. Они широко распространены в животном и растительном мире. 1. Гистоны. Имеют сравнительно низкую молекулярную массу (12-13 тыс.), с преобладанием щелочных свойств. Локализованы в основном в ядрах клеток. Растворимы в слабых кислотах, осаждаются аммиаком и спиртом. Имеют только третичную структуру. В естественных условиях прочно связаны с ДНК и входят в состав нуклеопротеидов. Основная функция — регуляция передачи генетической информации с ДНК и РНК (возможна блокировка передачи). 2. Протамины. Самая низкая молекулярная масса (до 12 тыс.). Проявляет выраженные основные свойства. Хорошо растворимы в воде и слабых кислотах. Содержатся в половых клетках и составляют основную массу белка хроматина. Как и гистоны образуют комплекс с ДНК, функция - придают ДНК химическую устойчивость. 3. Глютелины. Растительные белки, содержащиеся в клейковине семян злаковых и некоторых других, в зеленых частях растений. Нерастворимые в воде, растворах солей и этанола, но хорошо растворимы в слабых растворах щелочей. Содержат все незаменимые аминокислоты, являются полноценными продуктами питания. 4. Проламины. Растительные белки. Содержатся в клейковине злаковых растений. Растворимы только в 70%-м спирте (это объясняется высоким содержанием пролина и неполярных аминокислот). Сложные белки делят на ряд классов в зависимости от характера простетической группы. 1. Фосфопротеины. Имеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Такая локализация фосфопротеидов свидетельствует о важном их значении для развивающегося организма. У взрослых форм эти белки присутствуют в костной и нервной тканях.2. Липопротеины. Сложные белки, простетическая группа которых образована липидами. По строению это небольшого размера (150-200 нм) сферические частицы, наружная оболочка которых образована белками (что позволяет им передвигаться по крови), а внутренняя часть — липидами и их производными. Основная функция липопротеинов — транспорт по крови липидов. В зависимости от количества белка и липидов, липопротеиды подразделяются на хиломикроны, липопротеиды низкой плотности (ЛПНП) и высокой плотности (ЛПВП), которые иногда обозначаются как - и -липопротеиды.5. Хромопротеины. Выполняют ряд функций: участие в процессе фотосинтеза и окислительно-восстановительных реакциях, транспорт С и СО2. Являются сложными белками, простетическая группа которых представлена окрашенными соединениями.6. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. Такие комплексы ДНК с протаминами обнаружены в сперматозоидах, а с гистонами — в соматических клетках, где молекула ДНК “намотана” вокруг молекул белка-гистона. Нуклепротеинами по своей природе являются вне клетки вирусы — это комплексы вирусной нуклеиновой кислоты и белковой оболочки — капсида. Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Название протеины (от греческого proteos - первый, важнейший) отражает первостепенное значение этого класса веществ. Белкам принадлежит особая роль в жизнедеятельности каждого живого существа. Первые попытки выделить белки были предприняты еще в 18 веке. К началу 19 века появляются первые работы по химическому изучению белков. К концу 19 века было изучено большинство аминокислот, входящих в состав белков. Позже, благодаря использованию физико-химических методов анализа, была определена молекулярная масса многих белков, установлена сферическая форма глобулярных белков, проведен рентгеноструктурный анализ аминокислот и пептидов, разработаны методы хроматографического анализа. 1.6 Обмен белков в организме и их содержание в органах «Во всех растениях и животных присутствует некое вещество, которое без сомнения является наиболее важным из всех известных веществ живой природы и без которого жизнь была бы на нашей планете невозможна. Это вещество я наименовал – протеин». Так писал еще в 1838 году голландский биохимик Жерар Мюльдер, который впервые открыл существование в природе белковых тел и сформулировал свою теорию протеина. Слово "протеин" (белок) происходит от греческого слова "протейос", что означает "занимающий первое место". Все живое на земле содержит белки. Они составляют около 50% сухого веса тела всех организмов. У вирусов содержание белков колеблется в пределах от 45 до 95%. Организм человека состоит из белков (19,6 %), жиров (14,7 %), углеводов (1 %), минеральных веществ (4,9 %), воды (58,8%). Белки являются одними из четырех основных органических веществ живой материи (белки, нуклеиновые кислоты, углеводы, жиры), но по своему значению и биологическим функциям они занимают в ней особое место. Около 30% всех белков человеческого тела находится в мышцах, около 20% - в костях и сухожилиях и около 10% - в коже. Но наиболее важными белками всех организмов являются ферменты, которые, холя и присутствуют в их теле и в каждой клетке тела в малом количестве, тем не менее управляют рядом существенно важных для жизни химических реакций. Все процессы, происходящие в организме: переваривание пищи, окислительные реакции, активность желез внутренней секреции, мышечная деятельность и работа мозга регулируется ферментами. 1.6 Белковый обмен в организме Белок – необходимая составная часть продуктов питания. Проблема пищевого белка стоит очень остро. По данным Международной организации по продовольствию и сельскому хозяйству при ООН больше половины человечества не получает с пищей необходимого количества белка. Недостаток белка в пище вызывает тяжелое заболевание – квашиоркор. В связи с тем, что при различных условиях питания минимум может изменяться, а значение больших количеств белков в пище не выяснено, белковые нормы не являются определенными. Фойт, исходя из статистических цифр, предложил в качестве суточной нормы 118 г белка. Нормы Читтендена (50—60 г) и Хиндхеде (25—35 г), как показывает большой ряд наблюдений, являются совершенно недостаточными и, как правило, приводят к отрицательному азотистому балансу. Энергетическая ценность 1 г белка составляет 4 ккал (16,7 кДж). В процессе пищеварения белки подвергаются гидролизу до аминокислот, которые и всасываются в кровь. После расщепления белков в пищеварительном тракте образовавшиеся аминокислоты всасываются в кровь. В кровь всасывается также незначительное количество полипептидов - соединений, состоящих из нескольких аминокислот. Из аминокислот клетки нашего тела синтезируют белок, причем белок, который образуется в клетках человеческого организма, отличается от потребленного белка и характерен для человеческого организма. Образование нового белка в организме человека и животных идет беспрерывно, так как в течение всей жизни взамен отмирающих клеток крови, кожи, слизистой оболочки, кишечника и т. д. создаются новые, молодые клетки. Для того чтобы клетки организма синтезировали белок, необходимо, чтобы белки поступали с пищей в пищеварительный канал, где они подвергаются расщеплению на аминокислоты, и уже из всосавшихся аминокислот будет образован белок. Если же, минуя пищеварительный тракт, ввести белок непосредственно в кровь, то он не только не может быть использован человеческим организмом, он вызывает ряд серьезных осложнений. Существуют множество различных классификаций белков: по составу, строению, функциональному назначению и т.д. Это обусловлено тем, что, хотя элементарный состав белков не велик и включает в себя лишь атомы C, H, O, N, S, (иногда P) и белки построены из остатков лишь 20 аминокислот. Но с другой стороны в состав их молекул может входить от несколько десятков до сотен тысяч и даже миллионов аминокислотных остатков в различных вариациях, и молекулы белка могут содержать всевозможные функциональные группы (практически всю органическую химию). Но, кроме того, с точки зрения пищевой ценности белков, определяемой их аминокислотным составом и содержанием так называемых незаменимых аминокислот, белки подразделяются на полноценные и неполноценные. Для поддержания жизнедеятельности и функционирования всех живых организмов должен существовать постоянный обмен вещества и энергии. Главный элемент, входящий в состав белков, который нужен всем живым организмам – углерод. Высшие растения способны синтезировать все необходимые им аминокислоты и входящие белки. Для этого им нужен азот в виде аммиака или нитратов, сера и фосфор в виде сульфатов и фосфатов, получаемые из почвенного раствора. Источником углерода служит фосфороглицериновая кислота продукт фотосинтеза. А из аминокислот в растениях синтезируются все необходимые для них белки. Млекопитающие не могут синтезировать некоторые аминокислоты и поэтому должны получать их в виде пищи. Таких незаменимых аминокислот восемь: валин, лейцин, изолейцин, треонин, метионин, лизин, триптофан, фенилаланин. Полноценными считаются белки, включающие в состав эти восемь незаменимых аминокислот. Причем продукты, содержащие эти белки, не могут быть заменены продуктами, содержащими жиры и углеводы. Основными источниками белков для человека являются: мясо, яйца, рыба, фасоль, горох и бобы. В отличие от углеводов и жиров в организме не происходит накапливания и запасания белков. Первая группа - молочные продукты. Именно молоко почти полностью обеспечивает потребности не только детского, но и взрослого организма. В 100 г молока содержится 3 г белка. Пол-литра молока в день - это более половины суточной потребности человека в животном белке. Белки молока содержат все аминокислоты и в наилучшем соотношении, необходимом организму. В молочных белках содержатся в значительных количествах метионин - аминокислота, важная для обеспечения нормальной деятельности печени. Таким образом в молоке и молочных продуктах весьма удачно сочетаются полноценные белки. Вторая группа - мясо, рыба, яйца. Изучение аминокислотного состава различных продуктов показало, что степень усвоения мясных продуктов очень высока. Биологическая ценность белков рыбы не ниже, поскольку их аминокислотные составы весьма близки. Установлено, что белки рыбы и многих продуктов моря даже несколько легче перевариваются и усваиваются в организме человека, чем белки мяса. Весьма ценным и питательным продуктом являются яйца, в них содержатся лучшие по аминокислотному составу белки. Мясо, несомненно, очень полезный продукт благодаря высокому содержанию полноценного животного белка - в различных сортах мяса и птицы содержится от 14 до 24% белка. Третья группа - мука, хлебобулочные изделия, крупы, макаронные изделия. Основное значение продуктов этой группы, содержащих большое количество углеводов, - снабжение организма энергией. Как бы промежуточным звеном между продуктами третьей и пятой группы является картофель. Картофель употребляется населением многих стран в относительно больших количествах. Содержащиеся в них растительные белки удовлетворяют общую потребность человека в белках примерно на 30 - 35%. Белки поступают в организм человека и животных с различными пищевыми продуктами, в которых содержание белка колеблется в широких пределах. Приведем таблицу, дающую представление о содержании белка в некоторых продуктах питания. 1.7 Патологическая физиология белкового обмена Генетически обусловленные нарушения структуры, а, следовательно, и свойств белков представляют собой в сущности группу моногенных наследственных болезней. Она возникают в результате точечных мутаций как структурных, так и регуляторных генов и передаются в поколениях в соответствии с законами Менделя. Фенотипические проявления этих заболеваний обусловлены функциональными свойствами белков, их органной и тканевой принадлежностью, значимостью для метаболизма и т.д. Следует отметать, что первичный генетический дефект ряда моногенных болезней (муковисцедоз, ахондроплазия, мышечные дистрофии и др.) пока на выяснен, но роль нарушений биосинтеза белков несомненна. Общность функций белков, ответственных за транспорт веществ в организме, объединяет в одну группу заболевания с самыми различными клиническими проявлениями. Наиболее распространенными среди них являются гемоглобинопатии – наследственные дефекты синтеза гемоглобина, при которых возможно развитие серьезных нарушений транспорта газов в организме. К этой же категории относятся различные типы наследственных дислипопротеидемий, проявления которых связаны с нарушением транспорта холестерина и других липидов. Генетические дефекты могут явиться также причиной нарушения синтеза структурных белков организма. Чаще всего это связано с патологическими изменениями структуры пластических белков соединительной ткани. Биохимические дефекты фибриллярного белка – коллагена объединяются в группу коллагеновых болезней, характеризующихся полиморфностью клинических проявлений. Врожденный адреногенитальный синдром связан с генетически обусловленной неполноценностью ферментных систем стероидогенеза в коре надпочечников. Недостаток ферментов (в первую очередь 21-гидроксилазы), участвующих в биосинтезе кортикостероидов, приводит к снижению продукции кортизола и накоплению в крови предшественников его метаболизма (17-окси-прогестерон, прогестерон). Растормаживание секреции кортикотропина стимулирует выработку андрогенов, которые оказывают вирилизирующее действие на детский организм. При глубоком дефиците 21-гидроксилазы также происходит резкое снижение биосинтеза альдостерона, в результате развивается сольтеряющий синдром. В ряде случаев нарушения функционирования иммунной системы связаны с патологическими изменениями в геноме. Наследственная недостаточность иммунного ответа может затрагивать специфические механизмы гуморального и клеточного иммунитета. В этих случаях речь идет о первичных иммунодефицитах. Наследственные дефекты неспецифических факторов защиты (фагоцитоза, системы комплемента и др.) могут встречаться как в изолированных вариантах, так и в комбинации с дефектами специфических факторов иммунной защиты. Чрезвычайно многообразны проявления нарушений процессов биосинтеза и распада белков в организме при синдроме белковой недостаточности. 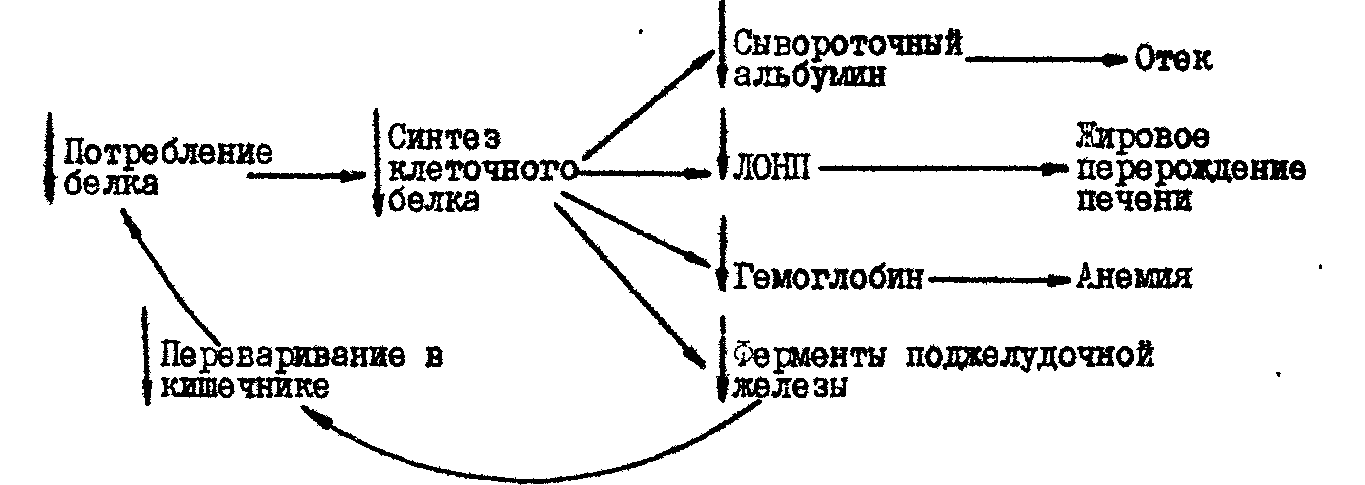 Рис. Порочный круг при квашиоркоре В экономически бедных районах тропической Америки, Центральной и Южной Африки, Индии недостаточное количество белка в рационе является важным этиологическим фактором заболевания детей – квашиоркора – на языке Ганы "красный мальчик" (синонимы: гидрокахексия, пеллагра детская, синдром "депигментация – отёк"). Отсутствие или снижение активности какого-либо фермента (нередко и избыточная активность) у человека приводит к развитию заболеваний (энзимопатий) или гибели организма. Так, передаваемое по наследству заболевание детей — галактоземия (приводит к умственной отсталости) — развивается вследствие нарушения синтеза фермента, ответственного за превращение галактозы в легко усваиваемую глюкозу. Причиной другого наследственного заболевания — фенилкетонурии, сопровождающегося расстройством психической деятельности, является потеря клетками печени способности синтезировать фермент, катализирующий превращение аминокислоты фенилаланина в тирозин. Определение активности многих ферментов в крови, моче, спинно-мозговой, семенной и других жидкостях организма используется для диагностики ряда заболеваний. С помощью такого анализа сыворотки крови возможно обнаружение на ранней стадии инфаркта миокарда, вирусного гепатита, панкреатита, нефрита и других заболеваний. В питательном отношении растительные белки менее ценны, чем животные; они беднее лизином, метионином и триптофаном, труднее перевариваются. Один из путей решения проблемы – добавление в растительную пищу синтетических аминокислот. Наряду с этим выводят новые сорта растений, содержащие гены, ответственные за синтез недостающих аминокислот. Перспективно использование для этого методов генетической инженерии. 1.8 Растительные белки и их использование в производстве пищевых продуктов В настоящее время уже неопровержимо доказано, что растительные белки, даже содержащие необходимый набор аминокислот усваивается очень плохо. Плохое усвоение растительного белка вызвано несколькими причинами: толстые оболочки клеток растительных белков, часто не поддающиеся действию пищеварительных соков; наличие ингибиторов пищеварительных ферментов в некоторых растениях, например, в бобовых; трудности расщепления растительных белков до аминокислот. Соя — растение семейства бобовых, родиной которого является восточная Азия. Семена сои, иногда называемые соевыми бобами (от англ. soya bean) — широко распространённый продукт питания, известный ещё в третьем тысячелетии до н. э. Сою часто называют чудо-растением — отчасти благодаря высокому содержанию растительного белка, в среднем составляющего около 40 % от массы семени, а у отдельных сортов достигающему 48-50 %, во многом аналогичном животному, отчасти благодаря сравнительно высокой урожайности. Вследствие этого, соя так же входит в состав некоторых кормов для животных. Культурная соя широко возделывается в Азии, Южной Европе, Северной и Южной Америке, Центральной и Южной Африке, Австралии, на островах Тихого и Индийского океанов на широтах от экватора до 55-60°. Питательная ценность бобов сои общеизвестна. Соя используется как сырье для промышленного получения не только белка, клетчатки, но и витаминов. В семенах сои содержатся витамины А, В1, В2, В3, В6, РР, Р, К, D, C. Соя, как пищевой продукт, с давних времен привлекает к себе внимание. По содержанию белка, жира, фосфатидов и некоторых других питательных веществ она значительно превосходит многие масленичные и злаковые культуры. В зависимости от места и условий произрастания сои содержание питательных веществ может меняться в значительных пределах: например, белок – от 29 до 50,3%, жир – от 13,5 до 25,4%, а сумма белка и жира – от 52 до 65%. – липаза – гидролаза эфиров глицерина (в качестве активной группы фермента присутствует кальций); – амилазы – ферменты, катализирующие гидролиз углеводов; – липоксигеназа и пероксидоза – ферменты, катализирующие окислительно-восстановительные реакции. В семенах сои обнаружено большое количество β-амилазы и липоксигеназы. Липоксигеназа способствует разрушению молекул жирных кислот, что ведет к прогорканию и окислительной порчи продуктов. Первоначально из соевых семян извлекали так называемую каротиноксидазу, которую применяли для «отбелки» каротина. В дальнейшем из этого препарата была выделена липоксигеназа в кристаллическом виде. Реакция, катализируемая этим ферментом, протекает на воздухе и ускоряется в присутствии кислорода. При этом происходят существенные потери витамина А, появление специфического запаха и вкуса. Из обезжиренной соевой муки выделены две липоксигеназы: липоксигеназа 1, катализирующая окисление свободной линолевой кислоты, и липоксигеназа 2, катализирующая окисление линолевой кислоты в составе трилинолеина. Активность липоксигеназы 1 повышается в присутствии ионов Са2+, которые ингибируют липоксигеназу 2. Для определения биологической ценности белков ФАО/ВОЗ (Всемирная организация здравоохранения) предложила стандартную аминокислотную шкалу для сопоставления состава любого исследуемого белка. С этой целью химическими методами определяют содержание всех аминокислот в исследуемом продукте. Затем вычисляют процентное содержание каждой из аминокислот по отношению к ее содержанию в стандартном «идеальном» белке. Эту величину называют аминокислотным скором. Лимитирующей биологическую ценность белка является та аминокислота, скор (%) которой имеет наименьшее значение. Обычно рассчитывают, скор для наиболее дефицитных аминокислот: лизина, триптофана и суммы серосодержащих аминокислот. В природе не существует белка, идеального по содержанию всех незаменимых аминокислот, хотя белок куриного яйца и белок женского молока имеют, скор для незаменимых аминокислот, близкий к 100%. Основное различие между растительными белками и белками животного происхождения в том, что последние имеют в своем составе более высокое содержание некоторых дефицитных аминокислот, определяющих их пищевую ценность. К таким аминокислотам относятся, прежде всего, лизин, содержание которого в растительных белках довольно низкое. Поэтому белок пшеницы, например, считается неполноценным среди белков растительного происхождения. Наибольшее количество лизина содержат бобовые культуры. Многочисленные исследования показали, что аминокислотный состав соевого белка является наиболее совершенным из всех источников растительных белков. Содержание лизина в белках сои приближается к его содержанию в таких продуктах, как мясо, молоко, яйца. Белки сои лишь по двум аминокислотам ниже норм потребления белка, разработанных ФАО. В семенах сои присутствует соин, известный также под названием соевый гемагглютинин, или ингибитор роста. Это биологически активный белок, способный обратимо связывать соединения, содержащие углеводные фрагменты (полисахариды, гликопротеин, гликолипиды), расположенные на поверхности мембран клеток, и вызывать агрегирование или агглютинацию. Соин относится к группе лектинов, которые вызывают агглютинацию эритроцитов крови человека и животных, спор микроскопических грибов, клеток бактерий и других микроорганизмов оказывают противовирусное действие, препятствуя, таким образом, болезням растений. Лектины – обязательный компонент любой живой системы, причем в одном и том же виде растения присутствует набор лектинов. Так, у сои выявлено шесть таких лектинов, различающихся по углеводной специфичности. Большинство лектинов содержат до 15% углеводов. Высокое содержание лектинов в семенах снижает пищевую ценность белков, так как лектины имеют очень высокую устойчивость в пищеварительном тракте и отрицательно на него воздействуют. В связи с этим используются оптимальные параметры технологической переработки семян, снижающие или полностью исключающие токсичность получаемых из них белков. Желудочно-кишечные расстройства при употреблении семян сои обусловлены присутствием в них гликозидов, у которых 1,6 – связь не разрывается во время переваривания в кишечнике. Эти соединения под влиянием кишечной флоры метаболизируются с образованием метана и углекислого газа, которые скапливаются в кишечнике. Из олигосахаридов сои, имеющих нежелательные функции, следует отметить раффинозу, образованную молекулами глюкозы, фруктозы и галактозы, а также стахиозу. Присутствие этих олигосахаридов вызывает у некоторых людей метеоризм и незначительное расстройство работы желудочно-кишечного тракта. Метеоризм обусловлен отсутствием в организме человека галактозидазы – фермента, необходимого для гидролиза раффинозы и стахиозы. В семенах сои синтезируются белки, регулирующие активность ферментов. Эти белки образуют с ферментами устойчивые комплексы, в составе которых ферменты полностью теряют каталитические свойства. Наиболее изучены белки-ингибиторы протеолитических ферментов, в первую очередь трипсина. В соевых бобах около 6% общего содержания белка приходится на долю ингибитора трипсина. Трипсин – одна из главных протеаз поджелудочной железы. Трипсин гидролизует белки и пептиды, а также сложноэфирные и амидные связи. Определение активности уреазы необходимо при контроле качества продуктов переработки сои. По ее активности косвенно судят об активности других ферментов и ингибиторов протеолитических ферментов. Семена сои содержат ядовитые вещества сапонины, общее содержание которых составляет 0,1% от массы семян. Присутствие сапонинов в семенах вызывает торможение и угнетение перевариваемости и обмена в организме, а иногда и общее токсическое действие на организм. Общим свойством указанных соединений является возможность их инактивации при влаготепловой переработке. Органическое применение соевых белковых продуктов в пищевой промышленности связано с наличием специфического вкуса. Считается, что неприятный вкус вызывают продукты разложения перекиси жирной кислоты под влиянием липоксигеназы. Имеются данные свидетельствующие о наличии 9 видов спиртов, таких как 1 – пентанол, 1 – гексанол, а также 6 видов альдегидов типа гексанал, 8 видов кетонов и 2 – пентилфурана, вызывающих неприятный запах. Под влиянием липоксигеназы происходит окисление и ферментация жиров, содержащихся в соевых бобах, а при измельчении соевых бобов указанное влияние ускоряется, поэтому имеется способ придания инертности липоксигеназе посредством этанола. При обработке соевых бобов 40 – 60%-ным раствором спирта достигается наилучший вкус. Таким образом, при использовании семян сои, богатых ценными белками, минеральными веществами, витаминами и другими биологически активными веществами необходимо учитывать наличие антипитательных компонентов сои. Соевый белок хорошо сбалансирован по аминокислотам, в том числе и по незаменимым. После потребления соевых белков появляется четкое снижение уровня холестерина в крови, поэтому их целесообразно использовать в рационе людей с избыточным весом, а также людей, страдающих непереносимостью молочных продуктов. Для производства пищевых добавок используются соевая мука (содержит 40-50% белка), соевый концентрат (65-75%) и соевый изолят (свыше 85%). |
